Эта статья о единице измерения; о мелких бабочках см. Моли.
| Моль | |
|---|---|
| моль, mol | |
| Величина | количество вещества |
| Система | СИ |
| Тип | основная |
Моль (русское обозначение: моль; международное: mol; устаревшее название грамм-молекула (по отношению к количеству молекул)[1]; от лат. moles — количество, масса, счётное множество) — единица измерения количества вещества в Международной системе единиц (СИ), одна из семи основных единиц СИ[2][3].
Значение одного моля определяется через число Авогадро, один моль — количество вещества, содержащее 6,022 140 76⋅1023 частиц (атомов, молекул, ионов, электронов или любых других объектов)[4].
Моль принят в качестве основной единицы СИ XIV Генеральной конференцией по мерам и весам (ГКМВ) в 1971 году[5], определение моля было изменено на XXVI Генеральной конференции в 2018 году[4].
Устаревшее определение[править | править код]
Точное определение моля формулировалось так[5][6]:
Моль — количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Из определения моля непосредственно следовало, что молярная масса углерода-12 равна 12 г/моль точно.
Количество специфицированных структурных элементов в одном моле вещества называется постоянной Авогадро (числом Авогадро), обозначаемой обычно как NA. Таким образом, в углероде-12 массой 0,012 кг содержится NA атомов. Значение постоянной Авогадро, рекомендованное Комитетом по данным для науки и техники (CODATA) в 2014 году[7], равно 6,022140857(74)⋅1023 моль−1. Отсюда, 1 атом углерода-12 имеет массу 0,012/NA кг = 12/NA г. 1/12 массы атома углерода-12 называют атомной единицей массы (обозначение а. е. м.), и, следовательно, 1 а. е. м. = 0,001/NA кг = 1 / NA г. Таким образом, масса одного моля вещества (молярная масса) равна массе одной частицы вещества, атома или молекулы, выраженной в а. е. м. и умноженной на NA.
Например, масса 1 моля лития, имеющего атомарную кристаллическую решётку, будет равна
7 а. е. м. ⋅ NA = 7 ⋅ 1 / NA г ⋅ NA моль−1 = 7 г/моль,
а масса 1 моля кислорода, состоящего из двухатомных молекул
2 ⋅ 16 а. е. м. ⋅ NA = 2 ⋅ 16 ⋅ 1 / NA г ⋅ NA моль−1 = 32 г/моль.
То есть, из определения а. е. м. вытекает, что молярная масса вещества, выраженная в граммах на моль, численно равна массе мельчайшей частицы (атома или молекулы) этого вещества, выраженной в атомных единицах массы.
При нормальных условиях объём одного моля идеального газа составляет 22,413 996(39) л[8]. Значит, один моль кислорода занимает объём 22,413 996(39) л (для простых расчётов 22,4 л) и имеет массу 32 г.
Произошедшее переопределение[править | править код]
На XXIV ГКМВ 17—21 октября 2011 года была принята резолюция[9], в которой, в частности, предложено в будущей ревизии Международной системы единиц переопределить четыре основные единицы СИ, включая моль. Предполагалось, что новое определение моля будет базироваться на фиксированном численном значении постоянной Авогадро, которой будет приписано точное значение, основанное на результатах измерений, рекомендованных CODATA[10]. В связи с этим в резолюции сформулировано следующее положение, касающееся моля[9]:
Моль останется единицей количества вещества; но его величина будет устанавливаться фиксацией численного значения постоянной Авогадро равным в точности 6,02214X⋅1023, когда она выражена единицей СИ моль −1.
Здесь Х заменяет одну или более значащих цифр, которые должны были быть определены в дальнейшем на основании наиболее точных рекомендаций CODATA.
Новая ревизия СИ, включающая переопределение моля, была принята на XXVI ГКМВ в 2018 году, с вступлением в силу с 2019 года[4][11].
По мнению Международного бюро мер и весов (МБМВ), новое определение моля сделало его независящим от определения килограмма, а также подчеркнуло различие между физическими величинами количество вещества и масса[12].
Кратные и дольные единицы[править | править код]
Десятичные кратные и дольные единицы образуют с помощью стандартных приставок СИ. Единицы измерения «иоктомоль», «ронтомоль» и «квектомоль» моль могут использоваться лишь формально, так как столь малые количества вещества должны измеряться отдельными частицами (1 имоль формально равен 0,60214076 частицы, 1 рмоль – 0,00060214076 частицы, 1 квмоль – 0,00000060214076 частицы).
| Кратные | Дольные | ||||||
|---|---|---|---|---|---|---|---|
| величина | название | обозначение | величина | название | обозначение | ||
| 101 моль | декамоль | дамоль | damol | 10−1 моль | децимоль | дмоль | dmol |
| 102 моль | гектомоль | гмоль | hmol | 10−2 моль | сантимоль | смоль | cmol |
| 103 моль | киломоль | кмоль | kmol | 10−3 моль | миллимоль | ммоль | mmol |
| 106 моль | мегамоль | Ммоль | Mmol | 10−6 моль | микромоль | мкмоль | µmol |
| 109 моль | гигамоль | Гмоль | Gmol | 10−9 моль | наномоль | нмоль | nmol |
| 1012 моль | терамоль | Тмоль | Tmol | 10−12 моль | пикомоль | пмоль | pmol |
| 1015 моль | петамоль | Пмоль | Pmol | 10−15 моль | фемтомоль | фмоль | fmol |
| 1018 моль | эксамоль | Эмоль | Emol | 10−18 моль | аттомоль | амоль | amol |
| 1021 моль | зеттамоль | Змоль | Zmol | 10−21 моль | зептомоль | змоль | zmol |
| 1024 моль | иоттамоль | Имоль | Ymol | 10−24 моль | иоктомоль | имоль | ymol |
| 1027 моль | роннамоль | Рмоль | Rmol | 10−27 моль | ронтомоль | рмоль | rmol |
| 1030 моль | кветтамоль | Квмоль | Qmol | 10−30 моль | квектомоль | квмоль | qmol |
| рекомендовано к применению применять не рекомендуется |
Молярная масса[править | править код]
Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента, то есть масса атомов вещества, взятых в количестве, равном числу Авогадро. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с молекулярной массой — массой молекулы, выраженной в а. е. м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности[13].
Молярный объём[править | править код]
Моля́рный объём Vm — объём одного моля вещества (простого вещества, химического соединения или смеси) при данной температуре и давлении; величина, получающаяся от деления молярной массы M вещества на его плотность ρ: таким образом, Vm = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём. В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Молярная теплоёмкость[править | править код]
Молярная теплоёмкость — отношение теплоёмкости к количеству вещества, теплоёмкость одного моля вещества (в принципе разная для различных веществ, хотя в свете закона Дюлонга — Пти — имеет близкое значение, и даже приближенно совпадает в достаточно широких пределах изменения температуры у многих веществ). Это — физическая величина, численно равная количеству теплоты, которое необходимо передать одному молю (данного) вещества для того, чтобы его температура изменилась на единицу, или — произведение удельной теплоёмкости элемента на его атомную массу дает количество тепла, необходимое для повышения температуры 1 моля этого элемента на 1°С (или, что равнозначно, на 1 К). В Международной системе единиц (СИ) молярная теплоёмкость измеряется в джоулях на моль на кельвин, Дж/(моль·К). Иногда используются и производные единицы, как Дж/(кмоль·К), или внесистемные единицы: калория/(кг·К) и т. д.
Мольная доля[править | править код]
Мольная доля вещества — способ выражения концентрации, отношение количества вещества к общему количеству всех веществ, содержащихся в смеси[14]:
- где
— мольная доля вещества A в смеси;
— количество вещества A, содержащееся в смеси (измеряется в молях);
— сумма количества вещества всех компонентов раствора (измеряется в молях).
Праздник «День моля»[править | править код]
День моля — неофициальный праздник, отмечаемый химиками Северной Америки 23 октября между 6:02 утра и 6:02 вечера (6:02 10/23 в американской нотации времени и даты). Эти время и дата выбраны в соответствии с численным значением постоянной Авогадро, приблизительно равной 6,02⋅1023 моль−1. Праздник также отмечается во многих школах США и Канады[15].
См. также[править | править код]
- Формульная единица
- Атомная единица массы
- Молярная внутренняя энергия/Энергия связи (Дж/моль)
- Постоянная Фарадея/Фарадей (единица измерения)
- Эйнштейн (единица измерения)
- Эквивалент вещества
- Универсальная газовая постоянная
- Постоянная Больцмана
- Постоянная Лошмидта
- Молярная активность лиганда
Примечания[править | править код]
- ↑ Термин грамм-атом применительно к молю атомов в настоящее время также мало используется.
- ↑ Моль (единица количества вещества) // Мёзия — Моршанск. — М. : Советская энциклопедия, 1974. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 16).
- ↑ Base units (англ.). Bureau International des Poids et Mesures. Международное бюро мер и весов (2019). Дата обращения: 19 декабря 2020. Архивировано 16 февраля 2021 года.
- ↑ 1 2 3 Resolution 1 of the 26th CGPM (2018) (англ.). Bureau International des Poids et Mesures. Международное бюро мер и весов (2018). Дата обращения: 19 декабря 2020. Архивировано из оригинала 4 февраля 2021 года.
- ↑ 1 2 SI unit of amount of substance (mole) Архивная копия от 9 октября 2017 на Wayback Machine (англ.) Резолюция XIV Генеральной конференции по мерам и весам (1971)
- ↑ Положение о единицах величин, допускаемых к применению в Российской Федерации. Официальный интернет-портал правовой информации. Дата обращения: 19 марта 2018. Архивировано 1 декабря 2017 года.
- ↑ CODATA Value: Avogadro constant. Дата обращения: 8 ноября 2012. Архивировано 29 июня 2015 года.
- ↑ CODATA Value: molar volume of ideal gas (273,15 K, 101,325 kPa). Дата обращения: 8 ноября 2012. Архивировано 5 ноября 2012 года.
- ↑ 1 2 On the possible future revision of the International System of Units, the SI Архивная копия от 13 января 2012 на Wayback Machine (англ.) Резолюция 1 XXIV Генеральной конференции по мерам и весам (2011)
- ↑ Towards the «New SI»… Архивная копия от 14 мая 2011 на Wayback Machine (англ.) на сайте Международного бюро мер и весов
- ↑ Ученые отказались пользоваться эталоном килограмма из платины, rbc.ru, РБК (16 ноября 2018). Архивировано 17 ноября 2018 года. Дата обращения: 19 декабря 2020.
- ↑ Why change the SI? Архивная копия от 27 января 2013 на Wayback Machine (англ.) на сайте Международного бюро мер и весов
- ↑ Дерябина Г. И., Кантария Г. В. 2.2. Моль, молярная масса. Органическая химия: веб-учебник. Дата обращения: 26 июня 2017. Архивировано 29 июля 2012 года.
- ↑ Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин / Отв. ред. И. И. Новиков. — АН СССР. Комитет научно-технической терминологии. Сборник определений. Вып. 103. — М.: Наука, 1984. — 40 с.
- ↑ What Is Mole Day? Архивная копия от 14 декабря 2006 на Wayback Machine (англ.) на сайте National Mole Day Foundation, Inc.
Ссылки[править | править код]
- ChemTeam: The Origin of the Word ‘Mole’
И молекулярная физика, и термодинамика изучают свойства вещества, но при этом пользуются разными методами.
Молекулярная физика рассматривает свойства вещества с точки зрения его внутренней структуры (движение молекул вещества, их взаимодействие).
Термодинамика не рассматривает внутреннюю структуру вещества, а интересуется его энергией, передачей энергии. Так, она рассматривает как за счёт тепла, полученного при сгорании топлива, можно получить работу (работа тепловой машины). О термодинамике будем говорить позднее, а пока речь пойдёт о молекулярной физике, которую ещё называют молекулярно-кинетической теорией или статистической физикой.
Молекулярная физика говорит о том, что любое вещество состоит из молекул. Металлы, имеющие кристаллическое строение,
состоят из атомов, но атомы можно считать одноатомными молекулами. Молекулы вещества находятся в непрерывном хаотическом движении (обладают кинетической энергией) и взаимодействуют друг с другом – одновременно притягиваются и отталкиваются (обладают потенциальной энергией взаимодействия).
На рисунке показан график зависимости силы взаимодействия молекул от расстояния между ними. Пунктирные линии относятся к силам притяжения и отталкивания, сплошная линия даёт результирующую силу взаимодействия молекул. При
эта сила равна нулю, что соответствует наиболее устойчивому состоянию молекул (наименьшему значению потенциальной энергии их взаимодействия).
Агрегатные состояния вещества определяются соотношением потенциальной и кинетической энергий молекул.
В газах молекулы находятся далеко друг от друга, их потенциальная энергия мала, а кинетическая велика., то есть
В кристаллических телах молекулы (атомы) располагаются вплотную друг к другу, их потенциальная энергия взаимодействия очень велика. Они обладают и кинетической энергией, совершая колебания около своих положений равновесия, но для них
В жидкостях, плотность которых меньше плотности твёрдых тел, молекулы и колеблются около положений равновесия, и время от времени совершают и поступательное движение. Кинетическая и потенциальная энергии молекул жидкости соизмеримы между собой
Так как молекулярная физика говорит о молекулах, то надо ввести понятия, связанные с молекулой – это масса молекулы, концентрация молекул и другие.
Один кг (или грамм) очень крупные для молекулы единицы массы, поэтому в молекулярной физике за единичную массу приняли 1/12 часть массы атома углерода (раньше единичную массу связывали с атомом водорода, кислорода):
Количество единичных масс в атоме назвали относительной атомной массой или просто атомной массой А, а количество единичных масс в молекуле – молекулярной массой М. Тогда молекула углерода содержит 12 единичных масс, так как
Для водорода А = 1, для кислорода А = 16 и так далее (см. таблицу Менделеева).
Молекулярная масса М складывается из атомных масс А. Так,
Атомная и молекулярная массы – безразмерные величины.
Единицей количества вещества в молекулярной физике является моль. Моль – это количество вещества, в котором содержится число молекул (атомов), равное числу атомов в 0,012 кг изотопа углерода.
Таким образом, молярная масса углерода равна 0,012 кг/моль.
Масса моля водорода (молярная масса водорода):
Молярная масса воды:
то есть если взять 0,018 кг воды, то это будет моль воды.
Моль любого вещества содержит одинаковое количество молекул, названное числом Авогадро
Объём моля для твёрдых и жидких тел находится путём деления молярной массы вещества на его плотность:
Объём моля любого газа при нормальных условиях равен
Задачи
Подписывайтесь на канал и сообщите о нём своим друзьям, одноклассникам. Здесь непременно найдёте много полезного для себя.
Посмотрите занятия 32 и 33.
Ссылки на другие занятия даны в Занятии 1.
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.

Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
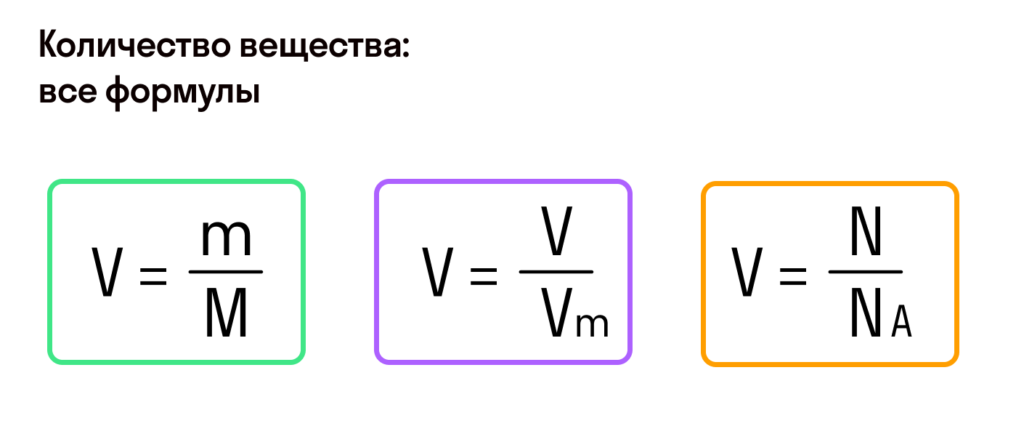
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.

Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.

Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Количество вещества
Чем больше атомов
или молекул в макроскопическом теле,
тем, очевидно, больше вещества содержится
в нем. Число молекул в макроскопических
телах огромно. Поэтому удобно указывать
не абсолютное число атомов, а относительное.
Принято
сравнивать число молекул или атомов в
данном теле с числом атомов, содержащихся
в углероде массой 12 г. Относительное
число атомов или молекул в теле
характеризуется особой физической
величиной, называемой количеством
вещества.
Количеством
вещества v
называют отношение числа молекул N
в
данном теле к числу атомов NA
в
12 г углерода*.
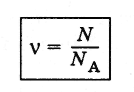
(2.2.2)
* Если вещество
состоит из отдельных атомов, не
объединенных в молекулы, то здесь и в
дальнейшем под числом молекул надо
подразумевать число атомов.
Зная
количество вещества v
и число NA,
мы
тем самым знаем число молекул N
в
веществе. Количество вещества выражают
в молях.
Моль
— это количество вещества, содержащего
столько же молекул, сколько атомов
содержится в углероде массой 12 г.
Если
количество вещества равно, например,
2,5 моль, то это означает, что число молекул
в теле в 2,5 раза превышает число атомов
в 12 г углерода, т. е. равно 2,5
NA.
Постоянная Авогадро
Число
молекул или атомов в моле вещества
называют постоянной Авогадро. Это
название дано в честь итальянского
ученого XIX
в. А. Авогадро**.
** А. Авогадро
(1776—1856) — итальянский физик и химик;
автор четырехтомного труда, который
был первым руководством по молекулярной
физике.
Согласно определению
моля постоянная Авогадро одинакова для
всех веществ. Она равна, в частности,
числу атомов в моле углерода, т. е. в 12 г
углерода.
Для
вычисления постоянной Авогадро надо
найти массу одного атома углерода (или
любого другого атома). Грубую оценку
массы можно сделать так, как это было
выполнено для массы молекулы воды.
Наиболее точные методы определения
массы основаны на отклонении пучков
ионов электромагнитным полем. Измерения
дают для массы атома углерода т0С
=
1,995·10-23
г. Отсюда постоянная Авогадро равна
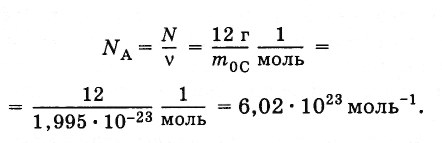
(2.2.3)
Наименование
моль-1
указывает, что NA
—
число атомов любого вещества, взятого
в количестве одного моля. Если количество
вещества v
= 2,5 моль, то число молекул в теле N
= vNA
= 1,5·1024.
Существует много
других методов определения постоянной
Авогадро, не связанных с нахождением
масс атомов. Все они приводят к одним и
тем же результатам. Постоянная Авогадро
играет важнейшую роль во всей молекулярной
физике и является универсальной
постоянной.
Огромная величина
постоянной Авогадро показывает, насколько
малы микроскопические масштабы по
сравнению с макроскопическими. Тело,
обладающее количеством вещества 1 моль,
имеет привычные для нас макроскопические
размеры.
Молярная масса
Наряду
с относительной молекулярной массой
Мr,
в
физике и химии широко используется
понятие молярной массы М.
Молярной
массой называют массу
вещества,
взятого в количестве одного моля.
Согласно этому
определению молярная масса равна
произведению массы молекулы на постоянную
Авогадро:

(2.2.4)
Молярная
масса простым образом связана с
относительной молекулярной массой.
Подставив в формулу (2.2.4) выражения т0
из
(2.2.2) и NA
из
(2.2.3), получим:
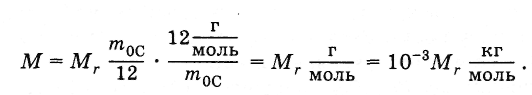
(2.2.5)
Например,
молярная масса воды Н2О
равна 18 г/моль, или 0,18 кг/моль, так как
относительная молекулярная масса воды
приближенно равна 18.
Масса
m
произвольного
количества вещества v
и молярная масса М
связаны
соотношением:
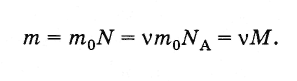
(2.2.6)
Так,
масса 3 моль воды равна: m
= 3
моль·0,018 кг/моль = 0,054 кг.
Используя
формулы (2.2.6) и (2.2.2), можно получить
формулу для числа молекул в теле в
зависимости от массы тела m
и
молярной массы М:
![]()
(2.2.7)
Нужно
запомнить значение постоянной Авогадро:
достаточно знать порядок величины 1023.
Столько
молекул содержится в
12 г углерода,
в
18 г воды
и т. д. Формулы (2.2.1),
(2.2.2) и
(2.2.4)
дают
определения новым физическим величинам:
относительной молекулярной массе,
количеству вещества и молярной массе.
Вывести их нельзя, их надо просто
запомнить. Остальные формулы можно
вывести, и запоминать их необязательно.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

