Masuma Melimurodova
22 января 2021 · 3,5 K
Помощь c решением задач по химии онлайн от выпускника химфака МГУ с красным дипломом… · 15 февр 2021 · chemhelp.ru
- 0,01 м^3 = 10 литров
Вычислим количество моль газа:
- n = V/Vm = 10/22.4 = 0.446 моль
Найдём количество молекул газа:
- N = n*Na = 0.446*6.02*10^23 = 2.6875*10^23 молекул
1,7 K
Комментировать ответ…Комментировать…
В 22,4 л любого газа при нормальных условиях находится одинаковое число молекул – 6,02*10^23.
В 0,01 м3 таких объемов будет 10^-2/22,4*10^-3 =0, 4464 моль.
Молекул там будет N= v*N0; N= 0, 4464*6,02*10^23 = 2,69*10^23 молекул.
Ответ: 2,69*10^23 молекул
338
Комментировать ответ…Комментировать…
Как найти количество молекул в веществе
Количество молекул в веществе измерить обычными методами практически невозможно. Это связанно с тем, что молекула вещества слишком мала для того, чтобы ее увидеть. Поэтому количество молекул в данной массе вещества рассчитывается с помощью специальных формул.
Вам понадобится
- – периодическая таблица химических элементов;
- – весы;
- – калькулятор.
Инструкция
Зная такую величину, как количество вещества ν, найдите число молекул в нем. Для этого количество вещества, измеренное в молях, умножьте на постоянную Авогадро (NА=6,022∙10^23 1/моль), которая равна числу молекул в 1 моле вещества N=ν/ NА. Например, если имеется 1,2 моль поваренной соли, то в ней содержится N=1,2∙6,022∙10^23 ≈7,2∙10^23 молекул.
Если известна химическая формула вещества, с помощью периодической таблицы элементов найдите его молярную массу. Для этого по таблице найдите относительные атомные массы атомов, из которых состоит молекула, и сложите их. В результате получите относительную молекулярную массу вещества, которая численно равна его молярной массе в граммах на моль. Затем, на весах измерьте массу исследуемого вещества в граммах. Чтобы найти количество молекул в веществе, умножьте массу вещества m на постоянную Авогадро (NА=6,022∙10^23 1/моль) и поделите результат на молярную массу M (N=m∙ NА/M).
Пример Определите количество молекул, которое содержится в 147 г серной кислоты. Найдите молярную массу серной кислоты. Ее молекула состоит из 2-х атомов водорода одного атома серы и 4-х атомов кислорода. Их атомные массы равны 1, 32 и 16. Относительная молекулярная масса равна 2∙1+32+4∙16=98. Она равна молярной массе, поэтому М=98 г/моль. Тогда количество молекул, содержащихся в 147 г серной кислоты, будет равно N=147∙6,022∙10^23/98≈9∙10^23 молекул.
Чтобы найти количество молекул газа в нормальных условиях при температуре 0ºС и давлении 760 мм рт. столба, найдите его объем. Для этого измеряйте или высчитайте объем емкости V, в которой он находится в литрах. Чтобы найти количество молекул газа поделите этот объем на 22,4 л (объем одного моля газа в нормальных условиях), и умножьте на число Авогадро (NА=6,022∙10^23 1/моль) N= V∙ NА/22,4.
Источники:
- как определить количество молекул
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
как узнать количество молекул газа ?
Pom4er
Знаток
(409),
закрыт
12 лет назад
Андрей Б
Просветленный
(32352)
12 лет назад
Нужно определить массуу газа, затем эту массу разделить на молярную массу, получим число молей. Число молей умножаем на число Авогадро, 6 с чем-то на 10 в 23 степени, получится число частиц газа. Молярная масса численно равна молекулярной массе газа, только выражается в гмоль
Кто не видел белого медведя? В зоопарках он – обычный гость. Нет нужды описывать, каков он на вид. Напомним лишь, что у него только нос черный, сам медведь белый и зимой, и летом (а не как, скажем, песец или заяц-беляк – те лишь зимой белые). Подошвы лап у белого медведя густой шерстью поросли, а пальцы примерно на половину своей длины соединены плавательными перепонками.
Плавают и ныряют белые медведи отлично. Две минуты могут пробыть под водой, но погружаются в нее редко глубже двух метров. Далеко в открытом море не раз видели белых медведей, даже медведиц с медвежатами. Плывут со скоростью 5 километров в час, не беспокоясь, что ни земли, ни льдов нигде вблизи не видно.
Белый медведь и тюленей ловит не только на льду, украдкой к ним подползая. Обычный его прием, так сказать, атаки с моря такой: поблизости от лежбищ тюленей медведь осторожно, без плеска и шума, сползает в воду, плывет туда, где заметил тюленей. Затем он бесшумно ныряет и выныривает уже у самого лежбища, быстро карабкается на лед, отрезая тем самым тюленям путь к спасительной воде. По отвесным ледяным стенам медведь может прямо из воды выпрыгнуть на льдину, даже если высота ее над водой два метра.
Тюлени – главная охотничья добыча белого медведя весной. За год ловит и съедает он примерно 50 тюленей. Летом меню его более разнообразно. Ловит он рыбу на мелкой воде, на берегу – леммингов, песцов, лакомится яйцами птиц. Когда голоден, ест ягоды, водоросли, мхи, лишайник, грибы.
Белый медведь – самый могучий из сухопутных хищных зверей. Лев и тигр в сравнении с ним легковесы: средний вес медведиц 310 килограммов, медведей-самцов – 420 килограммов. Если медведь матерый и хорошо упитанный, то он может весить целую тонну!
Акимушкин И.И. Мир животных: Млекопитающие, или звери. – М., 1988 г
IV. Тест по русскому языку
1. В тексте про белых медведей больше всего предложений:
а) повествовательных; б) вопросительных
2. Восклицательное предложение находится:
а) в начале текста; б) в конце текста
3. Вопросительное предложение находится
а) в начале текста; б) в конце текста
4. Выпиши из второй части текста (из второго абзаца) первое предложение. Разбери его по членам предложения. Что ты можешь сказать о сказуемых? Они являются
а) родственными словами; б) однородными членами предложения
5. Что можно сказать о глаголах, которыми выражены сказуемые? Эти глаголы:
а) I спряжения; б) II спряжения
6. Эти глаголы стоят в форме:
а) настоящего времени; б) будущего времени; в) прошедшего времени
7. Эти глаголы стоят в форме:
а) единственного числа; б) множественного числа
8. Эти глаголы стоят в форме:
а) 1-го лица; б) 2-го лица; в) 3-го лица; г)нельзя определить лицо
9. Эти глаголы стоят в форме:
а) ж.р.; б) м.р.; в) ср.р.; г) нельзя определить род
10. Найди во второй части текста (во втором абзаце) все слова, которые являются родственными существительному, являющемуся подлежащим в первом предложении. Запиши их столбиком, поставив в начальную форму. У тебя получилось:
а) два слова; б) три слова
11. Найди во второй части текста (во втором абзаце) другую форму слова, которое является подлежащим в первом предложении. Выпиши такое словосочетание с формой этого слова, из которого можно определить его падеж. Этот падеж:
а) Р.п.; б) В.п.
Примеры решения задач
1. Молекулярно-кинетическая теория идеальных газов
Задача
1. Определить,
сколько киломолей и молекул водорода
содержится в объеме 50 м3
под давлением 767 мм рт. ст. при температуре
18°С. Какова плотность и удельный объем
газа?
|
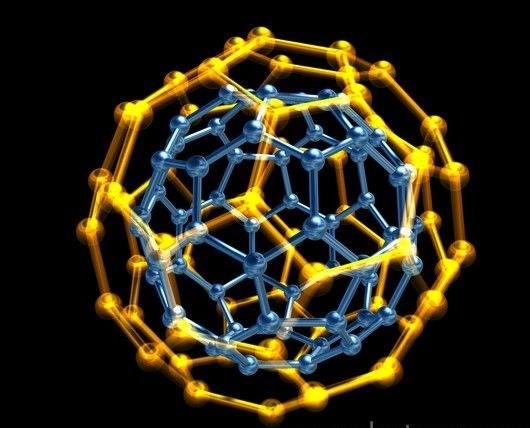
Дано: V = 50 м3 Ρ = 767 Т = 291 К М = 2 |
Решение: На основании уравнения
|
|
ν N ρ d |
можно
определить
ν:
![]()
Число
молекул N,
содержащихся
в данном объеме, находим, используя
число Авогадро NА
(которое определяет какое количество
молекул содержится в одном киломоле).
Общее количество молекул, находящихся
в массе m
данного
газа, может быть установлено, так как
известно число молей ν.
![]()
Подставляя
в формулу число киломолей, устанавливаем
число молекул, содержащихся в объеме
V:
![]() .
.
Плотность
газа ρ = m/V
определяем
из уравнения Менделеева – Клайперона:
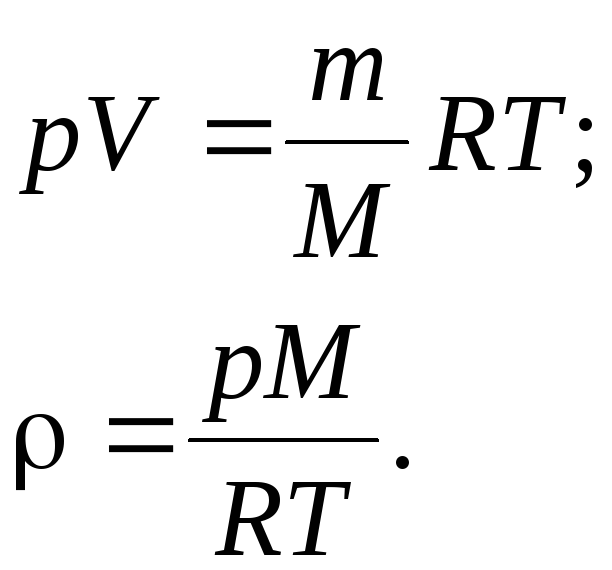
Подставляя
числовые значения в единицах СИ в
формулу, определим плотность газа:
![]()
Удельный
объем газа d
определяем из уравнения Менделеева –
Клайперона:

(м3/кг).
Ответ:
11,9 м3/кг.
Задача
2. В сосуде
объемом 2 м3
находится смесь 4 кг гелия и 2 кг
водорода при температуре 27°С. Определить
давление и молярную массу смеси газов.
|
Дано: V = 2 м3 m1= 4 кг М1= 4·10-3 кг/кмоль m2= 2 кг М2= 2·10-3 кг/кмоль Т1= 300 К |
Решение:
Воспользуемся
где |
|
р М |
М1
– его молярная
масса; V
– объем
сосуда; Т
– температура газа;
R = 8,31 Дж/(моль·К)
–молярная газовая постоянная; р2
–
парциальное
давление водорода; m2
– масса
водорода; М2
– его молярная масса.
По
закону Дальтона:
![]() (3)
(3)
Из
уравнений (1) и (2) выразим р1
и р2
и подставим
в уравнение (3):
![]() (4)
(4)
С
другой стороны, уравнение Менделеева
– Клайперона для смеси газов имеет вид:
![]() (5)
(5)
Сравнивая
(4) и (5) найдем молярную массу смеси газов
по формуле:
 ,
,
(6)
где
ν1
и ν2
– число молей гелия и водорода
соответственно.
(кг/моль).

Ответ:
3·10-3 кг/моль.
Задача
3. При каком
давлении средняя длина свободного
пробега молекул водорода <λ> = 2,5
см при температуре 68°С? Диаметр молекул
водорода принять равным d = 2,3·10
–10 м.
|
Дано: <λ>= 2,5·10-2 Т= 341 К d= 2,3·10-10 м NA = 6,02·1026 кмоль-1 |
Решение: Давление |
|
р |
Это
проводится следующим образом:
![]() ;
;
![]() ;
;
![]() ;
;
где
NA
– число
Авогадро и k
– постоянная Больцмана.
Следовательно,
![]() Так как
Так как![]() ,
,
имеем![]() .
.
Число
молекул в 1 м3
выразим через среднюю длину свободного
пробега. Из формулы
![]() ,
,
находим
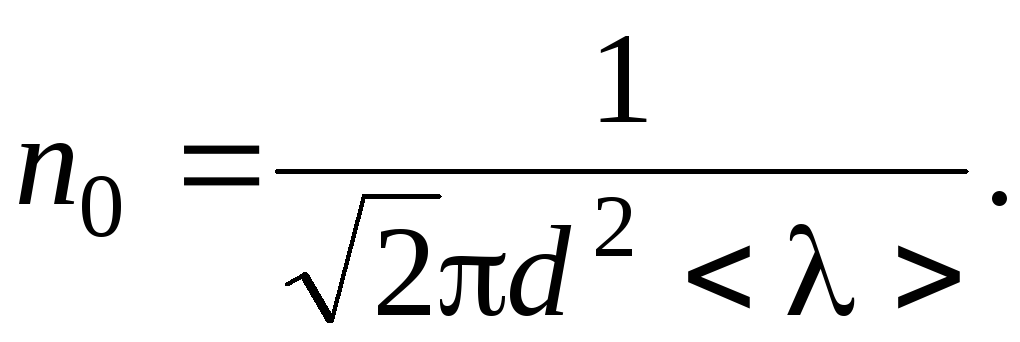 Таким
Таким
образом:

(Па).
Ответ:
0,8 Па.
Задача
4. Определить
плотность разреженного азота, если
средняя длина свободного пробега молекул
10 см. Какова концентрация молекул?
|
Дано: < λ > = 10 |
Решение: Средняя |
|
р n0 |
![]() ,
,
(1)
где
d
– эффективный
диаметр молекул (для азота d = 0,31·10
–9 м).
Концентрацию
молекул найдем из равенства:
![]() , (2)
, (2)
где
NA
– число
Авогадро; М = 28·10
–3 кг/моль
– молярная масса азота.
Решая
совместно уравнения (1) и (2), находим: 
![]()
![]()
![]()
(кг/м3).
Ответ:
1,09·10-6 кг/м3.
Задача 5.
Вычислить
коэффициент внутреннего трения и
коэффициент диффузии кислорода,
находящегося при давлении 0,2 МПа и
температуре 280 К.
|
Дано: p = 2·105 Па d = 2,9·10-10 м М = 32·10-3 кг/моль Т = 280 К |
Решение: На |
|
η D |
![]() (1);
(1);
![]() (2),
(2),
где
ρ –
плотность газа; < λ >
– средняя длина свободного пробега
молекул; <υар>
– средняя арифметическая скорость
молекул.
Из
(1) и (2) следует ![]() (3)
(3)
Среднюю
арифметическую скорость и среднюю длину
свободного пробега молекул находим по
формулам:
![]() (4)
(4)
![]() ,
,
(5)
где
R = 8,31 Дж/(моль·К) – молярная
газовая постоянная; Т – термодинамическая
температура;
d = 2,9·10 –10 м – эффективный
диаметр молекулы кислорода; n0 – число
молекул в 1 м3
(концентрация).
Из
уравнения Менделеева – Клайперона
определяем n0
(см. задачу
3):
![]() (6)
(6)
где
р
– давление; k
= 1,38·10 –23
Дж/К –
постоянная Больцмана.
Подставляя
(6) в уравнение (5), получаем:![]() . (7)
. (7)
Окончательный
вид расчетной формулы для коэффициента
диффузии найдем, подставляя выражения
(4) и (7) в уравнение (2):
![]() .
.
(8)
Плотность
кислорода определяется по формуле:![]() .
.
С учетом (6) имеем:![]() . (9)
. (9)
Подставляя
(9) и (8) в (3), получаем расчетную формулу
для коэффициента внутреннего трения:
![]() .
.
Вычисляем:
![]()
![]()
Ответ:
![]() .
.
Задача
6. Наружная
поверхность кирпичной стены площадью
25 м2
и толщиной 37 см имеет температуру
259 К, а внутренняя поверхность–293 К.
Помещение отапливается электроплитой.
Определить ее мощность, если температура
в помещении поддерживается постоянной.
Теплопроводность кирпича 0,4 Вт/(м·К).
|
Дано: S D T1 T2 χ |
Решение: Количество
где |
|
N |
За
время t
– электроплита
должна выделить такое же количество
теплоты: ![]() (2)
(2)
Приравнивая
правые части уравнений (1) и (2), получаем:
![]() ,
,
откуда
![]() ,
,
![]()
Ответ:
0,92 кВт.
Соседние файлы в предмете Физика
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
