Как найти количество молекул в молях
Молекула обладает настолько мизерными размерами, что количество молекул даже в крохотной крупинке или капле какого-либо вещества будет просто грандиозным. Оно не поддается измерению с помощью обычных методов исчисления.
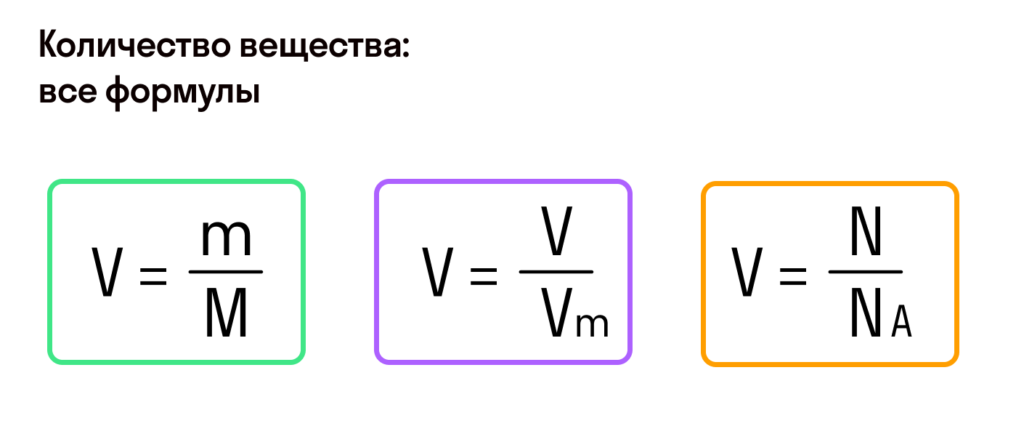
Для определения, сколько молекул находится в том или ином количестве вещества, используется понятие «моль». Моль – это такое количество вещества, в котором находится 6,022*10^23 его молекул (или атомов, или ионов). Эта громадная величина носит название «постоянная Авогадро», она названа в честь знаменитого итальянского ученого. Величина обозначается NA. С помощью постоянной Авогадро можно очень легко определить, сколько молекул содержится в любом количестве молей любого вещества. Например, в 1,5 молях содержится 1,5*NA = 9,033*10^23 молекул. В тех случаях, когда требуется очень высокая точность измерения, необходимо использовать значение числа Авогадро с большим количеством знаков после запятой. Наиболее полная его величина составляет: 6,022 141 29(27)*10^23.
Определить, сколько молей содержится в каком-то количестве вещества, очень просто. Для этого нужно только иметь точную формулу вещества и таблицу Менделеева под рукой. Предположим, у вас есть 116 граммов обыкновенной поваренной соли. Вам нужно определить, сколько молей содержится в таком количестве (и, соответственно, сколько там молекул)?
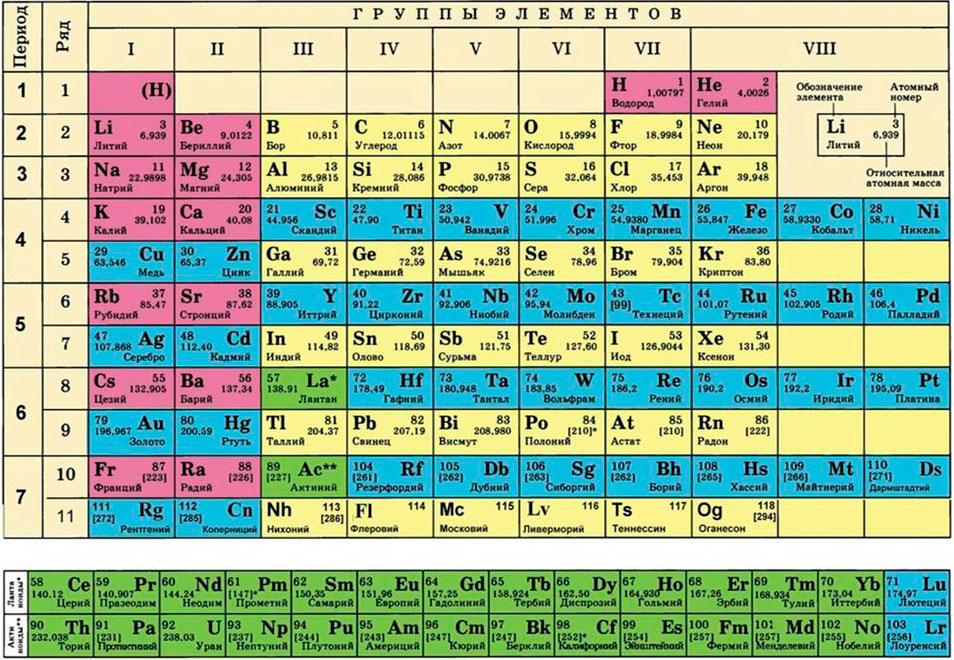
Прежде всего вспомните химическую формулу поваренной соли. Она выглядит следующим образом: NaCl. Молекула этого вещества состоит из двух атомов (точнее, ионов): натрия и хлора. Какова ее молекулярная масса? Она складывается из атомных масс элементов. С помощью таблицы Менделеева вы знаете, что атомная масса натрия приблизительно равна 23, а атомная масса хлора – 35. Следовательно, молекулярная масса этого вещества составляет 23 + 35 = 58. Масса измеряется в атомных единицах массы, где за эталон принят самый легкий атом – водорода.
А зная молекулярную массу вещества, вы тут же сможете определить и ее молярную массу (то есть массу одного моля). Дело в том, что численно молекулярная и молярная масса полностью совпадают, у них только разные единицы измерения. Если молекулярная масса измеряется в атомных единицах, то молярная – в граммах. Следовательно, 1 моль поваренной соли весит приблизительно 58 граммов. А у вас, по условиям задачи, 116 граммов поваренной соли, то есть 116/58 = 2 моля. Умножив 2 на постоянную Авогадро, вы определите, что в 116 граммах хлорида натрия находится примерно 12,044*10^23 молекул, или примерно 1,2044*10^24.
|
объясните как можно подробнее, просто ответ не пишите Моль здесь это количество вещества, равное 6,02*10^23 структурных единиц данного вещества – молекул (если вещество из молекул), атомов (если атомарное вещество), ионов (если вещество является ионым соединением ). Путем различных экспериментов в науке было доказано, что в 1 моле любого вещества содержится 6,02 х 10^23 молекул. Данное число называется постоянной Авогадро(Na). Количество молекул можно найти по формуле: N=n*Na, где N — количество молекул, n — количество вещества, Na — постоянная Авогадро. По условию нашей задачи n=0,04 моль, поэтому N=0,04*6,02*10^23=0,2408*10^23 (молекул). Эту задачу также можно решить с помощью пропорции: 1 моль – 6,02*10^23 молекул 0,04 моль – х молекул => х = 0,2408*10^23 система выбрала этот ответ лучшим КорнетОболенский 3 месяца назад Думается, что ответ на эту задачу интересует школьника, прогулявшего урок химии по соответствующей теме. Сама задача сложностей не представляет. Только следует четко понимать, что скрывается за терминами “количество вещества” и “моль”. Попробую разъяснить этот момент. Когда мы в магазине покупаем 5 килограммовых пачек сахара, то это можно трактовать так: сахар – вещество, 5кг – его количество, измеренное в единице измерения килограмм. Если бы за единицу измерения взяли грамм, то количество сахара составило бы 5000 грамм. Если за единицу измерения взять одну сахаринку, то там бы была другая, ещё бо́льшая цифра. Так вот, на уроках химии изучают различные вещества (серу,алюминий, углерод и пр.). Все эти вещества состоят из атомов или молекул (структурных единиц) в зависимости от того, какое строение имеет конкретное вещество. Количество вещества и определяется числом этих структурных единиц (атомов или молекул). И оно выражается в молях (по рассмотренной выше аналогии с сахаром – граммы или килограммы). Т.о. моль – единица измерения количества вещества. За один моль в химии принято считать количество вещества, содержащее в себе такое же количество структурных единиц (атомов или молекул), сколько содержится атомов в 12 граммах углерода. /то есть в ситуации с сахаром за единицу можно было бы взять количество сахаринок в 1 грамме/ Учёными установлено, что в 12г углерода содержится этих атомов. Это число имеет название “постоянная Авогадро” в честь открывшего его итальянского учёного. Постоянная Авогадро – гигантское число, намного превосходящее число стаканов воды, содержащихся во всех мировых океанах. Это была матчасть. Теперь перейдем к решению задачи. Вычисление производится по формуле N = n * Na, где N — количество молекул, n — количество вещества (по условию задачи оно равно 0,04 моль), Na — постоянная Авогадро. Решение задачи: FatalMoon 4 месяца назад 1 моль любого вещества – 6,02•10^23 молекул, это просто как константа. Соответственно, чтобы найти количество молекул в любом веществе, зная только его моль, нужно их перемножить (константу на известные данные) и мы получим ответ! И получаеся ничего сложного, 0,04 * 6,02•10^23 = 0,2408*10^23 maugli1 5 лет назад Чтобы узнать число молекул в определённом количестве вещества воспользуйтесь формулой N = Na*n N – число молекул Na – постоянная Авогадро равное 6*10 в 23 степени n – кол-во вещества в моль Isnotbig 5 лет назад 1 моль вещества = 6,02*10^23 молекул. 0.04 моль это 0.04*6.02*10^23 молекул. SVFE48 4 месяца назад Для того, чтобы найти количество молекул в 0,04 моль вещества, необходимо использовать уравнение Лоуренса: М = n/V где М – молярная масса вещества, n – количество молекул вещества, V – объем раствора. Поскольку в задаче указано, что количество вещества равно 0,04 моль, то мы можем записать уравнение следующим образом: М = n/V = 0,04 моль / V Чтобы найти количество молекул, нужно решить это уравнение для n. Для этого нужно знать молярную массу вещества и объем раствора. После того, как эти значения будут найдены, количество молекул можно вычислить с помощью уравнения Лоуренса. Степан БВ 3 месяца назад Если известно, что количество вещества равно 0,04 моль, то количество молекул можно найти, используя следующую формулу: Количество молекул = количество вещества (моль) / молекулярный вес вещества (г/моль) Здесь молекулярный вес вещества можно найти, используя периодическую таблицу элементов. Он указывается в единицах грамм на моль. Когда мы имеем молекулярный вес, мы можем вычислить количество молекул, деля количество вещества (0,04 моль) на молекулярный вес. владсандрович 3 месяца назад 1 моль того или иного вещества приравнивается к 6,02•10^23 молекулам, что является константой. Поэтому если мы хотим вычислить количество молекул в том или ином веществе, при том что нам известно количество его моль, нужно произвести умножение константы на известные данные и так мы сможем получить в итоге верный ответ. В данном вопросе нам известно количество вещества 0,04 моль, а значит нам надо: 0,04 * 6,02•10^23 = 0,2408*10^23. Скмшка 4 года назад Экспериментально доказано, что 1 моль любого вещества содержит 6,02•10^23 молекул. Это число названо постоянной Авогадро (Na). Найти число молекул можно по формуле: N=n•Na, где N-число молекул, n – количество вещества, Na – постоянная Авогадро. По условию задачи n=0,04 моль, тогда N=0,04•6,02•10^23=0,2408•10^23 (молекул). Можно решить и пропорцией: 1 моль – 6,02•10^23 молекул 0,04 моль – х молекул => х=0,2408•10^23 Rnd 3 месяца назад Количество молекул в любом веществе можно легко вычислить, используя константу Avogadro. Один моль любого вещества эквивалентен 6,02 x 10^23 молекулам. Просто перемножьте известное количество молей с этой константой, и вы получите общее количество молекул. Например, 0,04 моль * 6,02 x 10^23 молекул/моль = 0,2408 x 10^23 молекул. Долинн 4 месяца назад Моль в химии имеет вот такое определение: А в углероде-12 массой 0,012 кг содержится 6,02•10^23 молекул. Таким образом, один моль любого вещества – это 6,02•10^23 молекул. Дальше просто: умножаем число молей (тут по условию 0,04) на 6,02•10^23 и получаем ответ 0,2408*10^23 Знаете ответ? |
Смотрите также: ВПР по химии 8 класс 2020, задания, ответы, демоверсии, где найти? Химия 8 класс учебник Аббасов, где читать онлайн, краткое содержание? Химия 8 класс учебник Усманова, Сакарьянова, где читать онлайн? Химия 8 класс учебник Григорович, где читать онлайн, краткое содержание? Химия 8 класс учебник Еремин, Кузьменко, Дроздов, Лунин, где читать онлайн? Химия 8 класс учебник Габриелян, где читать онлайн, краткое содержание? Химия 8 класс учебник Кузнецова, Титова, Гара, где читать онлайн? ВПР 2022, химия, 8 класс, все варианты с ответами – где найти, скачать? ВПР по химии 8 класс 2021, задания, ответы, демоверсии, где найти? ВПР по химии 8 класс с ответами 2019 год все варианты – где найти/скачать? |
Дмитрий Вюрц
Образование
45
Готовлю к ОГЭ и ЕГЭ по химии онлайн. Выпустил более 2000 учеников, провожу бесплатные и… · 21 окт 2020
По формуле N = N(A) x n, где:
N(A) – постоянная Авогадро, 6,022×10^23 [моль^(-1)]
n – количество молей вещества [моль]
N – количество частиц вещества
Вот так вот 🙂
12,6 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.