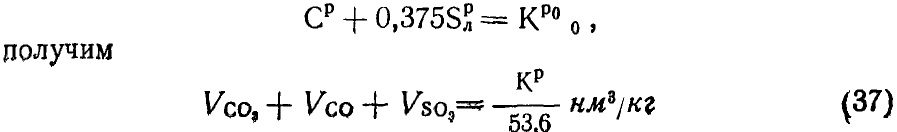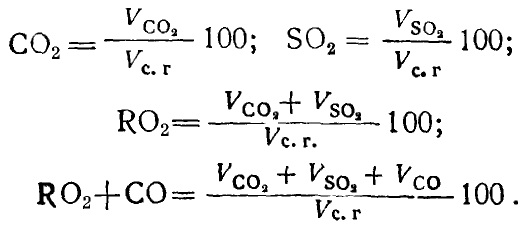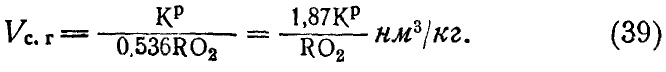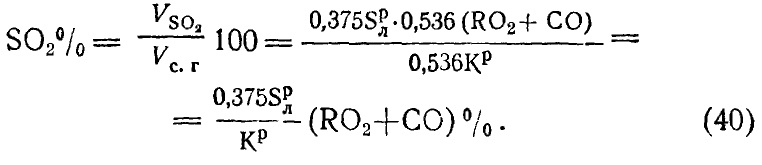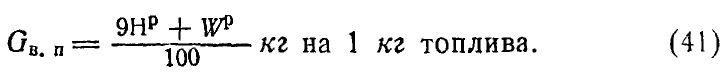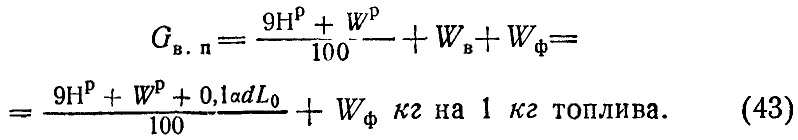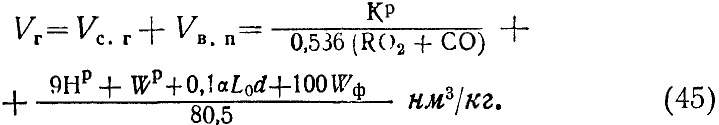С целью упрощения
расчёта все горючие вещества разделены
на три типа: индивидуальные, сложные,
смеси горючих газов (табл. 1.2.1).
Таблица 1.2.1
|
Тип горючего |
Расчетные |
Размерность |
|
Индивидуальное |
|
|
|
Вещество сложного |
|
|
|
Смесь |
|
|
Здесь
-теоретический
объём продуктов горения;-количествоi-го
продукта горения в уравнении реакции,
кмоль;
-количество
горючего, кмоль;-объём
1 кмоля газа;-молекулярная
масса горючего;-объёмi-го
продукта реакции; C,
H,
S,
O,
N
–содержание соответствующих элементов
(углерода, водорода, серы, кислорода и
азота) в горючем веществе, % вес;
-содержаниеi-го
горючего компонента в газовой смеси,
%об.;
–
содержаниеi-го
негорючего компонента в составе газовой
смеси, % об.
Практический
(полный) объём продуктов горения состоит
из теоретического объёма продуктов
горения и избытка воздуха
(1.2.9)
или
(1.2.10)
Состав продуктов
горения, т.е. содержание i-го
компонента определяется по формуле
(1.2.11)
где – содержаниеI
– го компонента в продуктах сгорания, %
об.;
– объём I
– го компонента, м3,
кмоль;
– полный объём
продуктов горения, м3,
кмоль.
При горении в
избытке воздуха в продуктах горения
содержится кислород и азот
(1.2.12)
(1.2.13)
где -теоретический
объём азота в продуктах горения, м3,
кмоль.
(1.2.14)
Примеры
Пример 1. Какое
количество продуктов горения выделится
при сгорании 1м3
ацетилена в воздухе, если температура
горения составила 1450 К.
Решение.
Горючее-индивидуальное
химическое соединение (формула 1.2.1).
Запишем уравнение химической реакции
горения
C2H2+O2+
N2=2CO2+H2O+
N2
Объём продуктов
горения при нормальных условиях
м3/м3
Объём продуктов
горения при 1450 К
м3/м3
Пример 2. Определить
объём продуктов горения при сгорании
1 кг фенола, если температура горения
1200 К, давление 95000 Па, коэффициент избытка
воздуха 1,5.
Решение.
Горючее-индивидуальное
химическое соединение(формула 1.2.2).
Запишем уравнение химической реакции
горения
C6H5OH+O2+
N2=6CO2+3H2O+
N2
Молекулярная масса
горючего 98.
Теоретический
объём продуктов горения при нормальных
условиях
м3/кг
Практический объём
воздуха при нормальных условиях
м3/кг
Объём продуктов
горения при заданных условиях
м3/м3
Пример 3. Определить
объём продуктов горения при сгорании
1 кг органической массы состава: С-55%,
О-13%, Н-5%, S-7%,
N-3%,
W
17%, если температура горения 1170 К,
коэффициент избытка воздуха – 1.3.
Решение.
Горючее вещество
сложного состава (формулы 1.2.3 – 1.2.6).
Теоретический состав продуктов горения
при нормальных условиях
м3/кг
м3/кг
м3/кг
м3/кг
Полный теоретический
объём продуктов горения при нормальных
условиях
=1+0,8+0,05+4,7=6,55
м3/кг
Практический объём
продуктов горения при нормальных
условиях
=6,55+0,269
(1,3-1)=6,55+1,8=8,35
м3/кг
Практический объём
продуктов горения при температуре
горения
=
м3/кг.
Пример 4. Рассчитать
объём продуктов горения при сгорании
1м3
газовой смеси, состоящей из С3Н6-70%,
С3Н8-10%,
СО2-5%,
О2-15%,
если температура горения 1300 К, коэффициент
избытка воздуха – 2,8. Температура
окружающей среды 293 К.
Решение.
Горючее – смесь
газов (формула 1.2.7).
Объём продуктов
горения определяется по формуле (1.2.8)
м3/м3
м3/м3
Так как газовая
смесь содержит в составе кислород, он
будет окислять часть горючих компонентов,
следовательно, понизится расход воздуха
(формула 1.1.5).
В этом случае
теоретический объём азота удобнее
определять по формуле (1.2.14)
м3/м3
Теоретический
объём продуктов горения
м3/м3
Практический объём
продуктов горения
Объём продуктов
горения при температуре 1300 К
м3/м3.
Пример 5. Определить
состав продуктов горения метилэтилкетона.
Решение.
При такой постановки
задачи рационально определить
непосредственно из уравнения горения
объём продуктов в кмолях, выделившихся
при сгорании 1 кмоля горючего
,
кмоля;
кмоля;
кмоля;
кмоля.
По формуле (1.2.11)
находим состав продуктов горения
Пример 6. Определить
объём и состав продуктов горения 1 кг
минерального масла состава: С-85%, Н-15%,
если температура горения 1450 К, коэффициент
избытка воздуха – 1,9.
Решение. По формулам
(1.2.3 – 1.2.6) определим объём продуктов
горения
м3/кг
м3/кг
м3/кг
Теоретический
объём продуктов горения при нормальных
условиях
м3/кг
Практический объём
продуктов горения при нормальных
условиях формула (1.2.10)
м3/кг
Объём продуктов
горения при температуре 1450 К
м3/кг
Очевидно, что
состав продуктов горения не зависит от
температуры горения, поэтому целесообразно
определить его при нормальных условиях.
По формулам (1.2.11;1.2.13)
;
;
Пример 7. Определить
количество сгоревшего ацетона, кг, если
объём выделившийся двуокиси углерода,
приведённый к нормальным условиям,
составил 50 м3.
Решение.
Запишем уравнение
реакции горения ацетона в воздухе
Из уравнения
следует, что при горении из 58 кг
(молекулярная масса ацетона) выделяется
м3
двуокиси углерода. Тогда для образования
50 м3
двуокиси углерода должно вступить в
реакцию Мг горючего
кг
Пример 8. Определить
количество сгоревшей органической
массы состава C-58%,
O-22%,
H-8%,
N-2%,
W-10%
в помещении объёмом 350 м3,
если содержание двуокиси углерода
составило 5%.
Решение. Определим
объём выделившейся двуокиси углерода
м3.
По формуле (1.2.6)
для вещества сложного состава определим
объём СО2,
выделившейся при горении 1 кг горючего,
м3/кг.
Определим количество
сгоревшего вещества
кг.
Пример 9. Определить
время, когда содержание двуокиси углерода
в помещении объёмом 480 м3
в результате горения древесины (C-45%,
H-50%,
O-42%,
W-8%)
составило 8%, если удельная массовая
скорость выгорания древесины 0,008
кг/(м2с),
а поверхность горения 38 м2.
При решении газообмен с окружающей
средой не учитывать, разбавлением в
результате выделения продуктов горения
пренебречь.
Решение.
Поскольку не
учитывается разбавление продуктов
горения, определяем объём выделившейся
в результате горения двуокиси углерода,
соответствующей 8% её содержания в
атмосфере
м3
Из выражения
(1.2.3) определим, сколько должно сгореть
горючего материала, чтобы выделился
данный объём двуокиси углерода
кг.
Время горения
определим, исходя из соотношения
,
где – время горения;
Мг
– масса выгоревшей древесины, кг;
– массовая скорость
выгорания древесины, кг/(м2с);
F
– поверхность горения, м2;
мин.
Задание на
самостоятельную работу
Задача 3: Определить
объем продуктов горения при сгорании
1 кг заданного вещества, если тепература
горения … К, давление … мм рт.ст., =
… .
|
Вариант |
Вещество |
Тп.г., |
Р, |
|
|
1 |
Амилбензол |
1200 |
740 |
1,1 |
|
2 |
Н-Амиловый |
1210 |
745 |
1,2 |
|
3 |
Анизол |
1220 |
750 |
1,3 |
|
4 |
Анилин |
1230 |
755 |
1,4 |
|
5 |
Бутилацетат |
1240 |
720 |
1,5 |
|
6 |
Бутиловый |
1250 |
725 |
1,6 |
|
7 |
Бензол |
1260 |
730 |
1,7 |
|
8 |
Диэтиловый |
1270 |
735 |
1,8 |
|
9 |
Ксилол |
1280 |
710 |
1,1 |
|
10 |
Уайт-спирит |
1290 |
715 |
1,2 |
|
11 |
Этиленгликоль |
1300 |
717 |
1,3 |
|
12 |
Трет-Амиловый |
1310 |
719 |
1,4 |
|
13 |
Гексан |
1320 |
724 |
1,5 |
|
14 |
Метиловый |
1330 |
732 |
1,6 |
|
15 |
Толуол |
1340 |
754 |
1,7 |
|
16 |
Стирол |
1350 |
756 |
1,8 |
|
17 |
Пентан |
1360 |
721 |
1,1 |
|
18 |
Этанол |
1370 |
700 |
1,2 |
|
19 |
Амилметилкетон |
1380 |
708 |
1,3 |
|
20 |
Бутилбензол |
1390 |
704 |
1,4 |
|
21 |
Бутилвиниловый |
1400 |
706 |
1,5 |
|
22 |
Ацетон |
1100 |
757 |
1,6 |
|
23 |
Этиловый |
1150 |
746 |
1,7 |
|
24 |
Гептан |
1160 |
738 |
1,8 |
|
25 |
Октан |
1120 |
737 |
1,1 |
|
26 |
Гексан |
1370 |
747 |
1,2 |
|
27 |
Бутиловый |
1365 |
754 |
1,3 |
|
28 |
Анилин |
1400 |
748 |
1,4 |
|
29 |
Бензол |
1354 |
750 |
1,5 |
|
30 |
Ксилол |
1378 |
751 |
1,6 |
Задача 4: Определить
объем и состав (% об.) продуктов горения,
выделившихся при сгорании 1 м3горючего газа, если температура горения
составила … К, давление … мм рт.ст.
|
Вариант |
Вещество |
Тп.г., |
Р, |
|
1 |
Ацетилен |
1200 |
750 |
|
2 |
Метан |
1210 |
749 |
|
3 |
Окись |
1220 |
748 |
|
4 |
Этан |
1230 |
747 |
|
5 |
Водород |
1240 |
746 |
|
6 |
Пропан |
1250 |
745 |
|
7 |
Сероводород |
1260 |
744 |
|
8 |
Бутан |
1270 |
743 |
|
9 |
Ацетилен |
1280 |
742 |
|
10 |
Метан |
1290 |
741 |
|
11 |
Окись |
1300 |
740 |
|
12 |
Этан |
1310 |
759 |
|
13 |
Водород |
1320 |
758 |
|
14 |
Пропан |
1330 |
757 |
|
15 |
Сероводород |
1340 |
756 |
|
16 |
Бутан |
1350 |
755 |
|
17 |
Метан |
1360 |
754 |
|
18 |
Этан |
1370 |
753 |
|
19 |
Пропан |
1380 |
752 |
|
20 |
Бутан |
1390 |
751 |
|
21 |
Окись |
1400 |
750 |
|
22 |
Ацетилен |
1100 |
749 |
|
23 |
Водород |
1150 |
748 |
|
24 |
Метан |
1160 |
747 |
|
25 |
Ацетилен |
1120 |
746 |
|
26 |
Метан |
1370 |
745 |
|
27 |
Окись |
1365 |
744 |
|
28 |
Этан |
1400 |
743 |
|
29 |
Водород |
1354 |
742 |
|
30 |
Пропан |
1378 |
741 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
16.3. Количество продуктов сгорания топлива
При
полном сгорании топлива продукты сгорания содержат газы: СО2, S2O,
N2, О2 и пары воды Н2О, т. е. СО2
+ S2O + N2 + О2 + Н2О = 100 %. Полный объем продуктов сгорания Vг (м3/кг)
представляет собой сумму объемов сухих газов Vс.г. и водяных паров VН2О
:
Vг
= Vс.г. + VН2О , (16.11)
при этом Vс.г. = VRO2 + VN2 + VO2
,
где VR2O = VCO2 + VSO2 – объем трехатомных
газов, м3/кг ;
VN2 + VO2 – объем двухатомных газов, м3/кг.
1.При
aт
= 1
1. Для твердых (кроме сланцев) и жидких топлив теоретические объемы (м3/кг)
продуктов полного сгорания определяются по формулам:
а). объем двухатомных газов :
VoN2 =
0,79Vo + 0,8No/100 ; (16.12)
б). объем трехатомных газов :
VRO2
= 0,0187(Ср + 0,375 Sрл) ; (16.13)
в). объем сухих газов :
Voс.г. = VRO2 + VoN2
=
= 0,0187 (Ср
+ 0,3753 Sрл) + 0,79Vo + 0,8No/100; (16.14)
г). объем водяных паров :
VoН2О
= 0,0124(9Нр + Wр) + 0,0161Vo ; (16.15)
д). полный объем продуктов сгорания :
Voг = Voс.г. + VoН2О
= 0,0187 (Ср + 0,3753 Sрл) + 0,79Vo
+ 0,8No/100 +0,0124(9Нр + Wр) + 0,0161Vo ;
(16.16)
2. Для сланцев объем трехатомных газов определяется по формуле :
VRO2К = VRO2 + [0,509(СО2)рк /
100] К = 0,0187(Ср + 0,375 Sрл) [0,509(СО2)рк
/ 100] К , (16.17)
где К – коэффициент разложения карбонатов:
при слоевом сжигании К= 0,7 ;
при камерном- 1,0 .
3. Для газообразного топлива теоретические объемы продуктов сгорания (м3/м3)
определяются по формулам:
а). объем двухатомных газов
VoN2 =
0,79 Vo + N2 / 100 ; (16.18)
б). объем трехатомных газов
VRO2
= 0,01[СO2 + СО + Н2S + SmCmHn] ;
(16.19)
в). объем сухих газов :
Voс.г. = VRO2 + VoN2
; (16.20)
г). объем водяных паров
VoH2O
= 0,01[Н2S + Н2 + S(n/2)CmHn +
0,124dг + 0,0161Vo , (16.21) где dг –
влагосодержание газообразного топлива, отнесенное к 1 м3 сухого
газа, г/м3;
д). полный объем продуктов сгорания
Voг
= Voс.г. + VoН2О . (16.22)
Б. При aт 1
1.
Для твердых (кроме сланцев),
жидких к газообразных топлив объемы продуктов полного сгорания (мД/кг)
определяются по формулам:
а). объем сухих газов :
Vс.г.
= Voс.г. + (aт – 1)Vo=
VRO2 + VoN2 + (aт – 1)Vo;
(16.23)
б).объем водяных паров :
VH2O = VoH2O
+ 0,0161(aт – 1)Vo ; (16.24)
в). полный объем продуктов сгорания определяется по (3.31).
2. Для сланцев полный объем
продуктов сгорания (м3/кг) :
Vг.к. = VRO2к + VoN2 + VH2O
= VRO2к + VoN2 + 0,0124(9Нр + Wр)
+ 0,0161
aтVo
. (16.25)
Содержание СО2, S2O и RO2 в сухих газах при
полном сгорании топлива определяется по формулам:
СО2
= (VCO2 / Vс.г.) ; (16.26)
S2O = (VSO2 / Vс.г.) ; (16.27)
RO2 = (VRO2 / Vс.г.) . (16.28)
Максимальное содержание (%) трехатомных газов RO2max в
сухих газах при полном сгорании топлива:
RO2max
= 21 / (1 + b),
(16.29)
b = 2,35 (Нр – 0,126Ор + 0,04Nр)
/ (Ср + 0,375Sрл) ; (16.30)
для газообразного :
b = 0,21 (0,01N2 + 0,79Vo) / VRO2
– 0,79 . (16.31)
Содержание (%) азота N2, и кислорода, в сухих газах и полном
сгорании топлива:
N2 = 100 – RO2
– O2 ; (16.32)
O2 = 21 –
bRO2
– RO2 . (16.33)
Масса продуктов
сгорания.
а). Для твердого (кроме сланцев) и жидкого топлива (кг/кг) :
Мг
= 1 – 0,01Ар + 1,306aтVo ; (16.34)
б). для газообразного топлива (кг/м3) :
Мг
= rсг.т.
+ 0,001d г.т. + 1.306aтVo , (16.35)
rсг.т. – плотность
сухого газа, кг/м3 ; d г.т. – содержание влаги в топливе,
кг/м3 ;
в). для сланцев (кг/кг):
Мг.к.
= 1- 0,01Арк + 1,306aтVo + 0,01(СО2)
ркК , (16.36)
где Арк – расчетное содержание золы в топливе с
учетом неразложившихся карбонатов, %, К – коэффициент разложения карбонатов:
при слоевом сжигании К == 0,7, при камерном – 1,0.
Расчетное содержание (%) золы в топливе с учетом неразложившихся карбонатов:
Арк
= Ар +(1 – К) (СО2) рк . (16.37)
Для твердых топлив концентрация золы в продуктах сгорания определяется
по формуле:
hзл = Ар аун / (100 Мг)
, (16.38)
где аун – доля золы топлива, уносимой продуктами сгорания.
Коэффициент избытка
воздуха в топке. При полном сгорании топлива коэффициент
избытка воздуха в топке определяется по формуле:
aт = 21 / (21 – 79 O2 / N2) , (16.39)
где O2
и N2 – содержание кислорода и азота в газах, (%).
Расчет объема продуктов сгорания газов
В случае полного сгорания отходящие из топки котла газы будут содержать: во-первых, газы, получившиеся после сгорания углерода, водорода и летучей серы, а именно СО2, Н2О и SО2, далее азот Nв2 – нейтральный газ, пришедший в топку с кислородом воздуха, азот из состава топлива Nт2 и, наконец, кислород избыточного воздуха. Для удобства подсчетов продукты сгорания разделяются на водяные пары и сухие газы. Таким образом, в случае полного сгорания газов состав сухих продуктов сгорания в процентах по объему равняется
CО2+SО2+Nв2+Nт2+О2=100. (27)
При производстве газового анализа путем поглощения водным раствором едкого кали СО2 из газов вместе с углекислотой поглощается в значительной степени и S02; таким образом, отсчет прибора дает сумму этих газов, выражаемую символом R02; тогда равенство (27) напишется так
RO2+ Nв2+Nт2 +О2=100°. (28)
Объем продуктов сгорания сухих газов, приходящихся на 1 кг сжигаемого топлива, можно подсчитать из уравнения
VCO3+VSO2+VO3+VNB2+VNT2=VС.Г. нм3/кг. (29)
Полный объем продуктов сгорания газов, включая и водяные пары, выражается суммой
VС.Г. + Vв.п. = Vг нм3/кг. (30)
В случае неполного объема продуктов сгорания газов в состав отходящих из топки газов включаются различные по своей структуре углеводороды, окись углерода, а иногда и чистый водород. Газовый анализ, а также формулы подсчета объемов и прочих величин чрезвычайно осложняются, чем уменьшается возможность их широкого применения в эксплуатационной практике котельных. Рассматривая только котельные установки и исключая специальные печные устройства, где иногда по технологическому процессу требуется цести сгорание со значительной химической неполнотой, все стремление как конструктора, так и персонала, эксплуатирующего топку, должно быть направлено к тому, чтобы свести неполноту сгорания к возможному минимуму. Поэтому, как правило, котельная установка работает или при полном сгорании, или с незначительной химической неполнотой. Это обстоятельство позволяет для упрощения расчетов сделать допущение, считая, что единственным продуктом неполноты сгорания является один из наиболее трудно поддающихся выжиганию газ СО. При незначительности вообще потери от химической неполноты сгорания эта неточность не внесет сколько-нибудь существенных искажений в дальнейшие подсчеты. С учетом сделанных замечаний уравнения состава сухих отходящих газов в общем случае при наличии неполноты сгорания могут быть написаны так:
RO2+NB2+NT2+O2+CO=100% (31)
VRO3+VNB2+VNт2+VO3+VCO=Vс.г. нм3/кг (32)
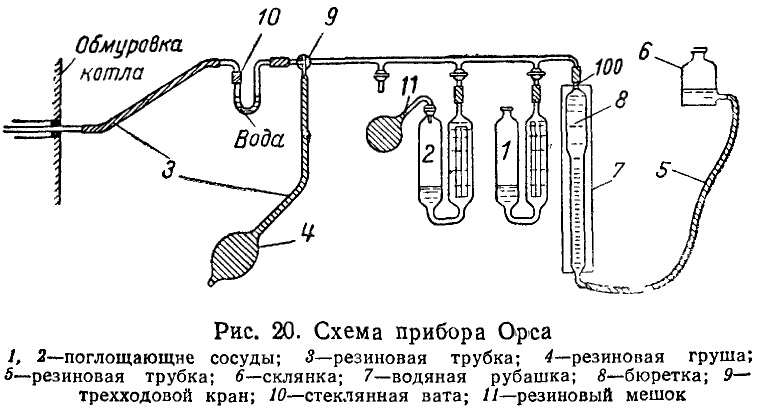
При эксплуатации котельных установок и производстве их испытаний можно получить, в числе прочих данных сведения о составе рабочего топлива и его теплотворной способности, а также о количестве RО2 и RО2 + О2 в процентах на состав сухих отходящих газов. Последние величины по большей части определяются прибором Орса (рис. 20).
Работа прибора Орса в основном сводится к тому, что от отсосанной из газоходов порции газов, равной 100 см3, отнимается СО2 + SО2 путем поглощения их водным раствором едкого кали (находится в поглощающем сосуде 1). Отмечая уменьшение объема, далее оставшийся газ перепускают в сосуд 2 с раствором пирогаллола в водном растворе едкого кали. Этот реактив обладает свойством поглощать не только СО2 и SО2, которых в остатке газов уже нет, но и О2. Таким образом, первый отсчет прибора дает RО2 %; второй – RО2 % +О2 %. Экспериментатор подсасывает из газохода свежие порции отходящих газов при помощи резиновой груши, из противоположного конца которой газ выбрасывается наружу. При этой операции трехходовой кран устанавливается так, чтобы прибор был отъединен от газохода.
На пути к прибору газ проходит через V-образную трубку, наполненную стеклянной ватой и водой.
Назначение стеклянной ваты – задержать частички золы, уносимые со струйкой газа, которые, попадая в капиллярные трубки прибора, их быстро засаривают. Проходя через воду, газ охлаждается и полностью насыщается водяными парами.
Приступая к газовому анализу, экспериментатор, соответственно переключая трехходовой кран, засасывает в бюретку 100 см3 газа. Засасывание производится путем опускания соединяющейся с бюреткой резиновой трубкой склянки, в которую наливается вода.
Невзирая на то, что анализ будет производится с газом, насыщенным водяными парами, получаемые отсчеты дают процентное содержание RО2 и RО2+О2 по отношению к сухим газам, как это требуется при расчетах, связанных с проектированием и эксплуатацией котельных установок. Высказанное подтверждается ниже.
В 100 см3 газа, находящегося под атмосферным давлением и имеющего температуру котельного помещения, содержится примерно 4 см3 водяного пара.
Перепуская газ, находящийся в бюретке, в первый поглощающий сосуд с раствором едкого кали (это производится несколько раз при помощи поднятия и опускания склянки), предположим, что получили уменьшение объема на 10%.
В таком случае в остатке имеется
Vc.r + Vв.п = 90 см3 =96*9/10 + 4*9/10=86,4+3,6см2.
Убыль сухого газа равняется 96-86,4 = 9,6, т. е. те же 10% и, следовательно, RО2 = 10%.
Величины отдельных составляющих объема продуктов сгорания газов можно подсчитать, пользуясь весовыми соотношениями основных реакций.
1. Углекислота (удельный вес при 0° и 760 мм рт. ст. у0= 1,964*) С + О2 = СО2; 12+32=44.
При полном сжигании 1 кг углерода получается
44/1,964*12=1,87СО2 нм3
и, обратно, на 1 нм3 СО2 требуется
1 : 1,87 = 0,536 кг углерода.
Таким образом, при сжигании 1 кг рабочего топлива получается углекислоты
2. Окись углерода (у0= 1,25 кг/нм3)
2С + О2 = 2СО; 24+32=56.
При неполном сжигании 1 кг углерода не в СО2, а в СО получается окиси углерода
56/1,25*2,12= 1,87 нм3
и, обратно, на 1 нм3 СО расходуется углерода 1 : 1,87 = 0,536 кг, т. е. такое же количество, как и на 1 нм3 СО2 при полном сгорании.
Следовательно, при частичной неполноте сгорания, когда часть углерода топлива сгорает в СО, суммарный объем получившихся СО2 и СО остается неизменным и подсчитывается по уравнению
3. Сернистый ангидрид (у0 = 2,86 кг/нм3)
S+О2=SО2; 32,06 + 32 = 64,06.
На 1 нм3 SО2 в газах приходится летучей серы
4. Объем продуктов сгорания газов рассмотренных сухих газов
Обозначая, как указывалось ранее:
Содержание данного газа в процентах к объему сухих газов определяется уравнениями
Из этих выражений, в частности из последнего, учитывая уравнение (37), определяют Vc.г:
В случае полного горения СО = 0 и уравнение примет вид
Если бы по RО2 потребовалось определить SО2, то эту зависимость можно установить, воспользовавшись только что приведенными соотношениями между элементами состава топлива и объемами газов:
5. Объем водяных паров. Водяные пары в продуктах сгорания образуются в результате испарения воды, находящейся в топливе и в результате сгорания водорода. Так мак принимается, что
единственным продуктом неполного сгорания является окись углерода, то объем водяных паров остается неизменным как при полном, так и при неполном сгорании. Учитывая реакцию горения водорода 2Н2 + О2 = 2Н2О, 4+32 = 36, находят вес водяных паров, приходящийся на 1 кг сжигаемого топлива:
К этим водяным парам при точных расчетах добавляется вес водяных паров, попавших в топку с воздухом. Обозначая через d влагосодержание воздуха в граммах на 1 кг сухого воздуха (обычно около 10 г), вес паров воздуха WB может быть подсчитан так:
Подача воздуха в поддувало топки может производиться при помощи вентилятора или иногда путем эжектирования воздуха струей пара. В таком случае этот пар также попадает в отходящие газы. При сжигании мазута иногда применяется пар для распиливания топлива. Количество пара, идущего на эжекцию или распыливание, зависит от конструкции соответствующих топочных приборов. Обыкновенно на эжекцию расходуется Wв = 0,7-0,8 кг пара на 1 кг сжигаемого твердого топлива, для распыливания мазута Wв=0,2-0,4 кг на 1 кг мазута.
С учетом добавочного пара формула (41) в своем общем виде напишется так:
Так как удельный вес водяного пара у0= 0,805 кг/нм3, то объем его получится
Полный объем продуктов сгорания газов [с учетом уравнений (38) и (44)] на 1 кг сжигаемого топлива выражается равенством
В частных случаях при полном горении (СО = 0) и при отсутствии парового дутья (Wф=0) уравнение (45) несколько упрощается.
Объем продуктов сгорания газов можно пользоваться приближенным соотношением
Vг=αV0.(46)
 (1.2.8)
(1.2.8)