Первое начало термодинамики (первый закон термодинамики) представляет собой закон сохранения энергии в тепловых процессах.
Первое начало термодинамики
Внутренняя энергия идеального газа изменяется двумя способами: за счет теплопередачи или при совершении работы.
±ΔU=±Q±A‘
Пояснение:
- +∆U — внутренняя энергия газа увеличивается.
- –∆U — внутренняя энергия газа уменьшается.
- +Q — газ нагревают (газу передают количество теплоты).
- –Q — газ охлаждается (газ отдает тепло окружающей среде).
- +A’ — газ сжимает внешняя сила.
- –A’ — газ расширяется, совершая работу.
Внимание! Знак перед работой показывает, как процесс совершения работы влияет на изменение внутренней энергии газа.
Пример №1. В некотором процессе внутренняя энергия газа уменьшилась на 300 Дж, а газ совершил работу 500 Дж. Какое количество теплоты было сообщено газу?
Чтобы рассчитать количество теплоты, сообщенное газу, нужно найти разность между изменением внутренней энергии и работой, совершенным газом. Для этого нужно правильно определить их знаки. Так как внутренняя энергия уменьшилась, она отрицательна. Но работа положительна. Поэтому газу было сообщено следующее количество теплоты:
Q = A – U = 500 – 300 = 200 (Дж)
Зависимость физических величин
Выясним, от чего зависят величины, входящие в формулу первого начала термодинамики. Изменение внутренней энергии идеального газа зависит от изменения температуры:
ΔU=32νRΔT
Работа идеального газа зависит от изменения его объема:
A‘=pΔV
Первое начало термодинамики для изопроцессов
| Изотермический процесс (T = const) |
ΔU=0, Q=A‘ |
| Изохорный процесс (V = const) |
A‘=0, ΔU=Q |
| Изобарное расширение газа (p = const) |
ΔU=Q−pΔV ΔU=Q−νRΔT |
| Адиабатный (система не получает тепло извне и не отдает его окружающей среде, или Q = 0) |
Q=0, ΔU=A‘ |
Пример №2. Идеальный одноатомный газ находится в сосуде с жесткими стенками объемом 0,6 куб. м. При нагревании его внутренняя энергия увеличилась на 18 кДж. На сколько возросло давление газа?
18 кДж = 18000 Дж
Внутреннюю энергию газа можно определить по формуле:
ΔU=32νRΔT
Отсюда изменение температуры равно:
ΔT=2ΔU3νR
Уравнение состояния идеального газа для 1 и 2 состояния:
p1V=νRT1
p2V=νRT2
Отсюда давления равны:
p1=νRT1V
p2=νRT2V
Разность давлений:
p2−p1=νRT2V−νRT1V=νRVΔT=νRV·2ΔU3νR=2ΔU3V
p2−p1=2·180003·0,6=20000 (Па)=20 (кПа)
Графические задачи на первое начало термодинамики
Рассмотрим графический способ решения задачи на первое начало термодинамики на конкретном примере.
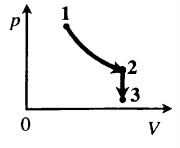
Задача: Один моль идеального одноатомного газа сначала изотермически расширился (T1 = 300 К). Затем газ охладили, понизив давление в 3 раза (см. рисунок). Какое количество теплоты отдал газ на участке 2–3?
Порядок решения:
1. Определить температуры для всех указанных точек, учитывая графики процессов, масштаб и условие задачи.
T1 = T2 = 300 К; T3 = 100 К
2. Определить, к какому изопроцессу относится тот участок графика, о котором спрашивают в задаче.
Участок 2–3 на графике — это изохорный процесс, так как давление остается постоянным.
3. Записать для него первое начало термодинамики.
В данном процессе:
ΔU=Q
4. Учитывая характер изменения величин, правильно расставить знаки: −ΔU=−Q.
5. Подставляя в первое начало термодинамики формулы для расчета изменения внутренней энергии и работы газа, решить задачу.
Формула изменения внутренней энергии газа:
ΔU=32νRΔT
Формула работы газа:
A‘=pΔV
Так как процесс изохорный, работа газа равна нулю. Поэтому количество теплоты, отданное газом на участке 2–3, равно изменению внутренней энергии газа:
Изменение внутренней энергии равно:
Q23=32νRΔT23=32·1·8,31·200=2493 (Дж)
Задание EF17492
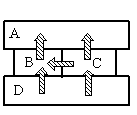 Четыре металлических бруска положили вплотную друг к другу, как показано на рисунке. Стрелки указывают направление теплопередачи от бруска к бруску. Температуры брусков в данный момент 100°С, 80°С, 60°С, 40°С. Температуру 40°С имеет брусок
Четыре металлических бруска положили вплотную друг к другу, как показано на рисунке. Стрелки указывают направление теплопередачи от бруска к бруску. Температуры брусков в данный момент 100°С, 80°С, 60°С, 40°С. Температуру 40°С имеет брусок
- A
- B
- C
- D
Алгоритм решения
- Определить тип теплопередачи.
- Вспомнить, как происходит этот тип теплопередачи.
- Сделав анализ рисунка, установить, какой брусок имеет указанную в задаче температуру.
Решение
Так как это твердые тела, поверхности которых соприкасаются друг с другом, и перенос тепла происходит без переноса вещества, то этот вид теплопередачи является теплопроводностью. Тепло всегда направлено от более нагретого тела к менее нагретому.
На рисунке видно, что самым нагретым телом является нижний брусок, так как он только отдает тепло, но не принимает его. Средний брусок справа менее нагрет, чем нижний, так как принимает от него тепло. Но он более теплый по сравнению со средним бруском слева, так как он делится с ним теплом. И оба этих бруска отдают свою энергию верхнему бруску, который сам только принимает тепло, но не отдает его. Следовательно, именно он имеет температуру +40 оС.
Ответ: A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A

pазбирался: Алиса Никитина | обсудить разбор
Задание EF17562
Газу передали изохорно количество теплоты 300 Дж. Как изменилась его внутренняя энергия в этом процессе?
Ответ:
а) увеличилась на 300 Дж
б) уменьшилась на 300 Дж
в) увеличилась на 600 Дж
г) уменьшилась на 600 Дж
Алгоритм решения
1.Записать исходные данные.
2.Записать первое начало термодинамики.
3.Установить, как меняется внутренняя энергия идеального газа.
Решение
Запишем исходные данные:
• Количество теплоты, переданное газу: Q = 300 Дж.
Первое начало термодинамики:
ΔU=Q+A
Так как по условию задачи это изохорный процесс, то работа равна 0. Следовательно, изменение внутренней энергии газа равно количеству теплоты:
ΔU=Q=300 (Дж)
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17597
Находясь в цилиндре двигателя, газ получил от нагревателя количество теплоты, равное 10 кДж. Затем он расширился, совершив работу 15 кДж. В результате всех этих процессов внутренняя энергия газа уменьшилась на
Ответ:
а) 5 кДж
б) 10 кДж
в) 15 кДж
г) 25 кДж
Алгоритм решения
1.Записать исходные данные.
2.Записать первое начало термодинамики.
3.Установить, как меняется внутренняя энергия идеального газа.
Решение
Запишем исходные данные:
• Количество теплоты, переданное газу: Q = 10 кДж.
• Работа, совершенная газом: A = 15 кДж.
Первое начало термодинамики:
ΔU=Q+A
В этой формуле за работу принимается та работа, что совершается над газом. Но в данном случае газ сам совершает работу. Поэтому первое начало термодинамики примет вид:
ΔU=Q−A=10−15=−5 (кДж)
Знак «–» указывает на то, что внутренняя энергия газа уменьшилась на 5 кДж.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17579
При постоянном давлении гелий нагрели, в результате чего он совершил работу 5 кДж? Масса гелия 0,04 кг. Насколько увеличилась температура газа?
Ответ:
а) 60 К
б) 25 К
в) 15 К
г) 3 К
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения величин в СИ.
2.Записать первое начало термодинамики.
3.Записать формулу для расчета работы газа.
4.Выполнить решение задачи в общем виде.
5.Подставить известные данные и выполнить вычисления искомой величины.
Решение
Запишем исходные данные:
• Газ совершил работу: A = 5 кДж.
• Масса гелия: m = 0,04 кг.
5 кДж = 5000 Дж
Первое начало термодинамики:
ΔU=Q+A
Учтем, что не над газом совершают работу, а сам газ совершает ее:
Отсюда:
ΔU=Q−A
Так как газ нагревали изобарно, часть тепла ушла на изменение внутренней энергии газа, а часть — на совершение этим газом работы.
Работа, совершенная газом, равна:
A=pΔV=mMRΔT
Молярная масса гелия равна 4∙10–3 кг/моль.
Отсюда:
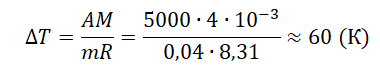
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 3.9k
Первый закон термодинамики
Необходимо запомнить
ВАЖНО!
Закон сохранения энергии, записанный применительно к термодинамической системе, выглядит следующим образом:
$Q = {A}’ + Delta U$,
где $Q$ – количество теплоты, переданное системе;
${A}’$ – работа системы (газа);
$Delta U$ – изменение внутренней энергии системы (газа).
Сообщенное системе количество теплоты расходуется на совершение системой работы против внешних сил и изменение внутренней энергии системы.к системе тела, то работа газа считается отрицательной, работа внешних тел положительной и $A = – {A}’$.
Тогда первый закон термодинамики лучше написать в виде $Delta U = Q + A$.
Применение первого закона термодинамики к изопроцессам:
– изотермический процесс, $T = const$.
$Delta T = 0; Delta U = 0, Q = {A}’$.
– изохорный процесс, $V = const$.
$Delta V = 0; {A}’ = 0$.
$Q = Delta U$.
$Delta U = frac{3}{2} frac{m}{M}R Delta T$.
– изобарный процесс, $p = const$.
${A}’ > 0, Delta V = 0;$
$Q = Delta U + {A}’$/
$Q = frac{5}{2} frac{m}{M} R Delta T$
Используя уравнение Менделеева–Клапейрона, получим
$nu R(T_2 – T_1) = P(V_2 – V_1) = P cdot Delta V$;
Подстановка в уравнение первого закона термодинамики для количества теплоты дает
$Q = Delta U + {A}’ = frac{3}{2} nu R(T_2 – T_1) + P cdot Delta V = frac{3}{2} P cdot Delta V + P cdot Delta V = frac{5}{2} P cdot Delta V = frac{5}{2} nu R(T_2 – T_1) = frac{5}{2} nu R Delta T$
Адиабатный процесс – процесс, протекающий без теплообмена, т.е. $Q = 0$.
Тогда система может совершать работу либо за счёт уменьшения внутренней энергии(газ расширяется) ${A}’ = – Delta U$, либо за счёт работы внешних тел над системой(происходит сжатие газа) $A = Delta U$.
Уравнение теплового баланса:
$Q_1 + Q_2 + Q_3 + Q_4 + … + Q_n = 0$
Первый закон термодинамики не определяет направление тепловых процессов. Необратимыми называются такие явления, которые самопроизвольно протекают только в одном направлении; в обратном направлении они протекают только при внешнем воздействии.
Направление термодинамических процессов определяется вторым законом термодинамики. Первый и второй законы термодинамики позволяют сделать заключение о невозможности создания вечного двигателя I и II рода
Лабораторная работа «Определение количества теплоты, полученной газом при его изобарном нагревании»
Связь между
молярной (Cm)
и удельной (с) теплоемкостями газа
Cm=cM,
где М
— молярная
масса газа.
Молярные
теплоемкости*
при
постоянном объеме и постоянном давлении
соответственно равны
Cv=iR/2;
Cp=(i+2)R/2
где i
— число
степеней свободы; R
— молярная
газовая постоянная.
Удельные
теплоемкости при постоянной объеме и
постоянном давлении соответственно
равны
![]() ,
,
![]() .
.
Уравнение Майера
Cр—Сv=R.
Показатель
адиабаты
![]() ,
,
или
![]() ,
,
или![]() .
.
Внутренняя
энергия идеального газа
U=N<>
или U=vCvT,
где <>—средняя
кинетическая энергия молекулы;
N—число
молекул газа;
v
— количество
вещества.
Работа, связанная
с изменением объема газа, в общем случае
вычисляется по формуле
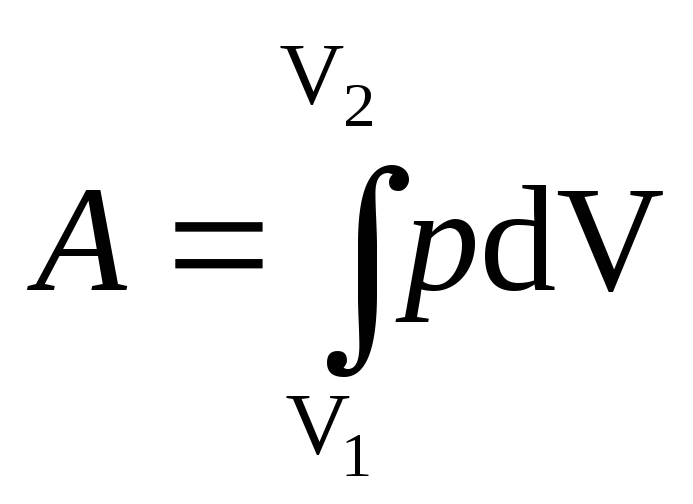 ,
,
где V1
— начальный
объем газа; V2
— его
конечный объем.
Работа газа:
а) при изобарном
процессе (p=const)
A=p(V2
–
V1);
б) при изотермическом
процессе (T=const)
![]() ;
;
*
Здесь и далее
в целях упрощения записи в индексах
обозначений молярной теплоемкости при
постоянном давлении и постоянном объеме
букву «m»
будем опускать.
в) при адиабатном
процессе
![]() ,
,
или
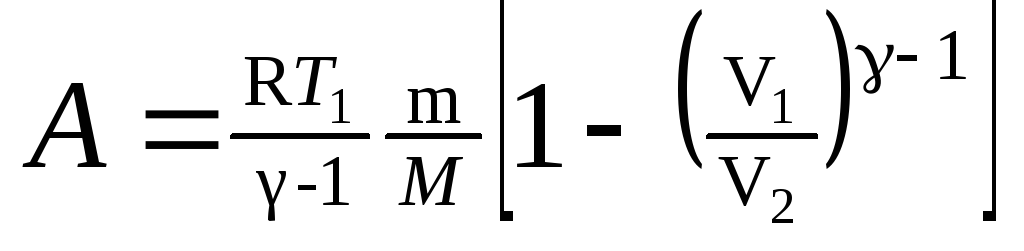 ,
,
где T1
— начальная
температура газа; T2
— его
конечная температура.
Уравнение Пуассона
(уравнение газового состояния при
адиабатном процессе)
![]() .
.
Связь между
начальным и конечным значениями
параметров состояний газа при адиабатном
процессе:
![]() .
.
Первое начало
термодинамики в общем случае записывается
в виде
Q=U+A,
где Q
– количество теплоты, сообщённое газу;
U—изменение
его внутренней энергии; А
—
работа, совершаемая газом против внешних
сил.
Первое начало
термодинамики:
а) при изобарном
процессе
![]()
б) при изохорном
процессе (A=0)
![]() ;
;
в) при изотермическом
процессе (U=0)
![]() ,
,
г) при адиабатном
процессе (Q=0)
![]() .
.
Термический
коэффициент полезного действия (КПД)
цикла
в
общем случае
![]() ,
,
где Q1—количество
теплоты, полученное рабочим телом
(газом) от нагревателя; Q2—количество
теплоты, переданное рабочим телом
охладителю.
КПД цикла Карно
![]() ,
,
или
![]() ,
,
где T1
— температура
нагревателя; T2
— температура
охладителя.
Изменение энтропии
![]()
где A
и B
— пределы
интегрирования, соответствующие
начальному и конечному состояниям
системы. Так как процесс равновесный,
то
интегрирование проводится по любому
пути.
Формула Больцмана
S=klnW,
где
S — энтропия
системы;
W
—
термодинамическая вероятность ее
состояния; k
—
постоянная Больцмана.
Примеры решения задач
Пример
1. Вычислить
удельные теплоемкости неона и водорода
при постоянных объеме (сv)
и давлении (cp),
принимая эти газы за идеальные.
Решение.
Удельные теплоемкости идеальных газов
выражаются формулами
![]() ; (1)
; (1)
![]() . (2)
. (2)
Для неона (одноатомный
газ) i1=3,
M1=2010-з
кг/моль.
Подставив в формулы
(1) и
(2) значения
i1,
M1
и R
и произведя вычисления, найдем:
сv1=
624
Дж/(кгК);
сp1=1,04
кДж/(кгК).
Для водорода
(двухатомный газ) i2=5,
M2=210-3
кг/моль.
Вычисление по
формулам
(1) и
(2) дает
следующие значения удельных теплоемкостей
водорода:
сv2=10,4
кДж/(кгK);
сp2=14,6
кДж/(кгK).
Пример
2. Вычислить
удельные теплоемкости сv
и сp
смеси неона и водорода. Массовые доли
газов соответственно равны 1=0,8
и 2=0,2.
Значения удельных теплоемкостей газов
взять из примера
1.
Решение.
Удельную теплоемкость смеси при
постоянном объеме сv
найдем из следующих рассуждений. Теплоту,
необходимую для нагревания смеси на
T,
выразим двумя соотношениями:
Q=сv(m1+m2)T
(1)
где сv
— удельная
теплоемкость смеси; m1
— масса
неона; m2
— масса
водорода, и
Q=(сv1m1+
сv2m2)T (2)
где сv1
и сv2
— удельные
теплоемкости неона и водорода
соответственно.
Приравняв правые
части выражений
(1) и
(2) и разделив
обе части полученного равенства на
T,
найдем
сv(m1+m2)=
сv1m1+
сv2m2,
откуда
![]()
Отношения
1=m1/(m1+m2)
и 1=m2/(m1+m2)
выражают массовые доли соответственно
неона и водорода. С учетом этих обозначений
последняя формула, примет вид
сv=сv11+
сv22.
Подставив в эту
формулу числовые значения величин,
найдем
сv=2,58
кДж/(кгК).
Рассуждая
таким
же
образок, получим формулу для вычисления
удельной теплоёмкости смеси при
постоянном давлении:
cp=сp11+
сp22
Произведя вычисления
по этой формуле, найдем
cp=3,73
кДж/(кгК).
Пример
3. Определить
количество теплоты, поглощаемой
водородом массой m=0,2
кг при нагревании его от температуры
t1=0°С
до температуры t2=100
°С при постоянном давлении. Найти также
изменение внутренней энергии газа и
совершаемую им работу.
Решение.
Количество теплоты Q,
поглощаемое газом при изобарном
нагревании, определяется по формуле
Q=mcpT,
(1)
где m
— масса
нагреваемого газа; cp
— его
удельная теплоемкость при постоянном
давлении; T
— изменение температуры газа.
Как известно,
![]() .
.
Подставив это выражение cp
в формулу
(1), получим
![]()
Произведя вычисления
по этой формуле, найдем
Q=291
кДж.
Внутренняя энергия
выражается формулой
![]() ,
,
следовательно, изменение внутренней
энергии
![]() .
.
После подстановки
в эту формулу числовых значений величин
и вычислений получим U=208
кДж.
Работу расширения газа
определим по формуле, выражающей первое
начало термодинамики: Q=U+A,
откуда
A=Q – U.
Подставив значения
Q и U,
найдем
А
=83 кДж.
Пример
4. Кислород
занимает объем V1=1
м3
и находится под давлением р1=200
кПа. Газ нагрели сначала при постоянном
давлении до объема V2=3
м2,
a
затем при постоянном объеме до давления
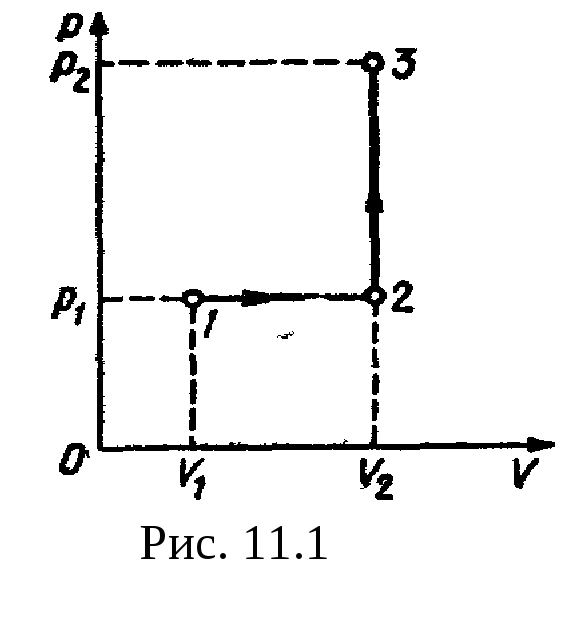
Рис
11.1 р2=500
кПа. Построить график процесса и найти:
1) изменение
U
внутренней энергии газа; 2)
совершенную им работу A;
3) количество
теплоты
Q,
переданное
газу.
Решение.
Построим график процесса (рис.
11.1). На
графике точками
1, 2, 3
обозначены состояния газа, характеризуемые
параметрами (р1,
V1,
T1),
(р1,
V2,
T2),
(р2,
V2,
T3).
1.
Изменение внутренней энергии газа при
переходе его из состояния
1 в состояние
3 выражается
формулой
U=cvmT,
где cv
— удельная
теплоемкость газа при постоянном объеме;
m
— масса
газа; T
— разность
температур, соответствующих конечному
3 и
начальному 1 состояниям, т. е. T=T3—
T1.
Так как
![]() ;
;
где М
— молярная
масса газа, то
![]() .
.
(1)
Температуры T1
и T3
выразим из уравнения Менделеева
— Клапейрона
(![]() ):
):
![]()
С учетом этого
равенство
(1) перепишем
в виде
U=(i/2)(p2V2–p1V1).
Подставим сюда
значения величин (учтем, что для кислорода,
как двухатомного газа, i=5)
и произведем вычисления:
U=3,25
МДж.
2.
Полная работа, совершаемая газом, равна
A=A1+A2,
где A1
— работа
на участке
1—2; A2
— работа
на участке
2—3,
На участке
1—2 давление
постоянно (p=const).
Работа в этом случае выражается формулой
A1=p1V=p1(V2—V1).
На участке 2—3
объем газа не изменяется и, следовательно,
работа газа на этом участке равна нулю
(A2=0).
Таким образом,
A=A1=p1(V2—V1).
Подставив в эту
формулу значения физических величин,
произведем вычисления:
A=0,4
МДж
3.
Согласно первому началу термодинамики,
количество теплоты Q,
переданное газу, равно сумме работы
A,
совершенной газом, и изменению U
внутренней энергии:
Q=A+U,
или
Q=3,65 МДж.
Пример
5. Идеальный
двухатомный газ, содержащий количество
вещества v=l
моль, находится под давлением p1=250кПа
и занимает объем V1==10
л. Сначала газ изохорно нагревают до
температуры T2=400
К. Далее, изотермически расширяя, доводят
его до первоначального давления.
После этого путем изобарного сжатия
возвращают газ в начальное состояние.
Определить термический КПД
цикла.
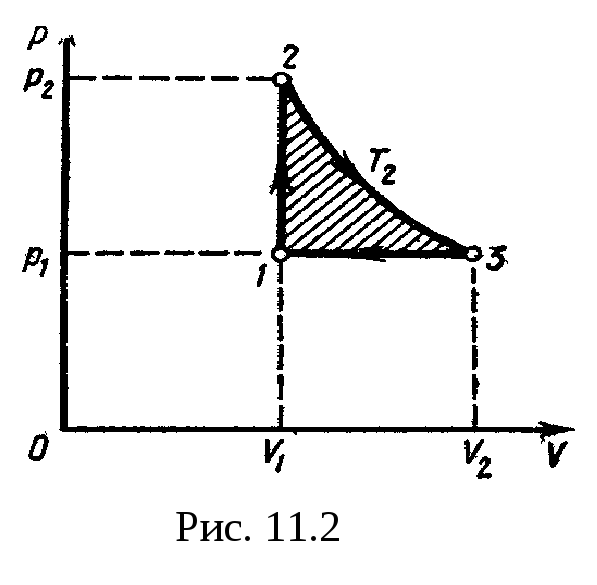
Решение.
Для наглядности построим сначала график
цикла, который состоит из изохоры,
изотермы и изобары. В координатах р,
Vэтот
цикл имеет вид. представленный на рис.
11.2. Характерные
точки цикла обозначим
1, 2, 3.
Термический КПД
любого цикла определяется выражением
=(Q1
– Q2)/Q1,
или =l
– Q2/Q1,
(1) где
Q1
—
количество теплоты, полученное газом
за цикл от нагревателя; Q2
— количество теплоты, отданное газом
за цикл охладителю.
Заметим, что разность
количеств теплоты Q1
– Q2
равна работе A,
совершаемой газом за цикл.
Эта
работа на графике в координатах р,
V (рис.
11.2)
изображается площадью цикла (площадь
цикла заштрихована).
Рабочее вещество
(газ) получает количество теплоты
Q1
на двух участках: Q1-2
на участке
1—2 (изохорный
процесс) и Q2-3
на участке
2—3
(изотермический процесс). Таким образом,
Q1=Q1-2+Q2-3.
Количество теплоты,
полученное газом при изохорном процессе,
равно
Q1-2=Cvv(T2
–
T1),
где Cv
— молярная
теплоемкость газа при постоянном объеме;
v
— количестве вещества. Температуру T1
начального состояния газа найдем,
воспользовавшись уравнением Клапейрона
— Менделеева:
T1=p1V1/(vR).
Подставив числовые
значения и произведя вычисления, получим
![]()
Количество теплоты,
полученное газом при изотермическом
процессе, равно
Q2-3=vRT2ln(V2/V1),
где V2
—
объем, занимаемый газом при температуре
T2
и давлении p1
(точка
3 на графике).
На участке
3—1 газ
отдает количество теплоты Q2,
равное
Q2=Q3-1=Cpv(T2
–T1),
где Cp
— молярная
теплоемкость газа при изобарном процессе.
Подставим найденные
значения
Q1
и Q2
в формулу
(1):
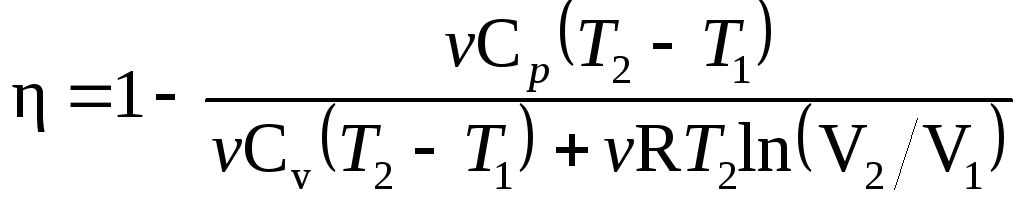
В полученном
выражении заменим отношение объемов
V2/V1,
согласно закону Гей-Люссака, отношением
температур (V2/V1=T2/T1)
и выразим Cv
и Cp
через число степеней свободы молекулы
[Cv=iR/2,
Cp=(i+2)R/2].
Тогда после сокращения на
v
и R/2
получим
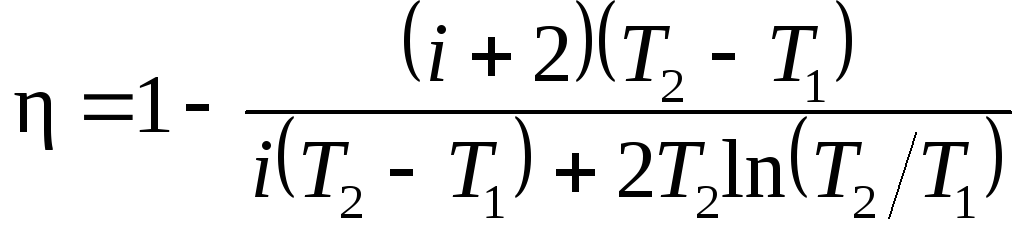 .
.
Подставив значения
i,
T1,
T2
и R
и произведя вычисления, найдем
![]()
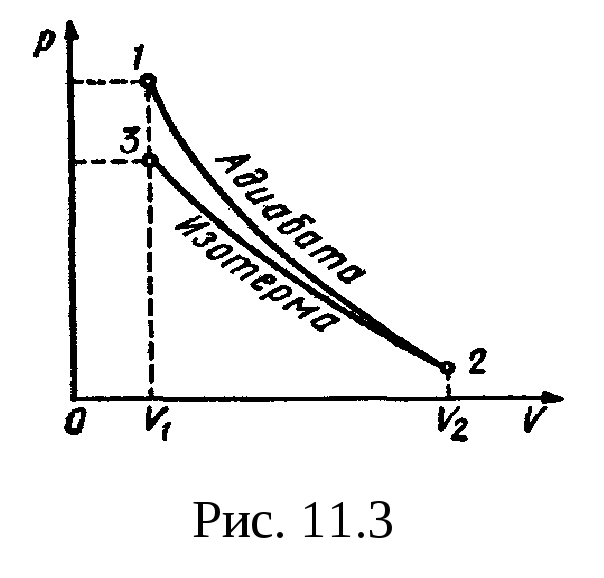
Пример 6.
В цилиндре под поршнем находится водород
массой m=0,02
кг при температуре T1=300K.
Водород начал расширяться адиабатно,
увеличив свой объем в пять раз, а затем
был сжат изотермически, причем объем
газа уменьшился в пять раз. Найти
температуру Т2,
в конце адиабатного расширения и работу
А,
совершенную газом. Изобразить процесс
графически.
Решение.
Температуры и объемы газа, совершающего
адиабатный процесс, связаны между
собой соотношением
![]() ,
,
где —
показатель адиабаты (для водорода как
двухатомного газа =1,4).
Отсюда получаем
выражение для конечной температуры T2:
![]() .
.
Подставляя числовые
значения заданных величин, находим
![]() .
.
Прологарифмируем
обе части полученного выражения:
lgT2=lg300+0,4(lgl
– lg5)=2,477+0,4( -0,699)=2,477—0,280=2,197.
Зная lgT2,
по таблицам антилогарифмов находим
искомое значение T2:
T2=157
К.
Работа A1
газа при адиабатном расширении
определяется по формуле
![]() .
.
Подставив сюда
числовые значения величин, после
вычисления получим
![]()
Работа A2
газа при изотермическом сжатии выражается
формулой
A2=RT2(m/M)ln(V2/V1).
Произведя вычисления
по этой формуле, найдем
A2=
-21 кДж.
Знак минус показывает,
что при сжатии газа работа совершена
внешними силами.
Общая работа,
совершенная газом при рассмотренных
процессах, А=A1+A2=29,8кДж
+ (-21 кДж)=8,8 кДж.
График процесса
приведен на рис.
11.3.
Пример
7. Нагреватель
тепловой машины, работающей по обратимому
циклу Карно, имеет температуру
t1==200°С.
Определить температуру Т2,
охладителя, если при получении от
нагревателя количества теплоты Q1=
1 Дж машина
совершает работу A=0,4
Дж? Потери на трение и теплоотдачу не
учитывать.
Решение.Температуру охладителя найдем, использовав
выражение для термического КПД машины,
работающей по циклу Карно,=(T1—
T2)/T1.
Отсюда
T2=
T1(1-).
(1)
Термический КПД
тепловой машины выражает отношение
количества теплоты, которое превращено
в механическою работу A,
к количеству теплоты Q1,
которое получено рабочим телом тепловой
машины из внешней среды (от нагревателя),
т. е. =A/Q1.
Подставив это выражение в формулу
(1), найдем
T2=
T1(1-A/Q).
(2)
Учтя, что T1=473
К, после вычисления по формуле
(2) получим
T2=284
К.
Пример
8. Найти
изменение S
энтропии при нагревании воды массой
m=100
г от температуры t1=0°C
до температуры
t2=100
°С и последующем превращении воды в пар
той же температуры.
Решение.
Найдем отдельно изменение энтропии S’
при нагревании воды и изменение энтропии
S”
при превращении ее в пар. Полное изменение
энтропии выразится суммой S’
и S”.
Как известно,
изменение энтропии выражается общей
формулой
![]() (1)
(1)
При бесконечно
малом изменении dT
температуры нагреваемого тела
затрачивается количество теплоты
dQ=mcdT,
где m
— масса
тела; с
— его
удельная теплоемкость. Подставив
выражение dQ
в равенство
(1), найдем
формулу для вычисления изменения
энтропии при нагревании воды:
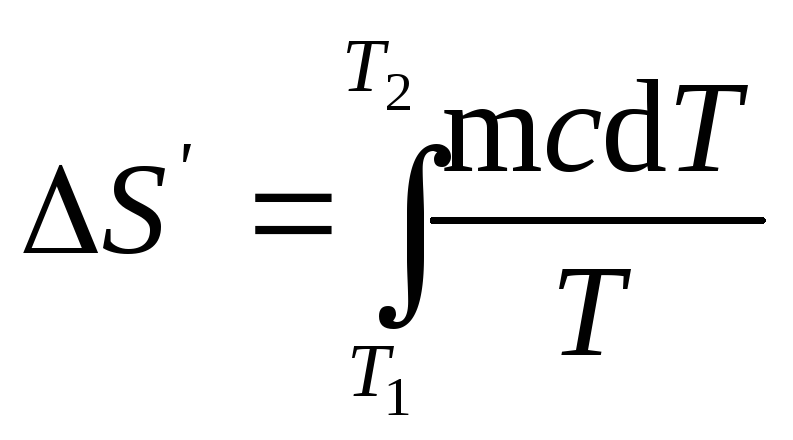 .
.
Вынесем за знак
интеграла постоянные величины и
произведем интегрирование, тогда получим
S’=mcln(T2/T1).
После вычислений
найдем S’=132
Дж/К.
При вычислении по
формуле
(1) изменения
энтропии во время превращения воды в
пар той же температуры постоянная
температуpa
T
‘выносится
за знак интеграла. Вычислив интеграл,
найдем
![]() (2)
(2)
где Q
—
количество теплоты, переданное при
превращении нагретой воды в пар той
же температуры.
Подставив в равенство
(2) выражение
количества теплоты Q=m,
где
— удельная
теплота парообразования, получим
![]()
(3)
Произведя вычисления
по формуле
(3), найдем
S”=605
Дж/К.
Полное изменение
энтропии при нагревании воды и последующем
превращении ее в пар S=S’+S”=737
Дж/К.
Пример
9. Определить
изменение S
энтропии при изотермическом расширении
кислорода массой m=10
г от объема V1=25
л до объема V2=100
л.
Решение.
Так как процесс изотермический, то в
общем выражении энтропии
![]()
температуру выносят за знак интеграла.
Выполнив это, получим
![]() (1)
(1)
Количество теплоты
Q, полученное
газом, найдем по первому началу
термодинамики: Q=U+A.
Для изотермического процесса U=0,
следовательно,
Q=A,
(2) а
работа А для этого процесса определяется
по формуле
A=(m/M)RT
ln(V2/V1).
(3)
С учетом
(2) и
(3) равенство
(1) примет
вид
S=(m/M)R
ln(V2/V1).
(4)
Подставив в
(4) числовые
значения и произведя вычисления, получим
S=(1010-3/(3210-3))
8,31
ln(10010-3/(2510-3))
Дж/К=3,60
Дж/К.
Полное условие задачи
Одноатомный идеальный газ совершает циклический процесс, показанный на рисунке. За цикл от нагревателя газ получает количество теплоты 8 кДж. Чему равна работа газа за цикл? Масса газа в ходе процесса не изменяется.
Краткое условие задачи
Решение задачи:
Определим количество теплоты, полученное газом от нагревателя за цикл. Для этого выясним, в каких процессах газ получает теплоту. Процесс 1 – 2 изобарный, газ нагревается:
и совершает работу:
Такое возможно, если газ получает теплоту.
Процесс 2 – 3 не является изопроцессом, газ в этом процессе охлаждается:
и над ним совершают работу сторонние силы:
Такое возможно, если газ отдает теплоту.
Процесс 3 – 1 является изохорным, газ нагревается:
и газ не совершает работы, и над ним не совершают работу:
Такое возможно, если газ получает теплоту.
Таким образом, теплота, полученная газом от нагревателя за цикл, равна сумме теплот, полученных в процессах 1 – 2 и 3 – 1:
Распишем эти теплоты, используя первое начало термодинамики:
Подставим выражения (8) и (9) в равенство (7):
Запишем формулы для внутренних энергий:
Для определения температур запишем уравнение состояния идеального газа для состояний 2 и 3:
Выразим температуры:
Из графика видно, что:
Тогда получаем:
Подставляем (21) в (11), а (22) в (12):
Определим теперь работу газа в процессе 1 – 2. Используем для этого геометрический смысл термодинамической работы, который заключатся в следующем: работа, совершаемая газом в процессе его расширения (или сжатия), при любом термодинамическом процессе, численно равна площади под кривой, изображающей изменение состояния газа на диаграмме (p,V). Эта площадь показана на рисунке штриховкой:
Получаем:
Подставляем (23), (24) и (25) в (10):
Отсюда получаем:
Найдем теперь работу за цикл. Используем для этого геометрический смысл работы за цикл, который заключается в том, что она численно равна площади фигуры, ограниченной кривыми, изображающими изменение состояния газа. Эта площадь показана на рисунке штриховкой:
Получаем:
Подставим в выражение (28) равенство (27):
Подставляем данные и находим численный результат:
Ответ: 0,7 кДж.
Первый закон термодинамики .
( Q=Delta U+A )
(Q) – Количество теплоты, полученное газом
Если (; Q>0 ; ,) то газ получает тепло
Если (; Q < 0 ; , ) то газ отдает тепло
( Delta U )-Изменение внутренней энергии газа
(A) – Работа газа
(A=P Delta V )
( Delta V )- Изменение объема газа
Если изменение объема газа равно нулю (( Delta V =0) ), то и работа газа равна нулю
Если газ расширяется , то (; A>0 ; ,) (газ совершает положительную работу)
Если газ сужается , то (; A < 0 ; , ) и говорят:”Внешние силы совершают работу над газом ”
или ” Работа газа отрицательна ”
Задача 1.
Внутренняя энергия идеального газа возрастает на 300 Джоулей ((Delta U=300 Дж) ; , )
при этом газ совершает работу (A=200 Дж ; . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 2.
Газ получает из внешней среды (Q=500 Дж ; , ) при этом газ совершает работу (A=200 Дж ; . )
Найти изменение внутренней энергии ( Delta U ; .)
Показать ответ
Показать решение
Видеорешение
Задача 3.
Газ получает из внешней среды (Q=700 Дж ; , ) при этом внутренняя энергия газа возрастает
на 150 Джоулей ( (Delta U=150 Дж) ; .)
Какую работу совершает газ?
Показать ответ
Показать решение
Видеорешение
Задача 4.
Газ получает из внешней среды (Q=1700 Дж ; , ) при этом внутренняя энергия газа возрастает
на 250 Джоулей ( (Delta U=250 Дж) ; .)
Какую работу совершает газ?
Показать ответ
Показать решение
Видеорешение
Задача 5.
Внутренняя энергия идеального газа уменьшается на 300 Джоулей ((Delta U=-300 Дж) ; , )
при этом газ совершает работу (A=500 Дж ; . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 6.
Внутренняя энергия идеального газа уменьшается на 400 Джоулей ((Delta U=-400 Дж) ; , )
при этом газ совершает работу (A=450 Дж ; . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 7.
Внутренняя энергия идеального газа уменьшается на 500 Джоулей ((Delta U=-500 Дж) ; , )
при этом газ совершает работу (A=500 Дж ; . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 8.
Внутренняя энергия идеального газа уменьшается на 500 Джоулей ((Delta U=-500 Дж) ; , )
при этом газ совершает работу (A=200 Дж ; . )
Какое количество теплоты получил(или отдал) газ?
Показать ответ
Показать решение
Видеорешение
Задача 9.
Внутренняя энергия идеального газа уменьшается на 1200 Джоулей ((Delta U=-1200 Дж) ; , )
при этом газ совершает работу (A=400 Дж ; . )
Какое количество теплоты получил(или отдал) газ?
Показать ответ
Показать решение
Видеорешение
Задача 10.
Газ отдал во внешнюю среду 40 Джоулей ( (Q=-40 Дж ) ; , ) при этом
внутренняя энергия газа уменьшается на 120 Джоулей ((Delta U=-120 Дж) . )
Найти совершенную газом работу.
Показать ответ
Показать решение
Видеорешение
Задача 11.
Газ отдал во внешнюю среду 85 Джоулей ( (Q=-85 Дж ) ; , ) при этом
внутренняя энергия газа уменьшается на 135 Джоулей ((Delta U=-135 Дж) . )
Найти совершенную газом работу.
Показать ответ
Показать решение
Видеорешение
Задача 12.
Газ отдал во внешнюю среду 180 Джоулей ( (Q=-180 Дж ) ; , ) при этом
внутренняя энергия газа уменьшается на 100 Джоулей ((Delta U=-100 Дж) . )
Найти совершенную газом работу.
Показать ответ
Показать решение
Видеорешение
Задача 13.
Работа внешних сил над газом равна 200 Дж ( (A=-200 Дж) )
при этом
внутренняя энергия газа увеличивается на 300 Джоулей ((Delta U=300 Дж) . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 14.
Внешние силы совершают над газом работу 800 Дж ( (A=-800 Дж) )
при этом
внутренняя энергия газа увеличивается на 800 Джоулей ((Delta U=800 Дж) . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 15.
Газ получает количество теплоты 500 Джоулей, при этом его внутрення энергия возрастает на 500 Джоулей.
Какую работу совершает газ?
Показать ответ
Показать решение
Видеорешение
