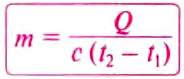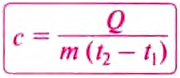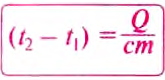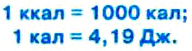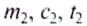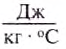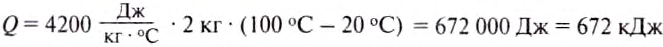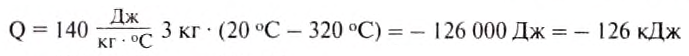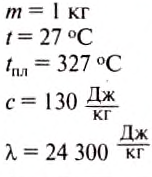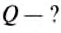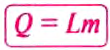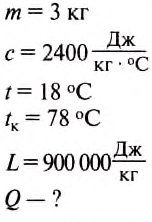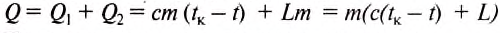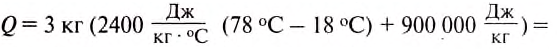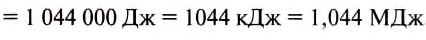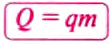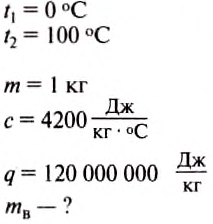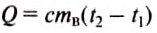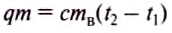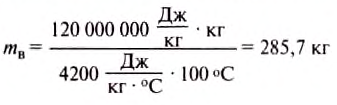Содержание:
Тепловое движение и температура тела и её измерение:
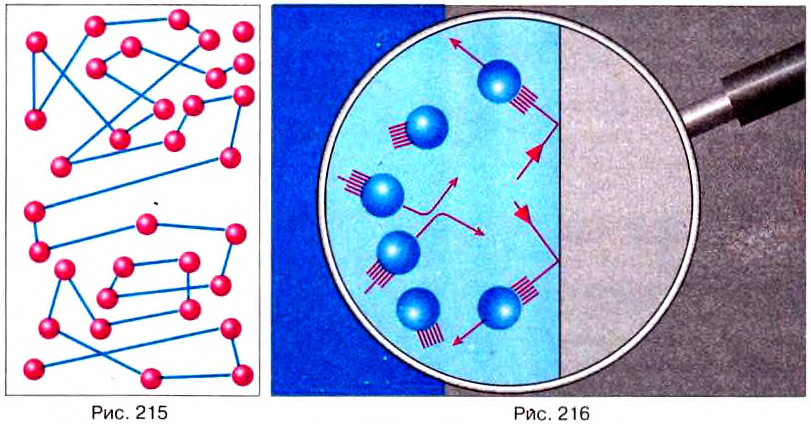
Из уроков физики в 7 классе вы знаете, что тела состоят из молекул. Молекулы находятся в непрерывном хаотическом (беспорядочном) движении и взаимодействуют между собой. Каждая отдельная молекула совершает механическое движение, подобное тому, что мы изучали ранее. Двигаясь с большой скоростью, она сталкивается с другими молекулами и при этом изменяет направление движения. Из рис. 215 видно, что траектория отдельной молекулы — это сложная ломаная линия, но можно определить пройденный молекулой путь и скорость её движения. Наблюдать такое движение, даже вооружённым глазом, невозможно из-за чрезвычайно малых размеров движущихся частиц. Только в специальных сложных опытах можно видеть результат механического движения групп молекул.
Исследование движения молекул методами механики ешё больше усложняется из-за чрезвычайно большого количества двигающихся частиц в обычных телах. Практически невозможно проследить за всеми «участниками» движения: миллиарды миллиардов маленьких частиц движутся с большими скоростями в разных направлениях, сталкиваются друг с другом и со стенками сосуда, изменяют собственные скорости движения (рис. 216).
Как же всё-таки можно исследовать механические характеристики движущихся молекул в телах: оценить скорости молекул, пути, которые они проходят между столкновеньями и пр. ?
Оказывается, что результатом беспорядочного механического движения молекул является не только перемещение их в пространстве, но и тепловое состояние тела, степень его нагретости. Чем быстрее движутся молекулы, тем выше температура тела и наоборот: если повышается температура тела, то и увеличивается скорость движения молекул. Поэтому хаотическое движение огромного количества молекул изучают методами физики тепловых явлений, а само такое движение называют тепловым.
Тепловое движение – это беспорядочное движение молекул и атомов, определяющее температуру тела.
В свою очередь, знания о строении вещества и тепловом движении позволяют объяснить различные тепловые явления. Предположим, что в двух сосудах содержатся газообразные молекулы разной массы, например в одной — кислород, а в другой — азот. Опыты свидетельствуют, что при одинаковой температуре средние кинетические энергии молекул обоих веществ одинаковые, а значения средних скоростей молекул оказываются различными.
Таким образом, приходим к выводу, что температура тела — это физическая характеристика теплового состояния вещества, из которого состоит тело, степени его нагретости, и она определяется значением средней кинетической энергии хаотического движения частиц вещества.
Несколько столетий назад наукой ещё не была признана теория молекулярного и атомного строения вещества, поэтому представление о температуре тела возникло не в связи с движением молекул и атомов в нём, а из сравнения ощущений тепла или холода, хотя они неточны и часто субъективны. Для объективных измерений температуры во время контакта с исследуемой средой были созданы специальные приборы – термометры. Действие термометров основывается на разных физических явлениях, зависящих от температуры: тепловом расширении жидкостей, газов, твёрдых тел, изменении с температурой электрических свойств вещества и др. Чаше всего используют жидкостные термометры, с помощью которых можно измерять температуру в широких пределах.
Опыты свидетельствуют, что при контакте горячего и холодного тел их температуры со временем выравниваются, т. е. горячее тело остывает, а холодное — нагревается. Установление теплового равновесия между несколькими телами означает, что их температуры становятся одинаковыми и в дальнейшем уже не будут различаться. С молекулярной точки зрения это означает, что в состоянии теплового равновесия во всех контактирующих телах кинетическая энергия беспорядочного движения частиц вещества одинакова.
Отсюда следует, что при измерении температуры жидкостным термометром нужно соблюдать такие правила: поместить колбу термометра в ту среду, температуру которой измеряют; подождать определенное время, пока столбик жидкости в трубке термометра остановится, т. е. пока не установится теплоовое равновесие между колбой и средой; не вынимая термометр из среды, определить по шкале значение его температуры.
В 1597 г. Г. Галилей сконструировал прибор – прототип термометра, который назвал термоскопом. Термоскоп Галилея (рис. 217) состоял из тонкой стеклянной трубки с небольшой колбой на верхнем конце.
Открытый нижний конец трубки опускали в сосуд с водой, которая заполняла и часть трубки. Когда воздух в колбе нагревался или охлаждался, то столбик воды в трубке опускался или поднимался.
Поскольку высота столбика зависела как от температуры, так и от атмосферного давления, то измерять температуру термоскопом было невозможно, тем не менее он позволял сравнивать температуры разных тел в одно и то же время и в одном и том же месте. Уже тогда врач и анатом Санкториус из Падуанского университета, не зная о термоскопе Галилея, сконструировал собственный подобный термометр и применял его для измерения температуры тела человека.
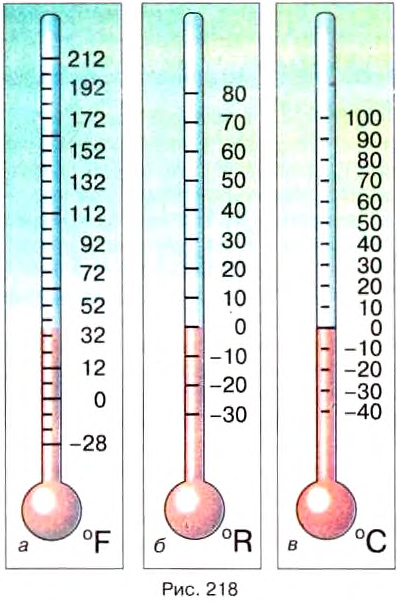
Первый современный термометр (рис. 218, а) был описан в 1724 г. Габриэлем Фаренгейтом, стеклодувом из Голландии.
Современников учёного удивляло, что показания разных спиртовых термометров, изготовленных Фаренгейтом, согласовывались между собой. Секрет Фаренгейта состоял в том, что он тщательно наносил деления на шкалу, используя для этого несколько опорных точек. За О0 F — первую фиксированную точку -Фаренгейт принял температуру плавления смеси льда, воды и нашатыря (аммоний хлорида 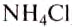
Во Франции в практику вошла шкала Реомюра (рис. 218, б) (около 1740 г.), построенная на точках замерзания воды (0° R) и её кипения (80°R). Реомюр на основании измерений вывел, что вода расширяется между этими двумя точками на 80 тысячных долей своего объёма (правильное значение 0,084). Спиртовые термометры Реомюра со временем были заменены ртутными термометрами Делюка (1740 г.), поскольку коэффициент расширения ртути в меньшей степени изменялся с температурой по сравнению со спиртом.
Современная температурная шкала (рис. 218, в) была предложена в 1742 г. шведским физиком А. Цельсием (1701—1744), который в своих ртутных термометрах ввёл 100-градусную шкалу.
Ему не нравились отрицательные значения температур, и он счёл нужным перевернуть старую шкалу и поместить О °С в точку кипения воды, а 100 °С — в точку её замерзания. Но «перевёрнутая» шкала не приобрела популярности и в скором времени по предложению шведского натуралиста К. Линнея возвратились к обычному размещению опорных температур.
К началу XIX в. термометр становится обычным физическим прибором. Принято, что единица температуры 1 °С (один градус Цельсия) — это одна сотая часть интервала между температурами плавления льда и кипения дистиллированной воды при нормальном атмосферном давлении (101 325 Па).
Кстати:
На Земле есть много жарких и холодных мест. В Долине смерти (Калифорния, США) зафиксирована жара + 56,7 °С, но рекорд принадлежит пустыне Сахара (Африка) + 63 °С в тени. Самыми холодными местами в Северном полушарии являются Якутия и Гренландия, где температура достигает – 70 °С. Но самое холодное место на нашей планете – это Антарктида. В её глубинных районах зафиксирована температура – 94,5 °С. На таком морозе металл становится хрупким, керосин превращается в густую желеобразную массу и не воспламеняется даже при контакте с пламенем.
Внутренняя энергия и способы её изменения
Тает снег, плавятся металлы, испаряется вода, нагревается жидкость в сосуде – всё это тепловые явления. При тепловых явлениях изменяются температура и состояние тела: лёд превращается в воду, вода — в пар и наоборот. Чтобы расплавить олово, нужно сначала его нагреть до температуры плавления, а потом плавить, непрерывно сообщая ему энергию. А какие физические величины характеризуют тепловое состояние вещества и дают возможность объяснять тепловые явления?
Вам уже известны понятия механической энергии, виды механической энергии – потенциальная и кинетическая. Сжатая или растянутая пружина обладает потенциальной энергией, каждое движущееся тело обладает кинетической энергией. Вы также знаете, что потенциальная и кинетическая енергии тела могут изменяться, что при их изменении выполняется механическая работа.
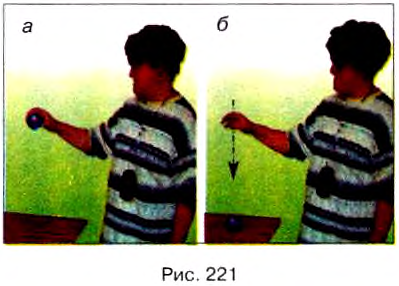
Опыт. Поднимем пластилиновый шар над столом и отпустим его. Под действием силы тяжести шар упадёт на стол и прилипнет к нему.
Проанализируем, как изменялась механическая энергия шара при этом. Шар, поднятый над столом, имел потенциальную энергию, его кинетическая энергия равнялась нулю, так как он был неподвижен (рис. 221, а). Когда шар отпустили, то во время падения его потенциальная энергия уменьшалась, так как уменьшалась высота шара над столом, а кинетическая энергия увеличивалась, так как увеличивалась скорость движения шара. Перед касанием шара поверхности стола его потенциальная энергия относительно него равнялась нулю, а значение кинетической энергии — значению потенциальной энергии шара до начала падения (рис. 221, б).
Когда шар упал на стол, то он остановился, т. е. его кинетическая энергия также стала равной нулю. Значит, механическая энергия шара относительно стола в этом положении равна нулю.
Куда же «исчезла» механическая энергия шара ?
Можно предположить, что такое «исчезновение» механической энергии связано с какими-то другими, отличными от механического движения, изменениями в состоянии тел. Действительно, если с помощью очень чувствительного термометра измерить температуры шара и поверхности стола до падения шара и после него, то окажется, что их температуры повысились. Следовательно, произошли изменения в тепловом состоянии тел при взаимодействии – увеличилась средняя скорость их молекул.
Изменение энергии теплового движения молекул тела произошло за счёт изменения кинетической энергии их движения вследствие изменения средней скорости молекул и изменения потенциальной энергии их взаимодействия из-за деформации шара.
Энергию движения и взаимодействия частиц, из которых состоит тело, называют внутренней энергией тела.
Итак, в процессе удара шара об стол произошёл переход механической энергии шара во внутреннюю энергию.
Внутренняя энергия тела зависит от его температуры. Повышается температура тела — увеличивается его внутренняя энергия и наоборот.
Внутренняя энергия тела не зависит ни от механического движения тела, ни от положения этого тела относительно других тел.
Итак, внутренняя энергия тела, в частности, связана со скоростью движения его частиц. Она изменяется, если изменяется средняя скорость движения частиц, из которых состоит тело. А каким образом можно увеличить или уменьшить эту скорость, т.е . изменить внутреннюю энергию тела?
Наблюдение 1. Вам, наверное, приходилось накачивать насосом велосипедную шину или мяч (рис. 222, а, б), и вы наблюдали, что насос при этом нагревался. 
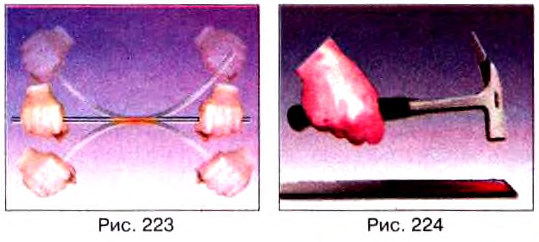
Если вы согнёте и разогнёте несколько раз проволоку из мягкого металла (рис. 223), то обнаружите, что место сгиба нагрелось.
Если вы ударите несколько раз молотком по куску свинца (рис. 224), то он также нагреется.
Когда у вас на морозе мёрзнут руки, то вы их согреваете, потирая одну об другую. Во всех случаях внутренняя энергия тел увеличивается за счёт выполнения работы над ними.
Внутреннюю энергию тела можно увеличить, выполняя над ним работу.
Опыт. В толстостенном стеклянном сосуде, плотно закрытом пробкой, содержится водяной пар. Через специальное отверстие будем накачивать в него воздух. Спустя некоторое время пробка выскочит из сосуда (рис. 225).
В тот момент, когда пробка выскакивает, в сосуде возникает туман (водяной пар превратился в жидкость), появление которого означает, что воздух в сосуде стал холоднее. Следовательно, внутренняя энергия воздуха в сосуде уменьшилась. Объясняется это тем, что сжатый воздух, выталкивая пробку, выполнил работу.
Если работу выполняет само тело, то его внутренняя энергия уменьшается.
Внутреннюю энергию тела можно изменить и другим способом, без выполнения работы.
Наблюдение 2. Кастрюля с водой, стоящая на горячей плите (рис. 226); металлическая ложка, помещённая в стакан с горячей водой; батарея водяного отопления, по которой проходит горячая вода; камин, в котором горит огонь (рис. 227); Земля, которую освещает Солнце (рис. 228), — все они нагреваются.

Можно наблюдать и охлаждение тел, когда, например, горячую ложку помещают в холодную воду, закипевший чайник снимают с плиты.
В приведённых примерах происходило изменение внутренней энергии тел, но механическая работа при этом не выполнялась. Такой процесс изменения внутренней энергии тел называют теплообменом, или теплопередачей.
Теплообмен – это процесс передачи внутренней энергии от нагретого тела к холодному без выполнения ими или над ними механической работы.
Каким образом происходит теплообмен при контакте холодной ложки с горячей водой? Вначале средняя скорость и кинетическая энергия молекул горячей волы превышают среднюю скорость и кинетическую энергию атомов металла, из которого изготовлена ложка. Но в местах касания ложки с водой при столкновениях быстрые молекулы воды передают часть своей кинетической энергии атомам металла, и они начинают двигаться быстрее. Кинетическая энергия молекул воды при этом уменьшается, а кинетическая энергия атомов металла возрастает. Вместе с энергией изменяется и температура: вода постепенно охлаждается, а ложка – нагревается. Этот процесс будет длиться до тех пор, пока температуры воды и ложки не станут одинаковыми.
Внутреннюю энергию тела можно изменить путём выполнения работы или теплообмена.
Виды теплообмена
Теплообмен может осуществляться разными способами.
Наблюдение 1. Если прикоснуться к предметам, изготовленным из металла и дерева, то металлические предметы кажутся холоднее деревянных, хотя их температура одинакова, например комнатная. Мы в этом случае ощущаем прохладу, так как металлические предметы лучше проводят тепло и быстрее отбирают его от руки, т. е. у них высокая теплопроводность.
Наблюдение 2. Радиаторы водяного отопления размещают под окном у пола. От них внизу холодный воздух нагревается и поднимается вверх. Держа руку над зажжённой свечкой, вы ощутите, как от её пламени вверх поднимаются тёплые потоки воздуха. Видим, что теплообмен может происходить за счёт перенесения масс газа или жидкости. Такой процесс передачи тепла называют конвекцией (от латинского конвекцио – перенесение).
Наблюдение 3. Жизнь на Земле может существовать потому, что планета имеет пригодную для этого температуру за счёт тепла, получаемого со светом от Солнца. Земля и Солнце расположены на большом расстоянии (150 млн километров), в пространстве между ними нет воздуха. В этом случае передача тепла происходит за счёт ещё одного вида теплообмена – излучения.
Опыт 1. К медному стержню парафином или воском приклеим несколько спичек (рис. 229).
Один конец стержня будем нагревать в пламени спиртовки или газовой горелки. Во время нагревания парафин начнёт плавиться, и спички будут отпадать от стержня. Сначала отпадут те спички, которые размещены ближе к пламени, а потом поочерёдно — остальные.
Передачу тепла от более нагретой части тела к менее нагретой ( вследствие теплового движения частиц тела называют теплопровод ностью. При этом происходит передача энергии, а переноса вещества нет.
Опыт 2. В сосуд, в котором нагревается вода, поставим алюминиевый, деревянный, пластмассовый и стеклянный стержни (рис. 230).
Положим сверху на них парафиновые шарики. Сначала расплавится шарик на алюминиевом стержне, потом — на стеклянном. На деревянном и пластмассовом стержнях парафин не расплавится.
Различные вещества имеют разную теплопроводность.
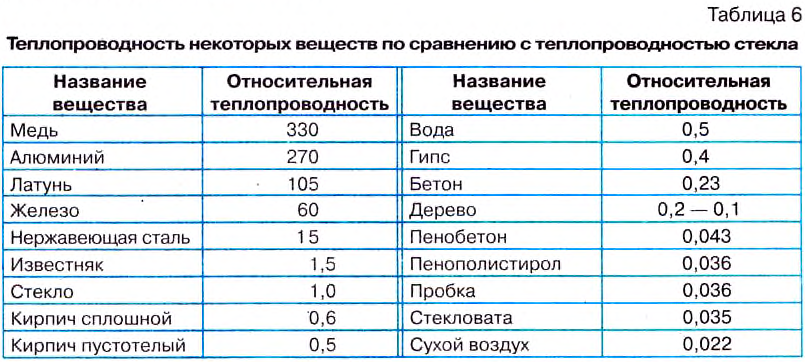
При комнатной температуре теплопроводность различных тел разная (табл. 6).
Хорошими проводниками тепла являются металлы, особенно серебро, золото, медь. Плохими проводниками тепла является вода, кирпич, бетон, лёд. Например, теплопроводность бетона в 210 раз ниже теплопроводности алюминия. Пробка, пенопласт, воздух имеют очень низкую теплопроводность. Такие вещества называют теплоизоляторами.
Шерсть, пух содержат воздух, и поэтому имеют низкую теплопроводность. Они защищают тело животных от охлаждения или перегрева.
Для достаточной теплоизоляции здания его стены из бетона имеют толщину 30 см. Для обеспечения такой же теплоизоляции стены из алюминия имели бы толщину 63 м, а стены из пробки — 1,2 см.
Опыт 3. Если нагревать воду в верхней части пробирки (рис. 231), то она в этом месте закипит, а внизу даже могут оставаться кусочки льда.
Это свидетельствует о том, что вода – плохой проводник тепла. Если же нагревать сосуд с водой снизу, то вся вода прогреется и закипит (рис. 232), так как будет происходить перемещение верхних холодных и нижних нагретых слоёв воды.
Такое перемещение жидкости называют конвекцией.
Конвекция – процесс переноса энергии струями жидкости или газа.
Опыт 4. Зажжём свечу, разместим над пламенем вырезанную из бумаги «змейку» (рис. 233).

Под действием струй нагретого воздуха бумажная «змейка» вращается.
Явлением конвекции можно объяснить возникновение ветров в природе.
Наблюдение 4. Зажжём свечу. Когда над ней разместим сначала низкий, а потом — более высокий стеклянный цилиндр, открытый с обеих сторон (рис. 234), то заметим, что пламя свечки будет удлиняться. Такой цилиндр — это маленькая дымовая труба, создающая воздушную тягу. Чем выше труба, тем лучше тяга.
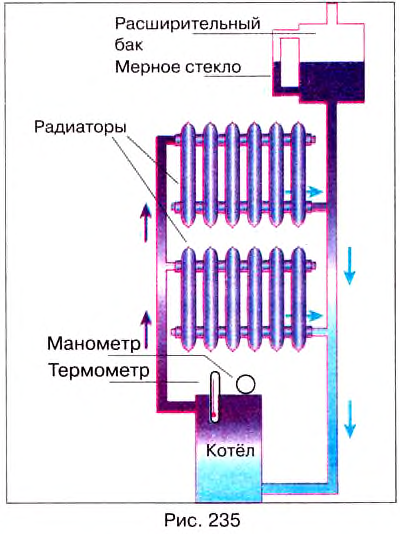
В современных домах устанавливают водяное отопление. Вода, нагретая в котле (рис. 235), поднимается по трубам вверх и отдаёт тепло радиаторам отопления.
Вследствие конвекции нагревается воздух в помещении, при этом охлаждаются радиаторы и вода в них. Охлаждённая вода опускается вниз к котлу, где снова нагревается. Чтобы вся вода, имеющаяся в системе водяного отопления, нагревалась, котлы или другие нагревательные установки размещают в доме как можно ниже.
Наблюдение 5. Сидя возле костра, мы ощущаем от него тепло. Следовательно, происходит теплопередача, но не вследствие теплопроводности, так как воздух между пламенем костра и нами — это теплоизолятор. Конвекцией в этом случае теплообмен тоже объяснить нельзя, так как мы находимся не над костром, а рядом с ним, и потоки холодного воздуха идут к костру с нашей стороны. Здесь имеем дело ещё с одним видом теплопередачи, который называют излучением, о нём мы уже упоминали, когда обсуждали нагревание Земли светом от Солнца сквозь безвоздушное пространство). Отсюда вытекает, что для теплопередачи с помощью излучения не нужно никакой промежуточной среды между телом и нагревателем.
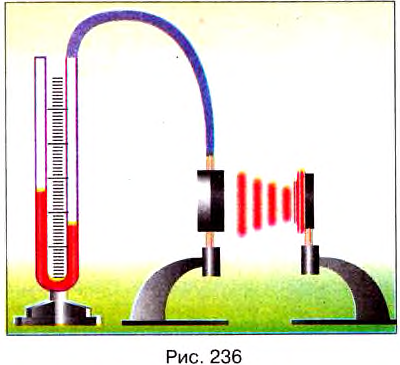
Опыт 5. Возьмём теплоприёмник — круглую коробочку, одна сторона которой зеркальная, а вторая — покрыта чёрной краской (рис. 236), соединим его с помощью резиновой трубки с манометром.
Разместим на некотором расстоянии от теплоприёмника включённую электроплитку. Вскоре манометр покажет, что давление воздуха в коробочке теплоприёмника увеличился за счёт его нагревания от стенки коробочки, температура которой повысилась вследствие теплообмена с электроплиткой. Люди и все окружающие тела при любой температуре являются источниками теплового излучения, которое по своей природе и свойствам подобно свету и радиоволнам. Чем выше температура тела, тем интенсивнее тепловое излучение от него. Мы не видим его, но воспринимаем кожей как жар, идущий от источника. В нашем опыте раскалённая электроплитка и была мощным источником тепловых лучей, воспринимаемых теплоприёмником.
Излучение – это вид теплопередачи, который может происходить без промежуточной среды между телами и обусловлен испусканием и поглощением ими теплового излучения.
Все тела не только испускают, но и поглощают тепловые лучи. Чтобы исследовать, как влияют свойства тела на его способность поглощать тепловое излучение, повторим наш опыт дважды: сначала повернём теплоприёмник к электроплитке блестящей поверхностью, а потом — тёмной.
Опыты, подобные нашим, показали, что тела с тёмной поверхностью лучше излучают и поглощают тепловые лучи. Тела, со светлой и блестящей поверхностью, излучают и поглощают энергию хуже чем с тёмной. Теперь можно ответить на вопрос, для чего одни предметы красят тёмными красками, а другие — делают блестящими. Например, чайник с блестящей поверхностью дольше сохраняет воду тёплой, так как такая поверхность меньше излучает тепла, чем тёмная. Вагоны-холодильники красят в светлый цвет, чтобы они не нагревались на солнце. Летом мы чаще носим светлую одежду, а зимой — тёмную.
Кстати:
Средняя температура тела человека 36,6 °С поддерживается организмом в разнообразных условиях жизни и деятельности. В тканях и органах его тела непрерывно происходят процессы окисления, которые сопровождаются выделением тепла. Большая часть энергии, получаемой в результате усвоения пищи, затрачивается на механическую работу, выполнение которой также сопровождается выделением тепла в организме. Всё это тепло рассеивается телом человека в окружающую среду.
Самочувствие человека в значительной мере зависит от количества тепла, которое теряет организм. В зависимости от назначения помещения, вида выполняемой работы и влажности воздуха нормальной для человека может быть температура окружающей среды от 11 до 23 °С. Низкие температуры ускоряют процессы выделения теплоты в организме, повышение температуры вызывает усиление потовыделения, которое является средством регулирования температуры организма. Однако организм человека способен поддерживать собственную температуру постоянной только при изменении температуры окружающей среды в небольших пределах. Например, для человека, находящегося в состоянии покоя, во влажном воздухе температура тела начинает повышаться при температуре воздуха выше 30 °С, а в сухом – выше 40 °С.
Особенно чувствителен организм человека к интенсивности излучения.
Отрицательно влияет на него излучение горячих предметов. Большое влияние на самочувствие человека оказывает температура поверхностей помещений, с которыми тело человека обменивается теплом вследствие излучения. Изменение температуры стен от 20 до 10 °С сопровождается увеличением излучения тела человека на 30 %.
Пример №1
В каком состоянии внутренняя энергия 1 кг воды больше: в твёрдом, жидком или газообразном?
Ответ: внутренняя энергия 1 кг воды в газообразном состоянии больше, чем в жидком, а в твёрдом — меньше, чем в жидком состоянии.
Пример №2
Как объяснить, что пожарный в специальной одежде спокойно стоит в огне и не ощущает его (рис. 237)?
Ответ: ткань спецодежды изготовлена из материалов, обладающих очень низкой теплопроводностью. Кроме того, спецодежда имеет серебристый цвет и отражает тепловые лучи.
Пример №3
Объясните, почему птицы с большими крыльями (орлы, коршуны) могут держаться на одной высоте, не делая взмахов крыльями.
Ответ: за счёт восходящих потоков воздуха, т. е. конвекции.
Количество теплоты и удельная теплоёмкость вещества
Для количественного описания свойств теплообмена применяют специальные физические величины, одной из которых является количество теплоты.
Количество теплоты показывает, какая кинетическая энергия хаотического (беспорядочного) движения молекул передалась от одного тела к другому при теплообмене, в результате которого изменилась внутренняя энергия обоих тел, находящихся в тепловом контакте.
От каких условии теплообмена зависит количество теплоты? Всем вам, наверное, приходилось нагревать воду, и вы хорошо знаете, что для нагревания чайника, заполненного до краёв водой, нужно большее количество теплоты, чем для того же чайника, наполненного наполовину. Отсюда следует, что чем больше масса тела, тем большее количество теплоты нужно затратить, чтобы изменить его температуру на то же количество градусов.
Опыт 1. На одинаковые нагреватели поставим одинаковые сосуды, в один из которых налито 200 г воды (рис. 242, а), а во второй — 400 г (рис. 242, б).

Чем больше масса тела, тем большее количество теплоты нужно сообщить ему, чтобы нагреть до определённой температуры.
В то же время, остывающее тело передаёт окружающей среде тем большее количества теплоты, чем больше его масса. Например, если оставить остывать сосуды из предыдущего опыта, то сосуд, в котором масса воды равна 400 г, понизит свою температуру до комнатной за большее время, чем тот, в котором 200 г воды, и отдаст при этом вдвое большее количество теплоты.
Опыт 2. Поставим теперь сосуд с водой комнатной температуры на нагреватель и нагреем воду, например, на 10°С. Процесс нагревания продолжается некоторое время, за которое телу будет передано определённое количество теплоты. Если мы решим поднять температуру воды ещё на 10 °С, то процесс нагревания нужно будет продолжить, и он будет длиться такое же время, которое потребовалось в первой части опыта. Понятно, что при этом воде будет передано дополнительно такое же количество теплоты, что и ранее. Следовательно, чем больше разность конечной и начальной температур тела при нагревании, тем большее количество теплоты необходимо для этого.
Чем больше разность конечной и начальной температур тела, тем большее количество теплоты ему будет сообщено при нагревании.
Опыт 3. Возьмём два одинаковых сосуда, первый из них содержит 400 г воды (рис. 243, а), а второй — 400 г масла (рис. 243, б) комнатной температуры и поставим их на одинаковые нагреватели.
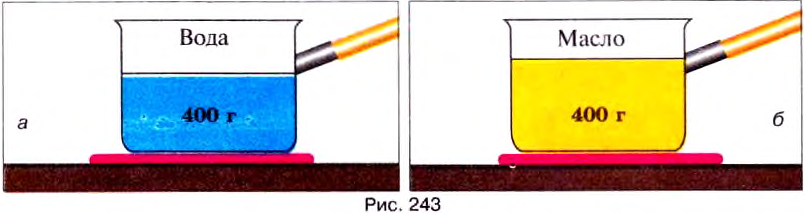
Наблюдая за показаниями термометров, погружённых в каждую из жидкостей, увидим, что масло приобретёт заданную температуру первым. Чтобы температура воды сравнялась с температурой масла, нагревание воды нужно продолжить и сообщить ей дополнительное количество теплоты.
Количество теплоты, необходимое для нагревания тела до определённой температуры, зависит от того, из какого вещества состоит тело.
Опыт 4. Нагреем железное и алюминиевое тела одинаковой массы до определённой температуры, например до 40°С (рис. 244).
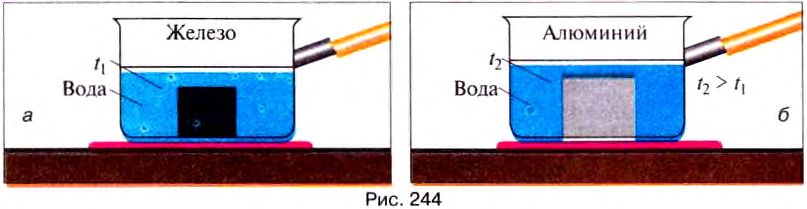
Тела из разных веществ одинаковой массы и температуры, остывая, выделяют разное количество теплоты.
Количество теплоты – это тепловая энергия, которую получает или теряет тело при теплообмене. Оно зависит от вещества, из которого состоит тело, массы этого тела и разности его конечной и начальной температур.
Количество теплоты обозначают большой латинской буквой 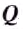
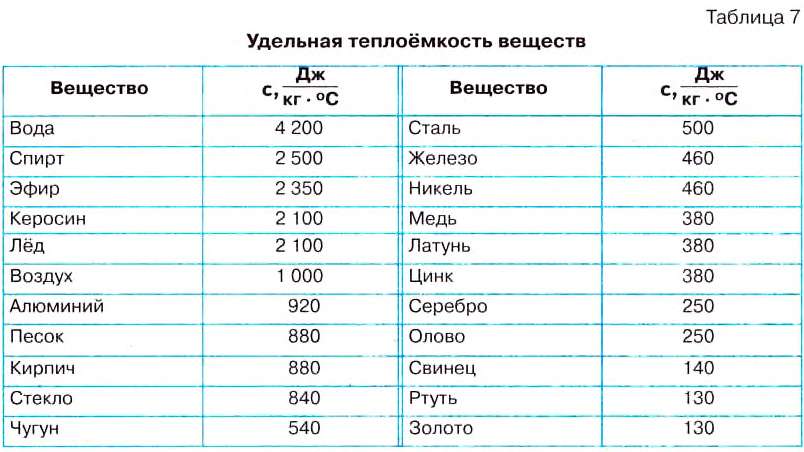
Чтобы повысить температуру воды массой 1 кг на 1°С, нужно сообщить ей количество теплоты, равное 4200 Дж; если нагревать 1 кг золота на 1°С, то понадобится лишь 130 Дж. Следовательно, для нагревания каждого вещества массой 1 кг на 1°С требуется определённое количество теплоты. При охлаждении на 1°С этих веществ массой 1 кг будут выделяться такие же количества теплоты.
Физическую величину, показывающую, какое количество теплоты необходимо для изменения температуры вещества массой 1 кг на 1°С, называют удельной теплоёмкостью вещества.
Удельную теплоёмкость вещества обозначают малой латинской буквой с. Единицей удельной теплоёмкости вещества является один джоуль, поделённый на один килограмм и один градус Цельсия 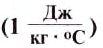
В таблице 7 приведены значения удельной теплоёмкости для многих веществ, используемых в промышленности и быту.
Что означает выражение “удельная теплоемкость серебра равна 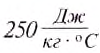
Это выражение означает, что для нагревания 1 кг серебра на 1°С нужно затратить количество теплоты, равное 250 Дж, или при охлаждении 1 кг серебра на 1°С выделяется количество теплоты, равное 250 Дж.
Анализируя табл. 7, видим, что вода имеет очень большую удельную теплоёмкость. Поэтому вода в морях и океанах, нагреваясь летом, поглощает большое количество теплоты, и в местах вблизи больших водоёмов летом не бывает так жарко, как в местах, отдалённых от воды. Зимой вода охлаждается и отдаёт значительное количество теплоты, поэтому зима в этих местах не такая суровая. Благодаря большой удельной теплоёмкости воду широко используют в системах водяного отопления, для охлаждения двигателей.
Ранее из результатов опытов был сделан вывод, что для нагревания любого тела нужно затратить определённое количество теплоты, зависящее от рода вещества, из которого оно изготовлено, и пропорциональное массе тела и разности его конечной и начальной температур.
А как вычислить количество теплоты, если заданы определённые значения всех этих величин ?
Например, нужно рассчитать, какое количество теплоты получила при нагревании медная деталь массой 5 кг, если её температура увеличилась с 20 до 520°С. В табл. 7 находим значение удельной теплоёмкости меди: она равна 380 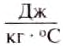

Чтобы вычислить количество теплоты, необходимое для нагревания тела, или количество теплоты, которое выделяет тело при охлаждении, нужно удельную теплоёмкость вещества умножить на массу тела и на разность конечной и начальной температур тела.
Математически это правило записывают в виде такой формулы: 
где 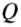
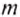
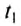
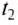
Чтобы определить массу тела, которое нагревается или охлаждается, нужно количество теплоты разделить на удельную теплоёмкость вещества и на разность конечной и начальной температур тела:
Чтобы определить удельную теплоёмкость вещества, из которого изготовлено тело, нужно количество теплоты разделить на массу тела и на разность его конечной и начальной температур:
Чтобы определить, на сколько градусов изменилась температура тела, нужно количество теплоты разделить на удельную теплоёмкость вещества и на массу тела:
Кстати:
Единицей количества теплоты с давних времён была особая единица – калория (от латинского слова калор – тепло, жар).
Калория (кал) – это количество теплоты, которое нужно сообщить 1 г воды для нагревания её на 1 °С. Можно сказать также, что калория – это количество теплоты, которую теряет 1 г воды, охлаждаясь на 1 °С.
Пользуются также большей единицей количества теплоты – килокалорией (это можно увидеть в надписях на консервах):
Тепловой баланс
Тела с разными температурами обмениваются между собой теплотой. Тела, более нагретые, отдают часть своей энергии телам, менее нагретым, до тех пор, пока у них температура не уравняется .
Количество теплоты, отданное всеми охлаждающимися телами, равно количеству теплоты, полученному всеми нагревающимися телами (при условии, что при этом не происходит превращения тепла в другие виды энергии).
При расчётах, касающихся обмена энергией между телами, всегда следует учитывать всё то количество теплоты, которое в рассматриваемых тепловых явлениях отдают тела, и то количество теплоты, которое получают другие тела, принимающие участие в тех же явлениях: эти количества теплоты должны быть равны между собой.
Применим это утверждение к смешиванию двух жидкостей разной температуры.
Обозначим массу холодной жидкости через 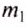
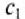
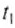
Если обе жидкости смешать в одном сосуде (для упрощения задачи будем считать, что он изготовлен из вещества, являющегося полным теплоизолятором и не принимает участия в теплообмене), то молекулы горячей жидкости будут отдавать энергию молекулам холодной жидкости до тех пор, пока не установится некоторая промежуточная температура смеси жидкостей. Обозначим окончательную температуру смеси большой греческой буквой 
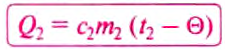
а количество теплоты, полученное жидкостью, которая нагревается,
такой: 
Поскольку количество теплоты, отданной охлаждающейся жидкостью, равно количеству теплоты, полученной нагревающейся жидкостью, т. е. 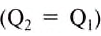

Это уравнение называют уравнением теплового баланса. В своё время для случая воды его вывел петербургский академик Георг Рихман.
Из уравнения теплового баланса можно, если остальные величины известны, определить массу одной из смешиваемых жидкостей, или её начальную температуру, или температуру смеси, а также значение неизвестной удельной теплоёмкости.
Пример №4
Какое количество теплоты нужно затратить, чтобы 2 кг води нагреть от 20 до 100°С?
Дано:
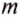
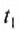
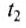
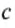
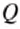
Решение:
Количество теплоты, необходимое для нагревания тела, определяется по формуле: 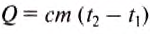
Ответ: 
Пример №5
Какое количество теплоты выделится при охлаждении 3 кг свинца от 320 до 20 0С?
Дано:
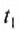
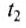
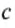
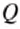
Решение:
Количество теплоты, необходимое для нагревания тела, определяется по формуле :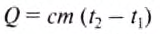
Знак «—» означает, что энергия выделилась при охлаждении тела.
Ответ: 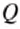
Плавление и кристаллизация твёрдых тел
Наблюдение. Лёд из морозильной камеры, положим в тарелку; через некоторое время он начинает таять и полностью превращается в воду.
Опыт 1 . Кусочки олова поместим в стальную ложку и будем нагревать на спиртовке или газовой горелке (рис. 248).

Следовательно, нагревая тела, их можно перевести из твёрдого состояния в жидкое, и, наоборот, охлаждая, – из жидкого состояния в твёрдое.
Процесс перехода вещества из твёрдого состояния в жидкое называют плавлением. Процесс перехода вещества из жидкого состояния в твёрдое называют кристаллизацией (отвердеванием).
Зимой, осенью, весной, когда температура воздуха может быть О °С. тают снег и лёд, но вместе с тем замерзает вода. При О °С снег и лёд тают (плавятся), а вода замерзает (отвердевает). На Севере, в Антарктиде, где температура воздуха может опускаться ниже — 40 “С, нельзя пользоваться ртутным термометром, так как ртуть отвердевает при температуре — 39 “С. Там используют спиртовые термометры, так как спирт замерзает при температуре -114°С.
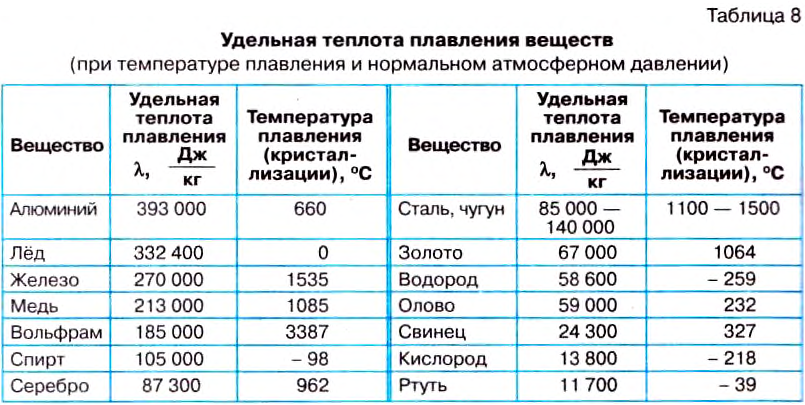
Каждое вещество плавится или кристаллизуется при определённой температуре. Температуру, при которой вещество плавится, называют температурой плавления, а при которой отвердевает, — температурой кристаллизации. Из опыта известно, что вещества отвердевают при той же температуре, при которой плавятся. Во время плавления тела поглощают теплоту, а во время отвердевания — выделяют. Значения температур плавления для наиболее используемых веществ представлены в таблице 8 на с. 193.
Опыт 2. В сосуд с кусочками льда поместим термометр и будем его подогревать (рис. 249). Лёд будет таять, а термометр будет показывать 0 °С. Пока весь лёд не растает, температура (0 °С) в сосуде изменяться не будет.
При плавлении вещества его температура не изменяется.
Опыт 3. Поставим на чашку весов закрытый сосуд со льдом, уравновесим весы (рис. 250, а). Через некоторое время лёд превратится в воду. Равновесие весов не нарушится (рис. 250, б).
При переходе вещества из одного состояния в другого его масса не изменяется.
Опыт 4. Нальём в бутылку воды и плотно её закупорим. Поместим бутылку с водой в холодильную камеру. Когда вода замёрзнет, бутылка треснет, так как объём льда больше, чем воды (рис. 251).
При переходе вещества из одного состояния в другое изменяется его плотность, а, следовательно, и объём данной массы вещества.
Теперь выясним, от чего зависит количество теплоты, которое нужно затратить, чтобы расплавить кристаллическое тело при температуре плавления или которое выделяется во время его кристаллизации.
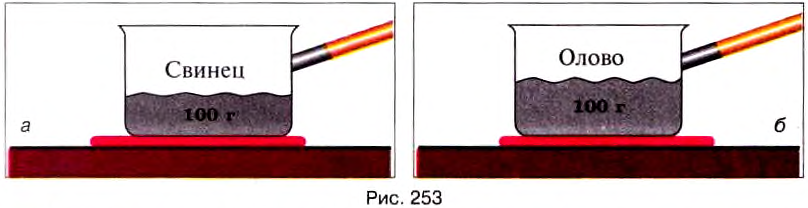
Опыт 5. В одном сосуде будем плавить 100 г свинца (рис.252, а), а во втором — 200 г (рис. 252, б).
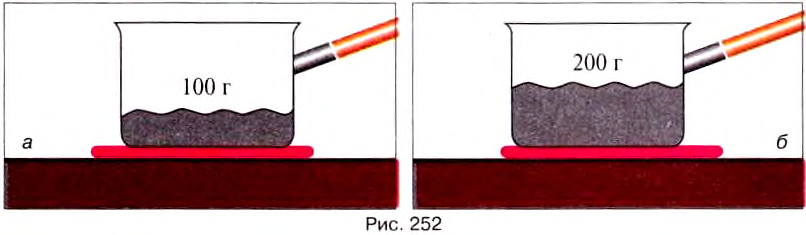
Количество теплоты, необходимое для плавлення тела, зависит от его массы.
Опыт 6. На одинаковых нагревателях в одном сосуде будем плавить 100 г свинца (рис. 253, а), а во втором – 100 г олова (рис. 253, б). В результате опыта увидим, что для плавления олова нужно затратить большее количество теплоты, чем для плавления свинца.
Количество теплоты, необходимое для плавления тела, зависит от рода вещества, из которого изготовлено тело.
Величину, характеризующую энергетические затраты на плавление определённого вещества, называют удельной теплотой плавления вещества. Её обозначают малой греческой буквой 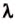
Единицей удельной теплоты плавления вещества в СИ является один джоуль на килограмм 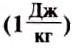
Удельную теплоту плавления вещества определяют с помощью опытов. Было установлено, что удельная теплота плавления льда равна 340 ООО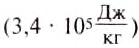
Удельная теплота плавления вещества – это физическая величина, показывающая, какое количество теплоты нужно сообщить телу массой 1 кг, чтобы превратить его в жидкость при температуре плавления.
Из опытов определена удельная теплота плавления для каждого вещества, значения которой для наиболее используемых веществ представлены в таблице 8.
Чтобы рассчитать количество теплоты 

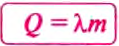
где 

Количество теплоты, которая выделяется при отвердевании тела массой 
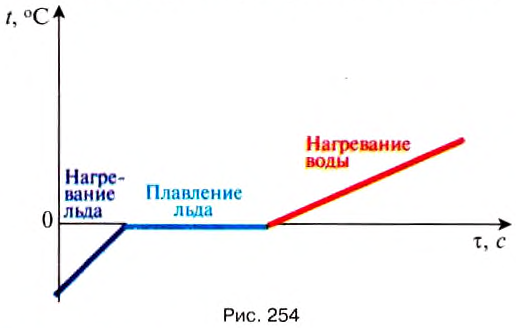
Процессы нагревания и кристаллизации можно изобразить графически. По оси Оу откладываем значение температуры вещества, а по оси Ох -время нагревания и плавления вещества. Например, на рис. 254 графически изображены процессы нагревания льда, плавления льда и нагревания воды. График нагревания и плавления вещества состоит из трёх участков: для нагревания льда — это прямая линия с определённым углом наклона, зависящим от значения удельной теплоёмкости вещества: чем больше её значение, тем меньший наклон, температура льда возрастает прямо пропорционально времени нагревания; для плавления льда – это горизонтальная линия, температура смеси воды и льда остаётся постоянной и равна температуре плавления льда до тех пор, пока весь лёд не растает; для нагревания образовавшейся воды — прямая линия, угол наклона которой определяется удельной теплоёмкостью воды. Её значение больше, чем для льда, поэтому и наклон меньший.
Пример №6
Пользуясь таблицей 8, выясните, в каком состоянии находятся металлы: серебрю, золото, медь, алюминий, вольфрам, сталь при температуре 1000 °С?
Ответ: серебро, алюминий — в жидком состоянии; золото, медь, вольфрам, сталь – в твёрдом состоянии.
Пример №7
Какое количество теплоты нужно затратить, чтобы расплавить 1 кг свинца, взятого при температуре 27 °С?
Дано:
Решение:
Для того чтобы расплавить свинец, его нужно нагреть до температуры плавления, а потом расплавить. Количество теплоты, необходимое для нагревания свинца, определяем по формуле: 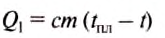
Количество теплоты, необходимое для того, чтобы расплавить свинец, определяем по формуле: 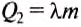
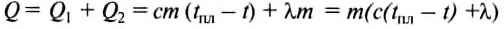
Подставив значения величин, получим:
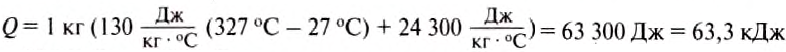
- Заказать решение задач по физике
Испарение и конденсация жидкостей
Наблюдение 1. Летом после дождя лужи быстро высыхают; вечером, когда воздух становится холоднее, выпадает роса. Если оставить на огне сосуд с водой, то спустя некоторое время воды в сосуде не останется, так как она выкипит. Следовательно, жидкости могут испаряться, т. е. переходить в газообразное состояние. Легко убедиться, что чем выше температура, тем интенсивнее происходит этот процесс. Так, летом лужи высыхают быстрее, чем весной или осенью.
Процесс перехода жидкости в пар (в газообразное состояние) называют парообразованием.
Существуют два способа перехода жидкости в газообразное состояние: испарение и кипение.
Испарение – это парообразование, происходящее со свободной поверхности жидкости.
Испарение происходит при любой температуре, но скорость его зависит от нескольких причин. Чтобы убедиться в этом, выполним такие опыты.
Опыт 1. На бумагу капнем эфира, воды, спирта, масла. Сначала испарится эфир, потом — спирт, вода, а масло будет высыхать несколько дней.
Скорость испарения зависит от вида жидкости.
Опыт 2. Нальём одинаковое количество воды в стакан и широкую тарелку. Вода сначала испарится из тарелки, а потом — из стакана.
Скорость испарения зависит от площади поверхности жидкости.
Опыт 3. Одну тарелку с водой поставим на столе в комнате, а другую — на батарею водяного отопления или другое тёплое место. Вода сначала испарится из той тарелки, которая стоит в более тёплом месте.
Скорость испарения зависит от температуры жидкости.
Наблюдение 2. Выстиранное бельё развешивают для просушки. В сухую ветреную тёплую погоду бельё сохнет намного быстрее, чем в тихую или прохладную погоду.
Скорость испарения зависит от наличия потоков воздуха и его влажности.
Теперь, зная причины, от которых зависит скорость испарения, мы можем объяснить, для чего, например, переливают чай из стакана в блюдце, дуют на горячий борщ или кашу, пользуются веером при высокой температуре воздуха.
При определённой температуре (температуре кипения) жидкости начинают интенсивно испаряться не только с поверхности, но и изнутри с образованием пузырьков. Это явление называют кипением (рис. 256).
Кипение – это интенсивное парообразование не только со свободной поверхности жидкости, но и из всего объёма внутрь пузырьков пара, которые при этом возникают.
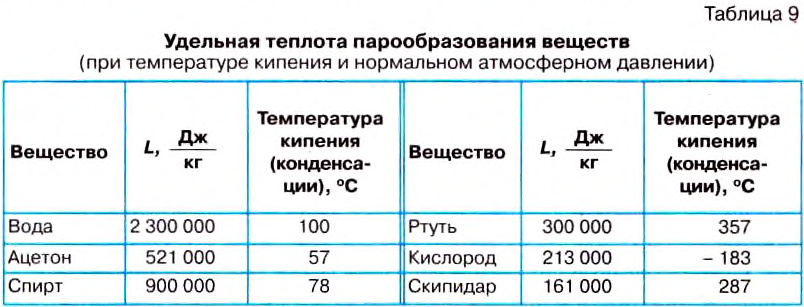
Значение температуры кипения жидкостей зависит от атмосферного давления. В таблице 9 на с. 199 представлены значения температуры кипения некоторых жидкостей при нормальном атмосферном давлении: вода кипит при температуре 100 °С, ацетон — при 56 °С, жидкий кислород — при —183 °С.
Из опытов известно, что с охлаждением газов до определённой температуры (температуры конденсации) они начинают сжижаться и становятся жидкостями. Установлено, что это происходит при той же температуре, при которой соответствующая жидкость кипит. Это обратные процессы, как и в случае перехода воды в лёд, направление перехода зависит от конкретных физических условий: если жидкость получает теплоту, то кипит и переходит в газообразное состояние; если газ отдаёт теплоту, то он сжижается, т. е. конденсируется. Например, аммиак конденсируется при температуре —33,4°С, жидкий кислород — при —183 °С, воздух — при – 195 °С.
В воздухе содержится много водяного пара. Когда воздух охлаждается, пар переходит в жидкое состояние: образуются тучи, туман, роса.
Теперь выясним, от чего зависит количество теплоты, которое нужно затратить, чтобы испарить жидкость при температуре кипения или которое выделяется при конденсации газа.
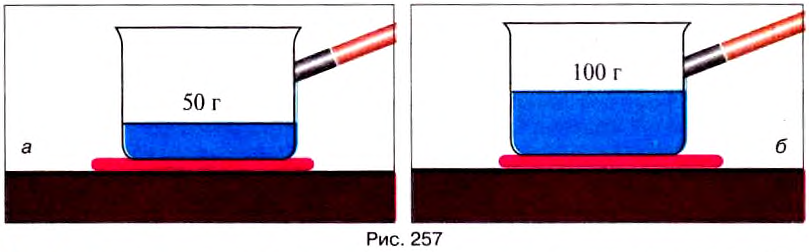
Опыт 4. Поставим на плиту два сосуда, в один из которых нальём 50 г воды (рис. 257, а), а в другой – 100 г воды (нагреватели и сосуды одинаковы) (рис. 257, б). Доведём воду до кипения и будем испарять. Сначала испарится вода в сосуде, где было 50 г, а потом — в сосуде со 100 г воды.
Количество теплоты, необходимое для испарения жидкости при температуре кипения, зависит от массы жидкости.
Опыт 5. На одинаковые нагреватели поставим сосуды, в одном из которых 50 г воды (рис. 258, а), а во втором — 50 г спирта (рис. 258, б).
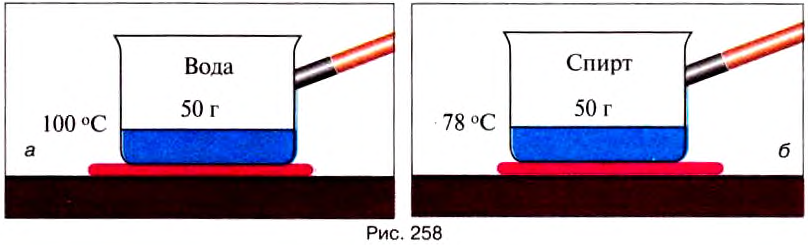
Количество теплоты, необходимое для испарения жидкости при температуре кипения, зависит от рода вещества.
Величину, которая характеризует энергетические затраты на испарение определённой жидкости массой 1 кг, называют удельной теплотой парообразования. Её обозначают большой латинской буквой L . Единицей удельной теплоты парообразование вещества в СИ является один джоуль на килограмм 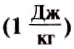
Удельную теплоту парообразования вещества определяют с помощью опытов. Установлено, что удельная теплота парообразования воды при 100 °С равна 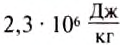
Это значит, что для превращения воды массой 1 кг в пар при 100 °С необходимо 2 300 000 Дж энергии.
При обратном процессе-конденсации — такое же количество теплоты выделится.
Удельная теплота парообразования вещества -это ■ физическая величина, определяющая, какое количество теплоты необходимо, чтобы превратить жидкость массой 1 кг в пар при температуре кипения.
Каждая жидкость имеет свою удельную теплоту парообразования. Значения удельной теплоты парообразования некоторых жидкостей приведены в таблице 9.
Чтобы рассчитать количество теплоты 

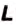
где 
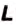

Количество теплоты, выделяющееся при конденсации пара массой 
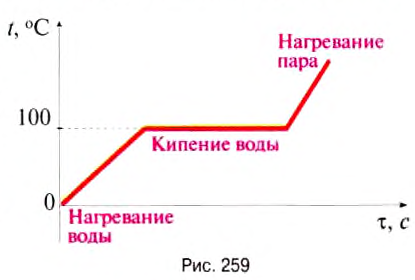
Процессы нагревания и испарения можно изобразить графически. По оси Оу откладываем значение температуры жидкости, а по оси Ох — время нагревания и испарения жидкости. Например, на рис. 259 графически изображены процессы нагревания и испарения воды кипением.
График нагревания и испарения жидкости состоит из трёх участков: для нагревания жидкости — это прямая линия с определённым углом наклона, который зависит от значения удельной теплоёмкости жидкости; для кипения жидкости — это горизонтальная линия, температура жидкости остаётся постоянной и равна температуре кипения жидкости до тех пор, пока вся жидкость испарится; для нагревания образовавшегося пара — прямая линия, угол наклона которой определяется удельной теплоёмкостью пара, температура пара возрастает прямо пропорционально времени.
Пример №8
Почему жирный суп долго не остывает даже тогда, когда его налили в тарелку?
Ответ: жир очень медленно испаряется по сравнению с водой, поэтому тонкий слой жира на поверхности супа задерживает испарение воды, в связи с этим охлаждение супа замедляется.
Пример №9
Какое количество теплоты нужно затратить, чтобы превратить 3 кг спирта, взятого при температуре 18 °С, в пар?
Дано:
Решение:
Для превращения спирта в пар нужно сначала его нагреть до температуры кипения, а потом испарить.
Количество теплоты, необходимой для нагревания -спирта, определяем по формуле: 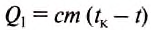
Количество теплоты, необходимое для испарения спирта
определяем по формуле: 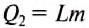
Тогда количество теплоты, затраченной на нагревание и испарение спирта, определим так:
Подставив значения величин, получим:
Ответ: 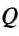
Сгорание топлива и удельная теплота
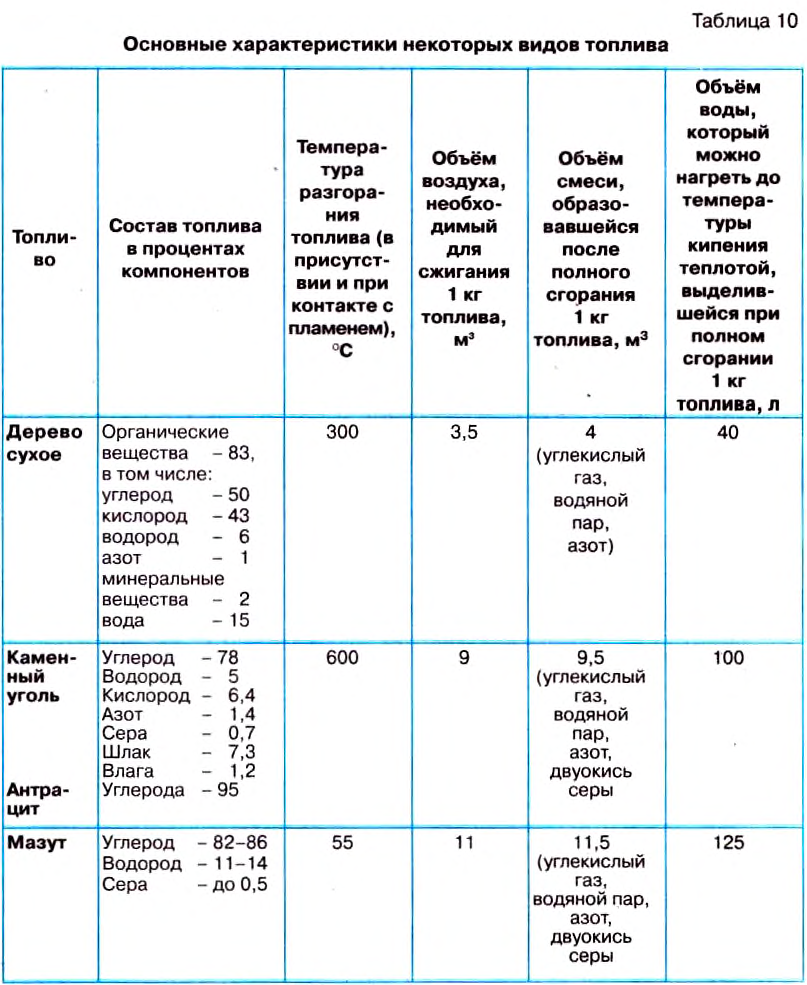
Основным источником энергии для обеспечения движения железнодорожных локомотивов, автомобилей, тракторов, самолётов и т. п. являются разные виды топлива. В промышленности, на транспорте и в быту используют такие виды топлива: уголь, горючие сланцы, нефть, бензин, дизельное топливо, природный газ и др.
Выясним, при каких условиях происходит полное сгорание топлива и каковы его результаты.
Опыт 1. Зажжём свечу. Она будет гореть. Накроем её стеклянным сосудом (рис. 261, а). Через некоторое время свеча гаснет (рис. 261, б).
Почему?
Процесс горения происходит при наличии воздуха.
Опыт 2. Цилиндр с поршнем соединяем со стеклянным шаром. На поршень ставим гирю. Нагреваем шар, сжигая сухое топливо. Воздух, нагревшийся в шаре, расширяется и выталкивает поршень, поднимая гирю, т. е. выполняет работу.
При сжигании топлива выделяется энергия, за счёт которой выполняется работа.
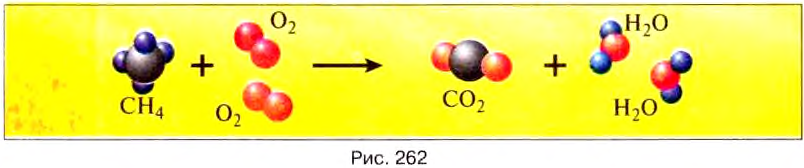
Уголь, нефть, мазут, дерево содержат углерод (табл. 10). При горении молекулы углерода соединяются с молекулами кислорода, содержащегося в воздухе. Каждая молекула углерода взаимодействует с двумя молекулами кислорода, образуя при этом молекулу углекислого газа. С образованием этой молекулы выделяется энергия.
При полном сгорании углерода образуется углекислый газ и выделяется энергия:
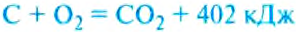
Горение связано с разрушением одних молекул и образованием других, например при горении метана образуются углекислый газ и вода (рис. 262) с выделением энергии:
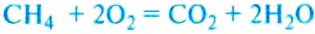
При горении изменение внутренней энергии вещества происходит не путём теплообмена или выполнения работы телом или над телом, а в результате термохимических реакций с участием топлива. При этом энергия движения молекул продуктов сгорания, а значит, и их температура будут больше, чем у молекул топлива.
Горение топлива — это процесс соединения молекул топлива с молекулами кислорода, который сопровождается выделением определённого количества теплоты и образованием новых веществ (табл. 10).
Опыт 3. Два одинаковых стакана наполним водой одинаковой массы. Под одним стаканом зажжём одну таблетку сухого топлива, а под вторым — дне таблетки. Температуру воды в стаканах измеряем с помощью термометров. После полного сгорания сухого топлива температура воды во втором стакане оказывается выше, чем в первом.
Количество теплоты, выделяющееся при полном сгорании топлива, зависит от массы топлива.
При конструировании и производстве тепловых двигателей всегда нужно знать, какое количество теплоты необходимо для работы определённого двигателя, а значит, и определять вид топлива. Для определения необходимого количества топлива нужно знать, какое количество теплоты выделяется при полном его сгорании. Чтобы сравнивать, какой вид топлива при его полном сгорании выделяет больше теплоты, ввели такую физическую величину, как удельная теплота сгорания топлива.
Количество теплоты, выделяющееся при полном сгорания 1 кг топлива, называют удельной теплотой сгорания топлива.
Удельную теплоту сгорания топлива обозначают малой латинской буквой 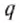
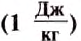
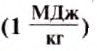
Удельная теплота сгорания топлива – это физическая величина, являющаяся энергетической характеристикой разных видов топлива.
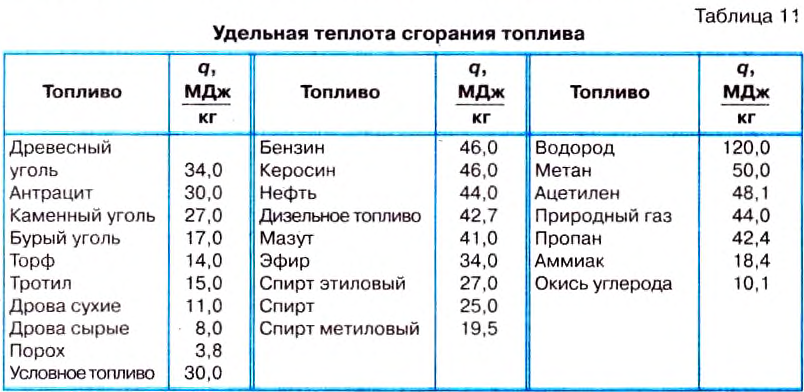
Её значения для распространённых видов топлива приведены в таблице 11.
Следует подчеркнуть, что приведённые в таблице данные соответствуют количеству теплоты, выделяющейся при полном сгорании топлива.
Чтобы подсчитать, какое количество теплоты выделится при полном сгорании 5 кг керосина, нужно рассуждать так. При сгорании 1 кг керосина выделяется 46 Мдж теплоты. Когда сгорит 5 кг керосина, количество выделенной теплоты будет в 5 раз больше, а именно: 46 Мдж • 5 = 230 МДж.
Чтобы определить количество теплоты, выделяющейся вследствие полного сгорания данной массы определённого вида топлива, нужно удельную теплоту сгорания этого вида топлива умножить на массу топлива:
где 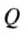
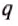
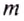
Кстати:
При неполном сгорания углерода, содержащегося в топливе, в печах или котлах, в двигателях внутреннего сгорания, выделяется оксид углерода (угарный газ): 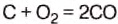
Пример №10
Каждое топливо в присутствии воздуха и в контакте с огнём загорается при определённой температуре: например, мазут — при 55 °С; сухое дерево – при 300 °С; каменный уголь – при 600 °С. Можно ли сразу засыпать в котел каменный уголь?
Ответ: нельзя, каменный уголь не загорится, так как в котле не достигнута соответствующая температура.
Пример №11
Какое количество воды можно нагреть от 0 до 100 °С, сжигая 1 кг водорода?
Дано:
Решение.
Количество теплоты, выделившееся при полном сгорании топлива, определяем по формуле: 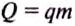
Количество теплоты, необходимой для нагревания води, определяем по формуле:
Считаем, что вся энергия, выделившаяся при сгорании водорода, пойдёт на нагревание воды. Тогда:
Отсюда: 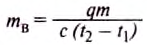
Подставим значение величины, получим:
Ответ: 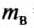
Тепловые двигатели
Тепловые машины были созданы в начале XVIII ст., в период бурного развития текстильной и металлургической отраслей промышленности. Паровую водоподъёмную установку построили англичане Т. Ньюкомен и Дж. Коули в 1712 г. В России паровой двигатель создал И. Ползунов в 1765 г., а в 1784 г. в Англии Д. Уатт получил патент на универсальный паровой двигатель. Создание паровых машин, двигателей внутреннего сгорания положило начало развитию автомобильного транспорта и самолётостроения. Газовая турбина дала толчок перестройке в авиации, самолёты с поршневыми двигателями были заменены реактивными и турбореактивными лайнерами, скорость которых
приближается или больше скорости звука 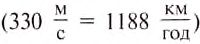
С помощью реактивных двигателей осуществлена давняя мечта человечества — выход в космическое пространство. На электростанциях паровые турбины приводят в движение электрические генераторы, вырабатывающие электрический ток.
Все тепловые машины, независимо от их устройства и назначения, разделяют на два вида: тепловые двигатели и холодильные установки.
Опыт. Нальём в пробирку немного воды, плотно закроем её пробкой (рис. 264) и нагреем воду до кипения. Под давлением пара пробка вылетит из пробирки вверх. В этом случае энергия топлива перешла во внутреннюю энергию пара, а пар, расширяясь, выполнил работу — поднял пробку. Внутренняя энергия пара превратилась в кинетическую энергию пробки. Если заменить пробирку крепким металлическим цилиндром, а пробку – припасованным поршнем, который может двигаться в цилиндре (рис. 265), то получим простейший тепловой двигатель, в котором внутренняя энергия топлива превращается в механическую энергию поршня.
Тепловыми д в и г а те л я м и называют машины, в которых внутренняя энергия топлива превращается в механическую энергию.
К тепловым двигателям относятся: паровая машина, двигатель внутреннего сгорания (карбюраторный, дизельный), паровая и газовая турбины, реактивный двигатель.
Во всех этих двигателях внутренняя энергия топлива сначала переходит во внутреннюю энергию газа или пара. Расширяясь, газ выполняет работу и при этом охлаждается – часть его внутренней энергии превращается в механическую энергию.
Двигатель внутреннего сгорания. Такое название происходит от того, что топливо сгорает в цилиндре, внутри самого двигателя.
Первый поршневой двигатель внутреннего сгорания (ДВС) был создан в 1860 г. французским инженером Э. Ленуаром. Преимущество такого двигателя перед другими тепловыми двигателями заключается в том, что он имеет сравнительно малые размеры и массу. Это дало возможность использовать его на транспорте (автомобиль, трактор, тепловоз), в авиации, на кораблях (дизель-электроход, катер, подводная лодка).
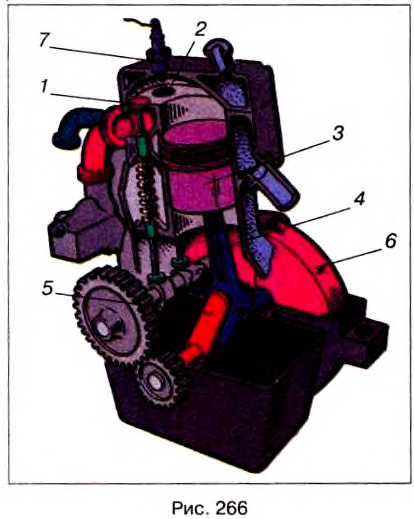
Двигатели внутреннего сгорания работают на жидком топливе (бензине, керосине, нефти) или на горючем газе. На рис. 266 показан разрез простейшего ДВС.
Двигатель состоит из цилиндра, в котором перемещается поршень 3, соединённый с помощью шатуна 4 с коленчатым валом 5. На валу закреплён тяжёлый маховик 6, предназначенный для уменьшения неравномерности вращения вала.
В верхней части цилиндра есть два клапана 1 и 2, которые во время работы двигателя автоматически открываются и закрываются в нужные моменты. Через клапан 1 в цилиндр поступает смесь, которая зажигается с помощью свечи 7, а через клапан 2 выходят отработанные газы.
Каждый ход поршня вверх или вниз называется тактом. Рассмотрим процессы, происходящие в течение каждого такта.
Пусть поршень движется вниз из крайнего верхнего положения (рис. 267, а), и впускной клапан 1 открыт. При опускании поршня через этот клапан в камеру сгорания всасывается горючая смесь — пар бензина с воздухом. В конце такта клапан 1 закрывается. Такой такт называется впуском.
Поршень начинает подниматься вверх, сжимая горючую смесь (рис. 267, б). Этот такт называется сжатием.
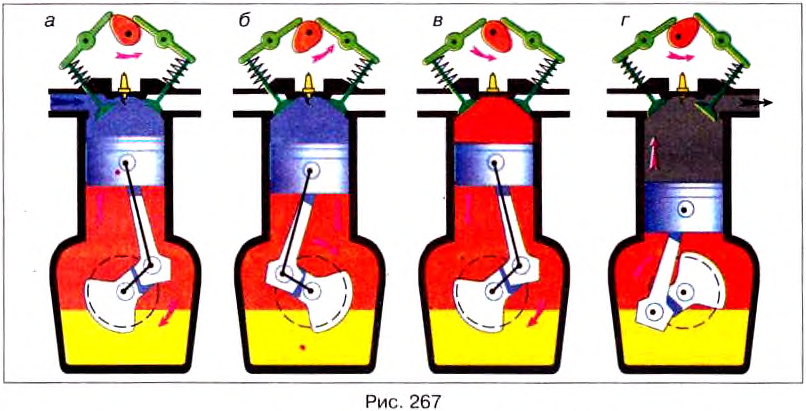
Третий такт двигателя (рис. 267, в) называется рабочим ходом. Во время сгорания смеси температура газов в цилиндре достигает 1600—1800 °С, а давление — 10 000 000 Па. Эти газы с большой силой давят на поршень, который опускается вниз и с помощью шатуна 4 и кривошипного механизма сообщают движение коленчатому валу.
В конце рабочего хода, когда поршень приходит в крайнее нижнее положение, открывается выпускной клапан 2 (рис. 267, г). Начинается четвертый такт – выпуск. Поршень, поднимаясь вверх, выталкивает отработанные газы в атмосферу.
Итак, работа четырёхтактного двигателя состоит из четырех процессов (тактов): впуска, сжатия, рабочего хода и выпуска.
В автомобилях чаше всего используют четырёхцилиндровые двигатели внутреннего сгорания. Работа цилиндров в нём согласована так, что в каждом из них поочерёдно осуществляется рабочий ход, и коленчатый вал всё время получает енергию от каждого из поршней. Есть также и восьмицилиндровые двигатели. Они лучше обеспечивают равномерность вращения вала и имеют большую мощность.
Паровая турбина
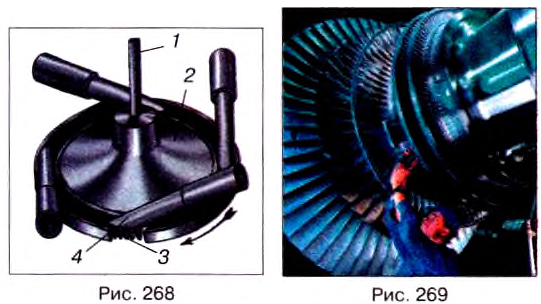
Это тепловой двигатель, в котором пар, нагретый до высокой температуры, находится под высоким давлением и вращает его вал без помощи поршня, шатуна и коленчатого вала. На рис. 268 приведена схема простейшей паровой турбины. На вал 1 насажен диск 2, по ободу которого закреплены лопатки 3. Возле лопаток размешены трубы, называемые соплами 4. Пар образующийся в котле, поступает в сопла, вырывается струями, действующими с большой силой на лопатки и приводящими во вращательное движение диск турбины. В современных паровых турбинах применяют не один, а много дисков, насаженных на общий вал (рис. 269). Пар последовательно проходит через лопатки всех дисков, отдавая каждому из них часть своей энергии. Паровые турбины являются незаменимыми тепловыми двигателями на тепловых и атомных электростанциях. Первую паровую турбину практического применения изготовил в 1889 г. К. Лавал.
Газовая турбина и реактивные двигатели
Преимущества паровой турбины и двигателя внутреннего сгорания объединены в газовой турбине, в которой внутренняя энергия газа превращается в кинетическую энергию вала.
В камеру сгорания 4 (рис. 270) газовой турбины с помощью компрессора 2 подаётся сжатый воздух при температуре приблизительно 200 °С и впрыскивается жидкое топливо (керосин) под высоким давлением. При горении топлива воздух и продукты сгорания нагреваются до температуры 1500—2200 °С. Газ, движущийся с большой скоростью, направляется на лопатки турбины 3. Проходя от одного диска турбины к другому, газ отдаёт свою внутреннюю энергию, приводя турбину в движение. Получаемая механическая энергия используется для вращения, например, винта самолёта 1 или электрического генератора.

Впервые возможность и необходимость использования ракетных двигателей для запуска летательных аппаратов в космическое пространство обосновал в 1903 г. К. Циолковский.
В своей жизни вы постоянно сталкиваетесь с разнообразными двигателями. Они приводят в движение автомобили и самолёты, трактора, корабли и железнодорожные локомотивы. С помощью тепловых машин на электростанциях вырабатывается электрический ток. Работа тепловых машин связана с использованием разных видов топлива. Топки тепловых электростанций, двигатели внутреннего сгорания автомобилей (рис. 272), самолётов и других машин выбрасывают в атмосферу вредные для человека, животных и растений вещества (угарный газ, углекислый газ, оксиды азота, серы и т. п.).
Эти вещества соединяются с атмосферной влагой и образуют кислоты. Это становится причиною выпадения кислотных дождей, в результате чего уничтожаются хвойные леса, гибнет рыба, снижается урожайность зерновых культур и сахарной свёклы. Увеличение количества автомашин, особенно в городах, приводит к чрезмерному загрязнению атмосферы выхлопными газами двигателей внутреннего сгорания. Чтобы уменьшить эти выбросы, проводят регулирование двигателей для полного сгорания топлива и уменьшения содержания угарного газа, внедряют двигатели в которых используют более чистое топливо.
Применение паровых турбин на электростанциях требует много воды и больших площадей, которые занимают водоёмы для охлаждения отработанного пара. Для экономии площади и водных ресурсов целесообразно строить комплексы электростанций, имеющих замкнутую систему водоснабжения.
Наиболее эффективный способ борьбы с загрязнением среды — замена двигателей внутреннего сгорания электрическими двигателями, использование энергии Земли, Солнца, ветра.
Кстати:
Мысль об использовании пара для потребностей транспорта возникла ещё в XVII в. Конструкторы сначала пытались приспособить паровые двигатели к обычным экипажам. В 1763 г. французский инженер Коньо сконструировал первую паровую тележку. Эта машина работала всего 12-15 мин. Позднее Жорж Коньо конструирует более совершенную тележку, но когда её пустили по улицам Парижа, то оказалось, что ей невозможно управлять. В 1787 г. американец Оливер Эванс сконструировал паровую тележку, но она тоже была непригодна к практическому использованию. В конце 80-х годов XVIII в. Уильям Мёрдок, ученик и помощник Дж. Уатта, создал паровую тележку с двигателем конструкции своего учителя. Он сконструировал ряд интересных моделей тележек, но создать практическую транспортную машину ему не удалось. Следует отметить, что проблема создания парового автомобиля так и не была решена, автомобиль был создан на базе двигателя внутреннего сгорания.
Многие изобретатели в ту эпоху старались сконструировать локомотив, который двигался бы по рельсам. Первым к идее применения паровых локомотивов на специальных рельсовых путях пришёл шотландский инженер и механик Ричард Тревитик. В 1803 г. он сконструировал паровоз для рельсового пути, а в следующем году провёл его испытания. В 1814 г. сконструировал и испытал свой первый паровоз Джордж Стефенсон. Его конструкция и решила проблему создания парового железнодорожного транспорта (рис. 273).
История создания парохода, как и паровоза, тоже интересная. Еще в начале XVIII в. Дени Папен сконструировал лодку, которая двигалась с помощью парового двигателя. Но из-за его несовершенства лодка двигалась довольно медленно. В 1736 г. англичанин Джонатан Кольз безуспешно пытался применить на судах паровую машину Т. Ньюкомена.
Более удачные попытки начались с изобретением двигателя Дж. Уатта. Так, в 1781 г. француз Клод Жоффруа сконструировал пароход, который с помощью парового двигателя мог целый час плыть против течения. Через четыре года американец Дж. Фитч построил лодку, в которой паровой двигатель приводил в движение вёсла. Однако испытание этого парохода были неудачными.
Первый практически пригодный пароход сконструировал ирландский инженер и механик Роберт Фультон, который, как и Стефенсон, был изобретателем-самоучкой. Свой первый ещё несовершенный пароход Фультон испытал в 1803 г. на р. Сене в Париже.
Опыт удался: судно в течение 1,5 ч плылло по Сене, развивая скорость 5 
Закон сохранения энергии в механических и тепловых процессах
При падении тела, поднятого над Землёй, его потенциальная энергия уменьшается, а кинетическая – увеличивается. При падении свинцового или пластилинового шарика на свинцовую плиту механическая энергия шарика уменьшается до нуля, но увеличивается внутренняя энергия шарика и плиты. В двигателе внутреннего сгорания автомобиля или трактора за счёт внутренней энергии топлива увеличивается механическая энергия подвижных частей двигателя.
Механическая и внутренняя энергии тел могут превращаться друг в друга.
Колёса водяной турбины вращаются за счёт кинетической энергии воды, а крылья ветряного двигателя — за счёт кинетической энергии ветра. При теплообмене внутренняя энергия одного тела изменяется за счёт изменения внутренней энергии другого (например, внутренняя энергия воды увеличивается за счёт уменьшения внутренней энергии нагретого куска железа, брошенного в воду).
Рассматривая пример смешивания горячей и холодной воды, выполнив соответствующие подсчёты, мы увидели, что количество теплоты, которую отдала горячая вода, равно количеству теплоты, которую получила холодная вода. «Изучение теплового баланса при смешивании воды разной температуры» подтвердила бы этот вывод, если бы вы выполняли её в условиях, не допускающих передачи тепла другим телам, кроме холодной воды, или учли бы всё количество теплоты, переданное всем телам.
При теплообмене в системе контактирующих тел количество теплоты сохраняется.
Наблюдения и опыты привели к открытию закона сохранения и изменения энергии.
Энергия не исчезает и не создаётся из ничего. Она только превращается из одного вида в другой, при этом полное значение её сохраняется.
Дополнительная энергия у тела может возникнуть только вследствие его взаимодействия с другим телом. Энергия воды океанских течений или ветра возникает за счёт энергии Солнца; потенциальная и кинетическая энергии ракеты — за счёт внутренней энергии топлива, израсходованного на её запуск и полёт.
Закон сохранения и изменения энергии — один из основных законов природы. Этот закон всегда нужно учитывать в науке и технике, с его помощью можно объяснить множество явлений природы.
Коэффициент полезного действия (КПД) нагревателя
Для оценки любого нагревателя очень важно знать, какую часть энергии, выделяющейся при сгорании топлива (или работы электронагревателя), он превращает в полезную работу. Чем больше эта часть энергии, тем более экономичен нагреватель. Для характеристики экономичности разных нагревателей вводят понятие коэффициента полезного действия (КПД) нагревателя.
Отношение той части энергии, которая расходуется на выполнение полезной работы нагревателя, ко всей энергии, выделяющейся вследствие сгорания топлива (или при работе электрического нагревателя), называется коэффициентом полезного действия (КПД) нагревателя.
КПД обозначают малой греческой буквой 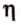
где 
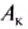
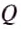
Определим, например, КПД спиртовки, газовой горелки или другого нагревателя. При сжигании массы 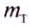
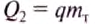
Эта энергия идет, например, на нагревание тела массой 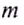
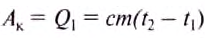
Если используем электрический нагреватель определённой мощности, то энергия, которая выделяется во время его работы, определяется по формуле: 
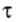
Тогда КПД нагревателя будет определяться так:
КПД нагревателя всегда меньше единицы (или меньше 100 %).
Пример №12
Почему радиатор является системой многих тонких трубок, а не сплошным резервуаром (рис. 275)?
Ответ: чтобы обеспечить достаточный теплоотвод от двигателя автомобиля за счёт увеличения площади теплообмена.
Пример №13
В каком тепловом двигателе струя пара или газа, нагретого до высокой температуры, вращает вал двигателя без помощи поршня, шатуна и коленчатого вала?
Ответ: в паровой турбине.
- Внутренняя энергия
- Теплопроводность в физике
- Конвекция в физике
- Излучение тепла в физике
- Воздухоплавание в физике
- Машины и механизмы в физике
- Коэффициент полезного действия (КПД) механизмов
- Тепловые явления в физике
Содержание:
- Определение и формула количества теплоты
- Формула расчета теплоты при изменении температуры
- Формула количества теплоты при фазовых переходах
- Единицы измерения количества теплоты
- Примеры решения задач
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем,
что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом
случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система
микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии,
которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой).
Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики.
Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $delta Q$. Обратим внимание,
что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом.
Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$delta Q=C d T(1)$$
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$delta Q=c m d T=nu c_{mu} d T(2)$$
где $c=frac{C}{m}$ – удельная теплоемкость тела, m – масса тела,
$c_{mu}=c cdot mu$ – молярная теплоемкость,
$mu$ – молярная масса вещества,
$nu=frac{m}{mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты
($Delta Q$), которое получает тело при увеличении его температуры на величину
$Delta t = t_2 – t_1$ можно вычислить как:
$$Delta Q=c m Delta t(3)$$
где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности
($Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты,
которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты
($delta Q$) равное:
$$delta Q=lambda d m$$
где $lambda$ – удельная теплота плавления, dm – элемент массы тела.
При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества.
При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$delta Q=r d m$$
где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$
где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 –
количество теплоты части воды температурой t1 и массой m1;
Q2=cm2t2– количество теплоты части воды температурой t2 и массой m2.
Из уравнения (1.1) следует:
$$
begin{array}{l}
mathrm{cmt}=mathrm{cm}_{1} t_{1}+mathrm{~cm}_{2} t_{2} rightarrow mathrm{mt}=mathrm{m}_{1} t_{1}+mathrm{~m}_{2} t_{2} rightarrow \
rightarrow rho mathrm{Vt}=rho V_{1} t_{1}+rho mathrm{V}_{2} t_{2} rightarrow mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2)
end{array}
$$
При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$
V=V_{1}+V_{2}(1.3)
$$$
Так, мы получаем систему уравнений:
$$
left{begin{array}{c}
V t=V_{1} t_{1}+V_{2} t_{2} \
V=V_{1}+V_{2}
end{array}right.
$$
Решив ее получим:
$$
begin{array}{l}
V_{1}=frac{left(t_{2}-tright)}{t_{2}-t_{1}} V \
V_{2}=frac{left(t-t_{1}right)}{t_{2}-t_{1}} V
end{array}
$$
Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$
begin{array}{l}
V_{1}=frac{(60-40)}{60-10} 200=80 text { (л) } \
V_{2}=frac{(40-10)}{60-10} 200=120 text { (л) }
end{array}
$$
Ответ. V1=80 л, V2=120 л.

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 396 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!
Пример
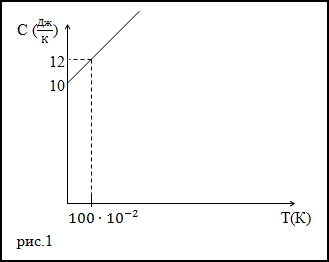
Задание. Теплоемкость тела изменяется по линейному закону (рис.1) в зависимости от абсолютной температуры в
рассматриваемом интервале $T_{1} leq T leq T_{2}$ .
Какое количество теплоты получает тело, если T1=300 К, T2=400 К.
Решение. Исследуя график функции теплоемкости (C(T)) (рис.1) запишем его аналитическое выражение, оно получится:
$C(T)=10+2 cdot 10^{-2} T$ (Дж/К)
Основой для решения задачи послужит формула для количества теплоты в виде:
$$delta Q=C d T(2.2)$$
Подставим полученное выражение для теплоемкости (2.1) в формулу (2.2) поведем интегрирование в заданном интервале температур:
$$
begin{array}{c}
Delta Q=int_{300}^{400}left(10+2 cdot 10^{-2} Tright) d T=left.left(10 cdot T+10^{-2} T^{2}right)right|_{300} ^{400}= \
=left(10 cdot 400+10^{-2} cdot(400)^{2}right)-left(10 cdot 300+10^{-2} cdot(300)^{2}right)=1700left(mathrm{~A}^{*}right)
end{array}
$$
Ответ. $Delta Q$=1700 Дж
Читать дальше: Формула напряженности магнитного поля.
Количество теплоты
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: количество теплоты, удельная теплоёмкость вещества, уравнение теплового баланса.
Как мы знаем, одним из способов изменения внутренней энергии является теплопередача (теплообмен). Предположим, что тело участвует в теплообмене с другими телами, и при этом не совершается механическая работа — ни самим телом, ни другими телами над этим телом.
Если в процессе теплообмена внутренняя энергия тела изменилась на величину , то говорят, что тело получило соответствующее количество теплоты:
.
Если при этом величина отрицательна, т.е. тело отдавало энергию, то говорят также, что тело отдавало тепло. Например, вместо формально верной, но несколько нелепой фразы «тело получило —5 Дж тепла» мы скажем: «тело отдало 5 Дж тепла».
Удельная теплоёмкость вещества
Предположим, что в процессе теплообмена агрегатное состояние вещества тела не изменяется (не происходит плавление, кристаллизация, парообразование или конденсация). Начальную температуру тела обозначим , конечную температуру —
.
Опыт показывает, что количество теплоты, полученное телом, прямо пропорционально массе тела и разности конечной и начальной температур:
Коэффициент пропорциональности c называется удельной теплоёмкостью вещества тела. Удельная теплоёмкость не зависит от формы и размеров тела. Удельные теплоёмкости различных веществ можно найти в таблицах.
Введя обозначение , получим также:
Чтобы понять физический смысл удельной теплоёмкости, выразим её из последней формулы:
Мы видим, что удельная теплоёмкость численно равна количеству теплоты, которое необходимо для нагревания 1кг данного вещества на (или, что то же самое, на
). Измеряется удельная теплоёмкость в Дж/(кг·
C) или в Дж/(кг·K).
Чем больше удельная теплоёмкость вещества, тем большее количество теплоты требуется для нагревания тела данной массы на заданное количество градусов.
В задачах часто фигурируют вода и лёд. Их удельные теплоёмкости желательно помнить.
Вода: Дж/(кг·
C).
Лёд: Дж/(кг·
C).
Произведение удельной теплоёмкости вещества на массу тела называется теплоёмкостью тела и обозначается :
Соответственно, для количества теплоты имеем:
Уравнение теплового баланса
Рассмотрим два тела (обозначим их 1 и 2), которые образуют замкнутую систему. Это означает, что данные тела могут обмениваться энергией только друг с другом, но не с другими телами. Считаем также, что механическая работа не совершается — внутренняя энергия тел меняется только в процессе теплообмена.
Имеется фундаментальный закон природы, подтверждаемый всевозможными экспериментами — закон сохранения энергии. Он гласит, что полная энергия замкнутой системы тел не меняется со временем.
В данном случае закон сохранения энергии утверждает, что внутренняя энергия нашей системы будет оставаться одной и той же: . Если изменение внутренней энергии первого тела равно
, а изменение внутренней энергии второго тела равно
, то суммарное изменение внутренней энергии будет равно нулю:
Но — количество теплоты, полученное первым телом в процессе теплообмена; аналогично
— количество теплоты, полученное вторым телом в процессе теплообмена. Стало быть,
(1)
Попросту говоря, сколько джоулей тепла отдало одно тело, ровно столько же джоулей получило второе тело. Так как система замкнута, ни один джоуль наружу не вышел. Соотношение (1) называется уравнением теплового баланса. В общем случае, когда тел образуют замкнутую систему и обмениваются энергией только с помощью теплопередачи, из закона сохранения энергии с помощью тех же рассуждений получаем общее уравнение теплового баланса:
(2)
В качестве простого примера применения уравнения теплового баланса рассмотрим следующую задачу.
Смешали г воды при температуре
и
г воды при температуре
. Найти установившуюся температуру смеси.
Обозначим искомую установившуюся температуру через . Запишем уравнение теплового баланса (1):
где — удельная теплоёмкость воды. Раскрываем скобки и находим:
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Количество теплоты» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Что такое тепло?
Начнем с вопроса одновременно легкого и сложного: что такое тепло?
Теплом называется природная энергия, которая создается беспорядочным движением частиц тела (атомов, молекул и т. п.) и проявляется в нагревании этого тела.
Такое определение не было известно людям сразу. Например, было такое предположение: теплота — это невидимая, невесомая жидкость, которая притекает в физические тела. И чем больше объем этой жидкости, тем тело горяче́е. Конечно же, эта гипотеза не нашла подтверждения.
Позже ученые обратили внимание на поведение молекул при нагревании или охлаждении тела. С ростом температуры скорость молекул возрастает, они чаще сталкиваются друг с другом. При этом растет потенциальная и кинетическая энергия, а значит, и внутренняя, что проявляется в буквальном нагревании тела. Такое хаотичное движение молекул называют тепловым движением.
Тепловое движение — процесс хаотичного движения частиц, образующих вещество.
Логично предположить: раз с ростом температуры скорость молекул увеличивается, то при понижении температуры скорость будет падать. Но возможна ли полная остановка движения? До какой температуры следует охладить тело в таком случае?
Чтобы это произошло, потребуется охладить тело до абсолютного нуля по шкале Кельвина, что соответствует −273,15 °C, или −459,67 °F. Молекулы в таких условиях прекратят движение и замрут в узлах кристаллической решетки. Но достичь такого температурного режима невозможно ни на планете Земля, ни во всей Вселенной, ни даже в лабораторных условиях.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Каким образом можно нагреть вещество?
На самом деле способов больше, чем один. Телу можно передать тепло непосредственно или же изменить его внутреннюю энергию, совершив над ним работу.
Теплопередача
К видам теплопередачи относятся теплопроводность, конвекция и излучение. Чтобы лучше понять, чем отличается один тип от другого, давайте разберем примеры.
-
Теплопроводность. Представьте, что ваши руки замерзли и вы держите в руках кружку кофе, чтобы их согреть. В таком случае тепло от более нагретого тела (кружки) передается менее нагретому (вашим рукам), до тех пор пока температура двух объектов не станет одинаковой. Так, горячая вода отдает свое тепло холодной при смешивании, а суп нагревает холодную ложку, если ее оставить в тарелке. Только аккуратно, не обожгитесь!
-
Конвекция — вид теплообмена, при котором внутренняя энергия передается струями и потоками самого вещества. Проще говоря, это процесс, который происходит в жидкостях и газах, когда слои вещества разной температуры перемешиваются. На этом принципе основано отопление помещения и проветривание комнаты. Кстати, ветры, дующие над поверхностью земного шара, — это тоже пример конвекции.
-
Излучение. Догадывались ли вы, что мы сталкиваемся с этим типом теплопередачи каждый день? Именно день, ведь солнечный свет излучает тепло с помощью электромагнитных волн, что делает жизнь на планете Земля возможной. По правде говоря, любое нагретое тело может стать источником тепла (человек, животные, свеча, костер, звезды). Это можно увидеть с помощью особого прибора — тепловизора.
Совершение работы над веществом
Здесь мы тоже не обойдемся без понятного примера. Возьмем пробирку с керосином, обыкновенный шнурок и термометр. Замерим начальную температуру и начнем натирать пробирку шнурком. Что произойдет с температурой? Она начнет возрастать. Это происходит благодаря теплопередаче? Или, может, невидимое излучение заставляет керосин нагреваться? Нет, мы изменили температуру вещества, совершив над ним работу.
Итак, подведем промежуточные итоги:
-
Тепло — это энергия, которая создается тепловым движением молекул.
-
Тепловое движение — процесс хаотичного движения частиц, образующих вещество.
-
С ростом температуры растет и скорость движения молекул, а полностью остановить это движение практически невозможно.
-
Изменить температуру тела можно двумя способами: с помощью теплопередачи или изменения внутренней энергии тела при совершении над ним работы.
Понятие тепловых явлений
Тепловые явления — это физические процессы, протекающие в телах при их нагревании или охлаждении. То есть это те явления, которые происходят с телами по мере изменения их температуры.
Давайте сделаем небольшую остановку на этом физическом понятии, а потом продолжим.
Температура — мера нагретости тела. Ее можно измерить с помощью термометра, или по-простому градусника. У этого прибора есть множество разновидностей, но в быту чаще всего пользуются ртутными (для измерения температуры человеческого тела), жидкостными (для измерения температуры воздуха или жидкости) и электронными термометрами.
В мире используют несколько температурных шкал: Цельсия, Кельвина и Фаренгейта. На онлайн-уроках физики в школе Skysmart вы подробнее познакомитесь с ними и научитесь легко переводить значения из одной шкалы в другую!
Какие бывают тепловые явления?
Давайте поразмышляем о том, что может происходить с телом под действием температуры. Для этого не придется идти далеко: достанем из холодильника кубик льда, опустим его в стакан и посмотрим, что получится. Спустя какое-то время лед начнет таять (или плавиться) и превратится в воду. Но на этом мы не остановимся! Перельем воду в кастрюлю и начнем нагревать на плите. Что произойдет тогда?
Абсолютно верно! Вода начнет нагреваться, а дальше — кипеть. Если вовремя не выключить плиту или не снять с нее кастрюлю, вся вода может выкипеть — превратиться в водяной пар.
За короткий промежуток времени мы смогли пронаблюдать воду в трех агрегатных состояниях: твердом, жидком и газообразном. А можно ли обратить процесс вспять и снова получить кубик льда?
Так просто это сделать не получится: должно быть, весь водяной пар разлетелся по квартире, и его будет очень сложно собрать воедино. Но это не говорит о том, что процесс перехода из одного агрегатного состояния в другое необратим.
Предположим, нам удастся добыть целый литр водяного пара. Охлаждая его, мы заметим, как пар конденсируется — превращается в капельки жидкости. А получить лед совсем просто, если поместить полученную жидкость в морозильную камеру.
Если внимательно проанализировать опыт, вы заметите, что переход из одного агрегатного состояния в другое не происходит мгновенно. Для этого необходимо нагреть или охладить вещество до определенной температуры, причем для каждого вещества эти температуры разные. Так, лед начинает таять при 0 °С, а железо плавится аж при 1 538 °С.
А как называются процессы, связанные с повышением и понижением температуры? Сколько их всего?
Начнем с самого легкого. Процессы, связанные с нагреванием или охлаждением, так и называются. Напомним, что эти процессы не ведут к изменению агрегатного состояния, а, можно сказать, являются подготовкой к нему.
Плавление — процесс перехода из твердого состояния в жидкое. А обратный процесс, когда жидкость превращается в твердое тело, называется кристаллизацией (или затвердеванием). Для этих процессов необходимо достичь одной и той же температуры вещества. То есть лед начнет плавиться при нуле градусов, но одновременно с этим вода начнет кристаллизоваться при этой температуре.
Парообразование (кипение) — процесс перехода жидкости в газ, а конденсация — обратный процесс перехода газа в жидкость. Для этих процессов также существует одна и та же температура. Ртуть кипит при температуре 356,7 °С, и при этой же температуре пары ртути превращаются в жидкость.
Отдельно выделим процесс сгорания вещества. Это явление также является тепловым, но, к сожалению, оно необратимо.
Рассмотрим график фазовых переходов для воды:
Обратите внимание на то, как одно тепловое явление сменяет другое.
Согласно графику, в начале опыта мы берем лед при температуре −40 °С и начинаем его нагревать. График этого процесса представлен наклонной прямой 1–2.
Достигнув 0 °С (точка 2), лед начинает таять. Для этого процесса не нужно увеличивать температуру, достаточно 0 °С, но понадобится время, чтобы процесс завершился. Поэтому плавление льда на графике представлено прямой линией 2–3, параллельной оси абсцисс.
Мы продолжаем нагревать воду (наклонная линия графика 3–4) до 100 °С — в этой точке начинается кипение. Если мы хотим показать на графике, что процесс кипения продолжается, от точки 100 °С мы бы провели прямую линию, параллельную оси абсцисс (4–5), а нагревание водяного пара выглядело бы как наклонная линия 5–6 (схожая с подобными процессами, уже представленными на графике).
Пойдем в обратном направлении: на графике процесс 6–7 — охлаждение пара, 7–8 — конденсация, 8–9 — охлаждение жидкости, 9–10 — кристаллизация, а дальше — охлаждение твердого тела.
Итого к тепловым явлениям относятся 7 процессов: сгорание, нагревание, охлаждение, кипение (парообразование), конденсация, плавление, кристаллизация (затвердевание).
Формулы для расчета количества теплоты
Количество теплоты, которое необходимо для возникновения процесса или выделяется при нем, можно рассчитать по формулам.
Количество теплоты, необходимое для нагревания тела или выделяющееся при охлаждении
Q = cmΔt
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества, из которого состоит тело [Дж/(кг·°C)]
m — масса тела [кг]
Δt — изменение температуры тела [°C]
Отдельно поговорим про с — удельную теплоемкость вещества. Это табличная величина, т. е. ее значение для каждого вещества различается, оно постоянно и его можно найти в конце учебника по физике или в интернете.
Количество теплоты, необходимое для плавления или выделяющееся при кристаллизации
Q = λm
Q — количество теплоты, необходимое для плавления кристаллического тела, находящегося при температуре плавления в нормальном атмосферном давлении [Дж]
m — масса тела [кг]
λ — удельная теплота плавления вещества, из которого состоит тело [Дж/кг]
Количество теплоты, необходимое для кипения или выделяющееся при конденсации
Q = Lm
Q — количество теплоты, необходимое для превращения в пар жидкости (выделяющееся при конденсации пара), находящейся при температуре кипения и нормальном атмосферном давлении [Дж]
m — масса тела [кг]
L — удельная теплота парообразования жидкости [Дж/кг]
Количество теплоты, выделяющееся при полном сгорании топлива
Q = qm
Q — количество теплоты, выделяющееся при полном сгорании топлива [Дж]
q — удельная теплота сгорания топлива [Дж/кг]
m — масса топлива [кг]
Как вы можете заметить, все формулы имеют одну и ту же логику: энергия Q прямо пропорциональна массе тела и удельным величинам. А значит, чем больше масса тела, тем больше энергии потребуется для его нагревания. Чем меньше тело, тем меньше энергии выделится при его остывании, и т. д.
Тепловые явления встроены в нашу жизнь на все сто процентов. Все — от кулинарии до погодных явлений, от медицины до промышленности — в той или иной мере зависит от процессов нагревания, плавления, кипения и других.
Мы можем плавить металлы и изготавливать из них различные предметы, повышать влажность воздуха, кипятить воду и выпекать булочки, изготавливать микросхемы и лекарства. Какой процесс ни возьмете, во всех можно отыскать примеры тепловых явлений.
Тепловые процессы в физике связаны между собой. Порой нагревание одного вещества влечет за собой плавление и даже кипение другого. Заинтригованы? Приходите на онлайн-уроки физики в школу Skysmart — там вы сможете детально разобраться в этом и других поразительных процессах.
Количество теплоты, удельная теплоемкость
От чего зависит количество теплоты
Внутренняя энергия тела изменяется при совершении работы или теплопередаче. При явлении теплопередачи внутренняя энергия передается теплопроводностью, конвекцией или излучением.
Каждое тело при нагревании или охлаждении (при теплопередаче) получает или теряет какое-то количество энергии. Исходя из этого, принято это количество энергии назвать количеством теплоты.
Итак, количество теплоты – это та энергия, которую отдает или получает тело в процессе теплопередачи.
Какое количество теплоты необходимо для нагревания воды? На простом примере можно понять, что для нагревания разного количества воды потребуется разное количество теплоты. Допустим, возьмем две пробирки с 1 литром воды и с 2-мя литрами воды. В каком случае потребуется большее количество теплоты? Во втором, там, где в пробирке 2 литра воды. Вторая пробирка будет нагреваться дольше, если мы подогреваем их одинаковым источником огня.
Таким образом, количество теплоты зависит от массы тела. Чем больше масса, тем большее количество теплоты требуется для нагрева и, соответственно, на охлаждение тела требуется большее время.
От чего еще зависит количество теплоты? Естественно, от разности температур тел. Но это еще не все. Ведь если мы попытаемся нагреть воду или молоко, то нам потребуется разное количество времени. Т.е получается, что количество теплоты зависит от вещества, из которого состоит тело.
В итоге получается, что количество теплоты, которое нужно для нагревания или количество теплоты, которое выделяется при остывании тела, зависит от его массы, от изменения температуры и от вида вещества, из которого состоит тело.
В чем измеряется количество теплоты
За единицу количества теплоты принято считать 1 Джоуль. До появления единицы измерения энергии ученые считали количество теплоты калориями. Сокращенно эту единицу измерения принято писать – “Дж”
Калория – это количество теплоты, которое необходимо для того, чтобы нагреть 1 грамм воды на 1 градус Цельсия. Сокращенно единицу измерения калории принято писать – “кал”.
1 кал = 4,19 Дж.
Обратите внимание, что в этих единицах энергии принято отмечать пищевую ценность продуктов питания кДж и ккал.
1 ккал = 1000 кал.
1 кДж = 1000 Дж
1 ккал = 4190 Дж = 4,19 кДж
Что такое удельная теплоемкость
Каждое вещество в природе имеет свои свойства, и для нагрева каждого отдельного вещества требуется разное количество энергии, т.е. количества теплоты.
Удельная теплоемкость вещества – это величина, равная количеству теплоты, которое нужно передать телу с массой 1 килограмм, чтобы нагреть его на температуру 1 0C
Удельная теплоемкость обозначается буквой c и имеет величину измерения Дж/кг*
Например, удельная теплоемкость воды равна 4200 Дж/кг*0C. То есть это то количество теплоты, которое нужно передать 1 кг воды, чтобы нагреть ее на 1 0C
Следует помнить, что удельная теплоемкость веществ в разных агрегатных состояниях различна. То есть для нагревания льда на 1 0C потребуется другое количество теплоты.
Как рассчитать количество теплоты для нагревания тела
Например, необходимо рассчитать количество теплоты, которое нужно потратить для того, чтобы нагреть 3 кг воды с температуры 15 0С до температуры 85 0С. Нам известна удельная теплоемкость воды, то есть количество энергии, которое нужно для того, чтобы нагреть 1 кг воды на 1 градус. То есть для того, чтобы узнать количество теплоты в нашем случае, нужно умножить удельную теплоемкость воды на 3 и на то количество градусов, на которое нужно увеличить температуры воды. Итак, это 4200*3*(85-15) = 882 000.
В скобках мы рассчитываем точное количество градусов, отнимая от конечного необходимого результата начальное
Итак, для того, чтобы нагреть 3 кг воды с 15 до 85 0С, нам потребуется 882 000 Дж количества теплоты.
Количество теплоты обозначается буквой Q, формула для его расчета выглядит следующим образом:
Q=c*m*(t2-t1).
Разбор и решение задач
Задача 1. Какое количество теплоты потребуется для нагрева 0,5 кг воды с 20 до 50 0С
Дано:
m = 0,5 кг.,
с = 4200 Дж/кг*0С,
t1 = 20 0С,
t2 = 50 0С.
Величину удельной теплоемкость мы определили из таблицы.
Решение:
количество теплоты определяется по формуле Q=c*m*(t2-t1).
Подставляем значения:
Q=4200*0,5*(50-20) = 63 000 Дж = 63 кДж.
Ответ: Q=63 кДж.
Задача 2. Какое количество теплоты потребуется для нагревания алюминиевого бруска массой 0,5 кг на 85 0С?
Дано:
m = 0,5 кг.,
с = 920 Дж/кг*0С,
t1 = 0 0С,
t2 = 85 0С.
Решение:
количество теплоты определяется по формуле Q=c*m*(t2-t1).
Подставляем значения:
Q=920*0,5*(85-0) = 39 100 Дж = 39,1 кДж.
Ответ: Q= 39,1 кДж.