На этой странице вы можете рассчитать количество теплоты, необходимое для превращение жидкости в пар с помощью калькулятора онлайн. Для этого необходимо ввести массу жидкости и ее удельную теплоту парообразования (см. таблицу).
Удельная теплота парообразования – физическая величина, показывающая, какое количество теплоты потребуется для превращения жидкости массой 1кг в пар без изменения температуры. Обозначается буквой L и измеряется в Дж/кг.
Содержание:
- калькулятор количества теплоты для превращения в пар
- формула количества теплоты для превращения в пар
- таблица “Удельная теплота парообразования”
- примеры задач
Формула количества теплоты для превращения в пар
{Q = L cdot m}
Q – необходимое количество теплоты для превращения жидкости, находящейся при температуре кипения в пар
L – удельная теплота парообразования (см. таблицу)
m – масса жидкости, находящейся при температуре кипения.
Удельная теплота парообразования жидкостей и расплавленных металлов при температуре кипения и нормальном атмосферном давлении
| Жидкость | Удельная теплота парообразования, кДж/кг |
|---|---|
| Азот жидкий | 201 |
| Аллюминий | 9200 |
| Аммиак | 1370 |
| Бензин | 230 – 310 |
| Висмут | 840 |
| Вода (при 0°С) | 2500 |
| Вода (при 20°С) | 2450 |
| Вода (при 100°С) | 2260 |
| Вода (при 370°С) | 440 |
| Вода (при 374,15°С) | 0 |
| Водород жидкий | 450 |
| Воздух | 197 |
| Гелий жидкий | 23 |
| Железо | 6300 |
| Золото | 1650 |
| Керосин | 209 – 230 |
| Кислород жидкий | 214 |
| Магний | 5440 |
| Медь | 4800 |
| Никель | 6480 |
| Олово | 3010 |
| Ртуть | 293 |
| Свинец | 860 |
| Спирт этиловый | 906 |
| Эфир этиловый | 356 |
| Цинк | 1755 |
Примеры задач на нахождение количества теплоты
Задача 1
Какое количество теплоты требуется для обращения в пар воды массой 0.2 кг при температуре 100°C?
Решение
Подставим значения из условия в формулу и рассчитаем результат. Удельную теплоту парообразования для воды при температуре 100°C возьмем из таблицы: L = 2260 кДж/кг.
Q = L cdot m = 2260 cdot 0.2 = 452 Дж
Ответ: 452 Дж
Проверим ответ с помощью калькулятора .
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 сентября 2021 года; проверки требуют 13 правок.
Уде́льная теплота́ парообразова́ния и конденса́ции — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить количество жидкости с единичной массой в пар, при данной температуре жидкости и без её изменения (температуры) в процессе испарения. Равна удельной теплоте конденсации единичной массы пара в жидкость.
Расчёт[править | править код]
Удельная теплота парообразования и конденсации обозначается буквой 
где Q — теплота, истраченная на превращение жидкости в пар или пара в жидкость, m — масса.
Наименьшее значение удельной теплоты парообразования будет при температуре кипения жидкости.
Размерность удельной теплоты парообразования в СИ — Дж/кг. Устаревшие, но иногда применяемые единицы для теплоты парообразования — ккал/кг и кал/кг.
В химии теплота парообразования обычно приводится к молю вещества. Эта величина называется молярной теплотой испарения (конденсации); единица её измерения — Дж/моль. Также используются устаревшие единицы: ккал/моль, кал/моль.
Значения для некоторых веществ[править | править код]
Удельная теплота парообразования некоторых веществ при нормальном атмосферном давлении (760 мм. рт. ст. = 101,325 кПа) и температуре, равной температуре кипения вещества[1]:
| Вещество | Температура кипения, °C |
Удельная теплота парообразования/ конденсации, кДж/кг |
|---|---|---|
| Азот | −195,8 | 199 |
| Ртуть | 357 | 282 |
| Диэтиловый эфир | 34,6 | 380 |
| Водород | −252,6 | 448 |
| Этиловый спирт | 78,4 | 837 |
| Свинец | 1 740 | 855 |
| Аммиак | −33,4 | 1 370 |
| Вода | 100 | 2300 |
| Медь | 2 600 | 4 820 |
| Железо | 3 200 | 6 120 |
| Алюминий | 2 450 | 10 900 |
| Литий | 1 340 | 21 000 |
| Графит | 4 200 | 29 700 |
| Бериллий | 2 469 | 32 500 |
| Бор | 3 865 | 45 300 |
См. также[править | править код]
- Удельная теплоёмкость
- Удельная теплота плавления
- Сублимация
Примечания[править | править код]
- ↑ Теплота испарения // БСЭ, 3 изд.
Испарение сопровождается остыванием жидкости. Чем она холоднее, тем менее интенсивно происходит образование пара. Но скорость процесса можно поддерживать, если жидкость подогревать, то есть подводить к ней тепло.
Так возникает понятие удельной теплоты парообразования. У каждого жидкости и даже твердого тела (ведь и его можно превратить в пар) эта величина своя. Рассмотрим, как найти удельную теплоту парообразования.
Содержание
- Единица измерения
- Формула для величины
- Какие данные нужны, чтобы рассчитать значение?
- Алгоритм и правила расчета
- Несколько примеров нахождения
- Таблица для ряда веществ
- Видео по теме статьи
- Заключение
Единица измерения
Удельная теплота парообразования – это величина, которая показывает, сколько теплоты необходимо сообщить веществу массой 1 кг, чтобы превратить его в пар. При этом температура вещества должна быть постоянной.
Обычно рассматриваемую величину обозначают латинскими буквами L, r или греческой λ (лямбда). Теплота в системе СИ измеряется в Джоулях (Дж), масса – в килограммах (кг). Таким образом, L измеряется в Дж/кг.
Так как теплота в джоулях принимает зачастую большие значения, может встречаться обозначения кДж (килоджоули) – Дж*1000, или МДж (мегаджоули) – Дж*1000 000.
Формула для величины

- Q – теплота,
- m – масса.
Ее часто используют для расчетов энергетических затрат на выпаривание воды из растворов: Q= L* m.
L определяют в лабораториях и заносят в таблицы, составляют справочники, которыми можно пользоваться любому желающему. При этом всегда указывают температуру и давление, при которых находилось L.
С ростом температуры L уменьшается, так как жидкость расширяется, взаимодействие между ее частицами уменьшается, и ее легче превратить в пар. Когда плотность пара и жидкости сравниваются, наступает критическое состояние.
Оно характеризуется определенным давлением и температурой. Для воды — это 374 ℃ и 218,5 атм. В таком состоянии L=0.
Какие данные нужны, чтобы рассчитать значение?
Чтобы вычислить искомую величину, применяют знания о том, что теплота испарения равна теплоте конденсации со знаком «минус». Это значит, что когда пар конденсируется (превращается в воду), он охлаждается и отдает свое тепло окружающей среде. Можно применить формулу: Q= L* m.
Для расчетов необходимы следующие данные:
- Q – теплота, отданная паром, Дж,
- m – масса образовавшейся в процессе конденсации воды, кг;
- L – удельная теплота парообразования, Дж/кг – собственно то, что нужно определить.
Применяют также закон сохранения энергии и понятие теплоемкости: Qв=С*Mв*(T2-T1), где:
- С – удельная теплоемкость воды, которая нагревается под действием сконденсированного пара, Дж/(кг*К), – считается известной и берется из таблицы,
- Mв – ее масса;
- T2-T1 – изменение температуры в Кельвинах или градусах Цельсия.
Алгоритм и правила расчета

- Анализируют, как проходит процесс, какое вещество отдает, а какое получает тепло.
- Переводят все единицы измерения в одну систему.
- Записывают необходимые формулы.
- Решают уравнение с одним неизвестным.
При проведении расчетов надо следить за размерностью величин. В системе СИ масса измеряется в кг, теплота в Дж, а температура в градусах Кельвина. Разность температур можно считать в градусах Цельсия.
Часто бывает нужно найти удельную теплоту парообразования при условиях кипения жидкости и нормальном атмосферном давлении (760 мм рт. ст.). В таких условиях получают чистую воду из растворов или выделяют из смеси веществ ее части.
Процесс используется в химической и пищевой промышленности и даже на бытовом уровне.
Несколько примеров нахождения
Задача №1. Сколько необходимо энергии для превращения в пар следующих кипящих веществ:
- 2 кг этилового спирта;
- 2 кг воды;
- 2 кг расплавленного свинца.
Необходимо воспользоваться формулой Q= L* m и взять значение L из таблицы. Получится:
- 0,84*МДж*2 кг = 1,68 МДж;
- 2,3 МДж*2 кг = 4,6 МДж;
- 8,6 МДж *2 кг = 17,2 МДж.
Как видно, превратить в пар воду сложнее, чем этанол, но легче, чем металл. На первый взгляд, это очевидно, но когда дело касается веществ, близких по температуре кипения, то разница становится менее заметна, ее невозможно угадать. Тем не менее, она имеет особое значение.
Задача №2. Как вычислить, сколько энергии необходимо, чтобы превратить 1 тонну воды при 20 ℃ в пар при 100 ℃?
Решение: 1 т = 1000 кг.

- Q1 – тепло, ушедшее на нагревание воды с 20 до 100 градусов,
- Q2 – тепло, необходимое для образования пара (процесс происходит без изменения температуры).
Q1 = С*M* (T2-T1), С воды = 4200 Дж/(кг*К), Q2 = L*M, L воды при обычном кипении = 2,3 МДж/кг, T2-T1 = 100-20 = 80.
Подставляя известные величины, находят искомую энергию: Q = 4200*1000*80+2,3 *106*1000 = 4,2*80*106+2300*106=2636 (МДж)
Задача №3. Сколько надо затратить электроэнергии, чтобы превратить 1 л воды в пар?
Решение: Q= Lводы*m. Масса 1 литра обычной водопроводной воды равна 1 кг. Q=2260 кДж/кг *1 кг=2260 кДж=2,3 МДж.
1 кВт*ч = 3,6 МДж. Из простой пропорции следует, что надо затратить 0,64 кВт*ч. Для 2-х литров величина возрастет в 2 раза, для 3-х – в три, и так далее.
Зная тарифы на электроэнергию, несложно посчитать стоимость, во сколько рублей обойдется такое кипячение. Надо также учитывать, что частично энергия уйдет в воздух и на нагрев сосуда, частей плиты, поэтому реальный расход будет выше.
Таблица для ряда веществ
Удельная теплота парообразования при нормальном атмосферном давлении (1 атм = 760 мм рт. ст.) и температуре кипения (для каждого вещества она своя).
| Вещество | L, МДж/кг | T кипения, ℃ |
| Вода | 2,3 | 100 |
| Этиловый спирт | 0,84 | 78,4 |
| Метиловый спирт | 1,1 | 64,1 |
| Ртуть | 0,28 | 357 |
| Жидкий азот | 0,2 | -195,8 |
| Аммиак | 1,4 | -33,4 |
| Фреон 12 | 0,16 | -24,9 |
| Расплавленный алюминий | 10,9 | 2450 |
Для воды при 20 ℃ L=2,45МДж/кг.
Видео по теме статьи
Об удельной теплоте парообразования расскажет видео:
Заключение
Единица измерения удельной теплоты парообразования – Дж/кг. Она показывает, сколько при заданной температуре надо подвести тепла, чтобы преобразовать 1 кг вещества в пар. Величина определяется путем проведения экспериментов.
Для воды при 100 ℃ ее значение 2260 кДж/кг. Эта величина довольно большая в сравнении с характеристиками других веществ. С ростом температуры значение удельной теплоты образования пара уменьшается.
Твердые кристаллические вещества переходят в жидкое состояние посредством плавления. Чтобы расплавить вещество, необходимо сообщить ему некоторое количество теплоты. И, наоборот, при кристаллизации (переходе жидкости в твердое состояние) энергия выделяется в окружающую среду.
Проведем аналогию с переходом жидкости в пар. Этот переход может быть осуществлен двумя способами: испарением или кипением. Кипение является тем же испарением, но более интенсивным. Очевидно, что для того, чтобы происходил процесс кипения, жидкости необходимо сообщать какое-то количество теплоты. Это количество теплоты будет идти на образование пара.
На данном уроке мы познакомимся с новым определением — удельной теплотой парообразования и конденсации. Вы узнаете формулу для расчета количества теплоты, необходимого для парообразования жидкости и научитесь ею пользоваться.
Удельная теплота парообразования
Вы уже знаете, что кипение происходит при определенной для каждой жидкости температуре. Количество теплоты, которое потребуется сообщить этим жидкостям одинаковой массы для превращения их в пар тоже будет различно.
Опытным путем было выяснено следующее. Если мы возьмем воду массой $1 space кг$ при температуре $100 degree C$, то нам потребуется затратить $2.3 cdot 10^6 space Дж$ энергии для полного превращения этой воды в пар.
Температура кипения во время всего процесса остается постоянной. Следовательно, нам необходимо подводить к кипящей жидкости определенное количество теплоты. Для воды это энергия в $2.3 cdot 10^6 space Дж$.
Удельная теплота парообразования — это физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой $1 space кг$ в пар без изменения температуры.
- Обозначается буквой $L$
- Единица измерения удельной теплоты парообразования — $1 frac{Дж}{кг}$
- При температуре кипения внутренняя энергия вещества в парообразном состоянии больше внутренней энергии вещества такой же массы в жидком состоянии
Удельная теплота парообразования некоторых жидкостей
В таблице 1 приведены экспериментально полученные величины удельной теплоты парообразования некоторых жидкостей.
| Вещество | $L, frac{Дж}{кг}$ |
| Вода | $2.3 cdot 10^6$ |
| Аммиак (жидкий) | $1.4 cdot 10^6$ |
| Спирт | $0.9 cdot 10^6$ |
| Эфир | $0.4 cdot 10^6$ |
| Ртуть | $0.3 cdot 10^6$ |
| Воздух (жидкий) | $0.2 cdot 10^6$ |
Удельная теплота парообразования эфира равна $0.4 cdot 10^6 frac{Дж}{кг}$. Что это означает?
Возьмем $1 space кг$ эфира при его температуре кипения ($35 degree C$). Для того чтобы полностью превратить его в пар, нам потребуется $0.4 cdot 10^6 space Дж$.
Обратите внимание, что удельная теплота парообразования показывает количество теплоты, необходимое для превращения жидкости, взятой при ее температуре кипения, в пар.
Удельная теплота конденсации
Нужно ли сообщать пару энергию при его конденсации? Давайте рассмотрим простой опыт (рисунок 1).
Нальем в сосуд воду и закроем его пробкой. Через пробку проведем трубку и направим ее на кусочек охлажденного стекла. Доведем воду до кипения с помощью горелки.
Пар, поднимающийся над кипящей водой, будет конденсироваться, соприкасаясь с холодным стеклом. Если мы дотронемся до стекла, то обнаружим, что оно очень сильно нагрелось.
Так энергия пара передается стеклу. В результате этой потери энергии пар конденсируется. Если бы температура стекла была равна температуре пара, то теплопередача бы не происходила, и конденсат не образовывался бы.
Это говорит о том, что при конденсации пар отдает, выделяет энергию.
Более точные опыты также показывают, что
Конденсируясь, пар отдает то количество энергии, которое пошло на его образование.
Значит, при превращении $1 space кг$ водяного пара в воду при температуре $100 degree C$ выделяется $2.3 cdot 10^6 space Дж$ энергии.
Это довольно большая энергия, поэтому человечество стремится ее использовать. Например, на крупных тепловых электростанциях паром, который уже прошел через турбины, нагревают воду. Ее, в свою очередь, используют для отопления зданий и бытовых нужд.
Расчет количества теплоты, необходимого для парообразования
Чтобы вычислить количество теплоты $Q$, необходимое для превращения в пар жидкости любой массы, взятой при температуре кипения, нужно удельную теплоту парообразования $L$ умножить на массу $m$:
$Q = Lm$.
Из этой формулы при расчетах мы можем выражать массу ($m = frac{Q}{L}$) и удельную теплоту парообразования ($L = frac{Q}{m}$).
Для расчета количества теплоты, которое выделит пар массой $m$ при температуре кипения в ходе конденсации, используется эта же формула.
Упражнения
Упражнение №1
У вас есть вода массой $2 space кг$ с температурой $20 degree C$. Рассчитайте, какое количество энергии потребуется для ее превращения в пар.
Дано:
$m = 2 space кг$
$t_1 = 20 degree C$
$t_2 = 100 degree C$
$c = 4200 frac{Дж}{кг cdot degree C}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Сначала нам потребуется нагреть воду до температуры кипения, затратив на это количество энергии $Q_1$:
$Q_1 = cm (t_2 — t_1)$.
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot (100 degree C — 20 degree C) = 8400 frac{Дж}{degree C} cdot 80 degree C = 672 space 000 space Дж approx 0.7 cdot 10^6 space Дж$.
Теперь рассчитаем количество энергии $Q_2$, затраченное для превращения воды в пар:
$Q_2 = Lm$.
$Q_2 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 2 space кг = 4.6 cdot 10^6 space Дж$.
Рассчитаем общее количество энергии, которое нам потребуется:
$Q = Q_1 + Q_2 = 0.7 cdot 10^6 space Дж + 4.6 cdot 10^6 space Дж = 5.3 cdot 10^6 space Дж$.
Ответ: $Q = 5.3 cdot 10^6 space Дж$.
Упражнение №2
Вычислите, какое количество энергии выделится при охлаждении водяного пара массой $2 space кг$ от $100 degree C$ до $0 degree C$.
Дано:
$m = 2 space кг$
$t_1 = 100 degree C$
$t_2 = 0 degree C$
$c = 4200 frac{Дж}{кг cdot degree C}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение
Скрыть
Решение:
Температура $100 degree C$ — это температура парообразования воды и конденсации водяного пара. При понижении температуры пар сначала сконденсируется в жидкость, а жидкость продолжит охлаждаться.
Количество теплоты, выделенное при этом будет равно:
$Q = Q_1 + Q_2$, где
$Q_1$ — количество выделенной теплоты при конденсации пара,
$Q_2$ — количество теплоты, выделенное при охлаждении жидкости до $0 degree C$.
$Q_1 = Lm$.
$Q_1 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 2 space кг = 4.6 cdot 10^6 space Дж$.
$Q_2 = cm (t_1 — t_2)$.
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot (100 degree C — 0 degree C) = 8400 frac{Дж}{degree C} cdot 100 degree C = 840 space 000 space Дж approx 0.8 cdot 10^6 space Дж$.
$Q = 4.6 cdot 10^6 space Дж + 0.8 cdot 10^6 space Дж= 5.4 cdot 10^6 space Дж$.
Ответ: $Q = 5.4 cdot 10^6 space Дж$.
Упражнение №3
Из чайника выкипела вода объемом $0.5 space л$. Начальная температуры этой воды составляла $10 degree C$. Какое количество энергии оказалось излишне затраченным? Плотность воды — $1000 frac{кг}{м^3}$.
Дано:
$V = 0.5 space л$
$rho = 1000 frac{кг}{м^3}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
СИ:
$0.5 cdot 10^{-3} space м^3$
$Q — ?$
Посмотреть решение и ответ
Скрыть
Решение:
После закипания воды в чайнике огонь выключают. Если его не выключить, то процесс кипения продолжится, и вода из чайника будет испаряться. Так как превращение воды в пар не является целью кипячения воды, энергию, которая ушла на парообразование можно считать излишне затраченной. Рассчитаем ее по формуле: $Q = Lm$.
Массу мы можем выразить через плотность и объем:
$m = rho V$.
Тогда наша формула примет вид:
$Q = Lrho V$.
$Q = 2.3 cdot 10^6 frac{Дж}{кг} cdot 1000frac{кг}{м^3} cdot 0.5 cdot 10^{-3} space м^3 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 0.5 space кг = 1.15 cdot 10^6 space Дж$.
Ответ: $Q = 1.15 cdot 10^6 space Дж$.
Содержание:
- Определение и формула количества теплоты
- Формула расчета теплоты при изменении температуры
- Формула количества теплоты при фазовых переходах
- Единицы измерения количества теплоты
- Примеры решения задач
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем,
что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом
случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система
микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии,
которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой).
Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики.
Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $delta Q$. Обратим внимание,
что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом.
Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$delta Q=C d T(1)$$
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$delta Q=c m d T=nu c_{mu} d T(2)$$
где $c=frac{C}{m}$ – удельная теплоемкость тела, m – масса тела,
$c_{mu}=c cdot mu$ – молярная теплоемкость,
$mu$ – молярная масса вещества,
$nu=frac{m}{mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты
($Delta Q$), которое получает тело при увеличении его температуры на величину
$Delta t = t_2 – t_1$ можно вычислить как:
$$Delta Q=c m Delta t(3)$$
где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности
($Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты,
которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты
($delta Q$) равное:
$$delta Q=lambda d m$$
где $lambda$ – удельная теплота плавления, dm – элемент массы тела.
При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества.
При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$delta Q=r d m$$
где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$
где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 –
количество теплоты части воды температурой t1 и массой m1;
Q2=cm2t2– количество теплоты части воды температурой t2 и массой m2.
Из уравнения (1.1) следует:
$$
begin{array}{l}
mathrm{cmt}=mathrm{cm}_{1} t_{1}+mathrm{~cm}_{2} t_{2} rightarrow mathrm{mt}=mathrm{m}_{1} t_{1}+mathrm{~m}_{2} t_{2} rightarrow \
rightarrow rho mathrm{Vt}=rho V_{1} t_{1}+rho mathrm{V}_{2} t_{2} rightarrow mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2)
end{array}
$$
При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$
V=V_{1}+V_{2}(1.3)
$$$
Так, мы получаем систему уравнений:
$$
left{begin{array}{c}
V t=V_{1} t_{1}+V_{2} t_{2} \
V=V_{1}+V_{2}
end{array}right.
$$
Решив ее получим:
$$
begin{array}{l}
V_{1}=frac{left(t_{2}-tright)}{t_{2}-t_{1}} V \
V_{2}=frac{left(t-t_{1}right)}{t_{2}-t_{1}} V
end{array}
$$
Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$
begin{array}{l}
V_{1}=frac{(60-40)}{60-10} 200=80 text { (л) } \
V_{2}=frac{(40-10)}{60-10} 200=120 text { (л) }
end{array}
$$
Ответ. V1=80 л, V2=120 л.

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 396 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!
Пример
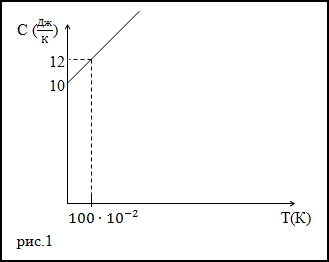
Задание. Теплоемкость тела изменяется по линейному закону (рис.1) в зависимости от абсолютной температуры в
рассматриваемом интервале $T_{1} leq T leq T_{2}$ .
Какое количество теплоты получает тело, если T1=300 К, T2=400 К.
Решение. Исследуя график функции теплоемкости (C(T)) (рис.1) запишем его аналитическое выражение, оно получится:
$C(T)=10+2 cdot 10^{-2} T$ (Дж/К)
Основой для решения задачи послужит формула для количества теплоты в виде:
$$delta Q=C d T(2.2)$$
Подставим полученное выражение для теплоемкости (2.1) в формулу (2.2) поведем интегрирование в заданном интервале температур:
$$
begin{array}{c}
Delta Q=int_{300}^{400}left(10+2 cdot 10^{-2} Tright) d T=left.left(10 cdot T+10^{-2} T^{2}right)right|_{300} ^{400}= \
=left(10 cdot 400+10^{-2} cdot(400)^{2}right)-left(10 cdot 300+10^{-2} cdot(300)^{2}right)=1700left(mathrm{~A}^{*}right)
end{array}
$$
Ответ. $Delta Q$=1700 Дж
Читать дальше: Формула напряженности магнитного поля.