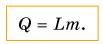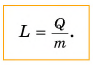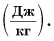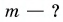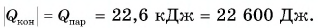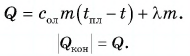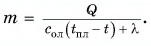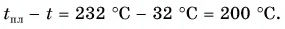Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 сентября 2021 года; проверки требуют 13 правок.
Уде́льная теплота́ парообразова́ния и конденса́ции — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить количество жидкости с единичной массой в пар, при данной температуре жидкости и без её изменения (температуры) в процессе испарения. Равна удельной теплоте конденсации единичной массы пара в жидкость.
Расчёт[править | править код]
Удельная теплота парообразования и конденсации обозначается буквой 
где Q — теплота, истраченная на превращение жидкости в пар или пара в жидкость, m — масса.
Наименьшее значение удельной теплоты парообразования будет при температуре кипения жидкости.
Размерность удельной теплоты парообразования в СИ — Дж/кг. Устаревшие, но иногда применяемые единицы для теплоты парообразования — ккал/кг и кал/кг.
В химии теплота парообразования обычно приводится к молю вещества. Эта величина называется молярной теплотой испарения (конденсации); единица её измерения — Дж/моль. Также используются устаревшие единицы: ккал/моль, кал/моль.
Значения для некоторых веществ[править | править код]
Удельная теплота парообразования некоторых веществ при нормальном атмосферном давлении (760 мм. рт. ст. = 101,325 кПа) и температуре, равной температуре кипения вещества[1]:
| Вещество | Температура кипения, °C |
Удельная теплота парообразования/ конденсации, кДж/кг |
|---|---|---|
| Азот | −195,8 | 199 |
| Ртуть | 357 | 282 |
| Диэтиловый эфир | 34,6 | 380 |
| Водород | −252,6 | 448 |
| Этиловый спирт | 78,4 | 837 |
| Свинец | 1 740 | 855 |
| Аммиак | −33,4 | 1 370 |
| Вода | 100 | 2300 |
| Медь | 2 600 | 4 820 |
| Железо | 3 200 | 6 120 |
| Алюминий | 2 450 | 10 900 |
| Литий | 1 340 | 21 000 |
| Графит | 4 200 | 29 700 |
| Бериллий | 2 469 | 32 500 |
| Бор | 3 865 | 45 300 |
См. также[править | править код]
- Удельная теплоёмкость
- Удельная теплота плавления
- Сублимация
Примечания[править | править код]
- ↑ Теплота испарения // БСЭ, 3 изд.
На этой странице вы можете рассчитать количество теплоты, необходимое для превращение жидкости в пар с помощью калькулятора онлайн. Для этого необходимо ввести массу жидкости и ее удельную теплоту парообразования (см. таблицу).
Удельная теплота парообразования – физическая величина, показывающая, какое количество теплоты потребуется для превращения жидкости массой 1кг в пар без изменения температуры. Обозначается буквой L и измеряется в Дж/кг.
Содержание:
- калькулятор количества теплоты для превращения в пар
- формула количества теплоты для превращения в пар
- таблица “Удельная теплота парообразования”
- примеры задач
Формула количества теплоты для превращения в пар
{Q = L cdot m}
Q – необходимое количество теплоты для превращения жидкости, находящейся при температуре кипения в пар
L – удельная теплота парообразования (см. таблицу)
m – масса жидкости, находящейся при температуре кипения.
Удельная теплота парообразования жидкостей и расплавленных металлов при температуре кипения и нормальном атмосферном давлении
| Жидкость | Удельная теплота парообразования, кДж/кг |
|---|---|
| Азот жидкий | 201 |
| Аллюминий | 9200 |
| Аммиак | 1370 |
| Бензин | 230 – 310 |
| Висмут | 840 |
| Вода (при 0°С) | 2500 |
| Вода (при 20°С) | 2450 |
| Вода (при 100°С) | 2260 |
| Вода (при 370°С) | 440 |
| Вода (при 374,15°С) | 0 |
| Водород жидкий | 450 |
| Воздух | 197 |
| Гелий жидкий | 23 |
| Железо | 6300 |
| Золото | 1650 |
| Керосин | 209 – 230 |
| Кислород жидкий | 214 |
| Магний | 5440 |
| Медь | 4800 |
| Никель | 6480 |
| Олово | 3010 |
| Ртуть | 293 |
| Свинец | 860 |
| Спирт этиловый | 906 |
| Эфир этиловый | 356 |
| Цинк | 1755 |
Примеры задач на нахождение количества теплоты
Задача 1
Какое количество теплоты требуется для обращения в пар воды массой 0.2 кг при температуре 100°C?
Решение
Подставим значения из условия в формулу и рассчитаем результат. Удельную теплоту парообразования для воды при температуре 100°C возьмем из таблицы: L = 2260 кДж/кг.
Q = L cdot m = 2260 cdot 0.2 = 452 Дж
Ответ: 452 Дж
Проверим ответ с помощью калькулятора .
Твердые кристаллические вещества переходят в жидкое состояние посредством плавления. Чтобы расплавить вещество, необходимо сообщить ему некоторое количество теплоты. И, наоборот, при кристаллизации (переходе жидкости в твердое состояние) энергия выделяется в окружающую среду.
Проведем аналогию с переходом жидкости в пар. Этот переход может быть осуществлен двумя способами: испарением или кипением. Кипение является тем же испарением, но более интенсивным. Очевидно, что для того, чтобы происходил процесс кипения, жидкости необходимо сообщать какое-то количество теплоты. Это количество теплоты будет идти на образование пара.
На данном уроке мы познакомимся с новым определением — удельной теплотой парообразования и конденсации. Вы узнаете формулу для расчета количества теплоты, необходимого для парообразования жидкости и научитесь ею пользоваться.
Удельная теплота парообразования
Вы уже знаете, что кипение происходит при определенной для каждой жидкости температуре. Количество теплоты, которое потребуется сообщить этим жидкостям одинаковой массы для превращения их в пар тоже будет различно.
Опытным путем было выяснено следующее. Если мы возьмем воду массой $1 space кг$ при температуре $100 degree C$, то нам потребуется затратить $2.3 cdot 10^6 space Дж$ энергии для полного превращения этой воды в пар.
Температура кипения во время всего процесса остается постоянной. Следовательно, нам необходимо подводить к кипящей жидкости определенное количество теплоты. Для воды это энергия в $2.3 cdot 10^6 space Дж$.
Удельная теплота парообразования — это физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой $1 space кг$ в пар без изменения температуры.
- Обозначается буквой $L$
- Единица измерения удельной теплоты парообразования — $1 frac{Дж}{кг}$
- При температуре кипения внутренняя энергия вещества в парообразном состоянии больше внутренней энергии вещества такой же массы в жидком состоянии
Удельная теплота парообразования некоторых жидкостей
В таблице 1 приведены экспериментально полученные величины удельной теплоты парообразования некоторых жидкостей.
| Вещество | $L, frac{Дж}{кг}$ |
| Вода | $2.3 cdot 10^6$ |
| Аммиак (жидкий) | $1.4 cdot 10^6$ |
| Спирт | $0.9 cdot 10^6$ |
| Эфир | $0.4 cdot 10^6$ |
| Ртуть | $0.3 cdot 10^6$ |
| Воздух (жидкий) | $0.2 cdot 10^6$ |
Удельная теплота парообразования эфира равна $0.4 cdot 10^6 frac{Дж}{кг}$. Что это означает?
Возьмем $1 space кг$ эфира при его температуре кипения ($35 degree C$). Для того чтобы полностью превратить его в пар, нам потребуется $0.4 cdot 10^6 space Дж$.
Обратите внимание, что удельная теплота парообразования показывает количество теплоты, необходимое для превращения жидкости, взятой при ее температуре кипения, в пар.
Удельная теплота конденсации
Нужно ли сообщать пару энергию при его конденсации? Давайте рассмотрим простой опыт (рисунок 1).
Нальем в сосуд воду и закроем его пробкой. Через пробку проведем трубку и направим ее на кусочек охлажденного стекла. Доведем воду до кипения с помощью горелки.
Пар, поднимающийся над кипящей водой, будет конденсироваться, соприкасаясь с холодным стеклом. Если мы дотронемся до стекла, то обнаружим, что оно очень сильно нагрелось.
Так энергия пара передается стеклу. В результате этой потери энергии пар конденсируется. Если бы температура стекла была равна температуре пара, то теплопередача бы не происходила, и конденсат не образовывался бы.
Это говорит о том, что при конденсации пар отдает, выделяет энергию.
Более точные опыты также показывают, что
Конденсируясь, пар отдает то количество энергии, которое пошло на его образование.
Значит, при превращении $1 space кг$ водяного пара в воду при температуре $100 degree C$ выделяется $2.3 cdot 10^6 space Дж$ энергии.
Это довольно большая энергия, поэтому человечество стремится ее использовать. Например, на крупных тепловых электростанциях паром, который уже прошел через турбины, нагревают воду. Ее, в свою очередь, используют для отопления зданий и бытовых нужд.
Расчет количества теплоты, необходимого для парообразования
Чтобы вычислить количество теплоты $Q$, необходимое для превращения в пар жидкости любой массы, взятой при температуре кипения, нужно удельную теплоту парообразования $L$ умножить на массу $m$:
$Q = Lm$.
Из этой формулы при расчетах мы можем выражать массу ($m = frac{Q}{L}$) и удельную теплоту парообразования ($L = frac{Q}{m}$).
Для расчета количества теплоты, которое выделит пар массой $m$ при температуре кипения в ходе конденсации, используется эта же формула.
Упражнения
Упражнение №1
У вас есть вода массой $2 space кг$ с температурой $20 degree C$. Рассчитайте, какое количество энергии потребуется для ее превращения в пар.
Дано:
$m = 2 space кг$
$t_1 = 20 degree C$
$t_2 = 100 degree C$
$c = 4200 frac{Дж}{кг cdot degree C}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Сначала нам потребуется нагреть воду до температуры кипения, затратив на это количество энергии $Q_1$:
$Q_1 = cm (t_2 — t_1)$.
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot (100 degree C — 20 degree C) = 8400 frac{Дж}{degree C} cdot 80 degree C = 672 space 000 space Дж approx 0.7 cdot 10^6 space Дж$.
Теперь рассчитаем количество энергии $Q_2$, затраченное для превращения воды в пар:
$Q_2 = Lm$.
$Q_2 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 2 space кг = 4.6 cdot 10^6 space Дж$.
Рассчитаем общее количество энергии, которое нам потребуется:
$Q = Q_1 + Q_2 = 0.7 cdot 10^6 space Дж + 4.6 cdot 10^6 space Дж = 5.3 cdot 10^6 space Дж$.
Ответ: $Q = 5.3 cdot 10^6 space Дж$.
Упражнение №2
Вычислите, какое количество энергии выделится при охлаждении водяного пара массой $2 space кг$ от $100 degree C$ до $0 degree C$.
Дано:
$m = 2 space кг$
$t_1 = 100 degree C$
$t_2 = 0 degree C$
$c = 4200 frac{Дж}{кг cdot degree C}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение
Скрыть
Решение:
Температура $100 degree C$ — это температура парообразования воды и конденсации водяного пара. При понижении температуры пар сначала сконденсируется в жидкость, а жидкость продолжит охлаждаться.
Количество теплоты, выделенное при этом будет равно:
$Q = Q_1 + Q_2$, где
$Q_1$ — количество выделенной теплоты при конденсации пара,
$Q_2$ — количество теплоты, выделенное при охлаждении жидкости до $0 degree C$.
$Q_1 = Lm$.
$Q_1 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 2 space кг = 4.6 cdot 10^6 space Дж$.
$Q_2 = cm (t_1 — t_2)$.
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot (100 degree C — 0 degree C) = 8400 frac{Дж}{degree C} cdot 100 degree C = 840 space 000 space Дж approx 0.8 cdot 10^6 space Дж$.
$Q = 4.6 cdot 10^6 space Дж + 0.8 cdot 10^6 space Дж= 5.4 cdot 10^6 space Дж$.
Ответ: $Q = 5.4 cdot 10^6 space Дж$.
Упражнение №3
Из чайника выкипела вода объемом $0.5 space л$. Начальная температуры этой воды составляла $10 degree C$. Какое количество энергии оказалось излишне затраченным? Плотность воды — $1000 frac{кг}{м^3}$.
Дано:
$V = 0.5 space л$
$rho = 1000 frac{кг}{м^3}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
СИ:
$0.5 cdot 10^{-3} space м^3$
$Q — ?$
Посмотреть решение и ответ
Скрыть
Решение:
После закипания воды в чайнике огонь выключают. Если его не выключить, то процесс кипения продолжится, и вода из чайника будет испаряться. Так как превращение воды в пар не является целью кипячения воды, энергию, которая ушла на парообразование можно считать излишне затраченной. Рассчитаем ее по формуле: $Q = Lm$.
Массу мы можем выразить через плотность и объем:
$m = rho V$.
Тогда наша формула примет вид:
$Q = Lrho V$.
$Q = 2.3 cdot 10^6 frac{Дж}{кг} cdot 1000frac{кг}{м^3} cdot 0.5 cdot 10^{-3} space м^3 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 0.5 space кг = 1.15 cdot 10^6 space Дж$.
Ответ: $Q = 1.15 cdot 10^6 space Дж$.
Количество теплоты. Удельная теплоемкость вещества
Количеством теплоты называют количественную меру изменения внутренней энергии тела при теплообмене.
Количество теплоты — это энергия, которую тело отдает при теплообмене (без совершения работы). Количество теплоты, как и энергия, измеряется в джоулях (Дж).
Удельная теплоемкость вещества
Теплоемкость — это количество теплоты, поглощаемой телом при нагревании на $1$ градус.
Теплоемкость тела обозначается заглавной латинской буквой С.
От чего зависит теплоемкость тела? Прежде всего, от его массы. Ясно, что для нагрева, например, $1$ килограмма воды потребуется больше тепла, чем для нагрева $200$ граммов.
А от рода вещества? Проделаем опыт. Возьмем два одинаковых сосуда и, налив в один из них воду массой $400$ г, а в другой — растительное масло массой $400$ г, начнем их нагревать с помощью одинаковых горелок. Наблюдая за показаниями термометров, мы увидим, что масло нагревается быстрее. Чтобы нагреть воду и масло до одной и той же температуры, воду следует нагревать дольше. Но чем дольше мы нагреваем воду, тем большее количество теплоты она получает от горелки.
Таким образом, для нагревания одной и той же массы разных веществ до одинаковой температуры требуется разное количество теплоты. Количество теплоты, необходимое для нагревания тела и, следовательно, его теплоемкость зависят от рода вещества, из которого состоит это тело.
Так, например, чтобы увеличить на $1°$С температуру воды массой $1$ кг, требуется количество теплоты, равное $4200$ Дж, а для нагревания на $1°$С такой же массы подсолнечного масла необходимо количество теплоты, равное $1700$ Дж.
Физическая величина, показывающая, какое количество теплоты требуется для нагревания $1$ кг вещества на $1°$С, называется удельной теплоемкостью этого вещества.
У каждого вещества своя удельная теплоемкость, которая обозначается латинской буквой $с$ и измеряется в джоулях на килограмм-градус (Дж/(кг$·°$С)).
Удельная теплоемкость одного и того же вещества в разных агрегатных состояниях (твердом, жидком и газообразном) различна. Например, удельная теплоемкость воды равна $4200$ Дж/(кг$·°$С), а удельная теплоемкость льда $2100$ Дж/(кг$·°$С); алюминий в твердом состоянии имеет удельную теплоемкость, равную $920$ Дж/(кг$·°$С), а в жидком — $1080$ Дж/(кг$·°$С).
Заметим, что вода имеет очень большую удельную теплоемкость. Поэтому вода в морях и океанах, нагреваясь летом, поглощает из воздуха большое количество тепла. Благодаря этому в тех местах, которые расположены вблизи больших водоемов, лето не бывает таким жарким, как в местах, удаленных от воды.
Расчет количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении
Из вышеизложенного ясно, что количество теплоты, необходимое для нагревания тела, зависит от рода вещества, из которого состоит тело (т. е. его удельной теплоемкости), и от массы тела. Ясно также, что количество теплоты зависит от того, на сколько градусов мы собираемся увеличить температуру тела.
Итак, чтобы определить количество теплоты, необходимое для нагревания тела или выделяемое им при охлаждении, нужно удельную теплоемкость тела умножить на его массу и на разность между его конечной и начальной температурами:
$Q=cm(t_2-t_1)$
где $Q$ — количество теплоты, $c$ — удельная теплоемкость, $m$ — масса тела, $t_1$ — начальная температура, $t_2$ — конечная температура.
При нагревании тела $t_2 > t_1$ и, следовательно, $Q > 0$. При охлаждении тела $t_2 < t_1$ и, следовательно, $Q < 0$.
В случае, если известна теплоемкость всего тела $С, Q$ определяется по формуле
$Q=C(t_2-t_1)$
Удельная теплота парообразования, плавления, сгорания
Теплота парообразования (теплота испарения) — количество теплоты, которое необходимо сообщить веществу (при постоянном давлении и постоянной температуре) для полного превращения жидкого вещества в пар.
Теплота парообразования равна количеству теплоты, выделяющемуся при конденсации пара в жидкость.
Превращение жидкости в пар при постоянной температуре не ведет к увеличению кинетической энергии молекул, но сопровождается увеличением их потенциальной энергии, т. к. расстояние между молекулами существенно увеличивается.
Удельная теплота парообразования и конденсации. Опытами установлено, что для полного обращения в пар $1$ кг воды (при температуре кипения) необходимо затратить $2.3$ МДж энергии. Для обращения в пар других жидкостей требуется иное количество теплоты. Например, для спирта оно составляет $0.9$ МДж.
Физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой $1$ кг в пар без изменения температуры, называется удельной теплотой парообразования.
Удельную теплоту парообразования обозначают буквой $r$ и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты, необходимое для парообразования (или выделяющееся при конденсации). Чтобы вычислить количество теплоты $Q$, необходимое для превращения в пар жидкости любой массы, взятой при температуре кипения, нужно удельную теплоту парообразования $r$ умножить на массу $m$:
$Q=rm$
При конденсации пара происходит выделение такого же количества теплоты:
$Q=-rm$
Удельная теплота плавления
Теплота плавления — это количество теплоты, которое необходимо сообщить веществу при постоянном давлении и постоянной температуре, равной температуре плавления, чтобы полностью перевести его из твердого кристаллического состояния в жидкое.
Теплота плавления равна тому количеству теплоты, которое выделяется при кристаллизации вещества из жидкого состояния.
При плавлении вся подводимая к веществу теплота идет на увеличение потенциальной энергии его молекул. Кинетическая энергия не меняется, поскольку плавление идет при постоянной температуре.
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить один килограмм льда, нужно затратить $332$ Дж энергии, а для того чтобы расплавить $1$ кг свинца — $25$ кДж.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой $1$ кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления измеряют в джоулях на килограмм (Дж/кг) и обозначают греческой буквой $λ$ (лямбда).
Удельная теплота кристаллизации равна удельной теплоте плавления, поскольку при кристаллизации выделяется такое же количество теплоты, какое поглощается при плавлении. Так, например, при замерзании воды массой $1$ кг выделяются те же $332$ Дж энергии, которые нужны для превращения такой же массы льда в воду.
Чтобы найти количество теплоты, необходимое для плавления кристаллического тела произвольной массы, или теплоту плавления, надо удельную теплоту плавления этого тела умножить на его массу:
$Q=λm$
Количество теплоты, выделяемое телом, считается отрицательным. Поэтому при расчете количества теплоты, выделяющегося при кристаллизации вещества массой $m$, следует пользоваться той же формулой, но со знаком «минус»:
$-Q=λm$
Удельная теплота сгорания
Теплота сгорания (или теплотворная способность, калорийность) — это количество теплоты, выделяющейся при полном сгорании топлива.
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обычное топливо (уголь, нефть, бензин) содержит углерод. При горении атомы углерода соединяются с атомами кислорода, содержащегося в воздухе, в результате чего образуются молекулы углекислого газа. Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Теплота сгорания топлива зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество теплоты, выделяющейся при его полном сгорании.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой $1$ кг, называется удельной теплотой сгорания топлива.
Удельную теплоту сгорания обозначают буквой $q$ и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты $Q$, выделяющееся при сгорании $m$ кг топлива, определяют по формуле:
$Q=qm$
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.
Уравнение теплового баланса
В замкнутой (изолированной от внешних тел) термодинамической системе изменение внутренней энергии какого-либо тела системы $∆U_i$ не может приводить к изменению внутренней энергии всей системы. Следовательно,
$∆U_1+∆U_2+∆U_3+…+∆U_n=∑↙{i}↖{n}∆U_i=0$
Если внутри системы не совершается работа никакими телами, то, согласно первому закону термодинамики, изменение внутренней энергии любого тела происходит только за счет обмена теплом с другими телами этой системы: $∆U_i=Q_i$. Учитывая ($∆U_1+∆U_2+∆U_3+…+∆U_n=∑↙{i}↖{n}∆U_i=0$), получим:
$Q_1+Q_2+Q_3+…+Q_n=∑↙{i}↖{n}Q_i=0$
Это уравнение называется уравнением теплового баланса. Здесь $Q_i$ — количество теплоты, полученное или отданное $i$-м телом. Любое из количеств теплоты $Q_i$ может означать теплоту, выделяемую или поглощаемую при плавлении какого-либо тела, сгорании топлива, испарении или конденсации пара, если такие процессы происходят с различными телами системы, и будут определятся соответствующими соотношениями.
Уравнение теплового баланса является математическим выражением закона сохранения энергии при теплообмене.
Содержание:
Кипение жидкостей:
Вы уже знаете, что испарение жидкости без притока теплоты при любой температуре приводит к ее охлаждению. А как будет идти испарение, если жидкости непрерывно передавать энергию (теплоту)?
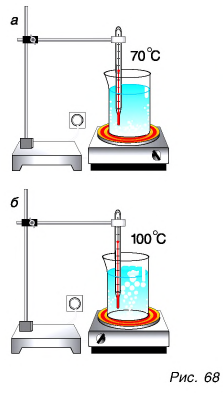
Проведем опыт. Поставим на электроплитку стакан с водой (рис. 68, а). По термометру будем следить за изменением температуры воды в стакане. Температура воды сначала растет. На дне стакана появляется множество маленьких пузырьков. Их размеры постепенно увеличиваются, так как вода испаряется внутрь пузырьков и давление пара в пузырьках при нагревании повышается. Пузырьки отрываются ото дна и стенок и движутся вверх. А что дальше? Если давление пара внутри пузырька больше, чем над жидкостью, то у поверхности он разрывается, и пар выходит наружу. При этом температура воды близка к 100 °C и практически не меняется. А все большее число пузырьков поднимается и лопается у поверхности, выбрасывая пар в атмосферу. Вода кипит (рис. 68, б).
Что такое кипение
Кипение — это процесс парообразования, идущий при постоянной температуре но всему объему жидкости. Действительно, любой пузырек можно рассматривать как сосуд с паром внутри жидкости (рис. 69). С поверхности его стенок идет испарение и обратный процесс — возврат молекул в жидкость, т. е. конденсация.
При кипении температура жидкости не меняется. По ведь энергия (от нагретой плитки) жидкостью поглощается. На что же она расходуется? Энергия, полученная жидкостью, идет на превращение ее в пар (газ), т. е. на преодоление сил притяжения между молекулами жидкости.
При обратном процессе — переходе пара в жидкость (рис. 70), или конденсации, это же количество энергии выделяется.
Температура, при которой происходит кипение жидкости, называется температурой кипения.
Температура кипения у разных жидкостей неодинакова. Это и понятно, ведь энергия взаимодействия их молекул тоже разная.
В таблице 4 приведены температуры кипения жидкостей при нормальном атмосферном давлении.
А случайно ли мы, говоря о температуре кипения жидкости, указываем давление? Нет, не случайно. Пузырьки кипящей жидкости лопаются при условии, что давление пара в них не меньше, чем давление снаружи. Значит, чем меньше внешнее давление, тем при более низкой температуре закипит жидкость.
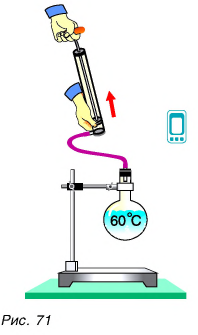
Подтвердим это опытом. Нальем в колбу теплой воды, температура которой t = 50—60 °C. Закроем колбу пробкой, подсоединенной к откачивающему насосу (рис. 71). Откачаем газ из колбы. Вода закипит, хотя ее температура меньше 100 °C. Ио это не значит, что в такой воде можно сварить яйцо. Яйцо варится не потому, что вода кипит, а потому, что она горячая.
А если в специальных условиях создать высокое давление над поверхностью воды, то в ней можно будет расплавить олово, но вода так и не будет кипеть. Объясните почему.
Зависимость температуры кипения от внешнего давления используется в практических целях. Например, для стерилизации медицинских инструментов их помещают в герметически закрытые камеры-автоклавы (рис. 72), вода в которых кипит при температуре значительно выше 100 °C. В быту используются кастрюли-скороварки (рис. 73), в которых температура кипения воды может повышаться до 120 °C. Поэтому пища в скороварках готовится гораздо быстрее, чем в обычных кастрюлях.
- Заказать решение задач по физике
Вернемся к парообразованию. Чтобы превратить в пар 1 кг жидкости при температуре кипения, необходимо передать ей определенное количество теплоты. А если масса жидкости будет 2 кг? Значит, теплоты понадобится в 2 раза больше. А при превращении в пар m кг жидкости количество теплоты увеличится в m раз, т. е. количество теплоты, необходимое для парообразования, прямо пропорционально массе жидкости:
В этой формуле коэффициент L называется удельной теплотой парообразования:
Как следует из формулы, единицей удельной теплоты парообразования в СИ является 1 джоуль на килограмм
Удельная теплота парообразования есть физическая величина, численно равная количеству теплоты, поглощенному 1 кг жидкости при переходе ее в пар при температуре кипения.
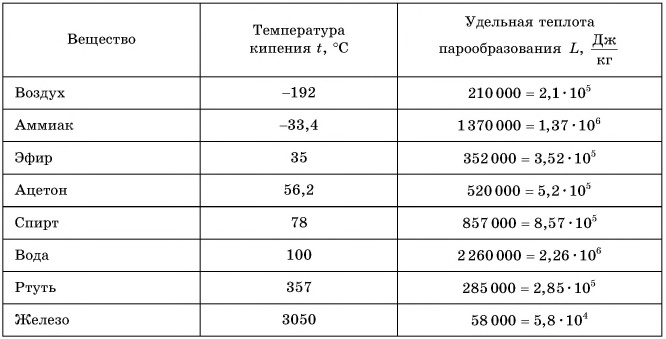
Таблица 4. Температура кипения и удельная теплота парообразования некоторых жидкостей (при нормальном атмосферном давлении)
Удельная теплота парообразования различных жидкостей дана в таблице 4. Что значит 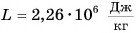
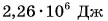
Можно сказать и иначе: 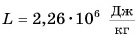
Главные выводы:
- Превращение жидкости в газ (пар) при постоянной температуре во всем объеме жидкости называют кипением.
- Температура кипения зависит от рода жидкости и внешнего давления.
- Чем выше давление над поверхностью жидкости, тем выше температура кипения.
- При кипении жидкость поглощает энергию, при конденсации пара выделяется равное количество энергии.
- Количество поглощенной при кипении тепловой энергии зависит от рода жидкости и ее массы.
Пример решения задачи
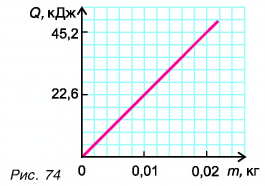
На рисунке 74 представлен график зависимости количества теплоты, идущего на парообразование некоторой жидкости, от ее массы. Какую массу олова можно расплавить, используя теплоту конденсации пара данной жидкости массой 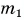
Дано:
Решение
Из графика найдем модуль количества теплоты, которое выделится при конденсации пара массой 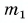
Для нагревания до температуры плавления 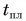
Откуда
Тогда
Ответ: m = 0,2 кг.
- Электромагнитные явления в физике
- Электромагнитные волны и их свойства
- Магнитные явления в физике
- Магнитный поток
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
- Поверхностное натяжение жидкости
- Свойства паров в физике