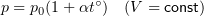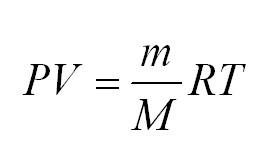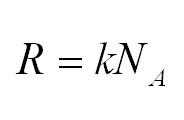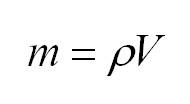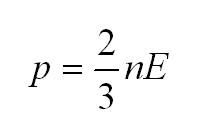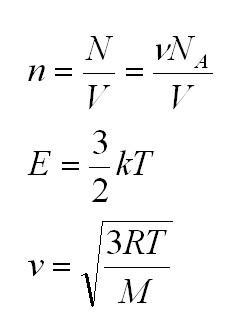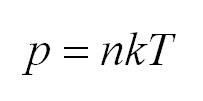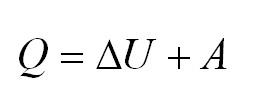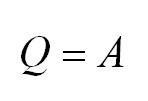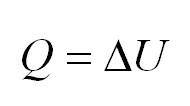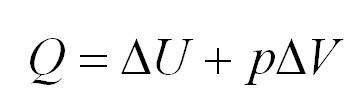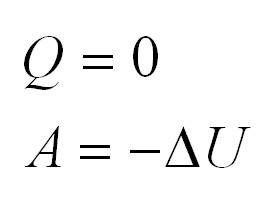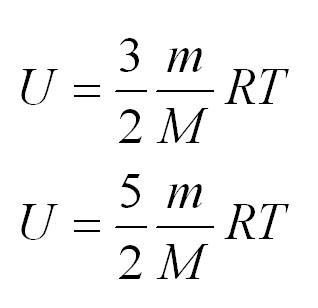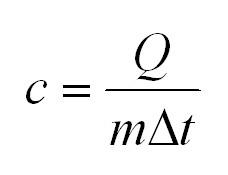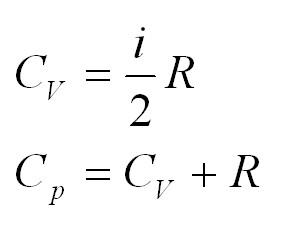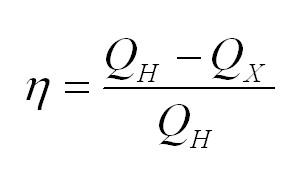Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Внутренняя энергия одноатомного и двухатомного идеального газа
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.
Виктор Матвеевич Скоков
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Раздел молекулярной физики посвящен вопросам изучения строения и свойств веществ, исходя из их молекулярно-кинетических характеристик. Законы и принципы этого раздела физики основываются на ряде базовых представлений, таких как:
- все физические тела состоят из частиц – атомов, молекул или ионов, которые, в свою очередь, обладают сложным строением;
- для атомов, молекул и ионов характерно непрерывное неупорядоченное тепловое движение; между скоростью движения частиц и температурой тела наблюдается прямая зависимость;
- между атомами и молекулами установлены силы взаимного притяжения и отталкивания.
Замечание 1
Важнейшей характеристикой вещества в этой системе является теплота. Теплота с точки зрения термодинамики – это энергия молекулярного движения.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Теплота может изменяется двумя способами – посредством совершения работы над системой или путем теплообмена системы с окружающей средой. Во втором случае речь идет о количестве теплоты или просто теплоте.
Единица измерения количества теплоты (а также работы и энергии) – джоуль (Дж). Один джоуль равен энергии, затраченной при перемещении точки приложения силы (1 ньютон) на расстояние 1 метра по направлению приложения силы. Иными словами, $1Дж = 1Н times 1м = 1кг times 1м^2 times 1с^2$.
Также, для измерения количества теплоты применимо понятие калория (вне системы единиц СИ). Одна калория равна энергии, затраченной для нагревания 1 грамма воды на 1 градус Цельсия.
Теплота и теплообмен
Существует три типа теплообмена:
- конвекция – теплообмен при перемешивании газов или жидкостей с разной температурой;
- лучеиспускание – теплообмен посредством электромагнитных волн теплового диапазона;
- теплопередача – непосредственный обмен энергией между неупорядоченно движущимися частицами тел при их тепловом контакте.
«Теплота в молекулярной физике» 👇
Энергия в форме теплоты может как сообщаться системе, так и изыматься из нее. Количество теплоты, переданное или принятое системой при теплообмене, обозначают как $Delta Q$. Условно принято, что при положительном значении $Delta Q$ энергия системе сообщается, а при отрицательном $Delta Q$ – изымается. По этому признаку, например, химические реакции разделяются, соответственно, на эндотермические и экзотермические.
Количество теплоты входит в математические формулировки первого и второго начал термодинамики. Так, например, первый закон, в самом простом варианте формулируется следующим образом:
Термодинамическая система может совершать работу исключительно за счет внутренней энергии системы или за счет внешних источников.
В математическом выражении первое начало выглядит как:
$Q = A + Delta U$, где:
- $Q$ – количество теплоты, принятое или переданное системой;
- $A$ – работа, совершенная системой;
- $Delta U$ – изменение внутренней энергии системы.
Замечание 2
Суть второго закона заключается в том, что в изолированной системе энтропия (мера хаоса, часть внутренней энергии замкнутой системы) остается неизменной либо возрастает до момента установления термодинамического равновесия. Иными словами, макроскопические процессы, протекающие с конечной скоростью, необратимы.
Математическая формулировка закона:
-
$ dS = frac {partial Q^*}{T} geqslant 0$, где:
-
$S$ – энтропия;
- $partial Q^*$ – элементарное количество тепла в изолированной системе;
- $T$ – абсолютная температура.
Связанные понятия
Определение 1
Внутренняя энергия – суммарная энергия неупорядоченного движения молекул, потенциальной энергии их взаимодействия и собственной, внутримолекулярной энергии молекул, входящих в состав тела.
Признаком изменения внутренней энергии является смена агрегатного состояния или температуры тела.
Бесконечно малое изменение внутренней энергии принято обозначать $dU$. Как и в случае с $delta G$, при отрицательном значении $dU$ внутренняя энергия системы уменьшается, при положительном $dU$ – увеличивается.
Определение 2
Температура – физическая величина, характеризующая термодинамическое равновесие системы.
Согласно молекулярно-кинетической теории, температура пропорциональна средней кинетической энергии составляющих системы.
В физике (в системе СИ) температуру принято измерять в кельвинах или в градусах Цельсия. Температуры по шкале Цельсия $t$ и Кельвина $T$соответствуют равенству:
$t = T – 273,15$
Определение 3
Теплоемкость тела – физическая величина, равная количеству теплоты, которое необходимо сообщить телу для изменения его температуры на один кельвин.
Таким образом, теплоемкость вычисляется как:
$C = frac {Q}{Delta T}$, где:
$C$ – теплоемкость тела, Дж/К
Следовательно, для вычисления количества тепла этого процесса используют формулу:
$Q = C times Delta T$
Удельная теплоемкость – теплоемкость тела, нормированная на 1 кг:
$c = frac {Q}{m times Delta T}$, где:
- $c$ – удельная теплоемкость, Дж/К кг;
- $m$ – масса тела, кг.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Физическая дисциплина «Термодинамика», имеющая дословный перевод с греческого как θέρμη — «тепло», δύναμις — «сила», занимается изучением общих характеристик макросистем и обращения энергии внутри них. Эту науку относят к феноменологическому типу, хотя опирается она на факты, полученные опытным путем.
Термодинамическая система, рассматриваемая в данном ракурсе, имеет конкретные характеристики, не применимые к единичным атомам и молекулам. К ним относят температуру, энергию, объем, концентрацию растворов, давление.
Определение таких параметров происходит по формулам термодинамики.
Основные формулы термодинамики
Особенностью термодинамики является то, что ее постулаты не касаются взаимодействия отдельных единиц (атомов, молекул), как в молекулярной физике. Предметом изучения предстают общие взаимопревращения энергии, образование теплоты, теплопередача и совершение работы.
Исходя из этого, выделяют основные формулы термодинамики, к которым относятся:
- Уравнение Менделеева-Клайперона: (PV=(m/M)*RT). Его смысл — в изменениях трех входящих величин, которые направлены на характеристику состояния идеального газа.
- Количество вещества, обозначаемое буквой (ν). (nu=N/NA=m/mu)
Величина, выражающая, сколько одинаковых структурных компонентов (единиц) находится в веществе.
- Закон Дальтона: давление смеси газов на стенку сосуда равно сумме давлений каждого входящего в смесь элемента: (p=p1+p2+…pn.)
- Главное уравнение МКТ (молекулярно-кинетической теории): (p=2n/3<varepsilon>n=N/V). Выражает математическое соотношение таких параметров, как давление газа и микропараметров: массы молекул, их скорости движения, концентрации.
- Средняя кинетическая энергия поступательного движения молекулы газа. Для обозначения применяется (E_k), выражается через формулу: (E_k=E_{моля}/NA=3/2ast RT/NA). Ее мерой является абсолютная температура идеального газа, поскольку потенциальная энергия (вследствие взаимодействия молекул друг с другом) равна нулю. Зная, что R/NA=k, получается формула: (E_k=3/2ast kT).
- Давление идеального газа прямо пропорционально концентрации и его температуре: (P=nkT.)
- Скорость молекул определяется по формулам:
(V=surd(2kT/m_o)=surd(2RT/mu)) — наиболее вероятная;
(<V>=surd(8kT/pi m_o)=surd(8RT/pimu)) — среднеарифметическая;
(<Vкв>surd(3kT/m_o)=surd(3RT/mu)) — средняя квадратичная. - Сумма кинетических энергий всех молекул определяет внутреннюю энергию всего идеального газа. Математически выражение выглядит так: (U=i/2ast(m/mu)ast RT.)
- Формула для определения работы, которую совершает идеальный газ при расширении:( A=P(V_2-V_1).)
- Формула первого закона термодинамики: (Q=Delta U+A.)
- Для определения удельной теплоемкости вещества применяется математическое выражение: (С=Delta Q/mdT.)
- Кроме удельной теплоемкости, существует понятие молярной теплоемкости. Для ее определения применяется формула: (C=cmu). Для изохорного процесса правильная формула принимает вид: (C_v=1/2ast R), для изобарного: (C_p=((i+2)/2)ast R).
Первое начало термодинамики
Согласно первому закону термодинамики, (Q) (количество внутренней теплоты), которое получил газ извне, расходуется на совершение работы (А) и изменение внутренней энергии (U). Формула закона: (Q=Delta U+A).
На практике газ может быть нагрет либо охлажден. Однако в данном случае рассматривается изотермический процесс, в котором один из характеризующих параметров остается неизменным.
Если процесс изотермичен, в химии включается закон Бойля-Мариота. В нем говорится, что давление газа соотносится к изначальному объему, при стабильной температуре, обратно пропорционально.
(Q=A)
Когда процесс происходит при неизменном объеме, говорят об изохорности. Здесь вступает в действие закон Шарля. В обозначенных условиях то тепло, которое поступило к газу, расходуется на изменение внутренней энергии. Другими словами, (P) пропорционально (T).
(Q=Delta U)
Протекание процессов в идеальном газе при неизменном давлении носит характер изобарного. Здесь действует закон Гей-Люссака, который выражается уравнением:
(Q=Delta U=pDelta V)
Полная формулировка закона гласит: полученное тепло при изобарном процессе расходуется на совершение работы газом, а также изменяет его внутреннюю энергию.
Часть процессов происходят изолированно от внешней среды. Газ не получает дополнительной энергии. Такая ситуация носит название адиабатной и математически записывается: (Q=0). Работа (А) в таком случае выражается: (A=-Delta U.)
Уравнение идеального газа в термодинамике
Молекулы идеального газа постоянно движутся. От того насколько велика скорость их движения, зависит общее состояние газа, а также величина его воздействия, например, на стенки сосуда. Поэтому одним из основных уравнений термодинамики является Клайперона-Менделеева:
(PV=(m/M)ast RT)
В уравнении (m) — единица массы газа, (M) — его молекулярная масса, (R) — универсальная величина, называемая газовой постоянной. Ее значение = 8,3144598. Измеряется в Дж/(моль*кг).
В основе термодинамики лежат и другие газовые постоянные, например, число Авогадро, постоянная Больцмана. Таким образом, (R=kNA.)
Из уравнения Клайперона-Менделеева можно также вычислить массу. Она будет равна произведению плотности на объем: (m=rho V).
Основное уравнение молекулярно-кинетической теории (МКТ)
Решение части задач зависит от знания особенностей взаимосвязи между давлением газа и характеристикой кинетической энергии его молекул. Математическое выражение такой зависимости носит название основного уравнения МКТ:
(p=2/3ast nE)
В данном выражении кинетическая энергия обозначена буквой (Е), а концентрация молекул — (n). Каждую из этих величин физики можно найти исходя из соответствующих формул, после чего уравнение для молекулярно-кинетической теории (МКТ) приобретает вид:
(p=nkT)
Формула теплоемкости и главная формула КПД в термодинамике
Когда теплообмен проявляется передачей телу определенного количества теплоты, его энергия, как и температура, меняются.
То количество теплоты, обозначаемое (Q), которое понадобится для того, чтобы 1 кг определенного вещества нагреется на 1 К, носит определение теплоемкости вещества и обозначается с.
Математическое выражение относительно переданного количества теплоты выглядит формулой:
(Q=cm(t_2-t_1)=cmDelta t)
Измеряется величина в Дж/(кг∙К).
При t2⟩t1, количество теплоты со знаком плюс, следовательно, вещество нагревается. Если наоборот, то Q — со знаком минус, и вещество остывает.
В физике, характеризуя свойства вещества, говорят о его теплоемкости. Это имеет значение, например, при выборе стройматериалов или сырья для изготовления нагревательных приборов. Теплоемкость равна произведению массы на удельную теплоемкость данного тела:
(C=cm)
Учитывая, что в величине теплоемкости уже отражена масса, то сокращенная формула для определения (Q) выглядит так:
(Q=C(t_2-t_1))
С другой стороны, то количество теплоты, которое отдает источник, можно высчитать по формуле:
(Q=Pt.)
В выражении буквой (P) обозначается мощность нагревателя, а (t) — время их контакта.
Конструкция, состоящая из нагревателя, тела-реципиента теплоты и охладителя, носит название тепловой машины. В качестве примера рассматривается двигатель внутреннего сгорания. Как и любой механизм, она имеет такую характеристику, как КПД — коэффициент полезного действия. Для его расчета применяется формула:
(eta=(Q_н-Q_x)/Q_н)
Внутренняя энергия одноатомного и двухатомного идеального газа
Характерной особенностью идеального газа является отсутствие у его составляющих частей потенциальной энергии. Вся внутренняя энергия — это сумма кинетических энергий всех молекул. Она является величиной, прямо пропорциональной температуре идеального газа:
(mw2/2=alpha T)
В этом уравнении:
(alpha T=3Rmu/2Nmu)
Исходя из приведенных формул, величина кинетической энергии поступательного движения идеального газа должна определяться исходя из выражения:
(mv2/2=(3Rmu/2Nmu)ast T)
Поступательное движение характеризуется тремя степенями свободы. На каждую из них приходится одна треть общей кинетической энергии.
Двух- и более атомные молекулы газа характеризуются степенями свободы, касающимися вращательного движения.
Если обозначить число молекул в одном киломоле за (Nμ), то внутренняя энергия идеального газа будет измеряться по формуле:
(Umu=1/2(Rmu Ti))
В формуле (i) — число степеней свобод.
Если газ одноатомный, (i=3), двуатомный — 5, трех- и более — 6.
Задачи на термодинамику характеризуют распространенные физические процессы, поэтому часть включаются в программы экзаменов. Если для их решения не хватает времени, можно обратиться за помощью в Феникс.Хелп. На профильном сайте вам помогут справиться с любой, даже запутанной задачей, экономя ваши время и силы.
153
1.
Основное уравнение молекулярно-кинетической
теории газов
Р = (n m0<υкв>2)/3
= (2/3)n<Wк>,
Р = nkT,
где Р– давление;n– число молекул в единице объема;m0– масса одной молекулы
газа; <υкв> – средняя
квадратичная скорость молекулы;k–постоянная Больцмана;Т– абсолютная
температура.
2.
Концентрация молекул
n = N/V,
где N– число молекул, содержащихся в данной
системе;V– объем.
3. Средняя
кинетическая энергия поступательного
движения молекулы
<Wк> =(3/2)
kT.
4. Средняя
кинетическая энергия молекулы
<W> =(i/2)
kT,
где i– число
степеней свободы молекулы.
5. Средняя
квадратичная скорость молекулы
<υкв> ==
,
где k– постоянная
Больцмана;Т– абсолютная температура;m0– масса молекулы;μ– молярная масса;R– универсальная
газовая постоянная.
6. Средняя
арифметическая скорость молекулы
<υ> =
=
.
7.
Наиболее вероятная скорость молекулы
υв==
.
8.
Количество вещества
= m/ μ = N/NA,
где m– масса
вещества;μ– его молярная масса;N– число молекул;NA– число
Авогадро.
9.
Уравнение состояния идеального газа
(уравнение Менделеева –Клапейрона)
PV=(m/μ)
RT,
где Р– давление
газа в сосуде;V– объем сосуда;m– масса газа, содержащегося в данном
сосуде;μ– молярная масса газа;R– универсальная газовая постоянная;Т– абсолютная температура.
10.
Изотермический процесс (Т = const,m
= const)
P1V1= P2V2.
11.
Изохорический процесс (V = const,m =
const)
P = P0
(1+
t)
или
P1/P2
= T1/T2,
где t– температура
по шкале Цельсия;T– температура
по шкале Кельвина;–
температурный коэффициент.
12.
Изобарический процесс (Р =const,m =const)
V = V0(1+
t)
или V1/V2= T1/T2.
13. Работа
расширения газа:
в общем
случае
A=;
при
изобарическом процессе
A = P V;
при изотермическом
процессе
A= νRTln(V2/V1);
при
адиабатическом процессе
A= – ν СVΔТ,
где V– изменение объема;R– универсальная
газовая постоянная; ν– количество
вещества; СV – теплоемкость
при постоянном объеме;Т– изменение температуры.
14.
Внутренняя энергия идеального газа
U=(ν
RT)(i/2)
= ν СVТ,
где i– число
степеней свободы молекулы.
15.
Удельные теплоемкости газа:
при
постоянном объеме
сv =(i/2)
(R/μ),
при
постоянном давлении
ср =(i+2/2)
(R/μ).
16.
Уравнение Майера для удельных теплоемкостей
ср – сv = R/μ.
17.
Уравнение Пуассона
(PV)γ=const,
где γ = Ср /
Сv =(i
+ 2)/i, Ср,Сv– молярные теплоемкости при постоянном
давлении, объеме.
18. Связь между
удельной (с) и молярной (С)
теплоемкостями
c = С/μ.
19.
Уравнение теплового баланса
Q=cm(t2–t1),
где Q– количество
теплоты, необходимое для нагревания
тела массойmот температурыt1до температурыt2;c– удельная теплоемкость вещества.
20.
Теплота плавления
Q = m,
где – удельная теплота плавления вещества.
21.
Теплота парообразования
Q = r m,
где r– удельная
теплота парообразования вещества.
22. Первый
закон термодинамики
Q = U + A,
где Q– количество
теплоты, сообщенное термодинамической
системе;U– изменение внутренней энергии системы;А– работа, совершенная системой
против внешних сил.
23.
Коэффициент полезного действия цикла
Карно
= (Q1–Q2)/Q1=(T1–T2)
/T1,
где Q1–
количество теплоты, полученное от
нагревателя;Q2– количество
теплоты, переданное холодильнику;Т1– абсолютная температура нагревателя;Т2– абсолютная температура
холодильника.
24.
Разность энтропий двух состояний ВиА
.
25. Закон
распределения молекул по скоростям
(закон Максвелла)
N=Nf(u)
u
f(u)
= (4/)
u2,
где ΔN– число
молекул, относительные скорости которых
лежат в интервале отuдо (u + Δu);u =υ/υв– относительная
скорость, гдеυ– данная скорость,υв– наиболее вероятная скорость молекул;Δu– величина интервала относительных
скоростей, малая по сравнению со скоростьюu.
26.
Барометрическая формула
Ph=P0e(–μgh/RT),
где Ph–
давление газа на высотеh;P0– давление на высотеh = 0;g–
ускорение свободного падения.
27.
Средняя длина свободного пробега молекул
газа
<λ> = <υ>/<z> = 1/(πσ2n),
где <υ> – средняя
арифметическая скорость; <z> –
среднее число столкновений каждой
молекулы с остальными в единицу времени;σ– эффективный диаметр молекулы;n– число молекул в единице объема.
28. Общее
число столкновений всех молекул в
единице объема за единицу времени
Z=(1/2)
<z>n.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #