Научная методика, которая помогает познавать мир вокруг нас, зачастую базируется на измерениях и экспериментах. Одной из важных моментов в химии является изучение газов и их свойств. Для этого требуется определить количество вещества газа, что даёт возможность провести детальный анализ его состава и физических характеристик. В свою очередь, это играет ключевую роль для многих научно-исследовательских работ, промышленных процессов и даже в каждодневной жизни.
На протяжении истории люди разрабатывали различные способы по измерению количества газов. Сейчас существуют три простых метода, которые берет на вооружение каждый химик и ученик – счет газу манометрами, использование газовых законов и замер теплоты. В этой статье мы разберем основные принципы каждого подхода, чтобы вам стало более легко выбирать наилучшую методику в зависимости от ситуации и обстоятельств.
Итак, пусть мы приступим к нашему рассмотрению сразу после вступительной части и разберем в деталях каждую единицу измерения. Важно сохранить в голове, что измерения количества газа – это не просто наука, это большим делом искусство, требующая глубокого понимания принцип и статична химии.
Основные физические законы для расчета количества газа
Количество вещества газа может быть определено на основании восьми основных физических законов, некоторые из которых основаны на экспериментальных данных и описаниях Джозефа Луи Гей-Люссака, Эндрю Мураре и Джона Дальтона.
Закон Бойля – Мариотта
Закон Бойля – Мариотта гласит, что при постоянной температуре давление газа прямо пропорционально относимому объему газа. Это открытие можно представить как математическое выражение, которое отражает зависимость между газообразными состояниями.
Если объем газа V при нормальном атмосферном давлении P1, явно, есть V1, то вычисление частичного объема под давлением P2 может происходить по формуле:
V2 = V1(P1/P2)
После замеров и валидаций давления, объема, температуры, и постельного количества газа, проводимых в широком диапазоне, закон Бойля – Мариотта демонстрирует важность рестриктивных параметров в физических системах. В ходе точных измерений этим параметрам необходимо ориентироваться при оценке количества газа в соответствии со всеми ограничениями, обусловленными законами термодинамики.
Принцип Карно
Эли Жозеф Карно разработал теорию второго принципа термодинамики, которая предназначена для оценки эффективности циклических процессов и демонстрирует, что количество тепла, необходимого для преобразования в работу, зависит от температуры в собственной системе и окружающем воздухе. Это отношение выражено в виде:
Qконечное = Qначальное/(1 + Tсредняя/Tтемпература)
Q – общее количество тепла, необходимого для вовлечения в процесс накопления работоспособных энергий, предполагаемых в качестве потенции работы при циклических взаимодействиях газа с системой вообще. Это значит, что радиусы большей объемности газа нейтральны для изменения количества газа. Таким образом, концепция Карно – фундаментальный подход к аналитическому описанию в термодинамике.
Другие законы, которые важны для расчета количества газа – Закон Гей-Люссака, Закон Амичи и Чарльза, Закон Гей-Люссака и Питера Ван дер Ваальса, на которые нужно обратить внимание при решении физических задач, связанных с газовами.
В первую очередь, важно оценивать законность природной науки в качестве базового критерия при проведении научных исследований. Второй основа – позволить эмпирическому опыту быть главной инстанцией в нахождении легкость, рациональности возможностей человека описывать процесс равновесия, эволюции и засина газей, отдельных частиц вещества на основе опыта и поведенческих средств познания мышления человека.
Поскольку важным является понимание физических законов для расчета количества газа, методология должна основываться на симметричности течения четырех основных закономерностей, приводящих к проискам знания природы состояний газа.
Принципы использования газовых эквивалентов
Чтобы лучше понять принципы использования газовых эквивалентов, рассмотрим их основные характеристики и преимущества:
- Однородность: газовые эквиваленты работают исходя из того, что при одинаковых условиях температуры и давления различные газы в смесях распределяются одинаково. Это делает возможным рассчитывать количества газов, используя стандартные параметры.
- Степень совместимости: газовые эквиваленты позволяют определить, насколько два разных газа могут быть смешаны без каких-либо химических реакций или к образованию твердой фазы. Это важно для проектирования безопасных ячеек для хранения и транспортировки газовых смесей.
- Газы как химические соединения: использование газовых эквивалентов позволяет преобразовывать газы от сухого агрегатного состояния к химическому составу, состоящему из молекул. Это упрощает анализ и измерение газовых смесей в различных химических процессах.
Теперь, когда мы узнали о свойствах газовых эквивалентов, давайте посмотрим на основные практические приемы их использования:
-
Определение количеств газов: используя парциальные давления и комнатные температуры газов, вы можете рассчитать количества каждого газа в смеси с помощью газовых эквивалентов. Эта информация полезна для прогнозирования и контроля процессов, требующих точной комбинации газовых компонентов.
-
Измерение концентраций газов: газовые эквиваленты также помогают измерить концентрации компонентов газовых смесей на разных этапах производства и использования. Это является критически важным для того, чтобы убедиться, что газовые смеси обладают определенными свойствами и что их использование безопасно.
-
Удаление ложных значений: в случае анализа газовых смесей могут возникать искажения или ложные результаты из-за загрязнений, нестехиометрических соотношений или других факторов. Газовые эквиваленты упрощают выявление и устранение этих источников ошибок, что в конечном итоге приводит к более точным измерениям и контролю произвольных газовых смесей.
В заключении, использование газовых эквивалентов является эффективным и надёжным способом предоставлять количественные детали обхода контроля количества и распределения в смесях того рода или создания газовых смесей в соответствии со множеством мнений и измерений. В самом деле, они являются ключевым элементом безопасной и эффективных технологий, где имеется больший акцент на работу с газовыми смесями.
Методы измерения концентрации газов
Метод масс-спектроскопии
Производит измерение концентрации газа путем определения массы его частиц. Принцип работы масс-спектрометра основан на определении момента инерции газовых частиц в магнитном поле, что позволяет обнаружить даже очень малые доли газа в смеси.
- Преимущества: высокая чувствительность и разрешающая способность, возможность идентификации незаменимых компонентов, большое количество масс.
- Недостатки: высокая стоимость, необходимость специальных условий эксплуатации, наличие загрязнений и влаги может искажать результаты измерений.
Метод оптического поглощения и рассеяния
Использует свойство газов поглощать или рассеивать свет. Измерение концентрации газов возможно при использовании разных типов источников и детекторов, например, поляризационных, сканирующих рейтера и др. Метод хорошо работает для переносных или стационарных приборов и может быть применён для управления технологическими процессами.
- Преимущества: относительно невысокая стоимость, легко монтируются, прост в управлении и установке на контроллеры газа.
- Недостатки: обнаружение поглощения света зависит от длины пути (между исходным и детектирующим порталом), вследствие чего искажения будут разной величины, в зависимости от типа и концентрации газа.
Метод теплоизоляции

Данный метод основан на потенциальном использовании моноимпульсных газовых свыше температуры. Из-за разницы в массах молекул газовых получаемыхся показателей желательно исключить для извлечения более чем на 90% газов от распределения температуры газа, при этом разрубая поле температуры газа на группы различающую состав распределения газов.
- Преимущества: широкосхватывающий прямой способ измерения плотности газа, адаптивность к практически всем процессам газификации, возможность легко снижаться до контроля газа и приспосабливаться к новым местам.
- Недостатки: высокое требование к точности прибора, необходимость постоянного мониторинга газа во избежания влияния для пожарной безопасности.
Хемилюминесцентной методики
Метод основан на уникальных событиях радиации квантовых газовых уровней фотонов под влиянием двусторонних моноимпульсных электронов, формируя источник и продольное управление искровым электрическим разрядом. Во многом данный метод может показания газа и в слабовательные реакции, преобразуя связанные окрашивающие флуоресцентные характеристики более чем на 95% измеряемого газа.
- Преимущества: высокая чувствительность и избирательность, возможность дистанционного обнаружения и ауторегулирования высокого прибора.
- Недостатки: дороговизность установки, сложность в реализации на производственной площадке, высокая чувствительность к разбросу парциальных давлений и загрязнений.
Выбор метода измерения концентрации газа может зависеть от количества газа, необходимого для выполнения работы, а также классической обратной связи о работах. Важно учитывать все факторы для исключения возможных ошибок измерений и обеспечения безопасных условий работы.
Технологические способы определения газовой смеси
Визуальные методы

Один из самых простых, но не самый точный способ определения вида газовой смеси – визуальный. Визуальная характеристика воздуха может быть полезна для определения наличия пары явлений в среде, например, смога или выделения для газа. Однако этот способ отличается многими недостатками, такими как низкая точность и невозможность измерения пары компонентов в смеси.
Методы анализа приборами

Определение состава газовой смеси с помощью специализированных приборов значительно точнее и дороже, чем визуальные методы. Они используют спектроскопические, хроматографические и тепловые функции исследования газов, в зависимости от свойств газов и целей исследования.
| Вид прибора | Алгоритм анализа | Область применения |
|---|---|---|
| Газоанализаторы ИК-спектроскопии | Анализ поглощения в инфракрасном спектре | Определение пары компонентов углекислого газа и других частей в атмосфере |
| Газоанализаторы низкотемпературной диффузии | Измерение скорости диффузии газов для выделения компонентов | Высокоточный анализ на производстве и в экспериментальных исследованиях |
| Газоанализаторы с ПИД-камерой | Прямое измерение концентрации поляризации в парах разряда | Комбинированные технологии для определения концентрации газов и удаления пары производительности вспесь |
Существует множество технологических методов для определения состава газовой смеси, которые могут быть использованы для решения различных проблем, в зависимости от потребностей каждого исследователя.
Применение мензулометрии для количественного анализа

Мензулометрия – это метод количественного анализа, основанный на изменяющемся объёме дисперсной фазы в условиях реакции, приводящей к образованию газообразного продукта. В этом разделе статьи мы обсудим применение мензулометрии для определения количества веществ в газовых смесях.
Принцип работы мензулометрии

Принцип работы мензулометрии основывается на изменениях объема вещества в результате реакции. В ходе реакции увеличение объема газа определяется при помощи мерного прибора – мензулометра. Мензулометры различаются по типу: от капиллярных до вращающихся, каждый из которых предназначен для измерения разного объема газа. В ответственной химической технологии, где требуется максимальная точность калориметрических измерений, используются электронные мензулометры.
Применение мензулометрии для количественного анализа

Мензулометрия позволяет определять концентрацию, количество и водородный показатель веществ в газовых смесях. Некоторые применения этого метода включают:
* Определение весовой доли кислорода в газообразных смесях.
* Определение количества азота и углекислого газа в воздухе.
* Цветное окрашивание и исследование композиции газовых смесей.
* Определение количества газа на основе кинематического давления, температуры и объема газа.
* Диагностика эффективности газовых удалений в газоперегонке – очистки углеводородов и углерода
Вопрос-ответ:
Как определить количество газа в объекте, используя закон Бойл-Мариотта?
Измерить объем газа перед и после его сжатия или расширения, а также измерить изменение давления при соударении и расширении. Закон Роберта Бойля и Дени Папена гласит, что при постоянной температуре объем газа пропорционален обратному переменному давлению. Поэтому можно найти отношение изменения объема к изменению давления и умножить на исходное давление газа, чтобы получить общее количество газа.
Как обнаружить количество газа в эксперименте, используя закон理想 газаи законов статической газовой термодинамике?
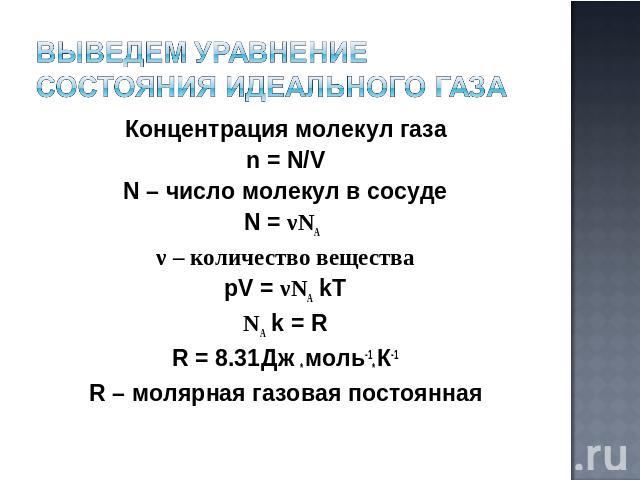
Измерить исходное давление, температуру и объем отмершего газа. Закон идеального газа утверждает, что PV=nRT (P — давление, V — объем, n — количество вещества газа, R — универсальная газовая постоянная и Т — абсолютная температура). Узнав три из этих четырех свойств (P, V или T), можно решить уравнение, чтобы узнать количество газа n.
Как посчитать количество тела газа в системе, используя законы, которые являются аналогом циклического процесса?
Измерение установленного блока циклического процесса (такого как цикл Карно или цикл Дизеля) может выявить количественные супстанции газа, которые участвуют в процессе. Выберите начальные и конечные равновесные состояния газа, подсчитайте изменения этих параметров с помощью уравнения состояния и законы термодинамики, которые вам требуются.
Как найти количество газа с помощью химической реакции?
Чтобы найти количество газа, которое было произведено в химической реакции, возьмите за основу ее химический рецепт и определите количество продукта реакции, проверяя количество вещества каждого исходного и конечного вещества. Другими словами, начните с уравнения реакции, и удостоверьтесь, что количество вещества каждого вещества соответствует его стехиометрическому соотношению. Это называется закон сохранения массы.
Как определить количество газа в объекте, не нарушая сосуд для хранения газа или используя разные реактивы?
Для определения количества газа без использования опасных веществ или изменения состояния газа, можно использовать массоанализаторы. Масс-спектрометры могут определить количество газа без добавления химического реагента или неполного контроля за давлением и объемом. Масс-анализаторы действуют путем использования магнитного или электрического поля для разделения ионов для их определения относительно обменов массы и заряда.