ЛЕКЦИИ ДЛЯ УЧИТЕЛЕЙ
Элементы научного поиска
при решении нестандартных
химических задач*
Основной способ активного освоения любой новой
области деятельности – тренировка. В химии и
других естественных науках тренировка сводится
к решению задач. Принципиально разных типов
химических задач сравнительно немного, особенно
в школьном курсе [1]. Все они известны и четко
классифицированы по содержанию и способам
решения [2]. Поэтому в принципе не представляет
больших проблем натренировать школьников решать
стандартные задачи, включающие, например,
расчеты по уравнениям химических реакций или
определение молекулярной формулы по элементному
составу.Другое дело – задачи нестандартные. Любое
малейшее отклонение от проторенной дорожки
приводит большинство учащихся в ступор,
переходящий в полный паралич умственной
деятельности. Они просто не знают, что делать.
Результатом является чистый лист.В этих случаях для выхода из тупиковой ситуации
можно привлечь в помощь элементы научного
способа познания мира. Ведь наука – это, по
определению, поиск нового, создание информации,
отличающейся от уже имеющейся. Поэтому она может
помочь найти новый способ решения задачи.
Элементарные представления о том, как вести себя
в незнакомой ситуации, какие использовать методы
для поиска решения, любому школьнику не повредят.Научная работа как способ деятельности – это
не перманентное творчество, она включает в себя и
повседневный, причем иногда утомительный труд.
Наука – это профессия, поэтому у научных
работников есть много профессиональных приемов
и рецептов, как добиваться своих целей.
Некоторыми из этих приемов мы и хотим поделиться:
они оказываются полезными при решении школьных
химических задач. Каждый рецепт будет
проиллюстрирован примерами.Разумеется, эти рецепты не универсальны: они
годятся для решения одних задач и совершенно
непригодны для других, требующих иных, может
быть, еще неизвестных подходов. Именно поэтому в
науке всегда было, есть и будет место творчеству.
![]() Р е ц е п т 1.
Р е ц е п т 1.
Пробовать
Дмитрий Иванович Менделеев, рассказывая о том,
как он открыл периодический закон, утверждал:
«Искать же что-либо, хотя бы грибы или
какую-нибудь зависимость, нельзя иначе, как
смотря и пробуя». Пробовать – это главный
научный рецепт. Для этого надо предложить любой
(пусть совсем неправильный) способ решения и
посмотреть, к чему он приводит. Можно попытаться
понять, в каком месте возникает отклонение от
условия задачи, и в этом месте подправить способ.
Так, путем проб и ошибок, методом
последовательных приближений иногда можно
решить задачу.
Пример 1. Установите возможную формулу
органического соединения, которое содержит 40%
углерода по массе.
Р е ш е н и е. Дана массовая доля углерода, а
больше про вещество ничего не известно. Давайте
пробовать разные варианты – будем
самостоятельно «назначать» дополнительную
информацию.
Самые простые органические вещества –
углеводороды CxHy. Пусть
неизвестное вещество содержит 40% углерода и 60%
водорода. Найдем его эмпирическую формулу
стандартным способом:
![]()
Углеводород CH18 не существует.
Пробуем дальше. Добавим в формулу вещества
символ кислорода: CxHyOz.
С помощью стандартного приема мы формулу найти
не можем, т.к. массовые доли кислорода и водорода
неизвестны. Попробуем принять наименьшее
возможное значение числа атомов углерода: x =
1. Тогда молярная масса вещества составляет:
M(CHyOz) = 12/0,4 = 30
г/моль.
Из 30 г на углерод приходится 12 г, а на водород и
кислород – 18 г, что соответствует H2O. Таким
образом, эмпирическая формула вещества – CH2O.
Этой формуле соответствуют, например, все
углеводы.
О т в е т. Возможная формула соединения
– CH2O.
Пример 2. Два углеводорода – A и B
– имеют одинаковый элементный состав: каждый
содержит по 92,3% мас. углерода. Образец
углеводорода A может присоединить в 6 раз
большее количество брома, чем равный по массе
образец углеводорода B. Определите возможные
структурные формулы веществ A и B.
Р е ш е н и е. Из элементного состава следует:
![]() (C) :
(C) : ![]() (H) = (92,3/12) : (7,7/1) = 1:1.
(H) = (92,3/12) : (7,7/1) = 1:1.
Эмпирическая формула обоих углеводородов – CH.
Кроме того, они содержат кратные связи, т.к.
способны присоединять бром.
Попробуем рассмотреть несколько простейших
углеводородов такого состава и рассчитаем
количество брома, способное присоединиться к
одной и той же массе каждого углеводорода. В
качестве ограничения выберем 104 г – массу 1 моль
самого тяжелого из рассматриваемых веществ: C8H8
(таблица).
Таблица
| Формула углеводорода |
Структура | Kоличество вещества Br2 на 1 моль углеводорода, моль |
Kоличество вещества Br2 на 104 г углеводорода, моль |
|---|---|---|---|
| C2H2 (Mr = 26) | HC |
2 | 2•4 = 8 |
| C4H4 (Mr = 52) | HC |
3 | 3•2 = 6 |
| C6H6 (Mr = 78) | HC |
4 | 4•4/3 = 16/3 |
| C8H8 (Mr = 104) | C6H5CH=CH2 | 1 | 1 |
Из таблицы видно, что условию задачи
удовлетворяют винилацетилен (A) и стирол (B).
Молярные массы у них отличаются в 2 раза, а
количества вещества присоединяемого брома на 1
моль углеводорода – в 3 раза, итого при равных
массах получаем искомый коэффициент 6.
Уравнения реакций:
HC![]() C–CH=CH2 + 3Br2
C–CH=CH2 + 3Br2
![]() CHBr2CBr2CHBrCH2Br,
CHBr2CBr2CHBrCH2Br,
C6H5CH=CH2 + Br2 ![]() C6H5CHBrCH2Br.
C6H5CHBrCH2Br.
Эта задача имеет бесконечно много решений, тем
она и трудна. Мы привели лишь самое простое
решение, найденное небольшим перебором.
О т в е т. Возможные структурные формулы
веществ: A – HC![]() C–CH=CH2, B
C–CH=CH2, B
– C6H5–CH=CH2.
![]() Р е ц е п т 2.
Р е ц е п т 2.
Правильно выбирать переменные
Решение многих расчетных задач значительно
облегчается правильным выбором переменных –
тех, которые характеризуют наиболее
существенные свойства изучаемых объектов. При
этом надо стараться обходиться минимальным
числом переменных.
Пример 3. В каком оксиде массовая доля
кислорода наибольшая?
Р е ш е н и е. Общая формула бинарных
кислородсодержащих соединений – RxOy.
Если ограничиться оксидами элементов с
постоянной валентностью, то число неизвестных
переменных можно сократить – R2On,
где n – степень окисления элемента R (n
изменяется от 1 до 8).
В задаче осталось две переменных – атомная
масса элемента R (обозначим ее через X) и
степень окисления n. Запишем выражение для
массовой доли кислорода:
![]()
Надо найти максимальное ее значение. С двумя
переменными это сделать очень трудно, но в данном
случае их можно объединить в одну. Поделим
числитель и знаменатель дроби на 16n:
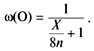
Для того чтобы выражение было максимальным,
знаменатель должен быть минимальным. Значит,
надо найти элемент, у которого отношение атомной
массы к степени окисления (это отношение иногда
называют эквивалентом) наименьшее: X/n = min.
Очевидно, что это водород: X = 1, n = 1. Искомый
оксид – вода.
О т в е т. Массовая доля кислорода
наибольшая в H2O.
Пример 4. 1000 г вещества содержат 0,3227 г
электронов. Определите формулу вещества (масса
электрона равна 1/1823 а.е.м.).
Р е ш е н и е. По данным задачи можно сразу найти
количество вещества электронов:
![]()
Количество самого вещества неизвестно, т.к. мы
не знаем его молярную массу. Обозначим ее через M
– это первая переменная, которую мы вводим.
Теперь находим количество вещества:
![]()
Как связаны между собой две указанные величины?
Для ответа на этот вопрос придется ввести еще
одну переменную n – число электронов в одной
молекуле. Тогда число молей электронов ровно в n
раз превышает число молей вещества:
![]()
Откуда M = 1,7n г/моль.
Предположим, что молярная масса выражается
почти целым числом, тогда n кратно 10. При n =
10 имеем M = 17 г/моль. Этой молярной массе
соответствует аммиак, его молекула содержит как
раз 10 электронов.
О т в е т. Формула вещества – NH3.
![]() Р е ц е п т 3.
Р е ц е п т 3.
Строить модели с разумными допущениями
Многие химические объекты – молекулы,
коллоидные частицы, кристаллы, растворы и т.д. –
исследуют путем построения моделей. Модель – это
идеализированное представление объекта, которое
отражает некоторые его существенные свойства и
пренебрегает всеми остальными. Хорошая модель
содержит лишь небольшое число параметров.
Правильность моделей подтверждается сравнением
с экспериментальными данными. Искусство
научного работника состоит в том, чтобы выбрать
главное в модели и пренебречь несущественным.
Пример 5. Радиус наночастицы золота
равен 1,5 нм, а радиус атома – 0,15 нм. Оцените,
сколько атомов входит в состав наночастицы и
какая их доля находится на поверхности.
Р е ш е н и е. Судя по условию задачи, наночастица
представляет большой шар, заполненный
маленькими шарами – атомами золота.
Шарообразные формы наночастицы и атома – это
первое допущение.
Предлагается определить число атомов по
порядку величины, т.е. получить ответ с невысокой
точностью. В таком грубом приближении можно
пренебречь свободным объемом между атомами в
наночастице и считать, что шары заполняют все
пространство. Это дает ошибку около 20%. Общее
число атомов равно отношению объема наночастицы
к объему атома:
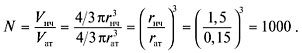
В случае гетерогенных катализаторов реакция
происходит на поверхности частиц. Поэтому, чтобы
оценить каталитические возможности наночастиц,
надо знать долю атомов на поверхности. Для этого
найдем объем поверхностного слоя Vпов и
разделим его на объем наночастицы Vнч.
Объем поверхностного слоя равен разности между
объемами самой наночастицы и «внутреннего» шара,
радиус которого меньше радиуса наночастицы на
диаметр атома (рис.).
Доля атомов на поверхности:
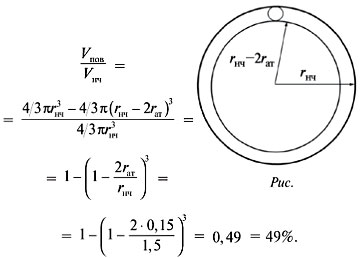
О т в е т. Число атомов золота в составе
наночастицы – 1000;
их доля на поверхности – 49%.
![]() Р е ц е п т 4.
Р е ц е п т 4.
Угадать и доказать, что правильно
Во многих задачах – преимущественно тех, в
которых зашифрованы цепочки превращений с
неизвестными веществами, – ответ можно угадать.
Но надо еще доказать, что он отвечает условиям
задачи.
Пример 6. После пропускания
электрического разряда через смесь газов А и
Б произошла реакция и образовалась смесь газов В
и Г с молярными массами, равными молярным
массам исходных газов. Определите формулы
исходных веществ А и Б.
Р е ш е н и е. Ключ к решению – равенство
молярных масс продуктов и реагентов. Известно
несколько газов с молярной массой 28 г/моль. Это CO,
C2H4, N2, B2H6. Другая
распространенная молярная масса – 44 г/моль, ей
отвечают CO2, N2O, C3H8, CH3CHO.
Числа 44 и 28 отличаются на 16 – это относительная
атомная масса кислорода. Поэтому реакция между
газами A и Б может сводиться к переходу кислорода
от одного вещества к другому. Такие вещества
среди перечисленных выше есть: N2O
(окислитель) и CO (восстановитель). Уравнение
реакции:
![]()
О т в е т. Формулы исходных
веществ – N2O и CO.
Мы рассмотрели лишь некоторые из большого
числа рецептов решения научных задач. Это очень
малая часть «технологии науки».На самом деле самое трудное в науке – не решать
задачи, а придумывать их. Ведь правильно заданный
вопрос содержит в себе большую часть ответа.
Самыми выдающимися считают не тех ученых,
которые решили какую-то проблему, а тех, которые
ее поставили. Самые крупные открытия начинаются
с правильной постановки задачи. Решение задачи –
зачастую дело техники, а вот формулировка
проблемы требует глубокого понимания скрытой
сути явлений. Подробно о том, как делались многие
открытия в химии и физике, можно прочитать в
книге [3].В заключение предлагаем несколько задач, при
решении которых можно использовать описанные
выше рецепты.
![]() Задачи для
Задачи для
самостоятельного решения
1. При количественном окислении 5 г
оптически активного вещества А
перманганатом калия в кислой среде получено 5 г
вещества Б, которое взаимодействует с
веществом А с образованием жидкости В
состава C15H14O2. Установите
структуры веществ А–В.
О т в е т. A – C6H5CH(OH)CH3,
Б – C6H5COОH, В – сложный эфир,
образованный веществами А и Б.
2. Оксид неметалла массой 10,16 г добавили к
124 г 10%-го раствора гидроксида натрия и получили
раствор, в котором массовая доля соли равна 11,27%.
Определите формулы оксида и соли.
О т в е т. SeO3, Na2SeO4.
3. Константа изомеризации некоторого
вещества A = Б равна 0,8. Смешали 5 г вещества A и
10 г его изомера Б и смесь выдержали до
установления равновесия. Вычислите массовую
долю изомера Б в полученной смеси. Зависит ли
результат от количества изомеров в исходной
смеси?
О т в е т. 0,44; не зависит.
4. В cлучае гетерогенных катализаторов
реакция происходит на поверхности частиц. Пусть
частица состоит из атомов металла радиусом r.
Определите долю атомов на поверхности
катализатора, если его частицы имеют форму: а)
шара радиуса R; б) куба со стороной L. В каком
случае – шара или куба – доля атомов на
поверхности больше, если куб и шар имеют
одинаковый объем?
О т в е т. а) 6r/R; б) 12r/L.
В случае куба доля атомов больше.
5. Два газообразных простых вещества,
состоящих из двухатомных молекул, смешали в
объемном соотношении 1 : 9 в закрытом
реакционном сосуде при температуре 20 °С и
высоком давлении. Сосуд нагрели до 215 °С; при
этом с количественным выходом образовалось
газообразное сложное вещество, а давление по
окончании реакции оказалось равным
первоначальному. Определите формулу продукта
реакции.
О т в е т. ClF5.
6. Для полного гидролиза 7,4 г смеси двух
сложных эфиров потребовалось 70 г 8%-го раствора
гидроксида калия. При добавлении к такому же
количеству смеси избытка аммиачного раствора
оксида серебра выделилось 6,48 г осадка.
Определите строение сложных эфиров и их
содержание в исходной смеси (в мольных %).
О т в е т. 30% HCOOC2H5, 70% CH3COOCH3.
7. При нагревании до 170 °С смеси двух
твердых при обычных условиях веществ, взятых в
мольном соотношении 1 : 41, образовались
твердое и газообразное вещества в мольном
соотношении 40 : 41. Определите все вещества.
О т в е т. C40H82, S, C, H2S.
* По материалам лекции для
учителей, прочитанной на Фестивале науки в МГУ
им. М.В.Ломоносова в октябре 2006 г.
Л и т е р а т у р а
1. Еремин В.В., Кузьменко Н.Е. Сборник задач и
упражнений по химии. Школьный курс. М.: Экзамен,
2006.
2. Олейников Н.Н., Муравьева Г.П. Химия.
Основные алгоритмы решения задач. М.: УНЦ ДО, 2003.
3. Краткий миг торжества. О том, как делаются
научные открытия (библиотека журнала «Химия и
жизнь»). М.: Наука, 1988.
В.В.ЕРЕМИН,
профессор химического факультета МГУ
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Пример.
Найти, в каком количестве углекислого
газа CO2
содержится 3 г углерода.
Решение:
Молекулярная
масса CO2
равна 12+(16×2)=44.
1
моль =44 г.
44
г CO2
содержат 12 г углерода
Х
г. содержат 3 г углерода
Составляем
пропорцию: 44 : Х = 12 : 3
Вычисляем
неизвестное:
Х=![]() =11
=11
Ответ:
3 г углерода содержится в 11 г углекислого
газа.
Справочный
материал:
Количество
вещества — физическая величина,
характеризующая количество однотипных
структурных единиц, содержащихся в
веществе. Под структурными единицами
понимаются любые частицы, из которых
состоит вещество (атомы, молекулы, ионы,
электроны или любые другие частицы).
Единица измерения количества вещества
в СИ — моль.
![]()
Задания:
1)Сколько
граммов оксида ртути(II)
HgO
содержат: а) 10 г ртути; б) 32 г кислорода?
(Ответ: а)216,6; б) 434 г.)
2)Сколько
тонн известняка CaCO3
содержат: а) 4 т кальция; б) 27 т углерода;
в) 16 т кислорода? (Ответ: а)10 т.; б) 225 т.
в)33,33 т.)
3)В
каком количестве бертолетовой соли
KClO3
содержится: а) 156 г калия; б) 177,5 г хлора;
в) 144 г кислорода? (Ответ: а)481,7 г. ; б)617,5
г. ; в) 367,5 г.)
1.6 Вычисление количества элемента в известном количестве вещества.
Пример.
Сколько граммов кислорода содержится
в 16 г сернистого газа SO2?
Решение:
Молекулярная
масса SO2
равна
32+(16×2)=64
1
моль=64 г.
Формула
SO2
показывает, что в 1 моль сернистого газа,
т.е. в 64 г его находится 2 атома кислорода,
т.е. 32 г кислорода.
На
этом основании делаем следующую запись:
в
64 г SO2
содержится 32 г кислорода
в
16 г SO2
содержится Х г кислорода
Составляем
пропорцию:
64
: 16 = 32 : Х
Вычисляем
известное:
Х=![]() =8.
=8.
Ответ:
в 16 г сернистого газа содержится 8 г
кислорода.
Задания:
1)Сколько
граммов кислорода содержится в 2 г: а)
оксида ртути(II)
HgO;
б) оксида меди(II)
CuO;
в) оксида серебра Ag2O;
г) оксида магния MgO;
д) калийной селитры KNO3;
е) бертолетовой соли KClO3;
ж) сурика Pb3O4?
(Ответ: а)0,15 г.; б)0,4 г., в)0,14 г. г)0,8 г, д)0,94
г е)1,15 г., ж)0,19 г.
2)Сколько
граммов азота содержится в 0,5 моль
каждого из перечисленных веществ: а)
аммиака NH3;
б) оксиде азота(I)
N2O;
в) оксиде азота(I
I)
NO;
г) азотистого ангидрида N2O3;
д) оксиде азота(IY)
NO2;
е) оксиде азота(Y)
N2O5?
(Ответ: а)8,5 г.; б)22 г.; в)15 г, г)38 г.; д)23 г.
е)54 г. г.)
3)
Сколько килограммов углерода содержится
в тонне: а) мрамора CaCO3;
б) магнезита MgCO3;
в) сидерита FeCO3?
(Ответ:
а)0,12 т..; б)0,14 т.; в)0,1 т.)
1.7Случаи более сложных вариантов задач разобранных выше типов.
На
практике редко приходится встречаться
с чистыми веществами. В связи с этим
расчёты в задачах приведённых выше
типов выражаются в определении содержания
элементов в смесях веществ или в
определении количества смеси по
известному количеству элемента в
веществе и др.
Пример.
Образец красного железняка – железной
руды, являющейся природным оксидом
железа(III),
содержит 92% оксида железа(III)
Fe2O3
,
остальное составляют примеси, не
содержащие железа.
Определить
содержание железа в 1 т этой руды.
Решение:
1)Сколько
оксида железа(III)
Fe2O3
содержит
1 т руды?
100
т -92 т
1
т – Х
Х=0,92
т
2)Сколько
железа находиться в 1 т руды ?
Fe2O3
– 2 Fe
160 – 112
160
– 112 0,92 – Х
160:0,92=112:Х
Х=0,644
Ответ:
одна тонна руды содержит 0,644 т железа.
Пример.
Сколько меди содержится в 200 г 5%-ного
раствора серной меди CuSO4?
Решение:
1)100
г раствора содержат 5 г CuSO4
200
г раствора содержат Х г CuSO4
Х=10
г
2)Сколько
меди содержится в 10 г CuSO4
CuSO4
– Cu
160 – 64
160
64 10 – Х
Х=![]() =4.
=4.
Ответ:
200 г 5%-ного раствора сернокислой меди
содержат 4 г меди?
Пример.
Сколько 15%-ного раствора хлористого
натрия NaCl
надо взять, чтобы в нём заключалось 2 г
хлора?
Решение:
1)Сколько
граммов NaCl
содержат 2 г хлора?
NaCl
– Cl
58,5 – 35,5
58,5
35,5 Х – 2
58,5:Х=35,5:2,
Х=3,29
2)100
г раствора содержат 15 г NaCl
Х
г раствора содержат 3,29 г NaCl
100:Х=15:3,29,
Х=![]() ,
,
Х=21,9.
Ответ:21,93
г.
Задания:
1)36
л воды подверглись полностью разложению.
Сколько при этом получилось: а) водорода;
б) кислорода? Ответ выразить в килограммах
и кило-молях. (Ответ: а) 2 кг или 1 кило-моль,
б) 32 кг или 1 кило – моль.)
2)Сколько
граммов оксида меди(II)
CuO
образуется при окислении: а) 4 г меди; б)
6 моль меди?
Ответ:
а)5 г., б)477 г.
3)Сколько
кислорода может выделиться при разложении
оксида ртути(II),
взятой в количестве: а) 86,8 г; б) 10 моль.
(Ответ: а) 6,36 г., б)160 г.)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Добрый день, дорогие друзья начинающие химики. Хочу начать делать разборы простых задач, чтобы потом перейти к более сложным. Для того, чтобы бегать быстрее всех, надо учиться ходить, точно также и в задачах по химии.
Начнем с теории.
Количество вещества (n, [ню]) – представляет собой размерную физическую величину, которая показывает число структурных единиц (атомов, молекул, ионов, электронов) в данной порции вещества.
Единицей количества вещества является моль.
Моль – это количество вещества, содержащие столь же структурных частиц данного вещества, сколько атомов в 12 г. углерода.
Молярная масса – величина равная отношения массы вещества к соответствующему количеству вещества.
Пример 1. Нахождение количества вещества (простого).
Какое количество вещества алюминия содержится в образце этого металла массой 10,8 г?
Пример 2. Нахождение количества вещества (сложного).
Какое количество вещества содержится в оксиде серы (IV), массой 12 г?
Пример 3. Нахождение массы вещества, исходя из количества вещества.
Определите массу Fe2O3, если известно, что его количество вещества равно 0,25 моль.
Потренироваться можно самостоятельно и решить типовые задачи. Из учебника Химия 8 класс О.С. Габрилян стр. 82., номера 1-4
Если ты хочешь больше узнать о том какие еще можно использовать методы при изучении химии подписывайся на мое сообщество в контакте https://vk.com/biochemschoolи в телеграмм https://t.me/biochemschool
Приглашаю желающих 10 января в 20:00 на разбор варианта ЕГЭ по химии в прямом эфире. Ссылка на вебинар: biochemschool.getcourse.ru/webinar
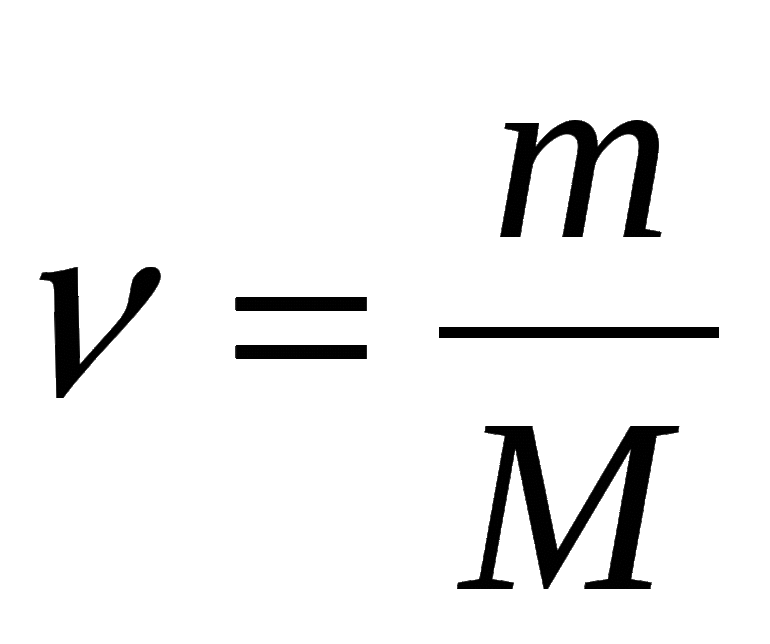
Общее понятие
Физическая величина применяется для вычисления количества конструкционных частиц в материальной субстанции. Понятие используется в случае, когда для численного определения количества вещества в химии требуется описание микроскопического строения формы материи.

Представление процессов в этом ключе нужно при проведении электролиза, получении азота и идеального газа, а также в других областях физики, которые рассматривают варианты превращения и передачи энергии.
Количество вещества является удобным понятием при характеристике различных химических процессов в отличие от массы. Это случается из-за того, что структурные электрические частицы реагируют независимо от их массы в объемах, которые являются кратными целым числам.
Примером служит процесс горения водорода, где число кислорода требуется в 2 раза меньше: О 2 + 2Н 2 = 2Н 2 О.
В этой реакции водородная масса меньше кислородной примерно в 8 раз из-за того, что атомная масса водорода меньше в 16 раз аналогичного показателя кислорода. Применение понятия количества элементов снижает неудобство при составлении уравнений. При этом взаимное соотношение между объемом веществ выражается уравнительным коэффициентом.
Формулы, которые применяются:

- Количество вещества закон Авогадро определяет на основании объема: n = V / V m, где V — объем порции газа в нормальном состоянии, а V m означает молярную величину объема субстанции в аналогичных условиях и равняется 22,4 л/моль.
- Другая формула показывает определение количества в зависимости от количества конструктивных элементов с применением постоянной Авогадро: n = N / N a, где N — число звеньев, а N a — постоянная константа Авогадро.
- В зависимости от массы и молярного веса расчет ведется по формуле: n = m / M, где m — масса субстанции, а М представляет его молярную массу.
Непосредственное число молекул не используется при расчете, т. к. это количество в реальности очень большое. Вместо обозначения молекул в штуках, применяется измерение в молях. Фактическое содержание единиц в 1 моле материи носит наименование числа Авогардо, при этом Na = 6,022141 х 1023 шт./моль.
Значение моля
Вес отдельных структурных элементов формы материи отличается, поэтому одинаковые объемы имеют различные массовые показатели. Моль — это количество материи, которое содержит число молекул, являющееся аналогичным количеству углеродных атомов в 12 г углекислого газа.
Массовый показатель не служит мерой количества субстанции, например:
- 1025 водородных молекул весят 33,5 г;
- 1025 кислородных частиц имеют массу 531,5 г.

Один моль составляет столько же нейтральных частиц, сколько их есть в 1 грамме водорода, такое положение принимается для удобства химических расчетов. При использовании наименования конструктивные элементы конкретизируются.
Понятия молекулы и моля взаимосвязаны между собой. Второе слово означает число, осязаемое множество и массу, а нейтральная частица рассматривается в качестве маленькой тяжести. Моль рассматривается в виде такого количества, которое можно отнести к понятию большой массы, состоящей из небольших весов отдельных элементов.
Молярная и молекулярная масса применяются не только к субстанциям, которые в основе конструкции имеют молекулы, но и к ионным и атомарным материальным формам.
Использование массы нейтральных частиц
В прошлом веке обнаружился научный факт, что если 2 газа содержатся в емкостях с одним и тем же объемом, то количество молекул остается одинаковым в этих субстанциях при соблюдении идентичного давления и нормальной температуры. Это значит, что важные характеристики тела определяются количеством структурных частиц, а не общим весом.
Количественное значение молярной массы M и показатели относительного молекулярного веса остаются равными, но первый предел измеряется в г/моль или моль, а вторая записывается в молях. Константа Авогадро обеспечивает пропорциональность и позиционирует переход к молярному соотношению.
Для расчета количества структурных элементов используется понятие молярной массы. Оно означает массу, которую составляет 1 моль вещества и получается от произведения молекулярной массы на количественный состав молекул в моле (число Авогардо). Молярная масса, для измерения которой используется единица грамм/ ммоль, является аналогичной по числу с относительным весом нейтральных частиц.
Примеры отмеривания равных молекулярных пропорций:
- 1 моль воды соответствует 6 х 1023 молекул Н 2 О.
- 1 моль хлора — 6 х 1023 атомов Fe.
- 1 моль ионов хлора — 6 х 1023 ионов Cl.
- 1 моль хлора — 6 х 1023 молекул Cl 2.
- 1 моль электронов е– — 6 х 1023 электронов е–.
Разница между молярной и молекулярной массой заключается в том, что они одинаковы в численном соотношении, но отличаются постоянной размерностью. Используется суммирование молярных масс составляющих элементов смеси для нахождения этой величины у многокомпонентных соединений. Для расчета молярной массы воды применяется калькулятор: М (Н 2 О) = М (О) + М (Н) = (16 + 2.1) = 18 моль.
Показатель относительного веса
Относительная молекулярная масса представляет собой вес молекулы, который выражается в атомных единицах. В расчетах используются не абсолютные веса, а относительные, т. к. масса молекулы очень мала. Например, молекула воды весит 3.10~26 кг, и частицы остальных веществ имеют значения подобного порядка. Нахождение показателя можно провести онлайн в соответствии с международными стандартами, которые сравнивают массы структурных элементов с 1/12 долей веса углеродного атома.

Успешное решение задачи связывается с тем, что углекислый газ является компонентом различных химических веществ. Принимается, что 1 атомная единица (1 а. е. м) соответствует весу водородного атома. Относительный атомный вес рассчитывается как масса неделимой частицы, выраженная в атомных единицах, при этом значение показателя берется из таблицы Д. И. Менделеева.
Относительные молекулярные массы сложных соединений находятся суммированием аналогичных показателей веса составляющих компонентов. Для подсчета требуется знание химической формулы и значение относительных атомных масс входящих элементов.
Например, молекулярный вес метана СН 4 равен 16 а. е. м (4+12), значит, при горении вещества применяется формула 2О + СН 4 = СО 2 + 2Н 2 О. Из 1 моля метана выходит 2 единицы воды, при этом 16 г газа служит для получения 36 г воды (пропорциональное соответствие).
Химические реакции
При реакции горения метана на каждую молекулу вещества требуется использовать 2 частицы кислорода. Но в условиях открытого воздуха содержание кислорода всегда является достаточным для прохождения реакции. В ограниченных условиях подводных или космических работ требуется точное определение количества вещества и молекул реагентов. Например, если в топку космического агрегата попадает больше кислорода, чем требуется, то снижается тяга и перерасходуется топливо.
Примеры использования относительного веса в реакциях:
- Сероводород имеет формулу H 2 S. Молекулярная масса его частицы рассчитывается в виде суммы относительных масс атомов, являющихся компонентами M r (H 2 S) = A r (S) + 2· Ar (H). Для расчета молекулярной массы используется уравнение Mr (H 2 S) = 2х1+32 = 2+32 = 34.
- Гелий в нормальных обстоятельствах работает, как идеальный газ, поэтому значение молярной массы рассчитывается по формуле Клайперона — Менделеева pV = mRT /М, где p — давление газа, V — объем, M — масса субстанции, Т — значение абсолютной температуры, R — постоянная константа, составляет 8,3.
- Серная кислота применяется в виде двухосновной сильной кислоты H 2 SO 4. Она отвечает за степень серного окисления. В технических реакциях используется смесь с водой и ангидридом серы S О 3. Молярная масса составляет 98,08 ± 0,006 г/миллимоль.
Химики применяют такие пропорции взаимодействия, которые имеют в составе равное число молекул для удобства работы. Точность весов в лаборатории составляет 1 мг, поэтому получается, что 1 млн молекул не всегда удается взвесить. Значит, выбирается не миллион, а другая порция, в которой число n больше этого количества.
Подсчет количества элементов
Примером простой реакции, когда в результате взаимодействия двух продуктов образовывается третья субстанция, является формула А + Б = В. Остается решить весовое количество веществ А и Б, чтобы хватило для реагирования и не осталось исходных материалов, в ином случае продукт В будет загрязнен одним из начальных компонентов.
В качестве примера подходит реакция с участием кальция: Н 2 О + С а О = С а (ОН) 2. Если простейшие формы А и Б состоят из различных атомных наборов Н 2 О и С а О, которые отличаются по весу. Соответственно, в них содержится неодинаковое число частиц, при реакции часть из них не будет использована. Если берется пропорция С а О с содержанием N молекул и порция воды с N частиц, то после взаимодействия не останется никаких веществ и получится количество N молекул.

Отсчет невидимых молекул можно выполнить с помощью взвешивания вещества, для этого требуется вес одной частицы. На весы помещается определенное количество субстанции в граммах, чтобы отмерить требуемое число молекул. Для определения величины вещества в граммах требуется сложить вес составляющих атомов, показатели которых приводятся в периодической таблице.
Атомный вес кальция составляет 40 а. е. м, кислорода — 16 а. е. м, значит, молекулярный вес Са О будет 56 а. е. м. (40+16). Неудобно брать малые количества, например, по 10 молекул субстанции для проведения реакции, поэтому нужно взвесить по миллиону структурных частиц каждого компонента. Для этого высчитывается вес будущей порции, для удобства делается переход из килограммов в граммы, при этом вес 1 а. е. м составляет 1,67х10-24 г. Для подсчета веса умножается это число на 56, получается 56х (1,67-24г) = 93,5х10-24.
Чтобы получить вес, который должен быть на весах, полученный результат умножается на миллион молекул, возникает результат 93,5х10-18 г. При увеличении количества оксида кальция и воды в одинаковое число раз порции частиц возрастают пропорционально, например, 0,1 моль кальция прореагирует с 0,1 молем воды, увеличение кальция до 10 моль потребует повышения числа моль воды также до 10.
Константа Авогадро для газов
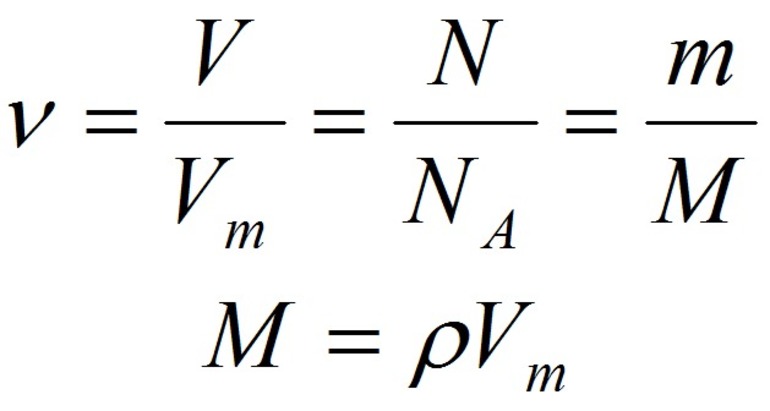
Закон Авогадро всегда точно выполняется как для газов в идеальном состоянии, так и для реальных газообразных смесей. Для последних субстанций понятие моля выражается в том, что любой объем газа всегда соответствует определенному количеству молекул. Примером служит реакция, где из аммиака и хлористого водорода выходит аммония хлорид в форме кристаллической твердой субстанции: NH 3 (газ) + HCL (газ) = NH 4 CL (крист.).
Для реагирования требуются одинаковые объемы газообразных веществ, т. к. после окончания реакции не должно оставаться избытка:
- В результате проведения опыта в замкнутом пространстве выяснилось, что при взрыве нужно 2 части водорода и одна порция кислорода, при этом получается 2 объема водяных паров в газовой консистенции О 2 + 2Н 2 = 2Н 2 О (все субстанции в виде газа).
- Одна порция водорода при реакции с 1 частью хлора преобразовывается в хлористый водород Cl 2 + H 2 = 2 HCL (все компоненты в газообразной форме).
Выводом из этого эксперимента следует то, что газы вступают в реакцию, и требуется объемные отношения с применением целочисленных показателей. Частицы в газе не связываются прочными контактами в отличие от атомов твердых субстанций. Занимаемый объем в похожих условиях зависит от количества молекул, но не от определенного типа газа. Исходя из этого положения, равные объемы газообразных субстанций всегда реагируют друг с другом без остатка.
