Тема: Определить число молей одноатомного идеального газа (Прочитано 10112 раз)
0 Пользователей и 1 Гость просматривают эту тему.
kirill5555
Определить число молей одноатомного идеального газа, если известно, что при температуре 500 К его внутренняя энергия составляет 249,3 кДж.
Записан
Kivir
Решение: внутренняя энергия идеального одноатомного газа определяется:
[ U=frac{3}{2}cdot nu cdot Rcdot T, ]
Здесь R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная, ν – искомое количество вещества. Получаем:
[ nu =frac{2cdot U}{3cdot Rcdot T}, ]
Ответ: 40 моль
Записан
- Идеальный газ:
- — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах;
- — газ, взаимодействие между молекулами которого пренебрежимо мало;
- — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией.
Общие сведения
В модели идеального газа:
-
- предполагается, что составляющие газ частицы не взаимодействуют друг с другом, то есть их размеры пренебрежимо малы, поэтому в объёме, занятом идеальным газом, нет взаимных столкновений частиц. Частицы идеального газа претерпевают столкновения только со стенками сосуда;
- между частицами газа нет дальнодействующего взаимодействия, например, электростатического или гравитационного;
- упругих столкновений между молекулами и стенками сосуда в рамках молекулярно-кинетической теории приводит к термодинамике идеального газа.
Модель идеального газа имеет широкое применения в ряде задач, например в инженерных расчетах (аэродинамический, гидравлический, теплотехнический и т.д.), связанные с воздухом и другими газами, при давлении и температуре близких к нормальным (стандартным) условиям.
При условиях сильно отличных от нормальных (стандартных) условий модель идеального газа дает результаты с погрешностью так, как модель не учитывает:
-
- притяжение между молекулами;
- конечные размеры молекул.
При высоких давления газа следует использовать различные варианты уравнений реальных газов, разработанных на базе модели идеального газа. Наиболее из известных уравнений реального газа — полуэмпирическое уравнение Ван-дер-Ваальса.
Основные уравнения состояние идеального газа
Уравнения состояния идеального газа служат для получения неизвестных параметров идеального газа или газов схожих по свойствам с моделью идеального газа.
В данном разделе будут рассмотрены варианты уравнение состояния идеального газа на основе уравнения Менделеева — Клапейрона (или уравнение Клапейрона).
P⋅VM=R⋅T или P⋅V=(m/M)⋅R⋅T
Эти уравнение имеет наибольшее практическое значение при инженерных расчетах. Но так же существуют другие варианты записи уравнения состояния идеального газа.
Основными параметрами идеального газа служат:
-
- давление идеального газа (Р), Па;
- температура идеального газа (T), °К;
- объем идеального газа (V), м3;
- молярная масса идеального газа (M), кг/моль;
- количества идеального газа (n), моль;
- масса идеального газа (m), кг;
- молярный объем (VM), м3/моль;
Другие физические величины используемые в уравнении состояния идеального газа:
-
- плотность идеального газа (ρ), кг/м3.
Калькуляторы параметров идеального газа
Калькулятор молярного объема идеального газа
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитается по формуле:
VM=(R⋅T)/P
Введите универсальную газовую постоянную (Run0)
Введите температуру газа (T0)
Введите давление газа (абсолютного) (PA0)
Результат расчета молярного объема газа (Vm0)
Формула расчета молярного объема газа:
Скачать результат расчета молярного объема газа:

Поделится ссылкой на расчет молярного объема:
Если по калькулятору, приведенному выше, посчитать молярный объем газа при нормальных условиях:
-
- давление Р=101325 Па;
- температура Т=273,15 ºК.
В результате получится молярный объем идеального газа при нормальных условиях равный 22,413971 литр/моль (частный случай закона Авогадро).
Молярные объёмы реальных газов и идеального газа для практических вычислений имеют не значительные отклонения и принимаются равными .
Калькулятор давления идеального газа
При решении инженерных задач часто необходимо определять давление газа в технических устройствах, для решения задачи по организации технологии, для выполнения расчета на прочность технических устройств или просто для выполнения гидравлических (аэродинамических расчетов).
Расчет давления газа, если известны:
-
- масса газа;
- объем занимаемый газом (внутри сосуда, трубопровода или другого устройства);
- молярная масса газа;
- температура газа,
выполняется по формуле:
P=(m⋅R⋅T)/(M⋅V)
Введите универсальную газовую постоянную (Run2)
Введите температуру газа (T2)
Введите молярную массу газа (Mg2)
Результат расчета давления газа (абсолютного) (PA2)
Формула расчета давления газа (абсолютного):
Скачать результат расчета давления газа (абсолютного):

Поделится ссылкой на расчет давления:
Калькулятор температуры идеального газа
Температуру газа необходимо обычно рассчитывать для:
-
- возможности принятия технологических решения;
- возможности проведения расчета на прочность технологического оборудования;
- расчета теплоизоляции оборудования и защиты персонала от повышенной или пониженной температуры.
Расчет температуры газа, если известны:
-
- масса газа;
- объем занимаемый газом (внутри сосуда, трубопровода или другого устройства);
- молярная масса газа;
- абсолютное давление газа.
выполняется по формуле:
T=(P⋅M⋅V)/(m⋅R)
Введите давление газа (абсолютное) (PA3)
Введите молярную массу газа (Mg3)
Введите универсальную газовую постоянную (Run3)
Результат расчета температуры газа (T3)
Формула расчета температуры газа:
Скачать результат расчета температуры газа:

Поделится ссылкой на расчет температуры:
Калькулятор объема идеального газа
Расчет объем занимаемый газом (внутри сосуда, трубопровода или другого устройства), если известны:
-
- масса газа;
- давление газа;
- молярная масса газа;
- температура газа,
выполняется по формуле:
V=(m⋅R⋅T)/(M⋅P)
На основе этого уравнения, так же находят объемный расход газа при различных условиях.
Введите универсальную газовую постоянную (Run4)
Введите температуру газа (T4)
Введите молярную массу газа (Mg4)
Введите давление газа (абсолютного) (PA4)
Результат расчета объема газа (V4)
Формула расчета объема газа:
Скачать результат расчета объема газа:

Поделится ссылкой на расчет объема:
Калькулятор массы идеального газа
Масса газа рассчитывают для:
-
- решения технологических задач;
- возможности проведения расчета на прочность технологического оборудования и трубопроводов (сбор нагрузок);
- на опасных производственных объектах с опасными веществами для расчета массы опасных веществ для возможности идентификации производственного объекта, как ОПО.
Расчет массы газа, если известны:
-
- абсолютное давление газа;
- молярная масса газа;
- объем занимаемый газом (внутри сосуда, трубопровода или другого устройства);
- температура газа,
выполняется по формуле:
m=(P⋅M⋅V)/(T⋅R)
Введите давление газа (абсолютное) (PA5)
Введите молярную массу газа (Mg5)
Введите температуру газа (T5)
Введите универсальную газовую постоянную (Run5)
Результат расчета массы газа (m5)
Формула расчета массы газа:
Скачать результат расчета массы газа:

Поделится ссылкой на расчет массы:
Калькулятор плотности идеального газа
Расчет плотности газа, если известны:
-
- абсолютное давление газа;
- молярная масса газа;
- температура газа,
выполняется по формуле:
ρ=(P⋅M)/(T⋅R)
Введите давление газа (абсолютное) (PA6)
Введите молярную массу газа (Mg6)
Введите температуру газа (T6)
Введите универсальную газовую постоянную (Run6)
Результат расчета плотности газа (pl6)
Формула расчета плотности газа:
Скачать результат расчета плотности газа:

Поделится ссылкой на расчет плотности :
Калькулятор параметров идеального газа системы исходя из разных состояний системы
Выполняется по формуле:
P1⋅V1/T1=P2⋅V2/T2=P3⋅V3/T3=…=const
Рассмотрим изменение параметров системы по двумя состояниям:
P1⋅V1/T1=P2⋅V2/T2
Калькулятор давления идеального газа
P1=(P2⋅V2⋅T1)/(T2⋅V1)
Введите давление газа (абсолютное) (Pg2)
Введите температуру газа (Tg1)
Введите температуру газа (Tg2)
Результат расчета давления газа (абсолютного) (Pg1)
Формула расчета давления газа (абсолютного):
Скачать результат расчета давления газа (абсолютного):

Поделится ссылкой на расчет давления:
Калькулятор температуры идеального газа
T3=(P3⋅V3⋅T4)/(P4⋅V4)
Введите давление газа (абсолютное) (Pg3)
Введите температуру газа (Tg4)
Введите температуру газа (абсолютное) (Pg4)
Результат расчета температуры газа (Tg3)
Формула расчета температуры газа:
Скачать результат расчета температуры газа:

Поделится ссылкой на расчет температуры:
Калькулятор объема идеального газа
V5=(P6⋅V6⋅T5)/(P5⋅T6)
Введите давление газа (абсолютное) (Pg6)
Введите температуру газа (Tg5)
Введите давление газа (абсолютное) (Pg5)
Введите температуру газа (Tg6)
Результат расчета объема газа (Vg5)
Формула расчета объема газа:
Скачать результат расчета объема газа:

Поделится ссылкой на расчет объема:
Поделиться ссылкой:
Уравне́ние состоя́ния идеа́льного га́за (иногда уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
,
где
Уравнение состояния идеального газа можно записать в виде:
,
где 


или в виде
,
где 


Эта форма записи носит имя уравнения (закона) Клапейрона — Менделеева.
Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную 
Менделеев обнаружил, что 


Связь с другими законами состояния идеального газа[править | править код]
В случае постоянной массы газа уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
— закон Бойля — Мариотта — Изотермический процесс.
— Закон Гей-Люссака — Изобарный процесс.
— закон Шарля (второй закон Гей-Люссака, 1808 г.) — Изохорный процесс
В форме пропорции 
С точки зрения химика этот закон может звучать несколько иначе: объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
.
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
.
- Закон Бойля — Мариотта
Закон Бойля — Мариотта
назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
где 

Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. Это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение 

См. также[править | править код]
- Совершенный газ
- Реальный газ
- Уравнение состояния реального газа
Примечания[править | править код]
Литература[править | править код]
- Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим. спец. вузов / Под ред. А. Г. Стромберга. — 7-е изд., стер. — М.: Высшая школа, 2009. — 527 с. — ISBN 978-5-06-006161-1.
Задача. При температуре оС внутренняя энергия идеального одноатомного газа
Дж. Определите число атомов газа.
Решение
Думаем: число атомов газа единственным образом можно найти через химическое количество газа.
(1)
— постоянная Авогадро, она нам известна.
Само химическое количество газа связано с данными нам температурой и внутренней энергией через определение самой внутренней энергии:
(2)
Решаем: выделим из (2) интересующий нас параметр химического количества вещества, а из (1) искомое количество молекул.
(3)
(4)
И подставим (3) в (4):
(5)
Считаем: вспоминаем значения введённых нами констант ( м
*кг*с
*К
*Моль
,
). Кроме того, температура газа должна быть определена в единицах Кельвина (
). Тогда:
шт.
Ответ: шт.
Ещё задачи на тему «Работа и внутренняя энергия идеального газа«.
Изучение свойств и поведения идеального газа является ключевым моментом для понимания физики этого направления в целом. Рассмотрим в данной статье, что включает в себя концепция идеального одноатомного газа, какими уравнениями описываются его состояние и внутренняя энергия. А также решим пару задач по этой теме.
Общее понятие
Каждый школьник знает, что газ – это одно из трех агрегатных состояний вещества, которое, в отличие от твердого и жидкого, не сохраняет объем. Кроме того, он также не сохраняет свою форму и всегда заполняет полностью предоставленный ему объем. В действительности последнее свойство относится к так называемым идеальным газам.
 Вам будет интересно:Первая женщина Герой Советского Союза – Гризодубова Валентина Степановна. Единственная женщина дважды Герой Советского Союза
Вам будет интересно:Первая женщина Герой Советского Союза – Гризодубова Валентина Степановна. Единственная женщина дважды Герой Советского Союза
Концепция идеального газа тесно связана с молекулярно-кинетической теорией (МКТ). В соответствии с ней частицы газовой системы движутся хаотически во всех направлениях. Их скорости подчиняются распределению Максвелла. Частицы не взаимодействуют друг с другом, и расстояния между ними намного превышают их размеры. Если все перечисленные условия соблюдаются с определенной точностью, то газ можно считать идеальным.
Любые реальные среды близки по своему поведению к идеальным, если они имеют невысокие плотности и высокие абсолютные температуры. Кроме того, они должны состоять из химически неактивных молекул или атомов. Так, водяной пар из-за присутствия между молекулами H2O сильных водородных взаимодействий не считается идеальным газом, а воздух, состоящий из неполярных молекул, является им.
Закон Клапейрона-Менделеева
Во время анализа, с точки зрения МКТ, поведения газа в равновесии можно получить следующее уравнение, которое связывает основные термодинамические параметры системы:
P * V = n * R * T.
Здесь давление, объем и температура обозначены латинскими буквами P, V и T соответственно. Величина n – это количество вещества, которое позволяет определить число частиц в системе, R – газовая постоянная, не зависящая от химической природы газа. Она равна 8,314 Дж/(К*моль), то есть любой идеальный газ в количестве 1 моль при его нагреве на 1 К, расширяясь, совершает работу 8,314 Дж.
Записанное равенство называется универсальным уравнением состояния Клапейрона-Менделеева. Почему? Названо оно так в честь французского физика Эмиля Клапейрона, который в 30-е годы XIX века, изучая установленные до этого экспериментальные газовые законы, записал его в общем виде. Впоследствии Дмитрий Менделеев привел его к современной форме, введя константу R.

Внутренняя энергия одноатомной среды
Одноатомный идеальный газ отличается от многоатомного тем, что его частицы обладают всего тремя степенями свободы (поступательное движение вдоль трех осей пространства). Этот факт приводит к следующей формуле средней кинетической энергии одного атома:
m * v2 / 2 = 3 / 2 * kB * T.
Скорость v называется средней квадратичной. Масса атома и постоянная Больцмана обозначена как m и kB соответственно.

Согласно определению внутренней энергии, она представляет собой сумму кинетической и потенциальной составляющих. Рассмотрим подробнее. Так как потенциальной энергией идеальный газ не обладает, то его внутренняя энергия – это энергия кинетическая. Какова ее формула? Рассчитывая энергию всех частиц N в системе, получим следующее выражение для внутренней энергии U одноатомного газа:
U = 3 / 2 * n * R * T.
Примеры по теме
Задача №1. Идеальный одноатомный газ переходит из состояния 1 в состояние 2. Масса газа при этом остается постоянной (закрытая система). Необходимо определить изменение внутренней энергии среды, если переход является изобарным при давлении, равном одной атмосфере. Дельта объема сосуда с газом составила три литра.
Выпишем формулу для изменения внутренней энергии U:
ΔU = 3 / 2 * n * R * ΔT.
Воспользовавшись уравнением Клапейрона-Менделеева, это выражение можно переписать в виде:
ΔU = 3 / 2 * P * ΔV.
Давление и изменение объема нам известно из условия задачи, поэтому остается перевести их значения в СИ и подставить в формулу:
ΔU = 3 / 2 * 101325 * 0,003 ≈ 456 Дж.
Таким образом, когда одноатомный идеальный газ переходит из состояния 1 в состояние 2, его внутренняя энергия возрастает на 456 Дж.
Задача №2. Идеальный одноатомный газ в количестве 2 моль находился в сосуде. После изохорного нагрева его энергия возросла на 500 Дж. Как изменилась при этом температура системы?
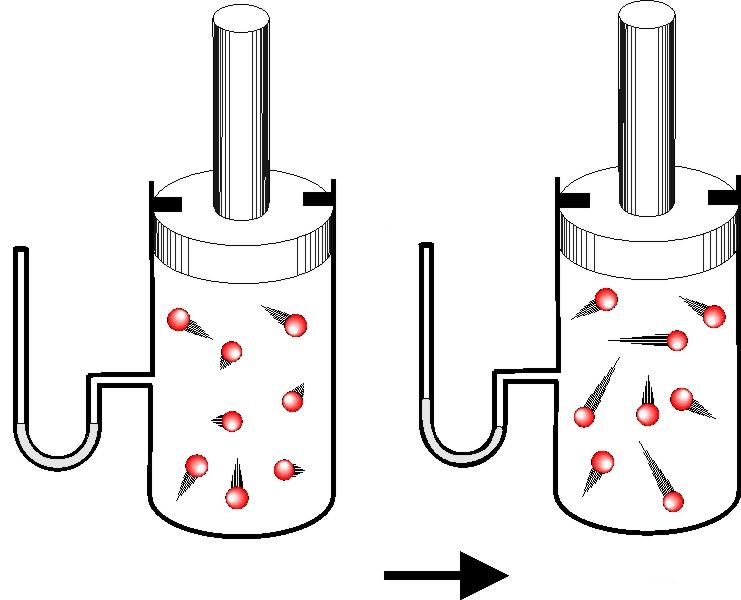
Снова выпишем формулу для изменения величины U:
ΔU = 3 / 2 * n * R * ΔT.
Из нее несложно выразить величину изменения абсолютной температуры ΔT, имеем:
ΔT = 2 * ΔU / ( 3 * n * R ).
Подставляя данные для ΔU и n из условия, получаем ответ: ΔT = +20 К.
Важно понимать, что все приведенные расчеты справедливы только для одноатомного идеального газа. Если система образована многоатомными молекулами, то формула для U уже будет не верна. Закон Клапейрона-Менделеева справедлив для любого идеального газа.





