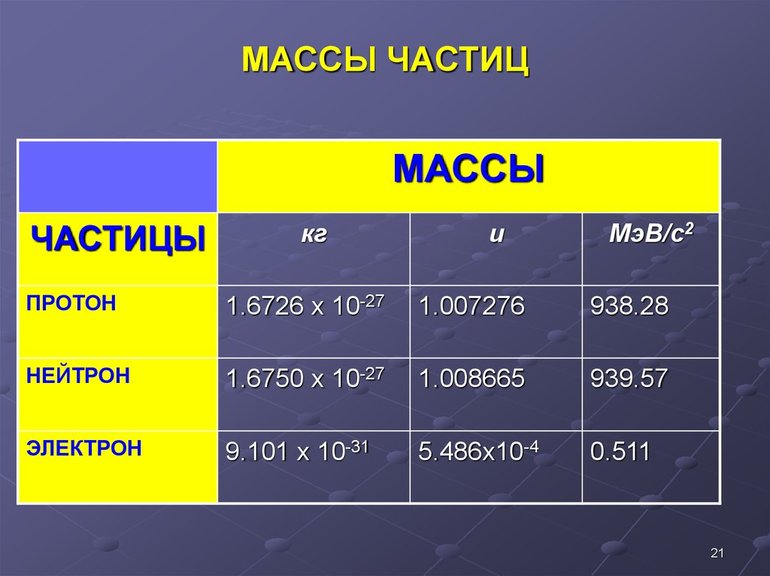
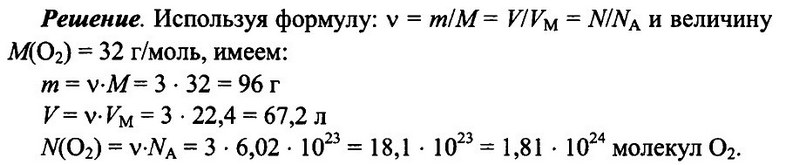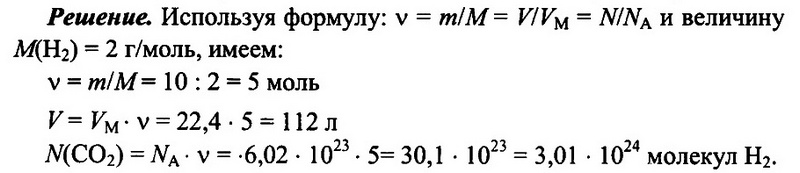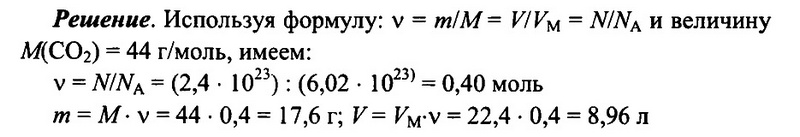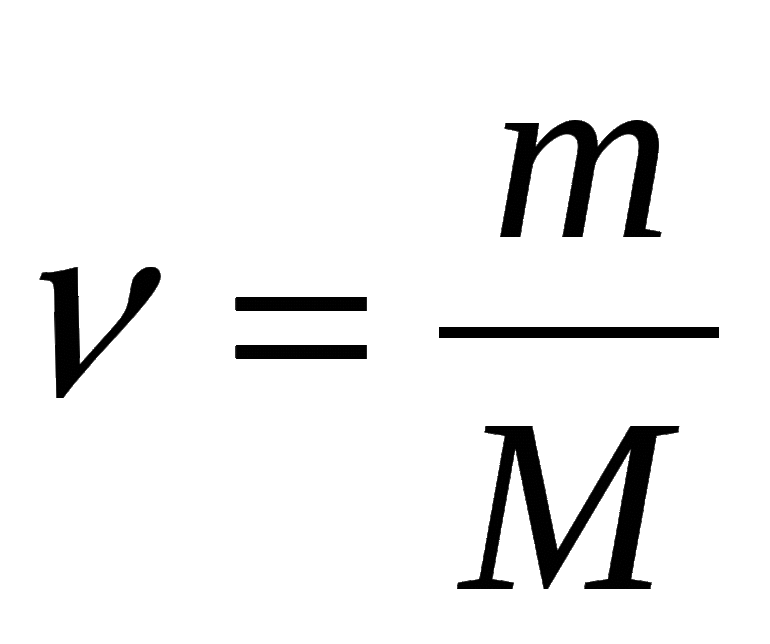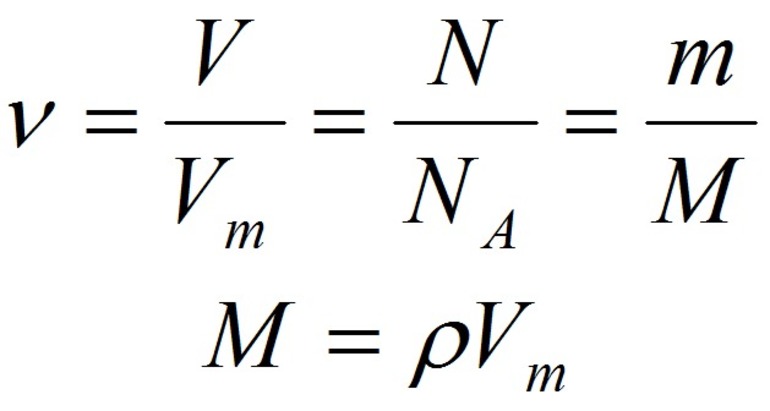Содержание
- Как найти количество вещества металла
- Решение задач на количество вещества, массу и объем
- ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
- РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
- Как определить количество атомов в молекуле?
- Примеры
- Количество вещества формула — примеры вычислений для разных веществ
- Общее понятие
- Значение моля
- Использование массы нейтральных частиц
- Показатель относительного веса
- Химические реакции
- Подсчет количества элементов
- Константа Авогадро для газов
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
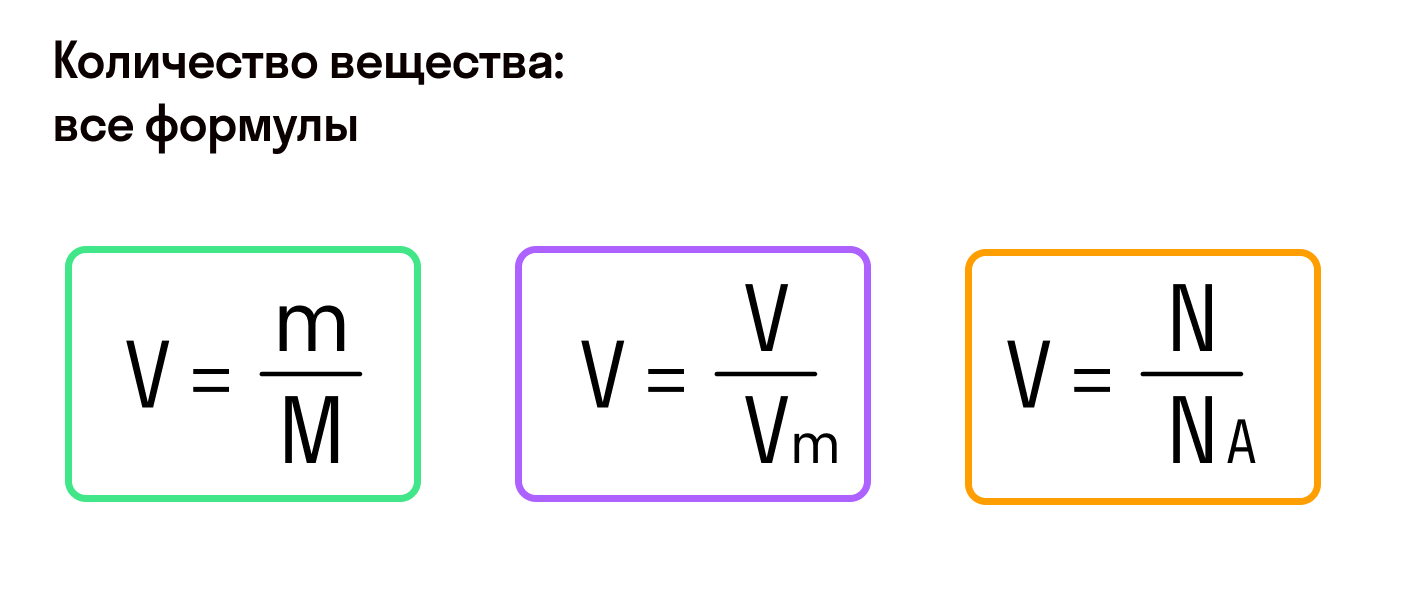
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:

Vm = 22,4 л/моль (мл/ммоль, м 3 /кмоль) при н.у.,
Na = 6,02 • 10 23 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1. Какое количество вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(СО2) = 0,75 моль.
Задача № 2. Какое число молекул содержится в 2,5 моль кислорода?

Ответ: N(O2) = 1,505 • 10 24 .
Задача № 3. Определите объем (н. у.), который займут 0,25 моль водорода.
Задача № 4. Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?
Задача № 5. Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 10 24 .
Задача № 6. Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
Ответ: 5 моль; 112 л; 3,01 • 10 24 .
Задача № 7. Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.
Ответ: 2,5 моль; 177,5 г; 1,5 • 10 24 .
Задача № 8. Имеется 2,4 • 10 23 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9. Какова масса порции оксида азота (IV), содержащей 4,816 • 10 23 молекул? Каков ее объем (н. у.)?
Задача № 10. Масса порции простого вещества, содержащей 1,806 • 10 24 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.
Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
Источник
Как определить количество атомов в молекуле?
Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Источник
Количество вещества формула — примеры вычислений для разных веществ
Общее понятие
Физическая величина применяется для вычисления количества конструкционных частиц в материальной субстанции. Понятие используется в случае, когда для численного определения количества вещества в химии требуется описание микроскопического строения формы материи.
Представление процессов в этом ключе нужно при проведении электролиза, получении азота и идеального газа, а также в других областях физики, которые рассматривают варианты превращения и передачи энергии.
Количество вещества является удобным понятием при характеристике различных химических процессов в отличие от массы. Это случается из-за того, что структурные электрические частицы реагируют независимо от их массы в объемах, которые являются кратными целым числам.
Примером служит процесс горения водорода, где число кислорода требуется в 2 раза меньше: О 2 + 2Н 2 = 2Н 2 О.
В этой реакции водородная масса меньше кислородной примерно в 8 раз из-за того, что атомная масса водорода меньше в 16 раз аналогичного показателя кислорода. Применение понятия количества элементов снижает неудобство при составлении уравнений. При этом взаимное соотношение между объемом веществ выражается уравнительным коэффициентом.
Формулы, которые применяются:
- Количество вещества закон Авогадро определяет на основании объема: n = V / V m, где V — объем порции газа в нормальном состоянии, а V m означает молярную величину объема субстанции в аналогичных условиях и равняется 22,4 л/моль.
- Другая формула показывает определение количества в зависимости от количества конструктивных элементов с применением постоянной Авогадро: n = N / N a, где N — число звеньев, а N a — постоянная константа Авогадро.
- В зависимости от массы и молярного веса расчет ведется по формуле: n = m / M, где m — масса субстанции, а М представляет его молярную массу.
Непосредственное число молекул не используется при расчете, т. к. это количество в реальности очень большое. Вместо обозначения молекул в штуках, применяется измерение в молях. Фактическое содержание единиц в 1 моле материи носит наименование числа Авогардо, при этом Na = 6,022141 х 10 23 шт./моль.
Значение моля
Вес отдельных структурных элементов формы материи отличается, поэтому одинаковые объемы имеют различные массовые показатели. Моль — это количество материи, которое содержит число молекул, являющееся аналогичным количеству углеродных атомов в 12 г углекислого газа.
Массовый показатель не служит мерой количества субстанции, например:
- 1025 водородных молекул весят 33,5 г;
- 1025 кислородных частиц имеют массу 531,5 г.
Один моль составляет столько же нейтральных частиц, сколько их есть в 1 грамме водорода, такое положение принимается для удобства химических расчетов. При использовании наименования конструктивные элементы конкретизируются.
Понятия молекулы и моля взаимосвязаны между собой. Второе слово означает число, осязаемое множество и массу, а нейтральная частица рассматривается в качестве маленькой тяжести. Моль рассматривается в виде такого количества, которое можно отнести к понятию большой массы, состоящей из небольших весов отдельных элементов.
Молярная и молекулярная масса применяются не только к субстанциям, которые в основе конструкции имеют молекулы, но и к ионным и атомарным материальным формам.
Использование массы нейтральных частиц
В прошлом веке обнаружился научный факт, что если 2 газа содержатся в емкостях с одним и тем же объемом, то количество молекул остается одинаковым в этих субстанциях при соблюдении идентичного давления и нормальной температуры. Это значит, что важные характеристики тела определяются количеством структурных частиц, а не общим весом.
Количественное значение молярной массы M и показатели относительного молекулярного веса остаются равными, но первый предел измеряется в г/моль или моль, а вторая записывается в молях. Константа Авогадро обеспечивает пропорциональность и позиционирует переход к молярному соотношению.
Для расчета количества структурных элементов используется понятие молярной массы. Оно означает массу, которую составляет 1 моль вещества и получается от произведения молекулярной массы на количественный состав молекул в моле (число Авогардо). Молярная масса, для измерения которой используется единица грамм/ ммоль, является аналогичной по числу с относительным весом нейтральных частиц.
Примеры отмеривания равных молекулярных пропорций:
- 1 моль воды соответствует 6 х 10 23 молекул Н 2 О.
- 1 моль хлора — 6 х 10 23 атомов Fe.
- 1 моль ионов хлора — 6 х 10 23 ионов Cl.
- 1 моль хлора — 6 х 10 23 молекул Cl 2.
- 1 моль электронов е — — 6 х 10 23 электронов е — .
Разница между молярной и молекулярной массой заключается в том, что они одинаковы в численном соотношении, но отличаются постоянной размерностью. Используется суммирование молярных масс составляющих элементов смеси для нахождения этой величины у многокомпонентных соединений. Для расчета молярной массы воды применяется калькулятор: М (Н 2 О) = М (О) + М (Н) = (16 + 2 . 1) = 18 моль.
Показатель относительного веса
Относительная молекулярная масса представляет собой вес молекулы, который выражается в атомных единицах. В расчетах используются не абсолютные веса, а относительные, т. к. масса молекулы очень мала. Например, молекула воды весит 3.10
26 кг, и частицы остальных веществ имеют значения подобного порядка. Нахождение показателя можно провести онлайн в соответствии с международными стандартами, которые сравнивают массы структурных элементов с 1/12 долей веса углеродного атома.
Успешное решение задачи связывается с тем, что углекислый газ является компонентом различных химических веществ. Принимается, что 1 атомная единица (1 а. е. м) соответствует весу водородного атома. Относительный атомный вес рассчитывается как масса неделимой частицы, выраженная в атомных единицах, при этом значение показателя берется из таблицы Д. И. Менделеева.
Относительные молекулярные массы сложных соединений находятся суммированием аналогичных показателей веса составляющих компонентов. Для подсчета требуется знание химической формулы и значение относительных атомных масс входящих элементов.
Например, молекулярный вес метана СН 4 равен 16 а. е. м (4+12), значит, при горении вещества применяется формула 2О + СН 4 = СО 2 + 2Н 2 О. Из 1 моля метана выходит 2 единицы воды, при этом 16 г газа служит для получения 36 г воды (пропорциональное соответствие).
Химические реакции
При реакции горения метана на каждую молекулу вещества требуется использовать 2 частицы кислорода. Но в условиях открытого воздуха содержание кислорода всегда является достаточным для прохождения реакции. В ограниченных условиях подводных или космических работ требуется точное определение количества вещества и молекул реагентов. Например, если в топку космического агрегата попадает больше кислорода, чем требуется, то снижается тяга и перерасходуется топливо.
Примеры использования относительного веса в реакциях:
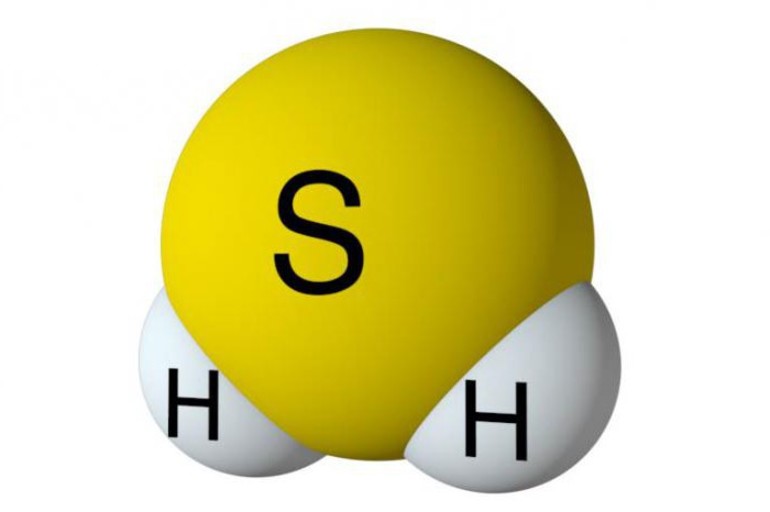
- Сероводород имеет формулу H 2 S. Молекулярная масса его частицы рассчитывается в виде суммы относительных масс атомов, являющихся компонентами M r (H 2 S) = A r (S) + 2· Ar (H). Для расчета молекулярной массы используется уравнение Mr (H 2 S) = 2х1+32 = 2+32 = 34.
- Гелий в нормальных обстоятельствах работает, как идеальный газ, поэтому значение молярной массы рассчитывается по формуле Клайперона — Менделеева pV = mRT /М, где p — давление газа, V — объем, M — масса субстанции, Т — значение абсолютной температуры, R — постоянная константа, составляет 8,3.
- Серная кислота применяется в виде двухосновной сильной кислоты H 2 SO 4. Она отвечает за степень серного окисления. В технических реакциях используется смесь с водой и ангидридом серы S О 3. Молярная масса составляет 98,08 ± 0,006 г/миллимоль.
Химики применяют такие пропорции взаимодействия, которые имеют в составе равное число молекул для удобства работы. Точность весов в лаборатории составляет 1 мг, поэтому получается, что 1 млн молекул не всегда удается взвесить. Значит, выбирается не миллион, а другая порция, в которой число n больше этого количества.
Подсчет количества элементов
Примером простой реакции, когда в результате взаимодействия двух продуктов образовывается третья субстанция, является формула А + Б = В. Остается решить весовое количество веществ А и Б, чтобы хватило для реагирования и не осталось исходных материалов, в ином случае продукт В будет загрязнен одним из начальных компонентов.
В качестве примера подходит реакция с участием кальция: Н 2 О + С а О = С а (ОН) 2. Если простейшие формы А и Б состоят из различных атомных наборов Н 2 О и С а О, которые отличаются по весу. Соответственно, в них содержится неодинаковое число частиц, при реакции часть из них не будет использована. Если берется пропорция С а О с содержанием N молекул и порция воды с N частиц, то после взаимодействия не останется никаких веществ и получится количество N молекул.
Отсчет невидимых молекул можно выполнить с помощью взвешивания вещества, для этого требуется вес одной частицы. На весы помещается определенное количество субстанции в граммах, чтобы отмерить требуемое число молекул. Для определения величины вещества в граммах требуется сложить вес составляющих атомов, показатели которых приводятся в периодической таблице.
Атомный вес кальция составляет 40 а. е. м, кислорода — 16 а. е. м, значит, молекулярный вес Са О будет 56 а. е. м. (40+16). Неудобно брать малые количества, например, по 10 молекул субстанции для проведения реакции, поэтому нужно взвесить по миллиону структурных частиц каждого компонента. Для этого высчитывается вес будущей порции, для удобства делается переход из килограммов в граммы, при этом вес 1 а. е. м составляет 1,67х10 -24 г. Для подсчета веса умножается это число на 56, получается 56х (1,67 -24 г) = 93,5х10 -24 .
Чтобы получить вес, который должен быть на весах, полученный результат умножается на миллион молекул, возникает результат 93,5х10 -18 г. При увеличении количества оксида кальция и воды в одинаковое число раз порции частиц возрастают пропорционально, например, 0,1 моль кальция прореагирует с 0,1 молем воды, увеличение кальция до 10 моль потребует повышения числа моль воды также до 10.
Константа Авогадро для газов
Закон Авогадро всегда точно выполняется как для газов в идеальном состоянии, так и для реальных газообразных смесей. Для последних субстанций понятие моля выражается в том, что любой объем газа всегда соответствует определенному количеству молекул. Примером служит реакция, где из аммиака и хлористого водорода выходит аммония хлорид в форме кристаллической твердой субстанции: NH 3 (газ) + HCL (газ) = NH 4 CL (крист.).
Для реагирования требуются одинаковые объемы газообразных веществ, т. к. после окончания реакции не должно оставаться избытка:
- В результате проведения опыта в замкнутом пространстве выяснилось, что при взрыве нужно 2 части водорода и одна порция кислорода, при этом получается 2 объема водяных паров в газовой консистенции О 2 + 2Н 2 = 2Н 2 О (все субстанции в виде газа).
- Одна порция водорода при реакции с 1 частью хлора преобразовывается в хлористый водород Cl 2 + H 2 = 2 HCL (все компоненты в газообразной форме).
Выводом из этого эксперимента следует то, что газы вступают в реакцию, и требуется объемные отношения с применением целочисленных показателей. Частицы в газе не связываются прочными контактами в отличие от атомов твердых субстанций. Занимаемый объем в похожих условиях зависит от количества молекул, но не от определенного типа газа. Исходя из этого положения, равные объемы газообразных субстанций всегда реагируют друг с другом без остатка.
Источник
Виктория
Ученик
(215),
закрыт
10 лет назад
Вячек
Высший разум
(391245)
11 лет назад
Стоит (на будущее) твёрдо запомнить – в 1 моле любого вещества содержится 6,02*10 в 23-ей степени частиц (молекул, атомов, ионов и т. д.) . Это число Авогадро.
Стало быть в любом случае нужно вычислить количество вещества в молях, а затем уж число атомов или молекул
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 1023. Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 1023 моль-1.
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где
— это масса вещества, а
— количество вещества.
Единица измерения молярной массы: г/моль.
Запоминаем!
Правильно говорить именно молярная, а не мольная масса.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
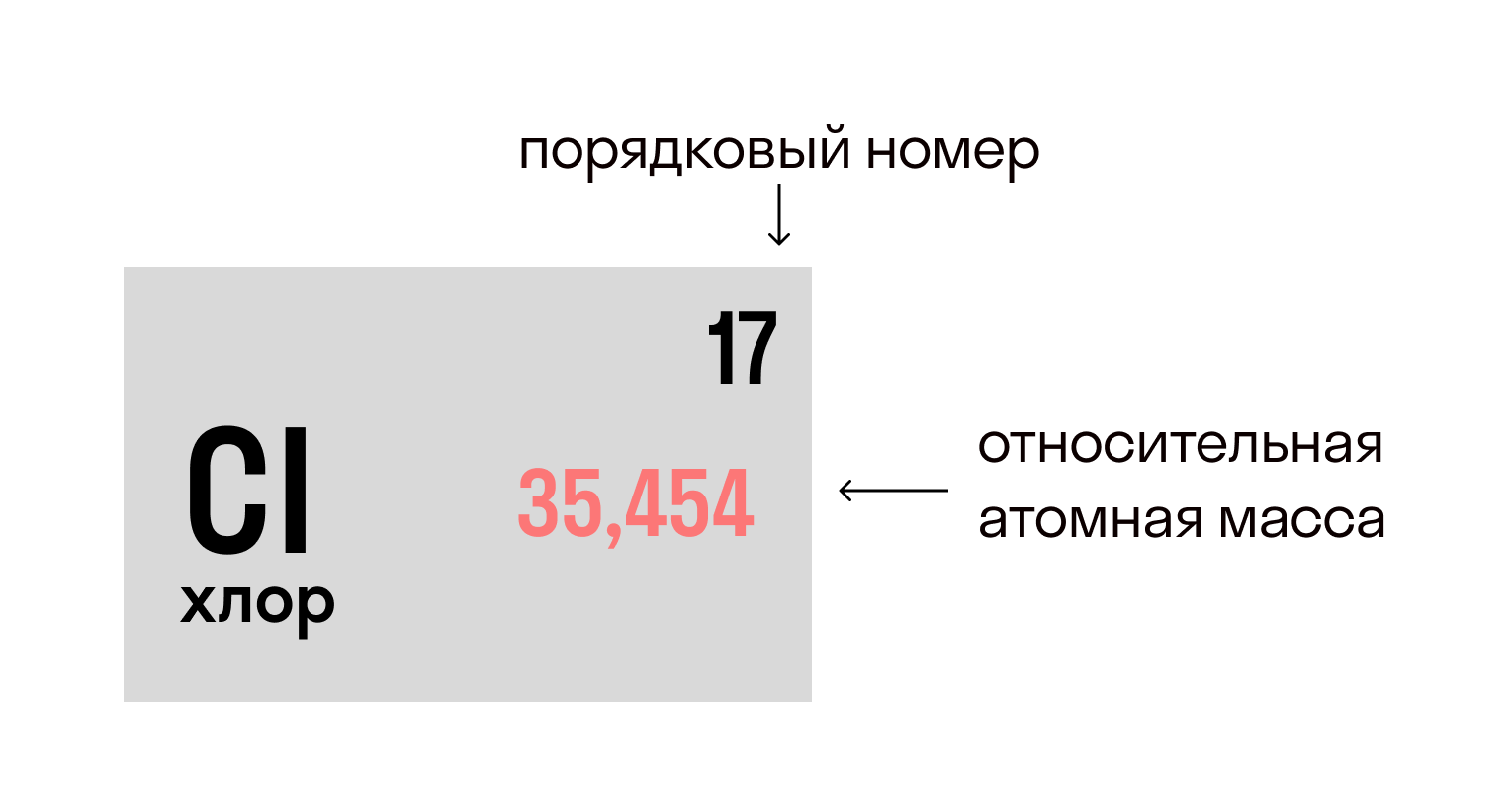
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где
— это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Ar(Na) = 23, Ar(N) = 14, Ar(O) = 16.
Mr(NaNO2) = 23 + 14 + 16 · 2 = 69.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Важно
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой
, так и греческой буквой
(ню). Международное обозначение —
, но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через
:
, следовательно
.
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Воспользуемся формулой
.
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Mr(BaSO4) = Ar(Ba) + Ar(S) + Ar(O) · 4 = 137 + 32 + 16 · 4 = 233.
М(BaSO4) = Mr(BaSO4) = 233 г/моль.
Подставим значение молярной массы в формулу:
моль.
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где
— число структурных единиц,
— число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 1023 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой
моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где
— фактический объем газа, а
— молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле
моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где
и
— некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
М(CO) = Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28.
М(H) = Mr(H2) = 2 · Ar(H) = 2 · 1 = 2.
.
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
M(CO2) = Mr(CO2) = 12 + 2 · 16 = 44.
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 1023 молекул. Чему равна молярная масса данного вещества?
Дано:
N(х) = 12,04 · 1023.
m(х) = 300 г.
M(х) = ?
Решение:
Найдем количество вещества
моль.
Подставим количество вещества в формулу
:
г/моль.
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
Дано:
моль.
Решение:
По формуле
мы можем найти объем
.
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
л.
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 1023 атомов кислорода. Какова масса этой порции?
Дано:
N(O) = 8,356 · 1023.
m(SO3) = ?
Решение:
Для решения задачи нам подходит формула
, т. е.
. Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
, следовательно
.
Зная количество молекул, рассчитаем количество вещества:
моль.
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
г.
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 1023 молекул? Назовите это вещество.
Дано:
m(x) = 100 г.
N(x) = 15,05 · 1023.
М(х) = ?
Решение:
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
моль.
Исходя из этого, рассчитаем молярную массу:
г/моль.
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Решение:
Нам требуется вычислить относительную плотность сероводорода по водороду:
.
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
.
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
-
Что такое число Авогадро и чему оно равно?
-
В чем измеряется молярная масса?
-
Напишите формулу молярной массы вещества.
-
Какая формула связывает количество вещества и его объем?
-
Как узнать количество вещества, если известно число молекул в порции?

Химия, опубликовано 2018-08-22 21:59:05 by Гость
Как найти количество сгоревшего вещества при известной массе оксида этого вещества

Ответ оставил Гость
1)узнать количество вещества оксида по формуле n=m/M2)посмотреть соотношение оксида и металла по молям, если это соотношение не будет равно 1:1, то составить пропорцию. Таким образом найти количество вещества металла.3) Если нужно дать ответ в массе, то количество вещества умножить на молярную массу металла

Не нашли ответа?
Если вы не нашли ответа на свой вопрос, или сомневаетесь в его правильности, то можете воспользоваться формой ниже и уточнить решение. Или воспользуйтесь формой поиска и найдите похожие ответы по предмету Химия.