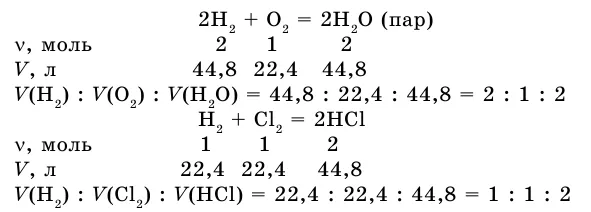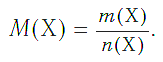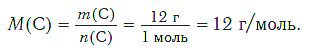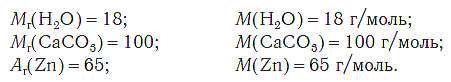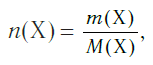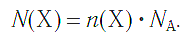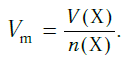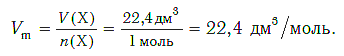Просмотров 3.4к. Опубликовано 28.06.2022
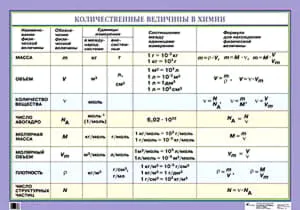
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.
Как найти объем в химии ℹ️
Вы знаете, что один и тот же химикат любого вещества содержит одинаковое количество структурных единиц. Однако у каждого вещества есть своя структурная единица массы. Поэтому масса одной и той же химической массы разных веществ также отличается.
Молекулярная масса — это масса той части вещества, которая приходится на один моль химической массы.
Молекулярная масса вещества X обозначается символом m(x). Она равна отношению массы конкретного вещества M(x) (г или кг) к химической массе N(x) (моль).
В Международной системе единиц молекулярный вес выражается в кг/моль. В химии чаще используется единица измерения Г/моль.
Определите молекулярную массу углерода. Масса углерода в одном моле стехиометрической массы составляет 0,012 кг или 12 г. Поэтому:.
Молекулярная масса любого вещества численно равна его относительной молекулярной массе, выраженной в Г/моль.
На рисунке 47 показан пример веществ (H2O, CACO3и Zn) с одинаковой химической массой — 1 моль. Как видите, массы различных веществ с одним молем химической массы различны.
Молекулярный вес является важной характеристикой всех индивидуальных веществ. Она отражает взаимосвязь между массой вещества и его химическим количеством. Знание одной из этих величин позволяет определить массу другой — химической — величины.
И наоборот, химическое количество по массе:.
А также количество структурных подразделений:.
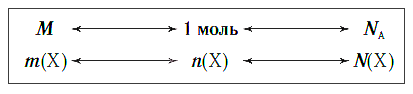
Связь между свойствами этих трех веществ в их кумулятивном состоянии можно представить с помощью простой диаграммы.
Формула и алгоритм нахождения объёма
Сегодня мы изучаем важный навык в химии — как находить количество различных растворов и других веществ. Эти знания необходимы, потому что они помогут вам решить многие проблемы как в тетради, так и в жизни. Все, что вам нужно знать, — это состоявшийся человек.
Важно понимать, что тип опухоли, которую нужно найти, может варьироваться в зависимости от сущности, которую нужно найти, а точнее, от общего состояния этой сущности. Типы нахождения объемов газа и жидкости противоположны друг другу.
Точный и правильный вид для нахождения объема жидкости: C = n/v.
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Используя другую задачу и другие данные, существует второй тип для нахождения объема жидкости: v = m/p.
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
Если в дополнение к объему вам нужно найти массу, вы можете сделать это, зная тип и количество интересующего вас вещества. Используя тип вещества, найдите его молекулярную массу, сложив атомные массы всех элементов, входящих в его состав.
Например, возьмем M(AUSO2). В наших расчетах мы должны получить 197 + 32 + 16 * 2 = 261 г/моль. После этих вычислений находим массу по типу m = n*m: где
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества обычно указывается в задаче. Если нет, то это может быть опечатка или ошибка в задаче, и вместо того, чтобы пытаться самостоятельно вычислить несуществующую цену, следует обратиться за помощью и объяснениями к преподавателю. В этой статье приведены основные алгоритмы типов и разрешений.
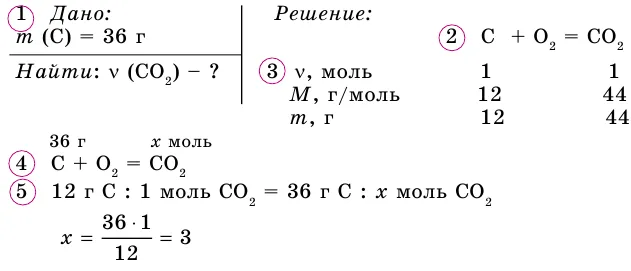
Существует также тип для определения количества газа. Это: v= n*vm:.
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Однако существуют определенные исключения. Исключением является то, что при нормальных условиях, т.е. при определенном давлении и температуре, объем газа постоянен и составляет 22,3 л/моль.
Также возможен третий вариант. Если сама задача содержит уравнения реакций, то решение должно проходить по-другому. Из полученных уравнений вы можете найти количество каждого вещества, равное коэффициенту. Например, Ch4 + 2O2 = CO2+H2O. Из этого уравнения следует, что при взаимодействии 1 моль метана и 2 моль кислорода образуется 1 моль углерода и 1 моль воды. Учитывая, что речь идет о количестве вещества одного компонента, нетрудно найти количества всех остальных веществ. Если количество метана составляет 0,3 моль, то n(Ch4) = 0,6 моль, n(CO2) = 0,3 моль и n(H2O) = 0,3 моль.
б) Газовые законы объем газа
В дополнение к приведенным выше формулам, для решения задач вычислительной химии часто необходимо использовать газовые законы, известные из физики.
При постоянной температуре объем данного количества газа обратно пропорционален давлению, при котором он находится.
При постоянном давлении изменение объема газа прямо пропорционально температуре.
Комбинированный закон Бойля-Мариотта и Гей-Люссака для газов.
Кроме того, если известна масса или количество газа, его объем можно рассчитать по формуле Менделеева-Клапейрона
где n — число молекул вещества, m — масса (г), b — молекулярная масса газа (г/моль) и R — глобальная газовая постоянная, равная 8,31 Дж/(моль х К).
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, количество содержащегося вещества, количество содержащихся молекул, определение объема (v.o.), обнаружение массы, ее массовые частицы, масса определенных молекул, названия веществ, обнаружение массы молекул, определение абсолютной массы молекул, количество содержащихся атомов, относительная плотность. Определение.
Количество вещества — это число строительных блоков (атомов, молекул, ионов), содержащихся в конкретном образце этого вещества. Единицей измерения количества вещества является моль. Количество вещества (n) связано с числом строительных блоков (N), массой (m) и объемом (V) (для газообразных веществ при температуре нулевой концентрации), содержащихся в образце вещества, следующей формулой
В котором.
Vm = 22,4 л/моль (мл/моль, м 3/кмоль) в н.у., Na = 6,02-10 23 (постоянная Авогадро) и молекулярная масса (М) численно равна относительной молекулярной массе вещества:.
Существование такой связи означает, что знание одной из величин (количества, массы, объема или числа структурных единиц вещества) позволяет определить все остальные величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Вопрос 1: Сколько вещества содержится в 33 г оксида углерода (IV)?
Ответ: ν(CO2) = 0,75 моль.
Задача № 2. Сколько молекул содержится в 2,5 моль кислорода?
Ответ: n (O2) = 1,505-1024.
Внимание. В этом сборнике лекций вы будете решать задачи общей сложности. Решения сложных задач и задач с кратким ответом см. в конспекте лекций «Решение упражнений по количественным свойствам».
Задача №3. Определите объем (н.у.), занимаемый 0,25 моль водорода.
Задача № 4. Какова масса куска оксида серы (IV) в объеме 13,44 л (об.)?
Вопрос № 5. Если 3 моль кислорода O2Чтобы. Определите массу кислорода, его количество и число молекул кислорода.
Ответ: m = 96 g- v = 67. 2 l- n(o2) = 1.81-10 24.
Работа №6. масса водорода h2. Определите количество водорода, его количество se. Количество доступных молекул водорода.
Ответ: 5 моль-112 L- 3,01- 10 24.
Работа № 7. Пример количества хлора.2 Н.О.С. Найдите количество хлора, его массу и число молекул хлора.
Ответ: 2,5 моль- 177,5 г- 1,5- 10 24.
Работа № 8. 2.4-10 23. Есть молекулы монооксида углерода (IV) CO2. Определите количество углекислого газа, его массу и количество углекислого газа (Н.С.).
Ответ: 0,4 моль — 17,6 г — 8,96 л.
Вопрос нет. 9. какова масса участка оксида азота (IV), содержащего 4,816-10 23 точки? Каков его объем (Н.С.)?
Вопрос нет. 10. 1,806-10 Масса простого отрезка вещества, содержащего 24 точки, равна 6 г. Определите молекулярный вес вещества и назовите его.
Внимание. В данном пособии рассматриваются задачи нормальной сложности. Нажмите на кнопку ниже, чтобы перейти к решению задач на количество и краткому ответу …
Решайте задачи на количество, массу и объем. Выберите следующие шаги: 1.
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Молярный объем: общая информация
Чтобы рассчитать молекулярный вес химического вещества, молекулярный вес вещества делится на его плотность. Таким образом, молекулярный вес рассчитывается по следующему типу
где VM — молекулярный вес вещества, m — молекулярная масса, p — плотность. В международной системе СИ это количество измеряется в кубических метрах на моль (м 3 /моль).
Рисунок 1.Типы молекулярных опухолей.
Молекулярная масса газов отличается от молекулярной массы жидкостей и твердых тел тем, что один молярный элемент газа всегда занимает один и тот же объем (при соблюдении одинаковых параметров).
При расчете объема газа при нормальных условиях, так как объем газа зависит от температуры и давления. Нормальными условиями являются температура 0°C и давление 101 325 кПа.
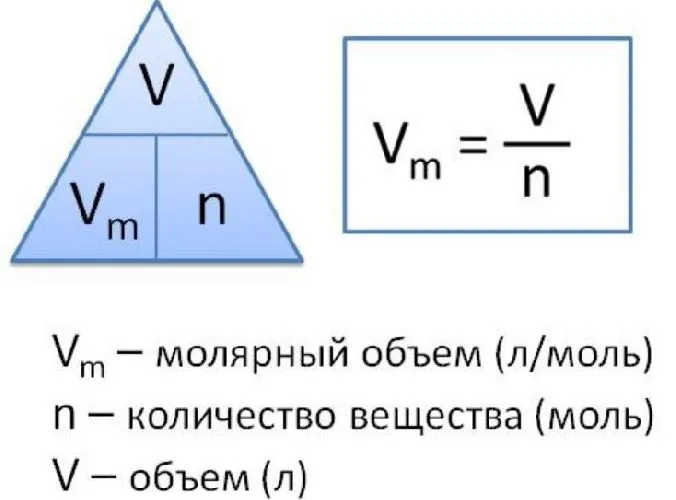
Молекулярный объем одного моля газа при нормальных условиях всегда одинаков и равен 22,41 DM3 /моль. Этот объем называется молекулярным весом идеального газа. Это означает, что для одного моля газа (кислорода, водорода, воздуха) объем составляет 22,41 дм3 /м.
Молекулярная масса при нормальных условиях может быть получена с помощью законного уравнения для идеального газа, называемого уравнением Клайперона-Менделеева
Где r — глобальная постоянная газа, r = 8,314 дж/моль*k = 0,0821 л*атм/моль k
Объем молярного газа v = rt/p = 8,314*273,15/101,325 = 22,413 л/моль, где t и p — значения температуры (к) и давления при нормальных условиях.
Рисунок 2.Таблица молекулярных опухолей.
Закон Авогадро
В 1811 году А. Авогадро предположил, что равные объемы различных газов (температура и давление) содержат одинаковые молекулы. Впоследствии этот случай был подтвержден и стал законом, названным в честь великого итальянского ученого.
Рисунок 3: Амедео Авогадро.
Закон становится понятным, если вспомнить, что расстояние между частицами в виде газа несравненно больше, чем размер самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы.
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствия закона Авогадро и понятие молекулярного объема основаны на том, что молекулы любого вещества содержат число частиц (в случае газов и молекул), равное постоянной Авогадро.
Чтобы найти количество молей растворенного вещества в литре раствора, необходимо определить молекулярную концентрацию вещества по формуле c = n / V Где n — количество растворенного вещества, выраженное в молях; V — объем раствора, выраженный в литрах C — молекулярный.
При расчетах газа часто необходимо преобразовать заданные условия в нормальные и наоборот. Таким образом, полезно использовать уравнения, полученные из законов газовой связи Бойля-Мариотта и Гей-Люссака.
Молярный объем
В этом видео учащиеся вспоминают основные формулы и физические величины, знакомятся с новыми понятиями молекулярного объема и учатся решать задачи на основе новых материалов. Это значительно облегчает изучение новых тем.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к видеоурокам этого и других наборов, необходимо приобрести их в каталоге и добавить в личный кабинет.
Конспект урока «Молярный объем»
Молекулярный объем — это объем одного моля вещества. Понятие молекулярного объема применимо к газам. Например, если взять 1 моль воды, то 18 г воды не взвешивают на весах, потому что это совершенно неудобно. Зная, что плотность воды составляет 1 г/мл, мы измеряем ее объем в цилиндре или мензурке.
В этом случае молекулярный объем воды составит 18 мл/моль. Молекулярный объем твердых тел и жидкостей зависит от их плотности. Вода, кислота, сахар и соль имеют разную плотность и, следовательно, разный молекулярный объем.
Если проглотить одну молекулу кислорода, одну молекулу углекислого газа и одну молекулу водорода, то при одинаковых нормальных условиях они занимают одинаковый объем, равный 22,4 л. Эти газы также содержат одинаковое число частиц, т.е. 6,02-1023. Нормальные условия или a.c. — это температура 0°C (градусов Цельсия) и давление 760 мм рт.ст. (миллиметров рт.ст.) или 101,3 кПа (килопаскалей).
Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Молекулярный объем — это также физическая величина, равная отношению объема вещества к количеству вещества. Он может быть записан в следующих типах форматов
Vm =
V — объем газа, а n — количество вещества.
Из этого уравнения также можно найти V.
V = n-Vm
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.
Объем 1 кмоль называется объемным объемом и измеряется в м 3 / кмоль. То есть 22,4 м 3 / кмоль, а объем 1 ммоль называется объемным объемом и измеряется в мл / моль. Другими словами, объем составляет 22, 4 мл/моль.
Используйте новую формулу для решения задачи.
1. найдите объем азота (N2 ) объемом 2 моль.
Найдите объем азота (N2) в объеме 2 моль. По условию, дано 2 моль азота. Найдите объем азота. Чтобы решить эту задачу, используйте уравнение, чтобы найти объем газа относительно объема вещества. Другими словами, умножьте объем молекулы на объем вещества. Подставьте значение в формулу. То есть 22,4 литра на моль, умноженные на 2 моля, дают 44,8 литра. Таким образом, 2 моль азота занимают объем 44,8 л.
2. найти объем озона (O3 ) имеет объем 67,2 литра.
Согласно этой задаче, учитывая объем озона — 67,2 литра, необходимо найти количество вещества озона. Чтобы решить проблему, используйте тип. Объем делится на молекулярный вес, и значения в формуле обмениваются. Итак, разделив 67,2 литра на 22,4 литра на молекулу, получаем 3 молекулы. Таким образом, 3 моль озона занимают объем 67,2 л.
Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Закон объемных отношений
Если в результате реакции также образуется газ, напишите уравнение реакции между газами.
Соотношение объемов реактора и вещества: 2:1:2. Получим соотношение этих газовых опухолей при нормальных условиях.
Как видите, коэффициент газовой опухоли соответствует отношению предыдущего коэффициента типа вещества в уравнении.
В этой же ситуации объемы реакционных газов и газообразных продуктов реакции относятся друг к другу как небольшие целые числа. Это закон Гей-Лоссака о пропорциональности объемов.
Из изученных примеров можно сделать вывод, что при решении задачи удобно использовать коэффициенты, так как они указывают на количество вещества в уравнении химической реакции.
Согласно уравнению, определите количество кислорода, необходимое для окисления 60 л серы (IV) оксидом серы (VI).
- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги в области химии:.
Лекции по химии:.
Лекции по неорганической химии:.
Лекции по органической химии:.
Отправляйте задания в любое время дня и ночи
Официальный сайт Брилёновой Натальи Валерьевны, профессора факультета информатики Екатеринбургского государственного института.
Все права интеллектуальной собственности на загруженный материал сохраняются за бенефициарами этого материала. Коммерческое и/или иное использование запрещено за пределами материалов предварительного изучения NataliblileNova.ru. Публикация и распространение опубликованных материалов не предназначены для получения коммерческой и/или иной выгоды.
Этот сайт предназначен для облегчения образовательного пути студентов. Наталья Брилёнова не предлагает и не оказывает товары и услуги.
Обязательно ссылайтесь на сайт Natalibrilenova.ru в случае создания копий материалов.
Ученик
(184),
на голосовании
7 лет назад
Дополнен 7 лет назад
Ничего НЕ понимаю! Неужели никто не может ответить на этот вопрос? Что случилось с людьми ?
Голосование за лучший ответ
Андрей Б
Просветленный
(32352)
7 лет назад
через моли… определяем массу вещества, определяем количество вещества в молях… умножаем число молей на число Авогадро
Владимир ГайбельУченик (184)
7 лет назад
Моли – это = МОЛЕКУЛЫ. Значит определяем колличество вещества в молекулах. Колличество вещества – это точное конкретное определённое их число, а мне именно это и нужно посчитать или узнать! Получается масло масляное. Число Авогадро – это приблизительный = средний коэффициент погрешности, установленный учёными примерно равный единице. Отсюда получается, что по лженаучной формуле мы определим вес, который действительно равен массе …
Допустимое отклонение
Искусственный Интеллект
(111186)
7 лет назад
Количество вещества в объекте не есть плотность, плотность есть масса единичного объёма вещества. Но да, можно найти через плотность, сначала находишь массу, потом делишь её на молярную массу, получаешь количество вещества в молях, один моль – 6,02*10^23 частиц. Если речь идёт о газах, тут проще, любой газ, количеством 1 моль при н. у. занимает 22,4 литра, отсюда и считаешь в молях, а потом через число Авогадро (те самые 6,02*10^23 частиц) находишь что тебе нужно.
Владимир ГайбельУченик (184)
7 лет назад
Объясните мне, как самому тупому в мире ))) Хорошо, разбираю и считаю на пальцах один моль – 6,02*10^23 частиц, то есть, это значит, что в одной молекуле 6,02*10^23 частиц = самых различных атомов. Так? То есть, это получается, что в одной молекуле в среднем = 0,0000000000000000000602 атомов? Но так как нужно знать ещё более точное их число, то нужно его умножить на число Авогадро = на коэффициент ?
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Если вам понадобилось перевести кубометр в другую величину, читайте статью. Из нее вы узнаете много нового об этой математической величине.
Содержание
- 1 кубометр: сколько метров, литров, вес
- Сколько метров в кубометре?
- Сколько литров в кубометре?
- Вес кубометра
- В 1 тонне сколько кубометров?
- Как посчитать куб: таблица
- Видео: Объем дров. Как посчитать кубатуру дров?
Кубический метр (м3) — это единица измерения объема. Она равняется объему куба, стороны которого раны 1 метру. Объем любой фигуры исчисляется по формуле: Объем = L × W × H. Но чему равен 1 кубометр? Это вы узнаете из статьи.
Чтобы понять, сколько в кубометре метров, литров или других единиц измерений, нужно сначала понять, чтобы такое кубометр. Кубический метр — это единица объема пространственной фигуры. Другими словами, это емкость с шириной, длиной и высотой равными одному метру.
Сколько метров в кубометре?
Это вопрос интересный, даже с то зрения философии. «Какая философия?» — спросите вы, ведь это же математика.
- Дело в том, что кубометр — это единица измерения объема, а метр — это единица измерения длины.
- Поэтому это две единицы, которые несопоставимы между собой.
Но можно сказать и по-другому, уже углубляясь в математические величины:
- По ребрам — 12 метров.
- 1 метр — длины, ширины и высоты.
- 6 м² — площадь одной грани или площадь куба.
- Если разрезать кубическую фигуру на полосы и от толщины этих полос будет зависеть, сколько метров в кубическом метре. Например, если сечение метра квадратное и равно 1х1 см, то это ровно 10000 метров. Если сечение толщиной 10х10 см, то это 100 метров. Если разрезать на полоски шириной равной ширине человеческого волоса, то получится очень много метров.
Если формально связывать кубический метр (объем) и линейный размер (метр), то можно в косвенном смысле соотнести 1 кубометр и 1 метр. Но такое соотношение будет больше полезным для практического применения, а не для решения логических упражнений.
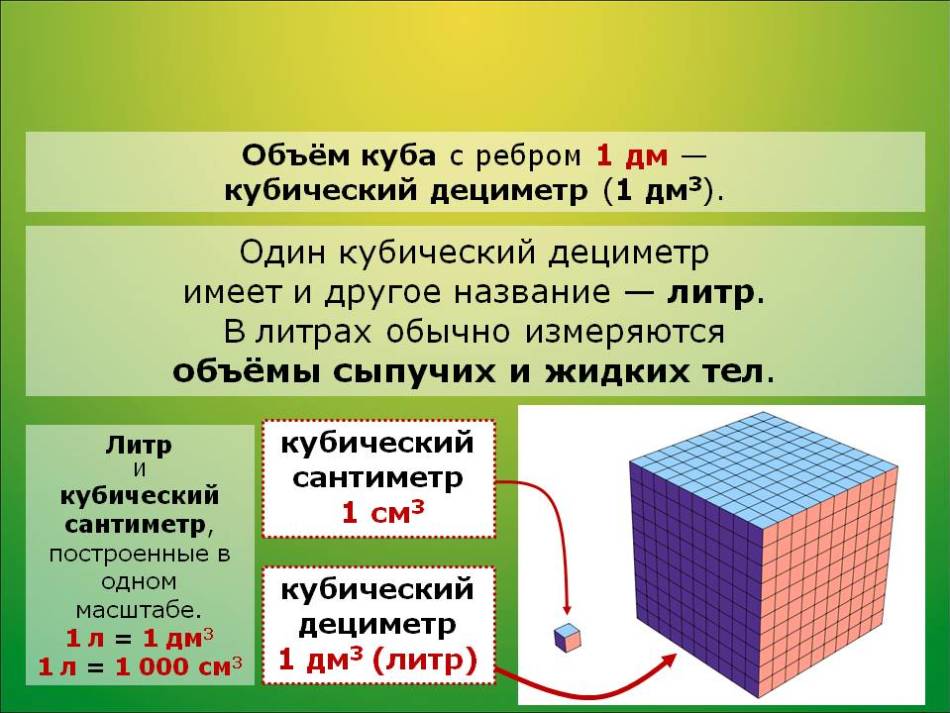
Сколько литров в кубометре?
Ответ на этот вопрос простой: в одном кубометре 1000 литров.
Вес кубометра
Сколько весит куб? Такой вопрос может возникнуть у любого человека. Но мало, кто знает и думает над тем, сколько килограмм в 1 куб. метре. Ответ: весовое значение будет зависеть от того, что находится в кубометре. Часто кубами измеряются, как сыпучие материалы (песок, щебенка), так и жидкости (H2O, кислота, спирт) и даже газообразные (газ). Пришла очередь разобраться по порядку:
- 1 куб. метр H2O — весовая величина будет зависеть от t°C: вода +20°С весит 998 кг, +4°С — одна тысяча кг.
- 1 куб. метр щебенки — зависит от характеристик и структурности камня. Кроме этого существует обычная плотность и насыпная плотность. Обычная плотность щебенки, гравия, гранита или известняка почти 2 раза больше, чем насыпная масса. Поэтому вес кубометра щебня будет равняться от 1,2 тонны до 2,6 тонны в зависимости от того, как уплотнен материал в кубическом метре.
- 1 куб. метр бетонного материала — зависит от свойств данного материала. Тяжелый бетон имеет вес 1,8-2,5 тонны (в зависимости от состава). Легкий бетон — 0,5 — 1,8 тонны.
- 1 куб. метр сыпучих материалов — зависит от составной величины и от наличия влаги в структуре. Вес песка, добытого в горах — 1,6 т, песок-перлит — 0,05-0,25 т, песка, добытого со дна реки — 1,4 — 1,86 т.
- 1 куб. метр древесного ствола или готового изделия — зависит от породы или наличия влаги. Чаще в строительстве применяется сосновые доски, брус и так далее, и именно строителям может понадобиться рассчитать, сколько в кубометре килограмм сосновых изделий. Свежесрезанный сосновый ствол — 0,8 т, полностью высушенная сосновая доска — 0,47 т.
- 1 куб. метр газа — вес этого материала найти невозможно, так как метан легче воздуха. Но можно измерить массу газа. В 1 кубе метана имеется 4,46 молей газа. Его молярная масса 16. Теперь вычисления: 4,46 х 16 = 71 грамм — масса газа.
Стоит отметить, что нет ответа на вопрос, сколько весит один кубометр. Это все равно что спросить — какая длина 1 килограмма, то есть все относительно. Если быть уверенным в том, какой материал находится в кубе, то можно измерить его величину веса, и она будет зависеть от различных физических и химических показателей.
В 1 тонне сколько кубометров?
Если вам нужно перевести одну единицу в другую, то есть массу в объем, то следует знать плотность вещества. Пойдем от обратного: чтобы узнать, сколько тонн в куб. метре — умножьте объем вещества на его плотность. К примеру:
- Плотность воды примерно 1000 кг/м3, а плотность золота 19621 кг/м3.
- В 1 кубометре воды будет 1000 кг или 1 тонна, то есть в 1 тонне 1 кубометр воды.
- В 1 кубометре золота 19,621 тонны (1 кубометр х 1 тонну / 19,621 = 0,059658 куб. метра), то есть в 1 тонне золота 0,05 кубометра.
Плотность веществ можно посмотреть в общепринятых таблицах. Вот одна из таких таблиц, которой пользуются строители и другие специалисты:
Также существует таблица расчета кубов.
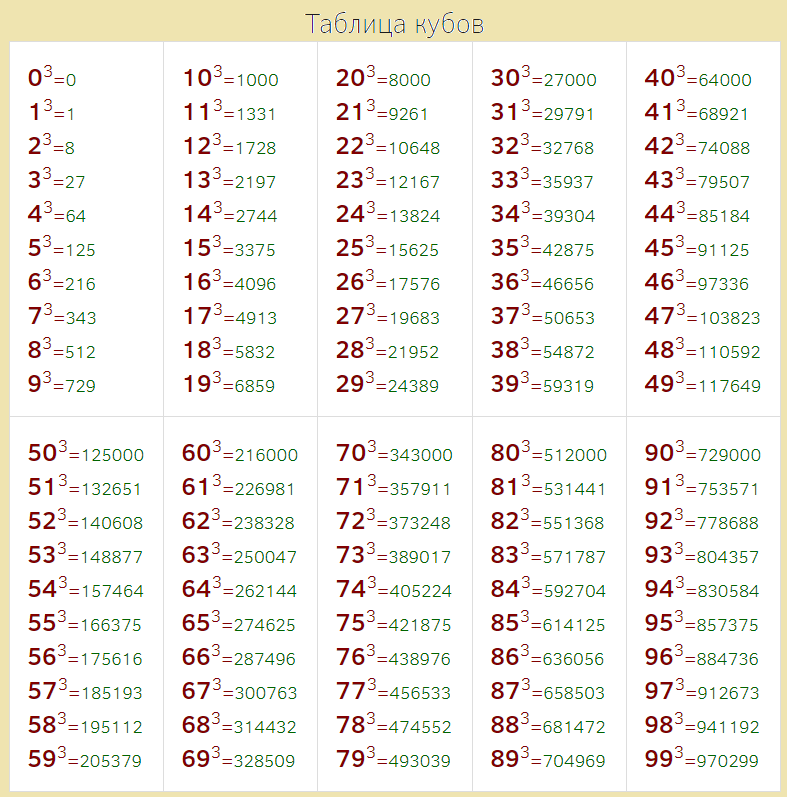
Как посчитать куб: таблица
Таблица кубов поможет вам быстро подсчитать те или иные значения. Распечатайте такую таблицу или сделайте фото на телефоне, чтобы она всегда была под рукой.
Чтобы знать, сколько весит кубометр, нужно знать исходные данные: какое это вещество, какая у него плотность и так далее. Иначе решить логическую задачу будет невозможно, и любой математик, на такой вопрос, может ответить, что это некорректный вопрос.
Видео: Объем дров. Как посчитать кубатуру дров?
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни. Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы.
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.
Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.
б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
— Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
pV = const
— Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
pV/T = const
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
pV = nRT;
pV = n/M ×RT,
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).
Молярный объем кристаллов
Объем Vя элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
Vm=VяNA/Z
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «».