= 2.(29,14)–8,54–37,41 =12,33 Дж/К.
Рассчитаем энергию Гиббса химической реакции при стандартном состоянии и заданных температурах 298 К, 500 К, 800 К, 1000 К с учетом зависимости ∆r H0Т и ∆r S0Т от температуры, считая постоянной величину удельной теплоемкости веществ ср , по формуле:
∆r G0T = ∆r H0Т – Т. ∆r S0Т = ∆r G0298 + ∆rс0р(Т – 298) –Т.∆r с0р ln (Т / 298).
∆r G0298 =120,15 кДж;
∆r G0500 =120,15+12,33.10-3 . (500-298) – 500.12,33.10-3 . ln (500/298)=
=84,67кДж;
∆r G0800 =120,15+12,33.10-3 . (800-298) – 800.12,33.10-3 . ln (800/298)=
=31,97кДж;
∆r G01000 =120,15+12,33.10-3 . (1000-298) – 1000.12,33.10-3 . ln (1000/298) =
= -3,16 кДж.
Термодинамическое условие химического равновесия: ∆rGT = 0.
Энергия Гиббса химической реакции при стандартном состоянии
∆r G0Т связана с константой равновесия Кр по соотношению:
∆r G0Т = – RTlnКр
Рассчитав величину ∆r G0T реакции , рассчитаем константу равновесия Кр по формуле:
Kp = exp(-∆G0Т /RT) ,
где R=8,31 Дж/моль.К – универсальная газовая постоянная.
Kp,298 = exp(-∆G0Т, 298 / R. 298) = exp( -120,15/8,31.10-3.298) =8.10-22;
Kp,500 = exp(-∆G0Т, 500 / R. 500) = exp(-84,67/8,31.10-3.500) =1,4.10-9;
Kp,800 = exp(-∆G0Т, 800/ R. 800) = exp(-31,97/8,31.10-3.800) =8,1.10-3;
Kp,1000 = exp(-∆G0Т, 1000 / R. 1000) = exp(3,16/8,31.10-3.1000) =1,46.
При увеличении температуры увеличивается константа равновесия, что объясняется эндотермическим тепловым эффектом данной реакции
( Δr Н0Т >0).
![]()
2. Выберите любую температуру из области самопроизвольного протекания реакции в прямом направлении. При этой температуре рассчитайте равновесные концентрации газообразных реагентов, если их исходные концентрации были равны, соответственно, ( см. п.3. табл. к задачам 1,2).
При Т=1000 К реакция протекает самопроизвольно в прямом направлении, т.к. ∆r G01000 = – 3,16 кДж <0, Kp,1000 = 1,46.
Выберем температуру Т=1000 для расчета равновесных концентраций газообразных реагентов, если исходные концентрации газообразных реагентов СО2 и СО были равны: сСО2 = 0,5 моль/л, сСО =0.
Выражения для констант равновесия, выраженных через относительные равновесные парциальные давления газов (рравн ) и равновесные концентрации (сравн) :
Кр =  ; Кс =
; Кс = 
Kp и Kс связаны через уравнение газового состояния:
Kс,1000 = ![]() =
= ![]() = 0,018
= 0,018
где R=0,082 л.атм/моль.К – универсальная газовая постоянная;
∆ν = 2-1= 1 (изменение числа молей газообразных веществ в ходе реакции).
Таблица материального баланса:
|
Компонент |
С |
СО2 |
2СО |
|
Начальные концентрации, сисх, моль/л |
– |
0,5 |
0 |
|
Изменение концентраций,Δс, моль/л |
– |
х |
2 x |
|
Равновесные концентрации, сравн., моль/л |
– |
0,5 – x |
2 x |
Подставляем равновесные концентрации газообразных реагентов в выражение для Kс и решаем алгебраическое уравнение относительно х :
Кс = ![]() = 0,018 , х = 0,0387моль/л
= 0,018 , х = 0,0387моль/л
ССО равн = 2. 0,0387 = 0,0774моль/л
ССО2равн = 0,5 – 0,0387 = 0,4613 моль/л.
3. Предложите способы увеличения выхода продуктов данной химической реакции.
Для увеличения выхода продуктов данной химической реакции необходимо смещение химического равновесия в сторону продуктов реакции. Применим принцип Ле-Шателье.
1) увеличить температуру системы, т.к. процесс эндотермический
(∆r H0Т > 0), в соответствии с изобарой Вант-Гоффа:
(dlnKp /dT) = ∆r H0Т /(RT2) ;
2) увеличить концентрацию (парциальное давление) исходного газа СО2 – дополнительный ввод газа;
снижать концентрацию (парциальное давление) продукта реакции СО – отводить газ из сферы реакции;
3) понизить общее давление в системе, т.к. прямая реакция идет с увеличением числа молей газообразных веществ.
ЗАДАЧА 4. Химическая кинетика.
Для заданной химической реакции nА + mВ ® AnBm
|
Т1, К |
Т2, К |
k1 |
k2 |
t , мин |
С0 , моль/л |
|
330 |
400 |
5 .10-5 л2×моль-2×с-1 |
2 .10-1 л2×моль-2×с-1 |
30 |
0,1 |
1. Рассчитайте энергию активации по значениям констант скорости реакции k1 и k2 при температурах Т1 и Т2 , соответственно. Дайте определение и предложите способы изменения энергии активации.
Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса:

где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная.
Для заданной химической реакции:
ln(2 .10-1/ 5 .10-5) = Еакт . (400 – 330 ) / 8,31. 400 . 330, решаем уравнение и получаем: Еакт =130 кДж/моль.
Энергия активации – энергия, необходимая для перехода реагирующих частиц в состояние активированного комплекса. Энергию активации можно уменьшить с помощью катализатора.
2. Определите количество вещества (моль/л), израсходованного за указанное время t при температуре Т2 , если начальная концентрация реагентов одинакова и равна С0 .
По размерности константы скорости химической реакции,
[ k ] = [л2×моль-2×с-1] , определяем порядок химической реакции: n=3.
Изменение концентрации исходных веществ по времени при одинаковой начальной концентрации исходных веществ для реакции третьего порядка рассчитывается по уравнению:
![]()
где с – текущая концентрация веществ в момент времени τ,
с0 – начальная концентрация веществ, k – константа скорости,
τ – время.
Рассчитаем текущую концентрацию исходных веществ с в момент времени τ =30мин =1800 сек при температуре 400 К,
k2= 2 .10-1 л2×моль-2×с-1:

![]() ,
,
решаем уравнение и получаем: с = 0,035 моль/л.
Количество вещества (моль/л), израсходованного за 30 минут при температуре 400 К:
Δс = с0 – с = 0,1- 0,035= 0,065 моль/л.
3. Рассчитайте период полупревращения для вашей реакции при температуре
Т2 . Определите, от каких факторов зависит период полупревращения для вашей реакции.
Рассчитаем период полупревращения τ1/2 для реакции 3-го порядка при температуре 400 К.
![]()
![]() = 750 сек.
= 750 сек.
Для реакции 3-го порядка период полупревращения зависит от температуры, природы и концентрации реагентов.
как найти количество вещества, оставшееся после протекания реакции или время реакции
Ученик
(89),
на голосовании
7 лет назад
Голосование за лучший ответ
Допустимое отклонение
Искусственный Интеллект
(111186)
8 лет назад
Смотришь по уравнению, из скольких молей реагента получается сколько молей продукта, к примеру 2Н2+О2=2Н2О, здесь видно, что из 1 моля кислорода имеем 2 моля воды. Это если у нас кислорода 16 грамм, то есть 0,5 моль (считается по молярной массе), значит воды будет в 2 раза больше-1 моль, или 18 грамм.
Загрузить PDF
Загрузить PDF
Периодом полураспада вещества, которое находится в стадии распада, называют время, в течение которого количество этого вещества уменьшится в два раза. Первоначально этот термин использовался для описания распада радиоактивных элементов, таких как уран или плутоний, но, вообще говоря, он может быть использован для любого вещества, которое подвергается распаду в установленной или экспоненциальной скорости. Вы можете рассчитать период полураспада любого вещества, зная скорость распада, которая является разницей между начальным количеством вещества и количеством вещества, оставшимся после определенного периода времени. Читайте далее, чтобы узнать, как быстро и легко подсчитать период полураспада вещества.
-

1
Разделите количество вещества в одной точке во времени на количество вещества, оставшееся после определенного периода времени.
- Формула для вычисления периода полураспада: t1/2 = t * ln(2)/ln(N0/Nt)
- В этой формуле: t – прошедшее время, N0 – начальное количество вещества и Nt – количество вещества через прошедшее время.
- Например, если вначале количество составляет 1500 граммов, а конечный объем составляет 1000 граммов, начальное количество, деленное на конечный объем, равно 1,5. Предположим, что время, которое прошло, составляет 100 минут, то есть (t) = 100 мин.
-

2
Вычислите десятичный логарифм числа (log), полученного на предыдущем шаге. Для этого введите полученное число в научный калькулятор, а затем нажмите кнопку log, либо введите log(1,5) и нажмите знак равенства для получения результата.
- Логарифмом числа по заданному основанию называется такой показатель степени, в который необходимо возвести основание (то есть столько раз, сколько необходимо основание умножить на само себя), чтобы получить это число. В десятичных логарифмах используется основание 10. Кнопка log на калькуляторе соответствует десятичному логарифму. Некоторые калькуляторы вычисляют натуральные логарифмы ln.
- Когда log (1,5) = 0,176, то это означает, что десятичный логарифм 1,5 равен 0,176. То есть если число 10 возвести в степень 0,176, то получится 1,5.
-

3
Умножьте прошедшее время на десятичный логарифм 2. Если вы рассчитаете log(2) на калькуляторе, то получится 0,30103. Следует помнить, что прошедшее время составляет 100 минут.
- Например, если прошедшее время составляет 100 минут, умножьте 100 на 0,30103. Результат равен 30,103.
-

4
Разделите число, полученное на третьем шаге, на число, вычисленное на втором шаге.
- Например, если 30,103 разделить на 0,176, то получится 171,04. Таким образом, мы получили период полураспада вещества, выраженный в единицах времени, используемых в третьем шаге.
-

5
Готово. Теперь, когда вы рассчитали период полураспада для этой задачи, необходимо обратить внимание на то, что для расчетов мы использовали десятичный логарифм, но вы могли использовать и натуральный логарифм ln – результат был бы таким же. И, на самом деле, при расчете периода полураспада натуральный логарифм используется чаще.
- То есть, вам было бы необходимо рассчитать натуральные логарифмы: ln(1,5) (результат 0,405) и ln(2) (результат 0,693). Затем, если вы умножите ln(2) на 100 (время), получится 0,693 x 100=69,3, и разделите на 0,405, вы получите результат 171,04 – тот же, что и при использовании десятичного логарифма.
Реклама
-

1
Узнайте, сколько вещества с известным периодом полураспада осталось через определенное количество времени. Решите следующую задачу: Пациенту было дано 20 мг йода-131. Сколько останется через 32 дня? Период полураспада йода-131 составляет 8 дней. Вот, как решить эту задачу:
- Узнаем, сколько раз вещество сократилось вдвое за 32 дня. Для этого узнаем, сколько раз по 8 (таков период полураспада йода) умещается в 32 (в количестве дней). Для этого необходимо 32/8 = 4, так, количество вещества сокращалось вдвое четыре раза.
- Другими словами, это означает, что через 8 дней останется 20мг/2, то есть 10 мг вещества. Через 16 дней будет 10мг/2, или 5мг вещества. Через 24 дня останется 5мг/2, то есть 2,5 мг вещества. Наконец, через 32 дня у пациента будет 2,5мг/2, или 1,25 мг вещества.
-

2
Узнайте период полураспада вещества, если известно начальное и оставшееся количество вещества, а также прошедшее время. Решите следующую задачу: Лаборатория получила 200 г технеция-99m и через сутки осталось только 12,5 г изотопов. Каков период полураспада технеция-99m? Вот, как решить эту задачу:
- Будем действовать в обратном порядке. Если осталось 12,5г вещества, тогда прежде, чем его количество сократилось в 2 раза, вещества было 25 г (так как 12,5 x 2); до этого было 50г вещества, а еще до этого было 100г, и, наконец, до этого было 200г.
- Это означает, что прошло 4 периода полураспада прежде, чем от 200 г вещества осталось 12,5 г. Получается, что период полураспада составляет 24 часа/4 раза, или 6 часов.
-

3
Узнайте, сколько периодов полураспада необходимо для того, чтобы количество вещества сократилось до определенного значения. Решите следующую задачу: Период полураспада урана-232 составляет 70 лет. Сколько периодов полураспада пройдет, чтобы 20 г вещества сократилось до 1,25 г? Вот, как решить эту задачу:
- Начните с 20г и постепенно уменьшайте. 20г/2 = 10г (1 период полураспада), 10г/2 = 5 (2 периода полураспада), 5г/2 = 2,5 (3 периода полураспада) и 2,5/2 = 1,25 (4 периода полураспада). Ответ: необходимо 4 периода полураспада.
Реклама
Предупреждения
- Период полураспада – это приблизительное определение времени, необходимого для распада половины оставшегося вещества, а не точный расчет. Например, если остался только один атом вещества, то после полураспада не останется только половина атома, а останется один или ноль атомов. Чем больше количество вещества, тем более точным будет расчет по закону больших чисел
Реклама
Что вам понадобится
- Инженерный калькулятор
Об этой статье
Эту страницу просматривали 55 193 раза.
Была ли эта статья полезной?
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)

обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
![]()
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
![]()
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:

Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
![]()
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
![]()
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
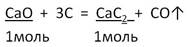 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
