Для того чтобы это сделать вам нужно знать 3 вещи:
- Как определить число протонов и нейтронов в атоме?
- Как определить общее число электронов в атоме?
- Что такое изотоп.
Вкратце напомню.
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
N = A — Z
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.

Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).

Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».

На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра

Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.

Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Мы знаем, что масса атома определяется массой ядра. Ядро состоит из протонов и нейтронов, относительные массы которых равны (1). Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Пример:
фтор — элемент № (9). Его относительная атомная масса равна (19).
В ядре атома фтора — (9) протонов и (19) (–) (9) (=) (10) нейтронов.
Рубидий — элемент № (37). Его относительная атомная масса равна (85).
В ядре атома рубидия — (37) протонов и (85) (–) (37) (=) (48) нейтронов.
Нуклиды
Вид атомов с определённым числом протонов и нейтронов в ядре называется нуклидом.
Нуклид обозначается следующим образом: внизу слева записывается число протонов (Z) (порядковый номер), вверху слева указывается массовое число (A) (сумма чисел протонов и нейтронов) —
RZA
, например:
C612
,
Se3479
.
Для обозначения нуклидов используют и другие способы записи:
углерод — (12),
C
— (12),
C12
;
селен — (79),
Se
— (79),
Se79
.
Изотопы
Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами (1), (2) и (3), атомы хлора с массами (35) и (37) и т. д.
Разновидности атомов одного химического элемента, имеющие разные атомные массы, называют изотопами.
С учётом знаний о строении ядра это определение можно сформулировать по-другому.
Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Значит, изотопы отличаются только числом нейтронов.
Рис. (1). Изотопы водорода
Протоны определяют свойства атома, то есть придают ему индивидуальность. А нейтроны не влияют на свойства атома, а отражаются на его массе. Поэтому все изотопы одного и того же элемента химически неотличимы.
Химический элемент — это вид атомов с определённым зарядом ядра.
Относительная атомная масса элемента
Большинство химических элементов существуют в виде смеси изотопов. Приведённая в Периодической таблице относительная атомная масса элемента — это средняя величина атомных масс всех его изотопов.
Пример:
определим относительную атомную массу хлора. (25) % его атомов — это атомы с массой (37), а (75) % — с массой (35). Найдём среднее значение:
·25+35
·75)100
= 35,5.
Источники:
Рис. 1. Изотопы водорода © ЯКласс
Начальное количество ядер радиоактивного изотопа
На чтение 3 мин Просмотров 68 Опубликовано 12.04.2021
Обновлено 14.03.2021
Способность ядер самопроизвольно распадаться, испуская частицы, называется радиоактивностью. Радиоактивный распад — статистический процесс. Каждое радиоактивное ядро может распасться в любой момент и закономерность наблюдается только в среднем, в случае распада достаточно большого количества ядер. λ — вероятность распада ядра в единицу времени. Если в образце в момент времени t имеется N радиоактивных ядер, то количество ядер dN, распавшихся за время dt пропорционально N.
Проинтегрировав (1) получим закон радиоактивного распада
N0 — количество радиоактивных ядер в момент времени t = 0. τ —
T1/2 — время, за которое первоначальное количество радиоактивных ядер уменьшится в два раза
A — среднее количество ядер распадающихся в единицу времени
Активность измеряется в кюри (Ки) и беккерелях (Бк)
1 Ки = 3.7·1010 распадов/c, 1 Бк = 1 распад/c.
Распад исходного ядра 1 в ядро 2, с последующим его распадом в ядро 3, описывается системой дифференциальных уравнений
гдеN1(t) и N2(t) -количество ядер, а λ1 иλ2 — постоянные распада ядер 1 и 2 соответственно. Решением системы (6) с начальными условиями N1(0) = N10; N2(0) = 0 будет
Количество ядер 2 достигает максимального значения при .

Если λ2 < λ1 (>), суммарная активность будет монотонно уменьшаться. Если λ2 >λ1 (<), суммарная активность вначале растет за счет накопления ядер 2. Если λ2 >>λ1, при достаточно больших временах вклад второй экспоненты в (7б) становится пренебрежимо мал, по сравнению со вкладом первой и активности второго A2 = λ2N2 и первого изотопов A1 = λ1N1 практически сравняются. В дальнейшем активности как первого так и второго изотопов будут изменяться во времени одинаково.
То есть устанавливается так называемое , при котором число ядер изотопов в цепочке распадов связано с постоянными распада (периодами полураспада) простым соотношением.
Поэтому в естественном состоянии все изотопы, генетически связанные в радиоактивных рядах, обычно находятся в определенных количественных соотношениях, зависящих от их периодов полураспада. В общем случае, когда имеется цепочка распадов 1→2→…n, процесс описывается системой дифференциальных уравнений
Решением системы (10) для активностей с начальными условиями N1(0) = N10; Ni(0) = 0 будет
где
Штрих означает, что в произведении, которое находится в знаменателе, опускается множитель с i = m.
Источник
- http://nuclphys.sinp.msu.ru/spargalka/006i.htm
| Ядерная физика |
|---|
 |
| Атомное ядро · Радиоактивный распад · Ядерная реакция · Термоядерная реакция |
|
Основные термины Атомное ядро · Изотопы · Изобары · Капельная модель ядра · Период полураспада · Массовое число · Составное ядро · Цепная ядерная реакция · Ядерное эффективное сечение |
|
Распад ядер Закон радиоактивного распада · Альфа-распад · Бета-распад · Кластерный распад |
|
Сложный распад Электронный захват · Двойной бета-распад · Двойной электронный захват · Внутренняя конверсия · Изомерный переход |
|
Излучения Ионизирующее излучение · Нейтронный распад · Позитронный распад · Протонный распад · Гамма излучение · Фоторасщепление |
|
Захваты Электронный захват · Нейтронный захват (r-процесс · s-процесс) · Протонный захват (p-процесс · rp-процесс) · Нейтронизация |
|
Деление ядра Спонтанное деление |
|
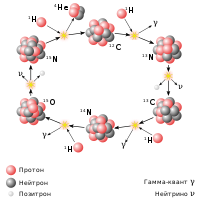
Нуклеосинтез Первичный нуклеосинтез · Протон-протонный цикл · CNO-цикл · Тройная гелиевая реакция · Гелиевая вспышка · Ядерное горение углерода · Углеродная детонация · Ядерное горение кислорода · Ядерное горение неона · Ядерное горение кремния · Реакции скалывания |
| См. также: Портал:Физика |
Изото́пы (от др.-греч. ἴσος «равный; одинаковый» + τόπος «место») — разновидности атомов (и ядер) химического элемента, имеющие одинаковый атомный номер, но разные массовые числа[1]. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева[2]. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N).
Все изотопы одного элемента имеют одинаковый заряд ядра, различаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222)[3]. Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Различают изотопы устойчивые (стабильные) и радиоактивные[4]. На 2017 год было известно 3437 изотопов всех элементов, из них 252 изотопа стабильны[en][5].
Пример изотопов: 16
8O, 17
8O, 18
8O — три стабильных изотопа кислорода.
Терминология[править | править код]
Первоначально изотопы также назывались изотопными элементами[6], а в настоящее время иногда называют изотопными нуклидами[7].
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов[править | править код]
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди с 1910 г. стали называть изотопами[источник не указан 818 дней].
На март 2017 года известно 3437 изотопов всех элементов[5], из них 254 стабильных, 29 условно-стабильных (с периодом полураспада более 10 миллиардов лет), 294 (9 %) изотопы трансурановых элементов, 1209 (38 %) нейтронно-избыточных и 1277 (40 %) протонно-избыточных (то есть отклоняющихся от линии бета-стабильности в сторону избытка нейтронов или протонов, соответственно). По количеству открытых изотопов первое место занимают США (1237), затем идут Германия (558), Великобритания (299), СССР/Россия (247) и Франция (217). Среди лабораторий мира первые пять мест по числу открытых изотопов занимают Национальная лаборатория им. Лоуренса в Беркли (638), Институт тяжёлых ионов в Дармштадте (438), Объединённый институт ядерных исследований в Дубне (221), Кавендишская лаборатория в Кембридже (218) и ЦЕРН (115). За 10 лет (2006—2015 годы включительно) в среднем физики открывали в год 23 нейтронно-избыточных и 3 протонно-избыточных изотопа, а также 4 изотопа трансурановых элементов. Общее количество учёных, являвшихся авторами или соавторами открытия какого-либо изотопа, составляет 3598 человек[8][9].
Изотопы в природе[править | править код]
Известно, что изотопный состав большинства элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Особое значение имеют процессы образования изотопов углерода в верхних слоях атмосферы под воздействием космического излучения. Эти изотопы распределяются в атмосфере и гидросфере планеты, вовлекаются в оборот углерода живыми существами (животными и растениями).
Изучение распределения изотопов углерода лежит в основе радиоуглеродного анализа.
Применение изотопов человеком[править | править код]
В технологической деятельности люди научились изменять изотопный состав элементов для получения каких-либо специфических свойств материалов. Например, 235U способен к цепной реакции деления тепловыми нейтронами и может использоваться в качестве топлива для ядерных реакторов или ядерного оружия. Однако в природном уране лишь 0,72 % этого нуклида, тогда как цепная реакция практически осуществима лишь при содержании 235U не менее 3 %. В связи с близостью физико-химических свойств изотопов тяжёлых элементов процедура изотопного обогащения урана является крайне сложной технологической задачей, которая доступна лишь десятку государств в мире. Во многих отраслях науки и техники (например, в радиоиммунном анализе) используются изотопные метки.
Нуклиды 60Co и 137Cs используются в стерилизации γ-лучами (лучевая стерилизация) как один из методов физической стерилизации инструментов, перевязочного материала и прочего. Доза проникающей радиации должна быть весьма значительной — до 20-25 кГр, что требует особых мер безопасности. В связи с этим лучевая стерилизация проводится в специальных помещениях и является заводским методом стерилизации (непосредственно в стационарах она не производится).[10]
| Количество энергетических уровней электронной оболочки |
Количество протонов (электронов) |
Символ | Элемент | Количество протонов и нейтронов |
Изотопная распространённость на Земле, % |
|---|---|---|---|---|---|
| 1 | 1 | H | Водород | 1 2 |
99,98 0,02 |
| 1 | 2 | He | Гелий | 3 4 |
0,00001 99,99999 |
| 2 | 3 | Li | Литий | 6 7 |
7,9 92,1 |
| 2 | 4 | Be | Бериллий | 9 | 100 |
| 2 | 5 | B | Бор | 10 11 |
18,8 81,2 |
| 2 | 6 | C | Углерод | 12 13 |
98,9 1,1 |
| 2 | 7 | N | Азот | 14 15 |
99,62 0,38 |
| 2 | 8 | O | Кислород | 16 17 18 |
99,76 0,04 0,20 |
| 2 | 9 | F | Фтор | 19 | 100 |
| 2 | 10 | Ne | Неон | 20 21 22 |
90,48 0,27 9,25 |
| 3 | 11 | Na | Натрий | 23 | 100 |
| 3 | 12 | Mg | Магний | 24 25 26 |
78,6 10,1 11,3 |
| 3 | 13 | Al | Алюминий | 27 | 100 |
| 3 | 14 | Si | Кремний | 28 29 30 |
92,23 4,67 3,10 |
| 3 | 15 | P | Фосфор | 31 | 100 |
| 3 | 16 | S | Сера | 32 33 34 36 |
95,02 0,75 4,21 0,02 |
| 3 | 17 | Cl | Хлор | 35 37 |
75,78 24,22 |
| 3 | 18 | Ar | Аргон | 36 38 40 |
0,337 0,063 99,600 |
| 4 | 19 | K | Калий | 39 41 |
93,258 6,730 |
| 4 | 20 | Ca | Кальций | 40 42 43 44 46 |
96,941 0,647 0,135 2,086 0,004 |
| 4 | 21 | Sc | Скандий | 45 | 100 |
| 4 | 22 | Ti | Титан | 46 47 48 49 50 |
7,95 7,75 73,45 5,51 5,34 |
| 4 | 23 | V | Ванадий | 51 | 99,750 |
| 4 | 24 | Cr | Хром | 50 52 53 54 |
4,345 83,789 9,501 2,365 |
| 4 | 25 | Mn | Марганец | 55 | 100 |
| 4 | 26 | Fe | Железо | 54 56 57 58 |
5,845 91,754 2,119 0,282 |
| 4 | 27 | Co | Кобальт | 59 | 100 |
| 4 | 28 | Ni | Никель | 58 60 61 62 64 |
68,27 26,10 1,13 3,59 0,91 |
| 4 | 29 | Cu | Медь | 63 65 |
69,1 30,9 |
| 4 | 30 | Zn | Цинк | 64 66 67 68 70 |
49,2 27,7 4,0 18,5 0,6 |
| 4 | 31 | Ga | Галлий | 69 71 |
60,11 39,89 |
| 4 | 32 | Ge | Германий | 70 72 73 74 |
20,55 27,37 7,67 36,74 |
| 4 | 33 | As | Мышьяк | 75 | 100 |
| 4 | 34 | Se | Селен | 74 76 77 78 80 |
0,87 9,02 7,58 23,52 49,82 |
| 4 | 35 | Br | Бром | 79 81 |
50,56 49,44 |
| 4 | 36 | Kr | Криптон | 80 82 83 84 86 |
2,28 11,58 11,49 57,00 17,30 |
| 5 | 37 | Rb | Рубидий | 85 | 72,2 |
| 5 | 38 | Sr | Стронций | 84 86 87 88 |
0,56 9,86 7,00 82,58 |
| 5 | 39 | Y | Иттрий | 89 | 100 |
| 5 | 40 | Zr | Цирконий | 90 91 92 94 |
51,46 11,23 17,11 17,4 |
| 5 | 41 | Nb | Ниобий | 93 | 100 |
| 5 | 42 | Mo | Молибден | 92 94 95 96 97 98 |
15,86 9,12 15,70 16,50 9,45 23,75 |
| 5 | 44 | Ru | Рутений | 96 98 99 100 101 102 104 |
5,7 2,2 12,8 12,7 13 31,3 18,3 |
| 5 | 45 | Rh | Родий | 103 | 100 |
| 5 | 46 | Pd | Палладий | 102 104 105 106 108 110 |
1,00 11,14 22,33 27,33 26,46 11,72 |
| 5 | 47 | Ag | Серебро | 107 109 |
51,839 48,161 |
| 5 | 48 | Cd | Кадмий | 106 108 110 111 112 114 |
1,25 0,89 12,47 12,80 24,11 28,75 |
| 5 | 49 | In | Индий | 113 | 4,29 |
| 5 | 50 | Sn | Олово | 112 114 115 116 117 118 119 120 122 124 |
0,96 0,66 0,35 14,30 7,61 24,03 8,58 32,85 4,72 5,94 |
| 5 | 51 | Sb | Сурьма | 121 123 |
57,36 42,64 |
| 5 | 52 | Te | Теллур | 120 122 123 124 125 126 |
0,09 2,55 0,89 4,74 7,07 18,84 |
| 5 | 53 | I | Иод | 127 | 100 |
| 5 | 54 | Xe | Ксенон | 126 128 129 130 131 132 134 |
0,089 1,910 26,401 4,071 21,232 26,909 10,436 |
| 6 | 55 | Cs | Цезий | 133 | 100 |
| 6 | 56 | Ba | Барий | 132 134 135 136 137 138 |
0,10 2,42 6,59 7,85 11,23 71,70 |
| 6 | 57 | La | Лантан | 139 | 99,911 |
| 6 | 58 | Ce | Церий | 136 138 140 142 |
0,185 0,251 88,450 11,114 |
| 6 | 59 | Pr | Празеодим | 141 | 100 |
| 6 | 60 | Nd | Неодим | 142 143 145 146 148 |
27,2 12,2 8,3 17,2 5,7 |
| 6 | 62 | Sm | Самарий | 144 150 152 154 |
3,07 7,38 26,75 22,75 |
| 6 | 63 | Eu | Европий | 151 153 |
52,2 47,8 |
| 6 | 64 | Gd | Гадолиний | 154 155 156 157 158 160 |
2,18 14,80 20,47 15,65 24,84 21,86 |
| 6 | 65 | Tb | Тербий | 159 | 100 |
| 6 | 66 | Dy | Диспрозий | 156 158 160 161 162 163 164 |
0,056 0,095 2,329 18,889 25,475 24,896 28,260 |
| 6 | 67 | Ho | Гольмий | 165 | 100 |
| 6 | 68 | Er | Эрбий | 162 164 166 167 168 170 |
0,139 1,601 33,503 22,869 26,978 14,910 |
| 6 | 69 | Tm | Тулий | 169 | 100 |
| 6 | 70 | Yb | Иттербий | 168 170 171 172 173 174 176 |
0,126 3,023 14,216 21,754 16,098 31,896 12,887 |
| 6 | 71 | Lu | Лютеций | 175 | 97,41 |
| 6 | 72 | Hf | Гафний | 176 177 178 179 180 |
5,26 18,60 27,28 13,62 35,08 |
| 6 | 73 | Ta | Тантал | 181 | 99,9877 |
| 6 | 74 | W | Вольфрам | 182 184 186 |
26,50 30,64 28,43 |
| 6 | 75 | Re | Рений | 185 | 37,07 |
| 6 | 76 | Os | Осмий | 184 187 188 189 190 192 |
0,02 1,96 13,24 16,15 26,26 40,78 |
| 6 | 77 | Ir | Иридий | 191 193 |
37,3 62,7 |
| 6 | 78 | Pt | Платина | 192 194 195 196 198 |
0,782 32,967 33,832 25,242 7,163 |
| 6 | 79 | Au | Золото | 197 | 100 |
| 6 | 80 | Hg | Ртуть | 196 198 199 200 201 202 204 |
0,155 10,04 16,94 23,14 13,17 29,74 6,82 |
| 6 | 81 | Tl | Таллий | 203 205 |
29,52 70,48 |
| 6 | 82 | Pb | Свинец | 204 206 207 208 |
1,4 24,1 22,1 52,4 |
| 6 | 83 | Bi | Висмут | 209[11] | 100 |
Тантал также имеет стабильный изомер (энергетически возбуждённое состояние): 180mTa (изотопная распространённость 0,0123 %).
Кроме стабильных нуклидов, в природных изотопных смесях также присутствуют примордиальные радионуклиды (т. е. нуклиды с очень большими периодами полураспада, сохранившиеся с момента образования Земли).
См. также[править | править код]
- Изобары
- Изотоны
- Изотопная распространённость
- Изомерия атомных ядер
- Таблица нуклидов
- Радиоактивные изотопы
- Изотопический сдвиг
Примечания[править | править код]
- ↑ Isotope. Encyclopedia Britannica. Дата обращения: 24 мая 2019. Архивировано 9 мая 2020 года.
- ↑ Soddy, Frederick The origins of the conceptions of isotopes. Nobelprize.org 393 (12 декабря 1922). — «Thus the chemically identical elements – or isotopes, as I called them for the first time in this letter to Nature, because they occupy the same place in the Periodic Table …» Дата обращения: 9 января 2019. Архивировано 10 января 2019 года.
- ↑ IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry — IUPAC Recommendations 2005 Архивная копия от 9 июля 2018 на Wayback Machine, The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition Архивная копия от 3 марта 2016 на Wayback Machine, 1970; probably in the 1958 first edition as well
- ↑ Изотопы // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2. (CC BY-SA 3.0)
- ↑ 1 2 Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2017. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — doi:10.1088/1674-1137/41/3/030001. — Bibcode: 2017ChPhC..41c0001A.

- ↑ Soddy, Frederick. Intra-atomic charge (англ.) // Nature. — 1913. — Vol. 92, no. 2301. — P. 399—400. — doi:10.1038/092399c0. — Bibcode: 1913Natur..92..399S. Архивировано 4 октября 2015 года.
- ↑ IUPAP Red Book Архивная копия от 18 марта 2015 на Wayback Machine // iupap.org.
- ↑ Thoennessen M. (2016), 2015 Update of the Discoveries of Isotopes, arΧiv:1606.00456 [nucl-ex].
- ↑ Michael Thoennessen. Discovery of Nuclides Project. Дата обращения: 6 июня 2016. Архивировано 4 марта 2016 года.
- ↑ Петров С. В. Глава 2. Асептика и антисептика // Общая хирургия. — СПб.: Лань, 1999. — С. 672.
- ↑ Практически стабилен, период полураспада 2,01·1019 лет.
Ссылки[править | править код]
- Таблица изотопов химических элементов на сайте Berkeley Laboratory
