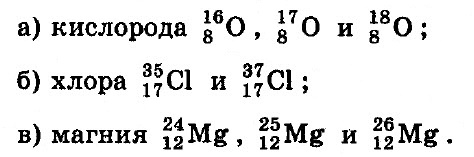Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные), таблицу Менделеева, манометр, термометр.
Инструкция
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром), то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Видео по теме
Обратите внимание
Как найти количество атомов в веществе. Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам понадобится.
Полезный совет
Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Зная это число, можно различными способами, которые и были испробованы в 1908-1910 гг., найти число N. Можно собрать α-частицы в цилиндре Фарадея, измерить их заряд и, разделив его на число частиц, получить заряд каждой из них; половина его дает нам элементарный заряд, по которому уже определяется число N…
Источники:
- как определить количество атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Задачи на Состав атомов с ответами
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Определите нуклонные числа элементов, в атомных ядрах которых содержатся:
а) 8 протонов и 8 нейтронов;
б) 19 протонов и 20 нейтронов;
в) 15 протонов и 16 нейтронов.
ОТВЕТ: а) 16; б) 39; в) 31.
Задача № 2.
Определите количество протонов и количество нейтронов в ядре атома элемента с атомным номером 10 и нуклонным числом 20.
Примечание: Атомный номер (в номенклатуре ИЮПАК) или порядковый номер (в учебной литературе) равен заряду ядра атома химического элемента.
ОТВЕТ: 10р и 10n .
Задача № 3.
Укажите количество протонов и количество нейтронов, которые содержатся в ядрах азота-14, кремния-28 и бария-137.
ОТВЕТ: N — 7р и 7n; Si — 14р и 14n; Ва — 56р и 81n.
Задача № 4.
Укажите протонное число элемента, если известно, что его нуклонное число 32, а количество нейтронов в ядре 16.
ОТВЕТ: 16.
Задача № 5.
В Периодической системе элементов найдите элементы с атомными номерами 12, 29, 50 и 80 и укажите для каждого количество электронов, содержащихся в атоме.
ОТВЕТ: 18. 12, 29, 50 и 80.
Задача № 6.
Назовите элемент, ядро атома которого содержит 21 протон и 24 нейтрона.
ОТВЕТ: Скандий.
Задача № 7.
Укажите заряд ядра, а также количество протонов, нейтронов и электронов в атомах изотопов:
ОТВЕТ: а) 8; 8р; 8e̅; 8n, 9n, 10n;
б) 17; 17р; 17e̅; 18n, 20n;
в) 12; 12р; 12e̅; 12n, 13n, 14n.
Задача № 8.
Назовите химический элемент, изотопы которого содержатся среди следующих формул:
ОТВЕТ: Калий, изотопы калия 3919К и 4019К.
Задача № 9.
Определите количество протонов и электронов, содержащихся в следующих атомах и ионах:
а) Ne, Na+ и F–;
б) Fе, Fе2+ и Fe3+.
ОТВЕТ:
Задача № 10.
Определите заряд ионов, образующихся:
а) при удалении из атома Аl трех электронов;
б) при присоединении к атому S двух электронов.
ОТВЕТ: а) Al3+; б) S2–.
Задача № 11.
Какие частицы участвуют в уравнениях следующих ядерных реакций:
ОТВЕТ: а) a-частица; б) электрон; в) позитрон; г) электрон.
Задача № 12.
Элементы с атомными номерами 93 и больше не встречаются в природе, их получают искусственно при помощи ядерных реакций. Какие химические элементы можно получить в следующих ядерных реакциях:
ОТВЕТ:
Задача № 13.
Составьте уравнения ядерных реакций, если известно:
а) что при температурах около 108 °С происходит слияние атомных ядер трития и дейтерия с образованием ядра гелия и нейтрона;
б) при соударении нейтронов космического излучения и атомов азота в верхних слоях атмосферы образуются тритий и ядра гелия;
в) при бомбардировке атомов азота ядрами гелия получают атомы кислорода и протоны. .
ОТВЕТ:
Это конспект по теме «ЗАДАЧИ на Состав атомов». Выберите дальнейшие действия:
- Перейти к теме: ЗАДАЧИ
- Посмотреть конспект по теме
- Вернуться к списку конспектов по Химии.
- Проверить свои знания по Химии.
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 953 719 раз.
Была ли эта статья полезной?
Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
ΔN=N(t)-N(t+Δt)=N(t)(1-e–λΔt)
Если
интервал времени распада Δt
очень мал по
сравнению с периодом полураспада T,
то число ядер, распавшихся за время Δt,
можно найти по приближенной формуле:
ΔN=λN(t)Δt
Период
полураспада T–
это промежуток времени, за который число
нераспавшихся ядер уменьшается в два
раза (см. рис. 1.1).
За
время 2T
число ядер
снижается в 4 раза и т.д. Связь между
периодом полураспада и постоянной
распада
Число ядер, содержащихся в массе m радиоактивного вещества:
где
μ
– молярная масса вещества; NA–
число Авогадро (NA=6,02·1023
моль-1).
Активность
радиоактивного препарата – это число
ядер, распавшихся в единицу времени:
или
,
где
a0=λN0–
активность в начальный момент времени.
Единица
активности в СИ – беккерель (Бк): 1 Бк –
активность изотопа, при которой за 1 с
происходит один акт распада.
Внесистемная
единица – кюри (Ku)
: 1 Ku=3,7·1010
Бк.
Удельной
активностью называется число распадов
в 1 с на единицу массы распадающегося
вещества.
1.8 Правила смещения при радиоактивном распаде
В
процессах радиоактивного распада имеют
место так называемые правила смещения,
позволяющие определить массовое число
и заряд ядра нового элемента, возникающего
в результате α-
и β-
превращений:
при
α – распаде
при
–
распаде
при
γ- излучении
значения A
и Z
у ядра не изменяются.
Если
дочернее ядро Y
также оказывается
радиоактивным, то возникает цепочка
радиоактивных превращений. Из правил
смещения видно, что массовое число при
α –
распаде уменьшается на 4, а при β
–распаде не
меняется. Следовательно, для всех ядер
одного и того же радиоактивного семейства
остаток от деления массового числа на
4 одинаков, т.е. существует четыре
различных семейства, для каждого из
которых массовые числа определяются
значениями
A
= 4n,
4n+1,
4n+2,
4n+3,
где
n
– целое
положительное число.
Семейства
начинаются на наиболее долгоживущем (
с наибольшим периодом полураспада )
«родоначальнике» семейства: тории ,
уране и актинии
и
заканчиваются после цепочки α-
и β-
превращений на устойчивых изотопах
свинца:
Семейство
4n+1
нептуния
состоит из цепочки искусственно-радиоактивных
ядер и заканчивается висмутом.
1.9 Ядерные реакции
Ядерные
реакции – это превращения атомных ядер,
вызванные взаимодействиями их друг с
другом или с элементарными частицами.
Как
правило, в ядерных реакциях участвуют
два ядра и две частицы. Развернутый вид
ядерной реакции выглядит, к примеру,
следующим образом:
При
ядерных реакциях выполняются законы
сохранения массового и зарядового числа
A1+A2=A3+A4
и
Z1+Z2=Z3+Z4,
где
индексы 1 и 2 относятся к исходным
реагентам, а 3 и 4 – к продуктам реакции.
В законе сохранения зарядового числа
учитывается знак заряда реагента
(алгебраическая сумма). Кроме того,
выполняются закон сохранения импульса
и релятивистской полной энергии.
Широко
распространен сокращенный способ записи
ядерных реакций согласно следующему
правилу: вначале записывается
бомбардируемое ядро (ядро- мишень), затем
в скобках указывается на первом месте
налетающая частица (частица-снаряд), а
за ней – все частицы, вылетевшие в
результате реакции; после скобок
обозначается окончательно получившееся
ядро (ядро-продукт). Сокращенная запись
реакции представима в виде:
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #