Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества

m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа

p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;
 — среднее значение квадрата скорости молекул.
— среднее значение квадрата скорости молекул.
1.3 Средняя квадратичная скорость молекул идеального газа

k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа

1.5 Давление идеального газа

n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта

p — давление;
V — объем газа.
1.7 Закон Шарля
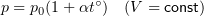
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака

V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона

1.10 Объединенный закон газового состояния (уравнение Клапейрона)

1.11 Закон Дальтона

pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа

ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV

p — давление газа.
При изменении объема от V1 до V2

2.3 Первый закон термодинамики

ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа

ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Формулы молекулярной физики
Формула концентрации молекул
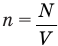
Здесь n — концентрация  , N — количество молекул (безразмерное), V — объем
, N — количество молекул (безразмерное), V — объем  .
.
Формула плотности
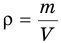
Здесь 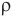 — плотность вещества
— плотность вещества 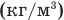 , m — масса вещества (кг), V — объем
, m — масса вещества (кг), V — объем  .
.
Формула относительной молекулярной массы
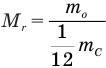
Здесь 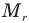 — относительная молекулярная масса (безразмерная),
— относительная молекулярная масса (безразмерная), 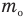 — масса одной молекулы (кг),
— масса одной молекулы (кг), 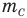 — масса атома углерода (кг).
— масса атома углерода (кг).
Формула количества вещества (количества молей)
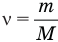
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
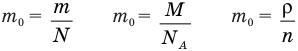
Здесь 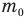 — масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль),
— масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль), 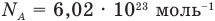 — число Авогадро,
— число Авогадро, 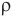 — плотность вещества
— плотность вещества 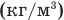 , n — концентрация молекул
, n — концентрация молекул  .
.
Формулы количества молекул
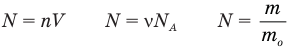
Здесь A — количество молекул (безразмерное), п — концентрация молекул  , V— объем
, V— объем  , v — количество вещества (количество молей) (моль),
, v — количество вещества (количество молей) (моль), 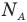 — число Авогадро
— число Авогадро 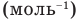 , m — масса вещества (кг),
, m — масса вещества (кг), 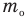 — масса одной молекулы.
— масса одной молекулы.
Формулы средней квадратичной скорости молекул
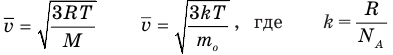
Здесь 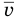 — средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль),
— средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль), 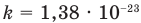 Дж/К — постоянная Больцмана,
Дж/К — постоянная Больцмана, 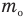 — масса одной молекулы (кг).
— масса одной молекулы (кг).
Основное уравнение кинетической теории идеального газа

Здесь р — давление газа (Па), 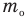 — масса одной молекулы (кг), n — концентрация молекул
— масса одной молекулы (кг), n — концентрация молекул  ,
, 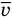 — средняя квадратичная скорость молекул (м/с),
— средняя квадратичная скорость молекул (м/с), 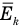 — средняя кинетическая энергия молекул (Дж).
— средняя кинетическая энергия молекул (Дж).
Формула средней кинетической энергии молекул
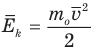
Здесь 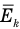 — средняя кинетическая энергия молекул (Дж),
— средняя кинетическая энергия молекул (Дж), 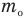 — масса одной молекулы (кг),
— масса одной молекулы (кг), 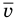 — средняя квадратичная скорость молекул (м/с).
— средняя квадратичная скорость молекул (м/с).
Связь шкал Цельсия и Кельвина
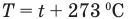
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
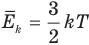
Здесь 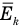 — средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
— средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
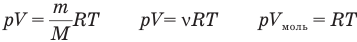
Здесь р — давление газа (Па), V — объем  , т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль),
, т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль), 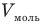 — объем моля
— объем моля 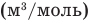 .
.
Объединенный газовый закон — уравнение Клапейрона
при 
Здесь 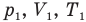 — давление (Па), объем
— давление (Па), объем  и абсолютная температура (К) газа в первом состоянии,
и абсолютная температура (К) газа в первом состоянии, 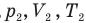 — давление (Па), объем
— давление (Па), объем  и абсолютная температура (К) газа во втором состоянии.
и абсолютная температура (К) газа во втором состоянии.
Закон Бойля — Мариотта (изотермический процесс)
при 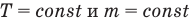
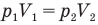
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 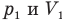 — давление (Па) и объем газа
— давление (Па) и объем газа  в первом состоянии,
в первом состоянии, 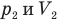 — давление (Па) и объем
— давление (Па) и объем  газа во втором состоянии.
газа во втором состоянии.
Закон Гей-Люссака (изобарный процесс)
при 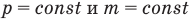
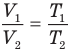
Здесь р — давление газа (Па), m — масса газа (кг), 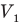 и
и 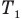 — объем
— объем  и абсолютная температура (К) газа в первом состоянии,
и абсолютная температура (К) газа в первом состоянии, 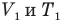 — объем
— объем  и абсолютная температура (К) газа во втором состоянии.
и абсолютная температура (К) газа во втором состоянии.
Закон Шарля
при 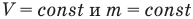
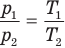
Здесь V — объем газа  , m — масса газа (кг),
, m — масса газа (кг), 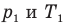 — давление (Па) и абсолютная температура (К) газа в первом состоянии,
— давление (Па) и абсолютная температура (К) газа в первом состоянии, 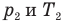 — давление (Па) и абсолютная температура (К) газа во втором состоянии.
— давление (Па) и абсолютная температура (К) газа во втором состоянии.
Связь давления идеального газа с концентрацией его молекул и температурой
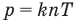
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа  , абсолютная температура Т (К).
, абсолютная температура Т (К).
Формулы относительной влажности
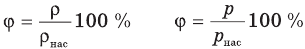
Здесь 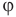 — относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре
— относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре 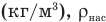 — плотность насыщенного водяного пара при той же температуре
— плотность насыщенного водяного пара при той же температуре 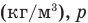 — давление водяного пара в воздухе при данной температуре (Па),
— давление водяного пара в воздухе при данной температуре (Па), 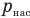 — давление насыщенного водяного пара в воздухе при той же температуре (Па).
— давление насыщенного водяного пара в воздухе при той же температуре (Па).
Работа при изобарном изменении объема газа
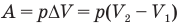
Здесь А — работа (Дж), р — давление газа (Па), 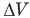 — изменение объема газа
— изменение объема газа 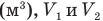 — соответственно начальный и конечный объемы газа
— соответственно начальный и конечный объемы газа  .
.
Внутренняя энергия идеального одноатомного газа
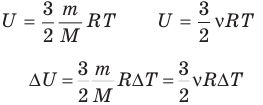
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 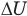 — изменение внутренней энергии (Дж),
— изменение внутренней энергии (Дж), 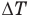 — изменение температуры (К).
— изменение температуры (К).
Первый закон термодинамики
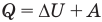
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 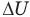 — изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
— изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при 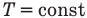
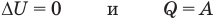
к изохорному: при V = const
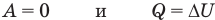
к изобарному: при р = const
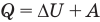
к адиабатному: при Q = 0

Здесь Т — абсолютная температура (К), 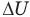 — изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем
— изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем  , р — давление (Па).
, р — давление (Па).
Формулы количества теплоты при нагревании или охлаждении тел
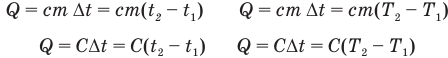
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 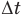 — изменение температуры тела по шкале Цельсия,
— изменение температуры тела по шкале Цельсия, 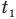 и
и 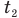 — температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия,
— температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия, 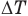 — изменение абсолютной температуры тела (К),
— изменение абсолютной температуры тела (К), 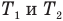 — абсолютные температуры тела в начале и в конце процесса передачи теплоты (К),
— абсолютные температуры тела в начале и в конце процесса передачи теплоты (К), 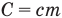 — теплоемкость тела (Дж/К).
— теплоемкость тела (Дж/К).
Формула количества теплоты при плавлении или кристаллизации
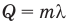
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 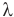 — удельная теплота плавления вещества (Дж/кг).
— удельная теплота плавления вещества (Дж/кг).
Формула количества теплоты при парообразовании или конденсации
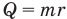
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
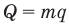
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
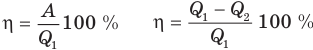
Здесь 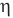 — коэффициент полезного действия (безразмерный или в %),
— коэффициент полезного действия (безразмерный или в %), 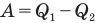 — работа, совершенная двигателем (Дж),
— работа, совершенная двигателем (Дж), 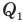 — количество теплоты, полученное рабочим веществом от нагревателя (Дж),
— количество теплоты, полученное рабочим веществом от нагревателя (Дж), 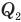 — количество теплоты, отданное рабочим веществом холодильнику (Дж).
— количество теплоты, отданное рабочим веществом холодильнику (Дж).
Коэффициент полезного действия идеального теплового двигателя
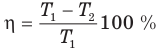
Здесь  — коэффициент полезного действия идеального теплового двигателя (безразмерный или в %),
— коэффициент полезного действия идеального теплового двигателя (безразмерный или в %),  — абсолютная температура нагревателя (К),
— абсолютная температура нагревателя (К),  — абсолютная температура холодильника(К).
— абсолютная температура холодильника(К).
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:

Количество вещества (моль)
ν – количество вещества
N – число молекул
N_A – Число Авогадро
Мольная масса
M – мольная масса
m – масса
ν – количество вещества
Масса молекулы
m0 – масса молекулы
m – масса
N – число молекул
Мольная масса
M – мольная масса
m0 – масса молекулы
N_A – Число Авогадро
Число молекул
N – число молекул
m – масса
N_A – Число Авогадро
M – мольная масса
Основное уравнение молекулярно-кинетической теории
p – давление
n – концентрация
m0 – масса молекулы
v – скорость
Внутренняя энергия молекул
E – энергия
m – масса
v – скорость
Давление идеального газа
p – давление
n – концентрация
E – энергия
Концентрация молекул
n – концентрация
N – число молекул
V – объём
Газ: давление, объем, средняя кинетическая энергия
p – давление
V – объём
N – число молекул
E – средняя кинетическая энергия
Газ: давление, объем, температура
p – давление
V – объём
N – число молекул
k – постоянная больцмана
T – температура
Средняя кинетическая энергия
E – средняя кинетическая энергия
k – постоянная больцмана
T – температура
Газ: давление, концентрация, температура
p – давление
n – концентрация
k – постоянная больцмана
T – температура
Газ: количество вещества, громкость
ν – количество вещества
V – объём
V_M – мольный (молярный) объём
Уравнение среднеквадратичной скорости молекулы
v – скорость
k – постоянная больцмана
T – температура
m0 – масса молекулы
Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона)
p – давление
V – объём
m – масса
R – универсальная газовая постоянная
T – температура
M – мольная масса
Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона)
p – давление
V – объём
T – температура
ν – количество вещества
R – универсальная газовая постоянная
Закон бойля-мариотта (изотермический процесс)
p1, p2 – давление
V1, V2 – объемы
Закон гей-люссака (изобарный процесс)
T1, T2 – температуры
V1, V2 – объемы
Тепловое расширение газа
V – объём
V0 – объем при 0 C
α – коэффициент объемного расширения
T – температура
Закон Шарля (изохорный процесс)
p1, p2 – давление
V1, V2 – объемы
Температурная зависимость давления газа
p – давление
p0 – давление газа при 0 C
T – температура
γ – термический коэффициент давления газа
Как найти количество молекул в веществе
Количество молекул в веществе измерить обычными методами практически невозможно. Это связанно с тем, что молекула вещества слишком мала для того, чтобы ее увидеть. Поэтому количество молекул в данной массе вещества рассчитывается с помощью специальных формул.
Вам понадобится
- – периодическая таблица химических элементов;
- – весы;
- – калькулятор.
Инструкция
Зная такую величину, как количество вещества ν, найдите число молекул в нем. Для этого количество вещества, измеренное в молях, умножьте на постоянную Авогадро (NА=6,022∙10^23 1/моль), которая равна числу молекул в 1 моле вещества N=ν/ NА. Например, если имеется 1,2 моль поваренной соли, то в ней содержится N=1,2∙6,022∙10^23 ≈7,2∙10^23 молекул.
Если известна химическая формула вещества, с помощью периодической таблицы элементов найдите его молярную массу. Для этого по таблице найдите относительные атомные массы атомов, из которых состоит молекула, и сложите их. В результате получите относительную молекулярную массу вещества, которая численно равна его молярной массе в граммах на моль. Затем, на весах измерьте массу исследуемого вещества в граммах. Чтобы найти количество молекул в веществе, умножьте массу вещества m на постоянную Авогадро (NА=6,022∙10^23 1/моль) и поделите результат на молярную массу M (N=m∙ NА/M).
Пример Определите количество молекул, которое содержится в 147 г серной кислоты. Найдите молярную массу серной кислоты. Ее молекула состоит из 2-х атомов водорода одного атома серы и 4-х атомов кислорода. Их атомные массы равны 1, 32 и 16. Относительная молекулярная масса равна 2∙1+32+4∙16=98. Она равна молярной массе, поэтому М=98 г/моль. Тогда количество молекул, содержащихся в 147 г серной кислоты, будет равно N=147∙6,022∙10^23/98≈9∙10^23 молекул.
Чтобы найти количество молекул газа в нормальных условиях при температуре 0ºС и давлении 760 мм рт. столба, найдите его объем. Для этого измеряйте или высчитайте объем емкости V, в которой он находится в литрах. Чтобы найти количество молекул газа поделите этот объем на 22,4 л (объем одного моля газа в нормальных условиях), и умножьте на число Авогадро (NА=6,022∙10^23 1/моль) N= V∙ NА/22,4.
Источники:
- как определить количество молекул
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
2.1. Основные понятия и формулы
Количество
вещества
—
число структурных элементов (молекул,
атомов, ионов и т. п.), содержащихся в
теле или системе. Количество вещества
выражается в молях. Моль равен количеству
вещества системы, содержащей столько
же структурных элементов, сколько
содержится атомов в
0,012
кг изотопа углерода 12C.
Количество вещества тела (системы)
![]() ,
,
где
N
—
число структурных элементов (молекул,
атомов, ионов и т.п.), составляющих тело
(систему). Постоянная Авогадро NА=6,021023
моль-1.
Молярная масса вещества ,
где
m—масса
однородного тела (системы);
—количество
вещества (число молей) этого тела
(системы). Выражается в единицах г/моль
(или кг/моль).
Единица
массы, равная 1/12 массы атома углерода
12C,
называется атомной единицей массы
(а.е.м.). Массы атомов или молекул выраженные
в атомных единицах массы называют
соответственно относительной атомной
или относительной молекулярной массой
вещества. Относительная молекулярная
масса вещества состоит из относительных
атомных масс химических элементов,
составляющих молекулу вещества.
Относительные атомные массы химических
элементов приводятся в таблице Д. И.
Менделеева (см. также таблицу 8 приложения
данного пособия).
Молярная
масса вещества численно равна относительной
атомной или молекулярной массе данного
вещества, если размерность а.е.м. заменить
на размерность г/моль.
Количество вещества смеси n газов
![]() или
или
![]() ,
,
где
νi,
Ni,
mi,
i
—
соответственно количество вещества,
число молекул, масса и молярная масса
i-го
компонента смеси (i=1,2,…,n).
Уравнение
Менделеева
—
Клапейрона (уравнение состояния
идеального газа)
![]() ,
,
где
т
—
масса газа,
—
молярная масса газа, R
—
универсальная газовая постоянная, ν
—
количество вещества, Т
—
термодинамическая температура.
Опытные
газовые законы, являющиеся частными
случаями уравнения Менделеева
—
Клапейрона для изопроцессов:
а)
закон Бойля—Мариотта
(изотермический процесс: T=const,
m=const)
![]()
или
для двух состояний газа, обозначенных
цифрами 1 и 2,
![]() ,
,
б)
закон Гей-Люссака (изобарический процесс:
р=const,
m=const)
![]() или
или
для двух состояний
![]() ,
,
в)
закон Шарля (изохорический процесс:
V=const,
m=const)
![]()
или
для двух состояний
![]() ,
,
г)
объединенный газовый закон (m=const)
![]() или
или
для двух состояний
![]() .
.
Под
нормальными условиями понимают давление
po=1
атм (1,013105
Па), температуру 0оС
(T=273
K).
Закон
Дальтона, определяющий давление смеси
n
газов.
![]() ,
,
где
pi
—
парциальные давления компонентов смеси
(i=1,2,…,n).
Парциальным
давлением называется давление газа,
которое производил бы этот газ, если бы
только он один находился в сосуде,
занятом смесью.
Молярная масса смеси n газов
![]() .
.
Массовая
доля i-го
компонента смеси газа (в долях единицы
или процентах)
![]() ,
,
где
т
—
масса смеси.
Концентрация молекул
![]() ,
,
где
N
—
число молекул, содержащихся в данной
системе;
—
плотность вещества в системе;
V
—
объем системы. Формула справедлива не
только для газов, но и для любого
агрегатного состояния вещества.
Уравнение
Ван-дер-Ваальса для реального газа
![]() ,
,
где
a
и b
—
коэффициенты Ван-дер-Ваальса
Для
идеального газа уравнение Ван-дер-Ваальса
переходит в уравнение Менделеева
—
Клапейрона.
Основное уравнение
молекулярно – кинетической теории газов
![]() ,
,
где
п
—
средняя кинетическая энергия
поступательного движения молекулы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
