Выберите подписку для получения дополнительных возможностей Kalk.Pro
Любая активная подписка отключает
рекламу на сайте
-
-
Доступ к скрытым чертежам -
Безлимитные сохранения расчетов
-
Доступ к скрытым чертежам -
Безлимитные сохранения расчетов
-
-
-
Доступ к скрытым чертежам -
Безлимитные сохранения расчетов
-
Доступ к скрытым чертежам -
Безлимитные сохранения расчетов
-
Более 10 000 пользователей уже воспользовались расширенным доступом для успешного создания своего проекта. Подробные чертежи и смета проекта экономят до 70% времени на подготовку элементов конструкции, а также предотвращают лишний расход материалов.
Подробнее с подписками можно ознакомиться здесь.
Молярная концентрация растворенного вещества
Молярная концентрация (молярность, мольность) — количество растворенного вещества (число молей) в единице объема раствора.
Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Молярную концентрацию растворов определяют по формуле:
где 



где 
Онлайн калькулятор позволяет рассчитать молярную концентрацию вещества (молярность).
Поделиться страницей в социальных сетях:
Разбавление раствора — это процесс уменьшения концентрации вещества при помощи добавления растворителя. Количество вещества при разбавлении растворов остается постоянным.
Концентрация растворов
В химической практике обычно приходится работать с растворами строгой концентрации. Например, приготовление лекарственных растворов требует строго заданного количества действующего вещества, иначе не будет достигнут лечебный эффект или раствор будет вреден для здоровья. Также большая часть химических реакций проводится в растворах, а для корректного протекания реакции требуется использовать вещества строгой концентрации. Одна ошибка — и реакция выйдет из-под контроля, и хорошо еще, если не нанесет вред химику и его имуществу.
Именно поэтому всегда указывается концентрация участвующих в реакции веществ. Одним из способов указания насыщенности растворов — это массовая доля, которая представляет собой массу растворенного вещества к общей массе раствора. Формула массовой доли выглядит следующим образом:
w = (m1 / m) × 100%,
где m1 — масса активного вещества, m — масса раствора.
Например, маринад для домашней капусты представляет собой раствор, который готовится по рецепту: 10 г поваренной соли на 1 литр воды. На первый взгляд кажется, что такой маринад имеет концентрацию соли в 1%, однако это не так. Если к 1 литру чистой воды, который весит 1000 г, добавить 10 г соли, то масса раствора составит 1,01 кг. Следовательно, концентрация маринада составит:
w = 10 / 1010 = 0,9%
Разница невелика, но в химических опытах такое различие может сыграть решающую роль. Поэтому при приготовлении растворов по рецептам из химических справочников вначале добавляют в мензурку действующее вещество, а затем доливают растворитель до заданной отметки.
Массовая концентрация вещества также носит название процентной концентрации, однако в некоторых случаях гораздо удобнее пользоваться другой мерой насыщенности — молярной концентрацией.
Молярная концентрация
При разбавлении раствора изменяется его объем и концентрация, но количество вещества остается статичным. Моль в химии — это количества вещества, в котором присутствует 6,022 × 1023 структурных частиц. Такое значение выбрано не случайно. Итальянский химик Амадео Авогадро принял моль в качестве единицы измерения, но не задавал для него определенного количества: он лишь знал, что это количество несоизмеримо большее. Позднее нобелевский лауреат Жан Батист Перрен задал для моля количество вещества, равное количеству атомов, которое содержится в 12 граммах изотопа углерод-12.
Молярная масса — это масса одного моля химического вещества, которое легко определяется по таблице Менделеева: достаточно суммировать атомные массы элементов, входящих в состав соединения. Например, 1 моль кислорода O2 имеет массу 32 грамма, так как каждый атом кислорода характеризуется атомной массой в 16 единиц.
Молярная концентрация — это количество молей активного вещества на 1 литр раствора. Представим, что в колбу добавлено 790 грамм марганцовки. Перманганат калия, он же марганцовка, имеет формулу KMnO4. Молярная масса вещества рассчитывается как сумма атомных масс элементов: 39 + 55 + 16 × 4 = 158 г/моль. Таким образом, в колбу добавлено 790 / 158 = 5 моль перманганата калия. Если мы добавим в колбу дистиллированную воду ровно до отметки 2 л, то получим раствор перманганата калия с концентрацией 2,5М или 2,5 моль/литр.
А теперь представим, что в колбу добавлено 360 г соляной кислоты. Один моль соляной кислоты имеет массу 36 г, следовательно, в колбу добавлено 10 моль вещества. Плотность хлористого водорода составляет 1,19 г/см³, следовательно, кислота занимает объем:
360 / 1,19 = 302,5 см³ или 0,3025 литра
Если добавим в колбу дистиллированную воду до отметки 2 литра, то получим раствор 5М. Но если заранее отмерить 2 литра воды и влить их в колбу, то молярная концентрация раствора изменится, так как теперь в колбе не 2 л раствора, а 2,3025 литра. Следовательно, молярная концентрация такого раствора составляет 10/2,3025 = 4,34 моль/литр.
Во избежание подобных казусов используется моляльная концентрация — количество растворенного вещества на 1 кг растворителя. Так как мы добавляли воду, то 2 л воды имеет массу 2 кг, следовательно, моляльная концентрация соляной кислоты составит 5м. В случае использования других растворителей (уайт-спирит, ацетон, скипидар) вначале потребовалось бы вычислить их массу по формуле:
m = V × p,
где p — плотность растворителя.
Если добавить еще больше растворителя, то молярная и моляльные концентрации снизятся.
Калькулятор разбавления растворов
Полученные выше растворы легко разбавлять при помощи растворителей или растворов меньшей концентрации. Разбавление происходит по простой формуле:
M1 × V1 = M2 × V2,
где M1 и V1 — концентрация и объем раствора до разбавления, а M2 и V2 — после разбавления.
Данная формула заложена в наш онлайн-калькулятор, при помощи которого легко рассчитать полученный раствор после разбавления и количество необходимого растворителя.
Пример из реальной жизни
Разбавление раствора
Пусть есть 2 литра раствора этанола с концентрацией 5М. Сколько нужно добавить дистиллированной воды, чтобы концентрация раствора снизилась до 1М? Итак, у нас есть все необходимые данные для расчета — их достаточно добавить в соответствующие ячейки калькулятора и получить ответ:
- Объем после разбавления (V2): 5,0000 L
- Объем добавленного растворителя (V): 3,0000 L
Заключение
Разбавление растворов — типичная задача не только в лаборатории, но и на кухне, в быту или профессиональной деятельности. Разбавлять концентрированные растворы веществ приходится поварам, аптекарям, уборщикам, автомобилистам, парфюмерам и представителям многих других профессий. Используйте наш калькулятор для проверки своих расчетов.
Онлайн калькулятор для расчета концентрации раствора после добавления растворителя.
Концентрация — величина, характеризующая количественный состав раствора.
В результате решения получаем однородную смесь двух или нескольких веществ, которые могут быть твердыми телами, жидкостью, газом или их комбинацией.Растворитель способен растворять другие вещества.
Формула:
Объем после разбавления (V2) = [(V1 * M1) / M2]
Объем добавленного растворителя во время разбавления (V) = (V2 — V1)
Где,
- V1 = объем раствора до разбавления
- V2 = объем раствора после разбавления
- M1 = Концентрация перед разбавлением
- М2 = концентрация после разбавления
×
Пожалуйста напишите с чем связна такая низкая оценка:
×
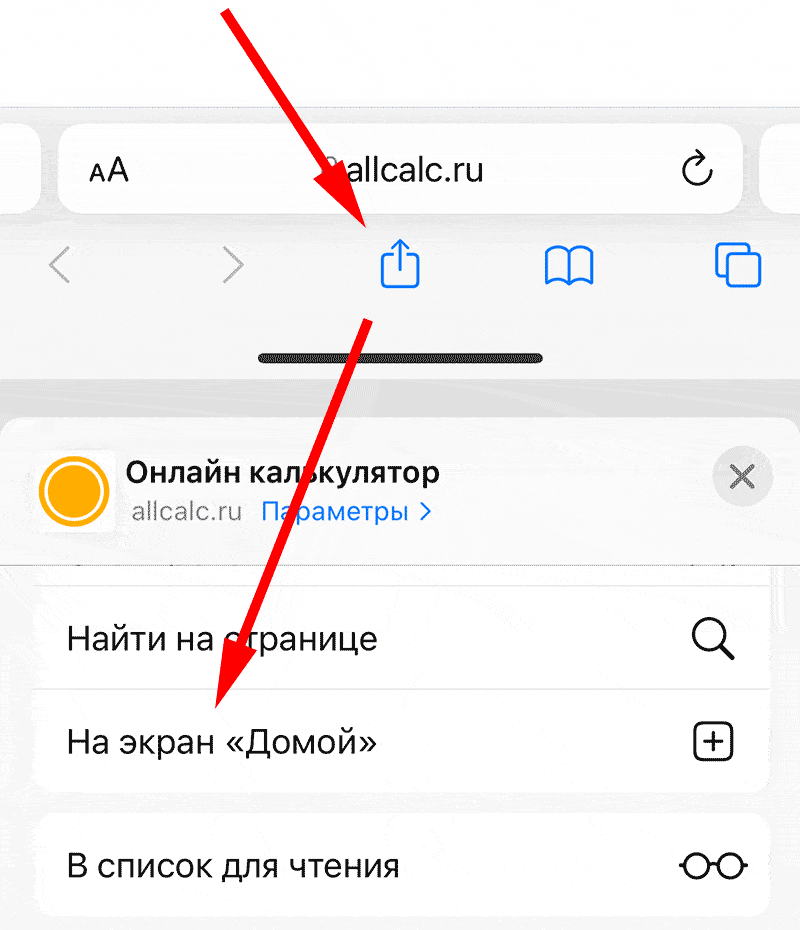
Для установки калькулятора на iPhone – просто добавьте страницу
«На главный экран»
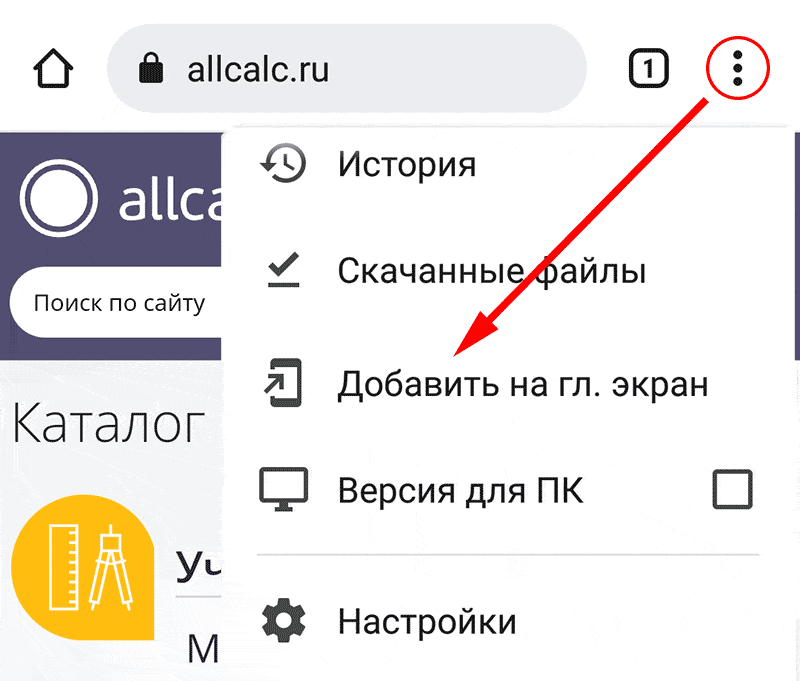
Для установки калькулятора на Android – просто добавьте страницу
«На главный экран»
Enter the volume or mass of both the solute and the solution into the calculator to determine the percent solution. This calculator can evaluate the amount of solute or solution if the other variables are known.
- Molar Concentration Calculator
- Percent Volume Calculator
- Molarity Dilution Calculator
- Percent Mixture Calculator
- Percent Solids In Slurry Calculator
Percent Solution Formula
The following formula is used to calculate a percent solution:
%S = Solute/Solution * 100
- Where %S is the percent solution by mass or volume
- The solute is the mass or volume of the solute
- The solution is the mass or volume of the solution
Note that the solute and solution measurements must be the same unit i.e. mass or volume.
To calculate the percent concentration of the solution, divide the solute mass or volume by the solution mass or volume, then multiply the result by 100.
Percent Solution Definition
A percent solution is defined as the total percentage of a solution in mass or volume that a solute takes up. In other words the ratio of solute to the solution of a mixture.
How to calculate a percent solution?
- First, determine the units you wish to use. For this example, we will look at the percent by mass.
- Next, determine the mass of the solute. For this example, the mass of the solute is 10g.
- Next, determine the mass of the solution. For this example, the mass of the solution is 100g.
- Finally, calculate the percent solution using the formula: 10g/100g * 100 = 10% of the solution by mass.
FAQ
What is a percent solution?
A percent solution is a measure of the ratio of mass or volume of a solute to the overall solution.
What does a 5 percent solution mean?
A 5 percent solution means that a solute makes up 5% of the total solution by either mass or volume.
What is the difference between a volume percent and mass percent?
A volume percent is a ratio of volumes of solute to the solution, while a mass percent is a ratio of mass. Typically they can be closer in value because the densities of the solute and solution are fairly close.


