Краткий обзор по методикам анализа белка в пищевых продуктах
В данном обзоре кратко описаны основные методы определения белка в пищевых продуктах. Указаны основные преимущества и недостатки имеющихся в настоящее время методик и оборудования. Данные обзор может быть полезен для специалистов пищевой промышленности и аналитических лабораторий на производстве продуктов питания. Для простоты восприятия текста при написании обзора авторы сознательно использовали упрощенную лексику и терминологию в описании химических процессов и молекулярной структуры соединений.
1. Введение
Белки (пептиды) представляют собой «полимеры» аминокислот. Белки состоят из двадцати различных аминокислот. Белки отличаются друг от друга в зависимости от типа, количества и последовательности аминокислот, составляющих основу полипептида. В результате они имеют разные молекулярные структуры и физико-химические свойства. Белки являются основными структурными компонентами многих натуральных продуктов, и зачастую определяют их общую текстуру, например, нежность мяса или рыбопродуктов. Изолированные белки часто добавляются в пищевые продукты в качестве ингредиентов, благодаря своим уникальным функциональным свойствам, т. е. их способностью обеспечить внешний вид, структуру или стабильность продукта. Белки нередко используются в процессах гелеобразования, как эмульгаторы, пенообразователи или загустители. Поэтому так важно иметь полную информацию о массовом содержании, типе, молекулярной структуре и функциональных свойствах белков входящих в состав пищевых продуктов.
2. Определение общей концентрации белка
2.1 Метод Кьельдаля
Метод Кьельдаля был разработан в 1883 году пивоваром Иоганном Кьельдалем. Сущность методики заключается в том, что образец продукта разлагается (сжигается) серной кислотой в присутствии катализатора, после чего полученный после разложения связанный в виде сульфата аммония азот может быть определен подходящей методикой титрования. Количество белка рассчитывается в зависимости от концентрации азота в продукте. В таком виде метод все еще используется и сегодня, хотя существует ряд усовершенствований для ускорения процесса и получения более точных данных. Данная методика считается арбитражным методом определения концентрации белка, например, в казеине. Поскольку метод Кьельдаля не измеряет содержание белка напрямую, необходим коэффициент преобразования (К), для перерасчета измеренной концентрации азота в концентрацию белка. Коэффициент 6,25 (что эквивалентно 0,16 г азота на грамм белка) используется для многих приложений, однако, это лишь среднее значение, и каждый белок имеет другой коэффициент преобразования в зависимости от его аминокислотного состава. Подробнее здесь
2.2. Общие принципы.
Метод Кьельдаля удобно разделить на три этапа: сжигание, нейтрализация и титрование.
Разложение. Образец анализируемой пробы взвешивается в специальную колбу, а затем разлагается при нагревании в присутствии серной кислоты (окислитель), безводного сульфата натрия (для ускорения реакции за счет повышения температуры кипения) и катализаторов, таких как медь, селен, титан, или ртуть. При разложении любого азота в продукте (кроме азота, который находится в виде нитратов или нитритов) образуется аммиак, который в растворе сильной серной связывается в ион аммония (NH 4 +) и, следовательно, остается в растворе. Общий вид реакции будет следующим:
N (food) ® (NH 4) 2 SO 4 (1) N (белков анализируемого продукта) ® (NH 4) 2 SO 4 (1)
Нейтрализация. После разложения содержимое колбы количественно переносят в специальную пробирку для отгонки, добавляют щелочь и отгоняют выделяющийся аммиак. Наиболее полно и гладко этот процесс проходит при использовании метода перегонки с паром. Общий вид реакции будет следующим:
(NH 4) 2 SO 4 + 2 NaOH ® 2NH 3 + 2H 2 O + Na 2 SO 4 (2) (2)
Газообразный аммиак, улавливается в отдельной колбе с избытком раствора бороной кислоты. Низкий рН раствора в колбе способствует переходу газообразного аммиака в ион аммония, и одновременно преобразует борную кислоту в борат ион: Общий вид реакции будет следующим:
NH 3 + H 3 BO 3 (борная кислота) ® NH 4 + + H 2 BO 3 – (Борат ионы) (3)
Титрование. Содержание азота рассчитывается по данным титрования. Борат ионы титруют серной или соляной кислотой, используя подходящий индикатор для определения конечной точки реакции.
H 2 BO 3 – + H + → H 3 BO 3 (4) H 2 BO 3 — + H + → H 3 BO 3 (4)
Концентрации ионов водорода (в молях), необходимое для достижения точки эквивалентности соответствует концентрации азота, в первоначальном образце (уравнение 3). Уравнение (5) может быть использовано для определения концентрации азота в образце, который весит м граммов и для титрования которого потрачено х М соляной кислоты:
(5) (5)
Где V S и V b объемы тирующей кислоты для образца и холостого опыта, 14g — молекулярная масса азота. Холостую пробу, как правило, используют, если требуется принять во внимание остаточный азот, который может содержаться в реагентах, используемых при проведении анализа. Как только содержание азота определено, можно рассчитать содержание белка с использованием соответствующего коэффициента преобразования:
Массовая доля белка = К * % N.
2.3. Преимущества и недостатки
Метод Кьельдаля широко используется в мире и до сих пор наравне со всеми другими методами. Его универсальность, высокая точность и хорошая воспроизводимость сделали его основным методом для оценки содержания белка в пищевых продуктах. Однако этот метод не отражает меру истинного белка, а определяет только общее содержание азота в образце, не выделяя небелковый азот. При этом в ряде случаев неучитывание при расчетах содержания небелкового азота может привести к критичным ошибкам при определении собственно белка. Более того, для различных белков требуются различные коэффициенты преобразования, вследствие отличия в аминокислотных последовательностях. Даже для различных белков одного продукта (например, молочных белков молока) коэффициент может отличаться значительно.
Использования концентрированной серной кислоты при высоких температурах также создает значительную опасность, как и использование некоторых дорогостоящих катализаторов. Кроме этого метод Кьельдаля трудоемок и требует значительного времени для его проведения. В настоящее время для снижения трудоемкости, времени и минимизации случайных ошибок разработаны системы различной степени автоматизации для выполнения всех описанных выше стадий анализа.
3. Метод Дюма
Разработанный и принятый не так давно метод Дюма предназначен для быстрого измерения концентрации белка в пробах продуктов питания. Этот метод впервые описан полтора века назад. Он начинает конкурировать с методом Кьельдаля как арбитражный метод анализа белков для некоторых продуктов питания в первую очередь из-за его оперативности.
3.1. Общие принципы
Образец известной массы сжигается при высокой температуре (около 900°С) в специальной ячейке в присутствии кислорода. Углекислый газ и вода удаляются путем пропускания газов через специальные колонки, которые поглощают их. Содержание азота измеряется путем передачи оставшегося после очистки газа на делительную колонку, на конце которой имеется детектор по теплопроводности. Дополнительно на колонке отделяется остаточной CO 2 и H 2 O. Прибор калибруется путем анализа материала, с известной концентрацией азота, например, ЭДТА (содержание азота 9,59%). После этого, сигнал с детектора по теплопроводности может быть преобразован в содержание азота. Как и для метода Кьельдаля необходимо преобразовывать концентрацию азота в образце, используя подходящие коэффициенты пересчета, которые зависят от точной аминокислотной последовательности белка.
3.2. Преимущества и недостатки
Основное преимущество — это скорость анализа, (по несколько минут на измерение, по сравнению с несколькими часами для Кьельдаля). Метод не требует токсичных химических веществ или катализаторов. Многие образцы могут быть измерены в автоматическом режиме. Метод прост в использовании.
Недостатки: Высокая начальная стоимость. Кроме того, метод также не дает меру истинного белка и для различных белков нужны различные поправочные коэффициенты. Небольшая масса и размер пробы затрудняет получение репрезентативной выборки.
4. Методы с использованием УФ-видимой спектроскопии
Для измерения концентрации белка существует ряд методов, основанных на УФ-видимой спектроскопии. Эти методы используют либо природные способности белков в поглощении (или рассеянии) света в УФ-видимой области электромагнитного спектра, либо предусматривает химическую или физическую модификацию белков, чтобы перевести их в форму, поглощающую (или рассеивающую) свет в этой области. Основные принципы любой из перечисленных ниже методик сходен. Прежде всего, при разработке методики следует выбрать химические группы, которые будут нести ответственность за поглощения или рассеяния излучения, например, пептидные связи, ароматические групп, основные группы для поглощения, для рассеивания — количество агрегированных белков. Далее создается градуировочная (калибровочная) зависимость поглощения (или мутности) от концентрации белка, для чего используются ряд белковых растворов с известной концентрацией. Абсорбцию (или мутность) анализируемой затем пробы определяется по построенной градуировочной зависимости.
Наиболее часто используемые УФ-методики для определения содержания белка в продуктах приводятся ниже:
4.1. Принципы
Прямые измерения при 280 нм. Триптофан и тирозин интенсивно поглощает ультрафиолетовый свет при 280 нм. Во многих белках содержание триптофана и тирозина, остается практически неизменным, так что их поглощения при 280 нм может быть использован для определения их концентрации. Преимущества этого метода в том, что процедура проста для выполнения, метод является неразрушающим, и никаких специальных реагентов не требуется. Основным недостатком является то, что нуклеиновые кислоты поглощают сильно при 280 нм и поэтому могут препятствовать измерению белка, если они присутствуют в достаточной концентрации. Для нивелирования этой проблемы были разработаны методы, в которых поглощение измеряется на двух различных длинах волн.
Биуретовый метод. При взаимодействии ионов меди (Cu 2 +) с пептидными связями в щелочных условиях продукт дает интенсивную фиолетово-пурпурную окраску. Биуретовый реагент, в готовой форме может быть приобретен как готовый реактив в специализированных магазинах. Его смешивают с белковым раствором, а затем выдерживают в течение 15−30 минут и определяют поглощение при 540 нм. Основным преимуществом этого метода это отсутствие помех от других соединений, которые поглощают на более низких волнах, и сама техника менее чувствительны к типу белка, поскольку она использует поглощения с участием пептидных связей, которые являются общими для всех белков, а не с отдельными его группами. Однако, метод имеет относительно низкую чувствительность по сравнению с другими УФ методами.
Метод Лоури. Метод Лоури объединяет биуретовый реагент с другим (реагент Фолина), последний реагирует с остатками тирозина и триптофа в белках. Это дает синеватый цвет, который поглощает в область между 500 — 750 нм в зависимости от того, какая требуется чувствительность. Существует небольшой пик поглощения около 500 нм, который может быть использован для определения высоких концентраций белка и интенсивный пик около 750 нм, который может быть использован для определения низких концентраций белка. Этот метод является более чувствительной к низкому содержанию белков, чем просто метод с биуретовым реактивом.
Методы со связыванием красителя (метод Брэдфорда) Сущность таких методов заключается в добавлении «отрицательно заряженного» красителя в раствор белка, рН которого регулируется так, чтобы белок находился в «положительно заряженной» области (т.е. меньше изоэлектрической точки). При этом белки образуют нерастворимый комплекс с красителем из-за электростатического притяжения между молекулами, а несвязанного краситель остается в растворе. Отрицательно заряженная часть красителя связывается с катионными группами основных аминокислот (гистидина, лизина и арганина) и любыми свободными аминогруппами. Количество несвязанного красителя, остающегося в растворе, после того как нерастворимый комплекс «белок-краситель» удаляется (например, центрифугированием) определяется при измерении его поглощения на соответствующей длине волны. Количество белка, которое присутствовало в исходном растворе пропорционально количеству красителя, добавленному первоначально и оставшемуся в растворе. (Для метода Бредфорда белки и их комплексы с красителем остаются в растворе, меняется интенсивность поглощения (визуально цвет) на анализируемой длине волны).
Турбометрический метод (рассеивание). Любые белковые молекулы, растворимые при обычных условия можно перевести в нерастворимую форму путем добавления определенных химических веществ, например, трихлоруксусной кислоты. Таким образом, концентрация белка может быть определено путем измерения степени мутности пропорциональной рассеиванию проходящего через раствор светового луча.
4.2. Преимущества и недостатки
Преимущества: УФ-видимой методы довольно быстро и просто выполнять, и они чувствительны к низкой концентрации белков.
Недостатки: Для большинства методов УФ-видимой спектроскопии необходимо использовать разбавленные и прозрачные растворы, которые не содержат загрязняющих веществ способных поглощать или рассеивать свет на выбранной для анализа длине волне. Необходимость прозрачного раствора означает, что большинство пищевых продуктов, должны пройти длительную пробоподготовку, прежде чем они будут пригодны для анализа, например, гомогенизация, экстракция, центрифугирование, фильтрация. Такая пробоподготовка может занять много времени и быть чрезвычайно трудоемкий. А иногда бывает невозможно количественно извлечь белки из определенных видов пищевых продуктов, особенно после того, как при обработке белки перешли в агрегированное состояние или образовали ковалентные связи с другими веществами. Кроме того, степень абсорбции зависит от типа анализируемого белка, которые могут отличаться в аминокислотных последовательностях.
5. Другие инструментальные методы
Существуют самые различные инструментальные методы для определения общего содержания белка в пищевых продуктах. Их можно разделить на три категории в соответствии с их физико-химическим принципом: (1) измерение объемных физических свойств, (2) измерения адсорбции излучения, и (3) измерение рассеяния излучения. Каждый инструментальных методов имеет свои преимущества и недостатки, и ассортимент объектов, на которые он может быть применен.
5.1. Принципы
Измерение физических свойств. Плотность: плотность белка больше, чем у большинства других компонентов пищи, таким образом, увеличение плотности пищи, напрямую связано с увеличением содержания белка. Следовательно, содержание белка в продукте может быть соотнесено с его плотностью. Показатель преломления: показатель преломления водных растворов увеличивается при увеличении концентрация белка, следовательно, результаты измерения этого показателя могут быть использованы для определения содержания белка.
Измерение адсорбции УФ-видимый: концентрация белков может быть определено путем измерения поглощения УФ-видимого излучения (подробнее описано выше).
ИК-ближняя и средняя область: Инфракрасные методы могут быть использованы для определения концентрации белков в пищевых продуктах. Белки поглощают в ИК-области за счет собственных молекулярных колебаний (растяжения и изгиба) определенных химических групп вдоль полипептидной цепочки. Таким образом, измеряя поглощение излучения на определенных длинах волн, можно рассчитать количественную концентрацию белка в образце. Он также не требует особой подготовки образца и является неразрушающим методом контроля. Его основные недостатки — высокая начальная стоимость и необходимость проведения комплексной и сложной калибровки.
Измерение рассеяния излучения. Рассеяние света: Концентрация белковых агрегатов в водных растворах может быть определена с помощью методов измерения рассеяния света, поскольку мутность раствора прямо пропорциональна концентрации белка. Ультразвуковое рассеяния: концентрация белковых агрегатов также может быть определена с помощью ультразвуковых методов рассеяния, поскольку скорость ультразвука и его поглощения связанны с концентрацией белка в растворе.
5.2. Преимущества и недостатки
Основные преимущества и недостатки инструментальных методов упоминалось выше. Также следует отметить, для всех этих методов должна существовать калибровочная кривая, которая с большой долей вероятности будет различной для различных типов белков и пищевых матриц, в которых они содержится. Как следствие все инструментальные методы наиболее корректно работают для анализа пищевых продуктов с относительно простыми композициями. Для продуктов питания, которые содержат множество различных компонентов, концентрация которых может варьироваться, определить вклад белка на фоне других компонентов зачастую бывает затруднительно.
6. Выбор метода
При анализе конкретного пищевого продукта обычно всегда возникает задача выбора конкретной методики для измерения концентрации белка в образце. Как решить, какой метод является наиболее подходящим? Первое, с чем нужно определиться это для каких целей будет проводиться анализ. Если анализ будет проводиться для сторонних организаций, с целью проведения сличений, или же для расчета за товар, следует пользоваться официально признанным арбитражным методом. Так Кьельдаль, и все чаще метод Дюма, были официально утверждены для широкого спектра пищевой промышленности. В противоположность этому, только небольшое число методом УФ спектроскопии были признаны официально. Но к примеру, для молока все чаще используется метод Брэдфорда, поскольку определение белка без одновременного определения и учета небелкового азота в молоке может привести к завышенным результатом с неприемлемой ошибкой.
Для целей контроля качества, часто более полезно иметь быстрый и простой метод измерения содержания белка и, следовательно, методы ИК-спектроскопии являются наиболее подходящими. В лабораториях где проводятся фундаментальные исследования, и где обычно работы выдуться с уже выделенными и очищенными образцами, методы с использованием УФ спектроскопии зачастую предпочтительнее, поскольку они дают быстрые и надежные измерения, и чувствительны к крайне низкой (до 0,001% масс.) концентрации белка.
Также следует учитывать и другие факторы, которые, возможно, придется рассматривать. В основном это:
- объем требуемой пробоподготовки
- требуемая чувствительность
- требуемая скорость проведения анализа
Методы Кьельдаля, Дюма, акустические и ИК методы, как правило, не требует специальной пробоподготовки, либо пробопоготовка автоматизирована в соответствующем блоке прибора. Во многих случаях после репрезентативной выборки объект анализируется непосредственно. В противоположность, различные методы УФ спектроскопии, как указано выше, требуют серьезной подготовки образца перед анализом. Белок должен быть сепарирован от образца, что обычно означает различные процедуры гомогенизации, экстракции, фильтрации и центрифугирования. Время, необходимое на анализ, и количество образцов, которые могут быть проанализирован одновременно, также являются важными факторами, которые следует учитывать при определении того, какая методика будет выбрана для анализа.
Другие заслуживающие упоминания факторы — это время амортизации оборудования, его начальная стоимость, наличие или отсутствие требуемого вспомогательного оборудования, стоимость расходных материалов и сроком их годности.
7. Цена вопроса
В заключении приведем ориентировочную стоимость постановки методики[1]:
|
Методика |
Примерная стоимость |
Примечания |
|
Метод Кьелдаля (ручной) |
От 20 000 руб. |
Без ОЛО |
|
Метод Кьелдаля (полуавтомат) |
От 200 000 руб. |
Без ОЛО |
|
Метод Кьелдаля (автомат) |
От 600 000 руб. |
|
|
Метод Дюма (автомат) |
От 100 000 руб. |
|
|
Метод ИК (БИК) (ручной [2]) |
От 400 000 руб. |
Без ОЛО |
|
Метод ИК (БИК) (автомат) |
От 1 200 000 руб. |
|
|
Метод УФ (ручной [3]) |
От 300 000 руб. |
Без ОЛО |
|
Метод УЗ (автомат) |
От 25 000 руб. |
|
|
Определение плотности |
От 5000 руб. |
Без ОЛО |
Дополнительно значительные суммы могут тратиться на проведение пусконаладочных работ, расходные материалы, доставку, обучение персонала, а также сертификацию и метрологическое обеспечение.
[1] Большинство автоматических анализаторов имеют специализированное применение.
[2] Указана стоимость собственно прибора. Калибровки выполняет пользователь, ручная пробоподготовка.
[3] Указана стоимость собственно прибора. Калибровки выполняет пользователь, ручная пробоподготовка.
Работа №4 ОПРЕДЕЛЕНИЕ
КОНЦЕНТРАЦИИ БЕЛКОВ МЕТОДОМ ЛОУРИ
1.Какими методами можно определить
концентрацию белка?
Концентрацию белка можно определить
оптическими методами, азотометрическим
и колориметрическим
методами.
К оптическим относят:
-спектрофотометрические методы,
оценивающие интенсивность поглощения
белками УФ лучей в диапазоне около 200
нм и 260 нм. Степень УФЛ – поглощения
пропорциональна концентрации белка;
-рефрактометрические методы основаны
на способности растворов белков
преломлять свет пропорционально их
концентрации;
-нефелометрические методы основаны на
способности растворов белков рассеивать
свет пропорционально их концентрации;
-поляриметрические методы основаны на
способности растворов белков вращать
плоскость поляризованного света
пропорционально их концентрации.
Азотометрический метод основан на
определении содержания азота и пересчёте
его на концентрацию белка (в белках 16%
азота).
К колориметрическому
методу относят качественную реакцию
на белки (биуретовая реакция), метод
Лоури, метод сорбции белками определенных
красителей. Интенсивность определяется
концентрацией белкового раствора.
Также разработаны другие методы,
например, флюориметрические,
поляриметрические, а также методы
атомно-абсорбционной спектрофотометрии
и аминокислотного анализа белка.
2.Что лежит в основе спектрофотометрического
определения концентрации белка?
В основе метода лежит способность
пептидных связей образовывать комплексные
соединения с солями меди. В щелочной
среде ионы Cu+2 образуют комплекс с
пептидными связями, переходя в Cu+.
Одновалентные ионы меди реагируют с
реактивом Фолина (фосфомолибденовая
кислота с фенолом), образуя нестабильный
продукт, переходящий в молибденовую
синь, с максимумом адсорбции при 750 нм.
Ответ не верен.
Спектрофотометрический метод основан
на способности ароматических аминокислот
(триптофана, тирозина и фенилаланина)
поглощать ультрафиолетовый свет со
средним максимумом поглощения при 280
нм. Таким образом, измерив величину
оптической плотности при этой длине
волны и используя коэффициент экстинкции
для данного белка, можно рассчитать его
количество. В ответе на следующий вопрос
Вы этот метод упомянули.
3.От чего зависит коэффициент экстинкции
белка?
Коэффициент молярной экстинкции является
характеристикой того, насколько сильно
вещество поглощает свет на заданной
длине волны. Он может быть использован
для определения концентрации белка в
растворе при помощи спектрофотометра.
Коэффициент экстинкции белка на длине
волны 280 нм зависит исключительно от
числа остатков ароматических аминокислот,
в частности, триптофана, и потому может
быть предсказан исходя из аминокислотной
последовательности.
4.Как учитываются примесные вещества
(соли и пр.) в растворителе?
Влияние мешающих веществ может быть
минимизировано путем разведения,
обеспечивающего концентрацию испытуемого
белка на уровне, достаточном для
проведения точных измерений. Для
освобождения от катехоламинов, дающих
окрашивание, белок осаждают трихлоруксусной
кислотой.
Для того, чтобы нивелировать
влияние не поглощающих в диапазоне
измерения примесей, используют кювету
сравнения, в которой присутствует
растворитель, но отсутствует белок.
Если используются колориметрические
методы, то в контрольный образец вносится
растворитель без белка в таком же объеме,
как и в опытные и калибровочные образцы
вносятся соответствующие растворы
белка. Величину поглощения в кювете
сравнения вычитают из величины поглощения
опытного образца. Если в измеряемом
растворе присутствуют детергенты
(мочевина, гуанидин), то от них избавляются
путем предварительного обессоливания
образцов (см вопрос 5). Некоторые
коммерческие наборы для определения
концентрации белка содержат дополнительные
добавки для нейтрализации небольших
количеств детергента.
5.Для чего проводится гель-фильтрация
перед определением концентрации белка,
полученного с помощью ионообменной
хроматографии в буферах, содержащих
мочевину?
Для определения белка методом Лоури
мешают примеси мочевины, меркаптоэтанола
и аминов. Для измерения концентрации
апобелков необходимо предварительно
перевести его в раствор, не содержащие
этих примесей с помощью гель-фильтрации
(обессоливания).
Практическое
задание.
1. Был построен калибровочный график
|
концентрация |
ОD750 |
|
0 |
0 |
|
0,015 |
0,003 |
|
0,0325 |
0,005 |
|
0,065 |
0,02 |
|
0,125 |
0,04 |
|
0,25 |
0,09 |
|
0,5 |
0,18 |
|
1 |
0,34 |
|
1,36 |
0,43 |
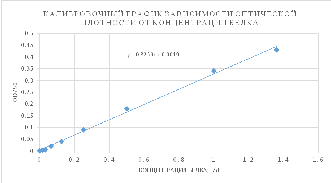
2. Исходя из уравнения (у=0,3259х+0,0019) была
рассчитана концентрация белка. Построен
график зависимости оптической плотности
от концентрации белка.
|
OD750 |
концентрация |
|
0,25 |
0,763385 |
|
0,013 |
0,034154 |
|
0,004 |
0,006462 |
|
0,1 |
0,301846 |

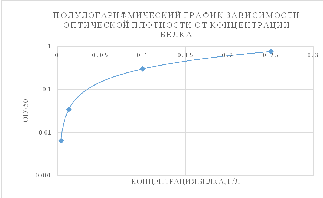
График по вычисленным
концентрациям белка строить было не
нужно. Либо построить его вместе с
калибровочным графикм, чтобы показать,
что кривые накладываются друг на друга
и расчет верный.
Х
И
М
И
Ч
Е
С
К
И
Е
НАУКИ
УДК 57
М.А. Матюшина ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВЕННОГО СОДЕРЖАНИЯ БЕЛКА
Определение содержания белка – важная часть любого исследования, которая связана с очисткой, выделением, характеристикой и анализом белка. Рассматриваемые мною методы в данной статье немного устарели и имеют многолетнюю историю, но несмотря на это широко используются в лабораторной практике и характеризуются рядом принципиальных моментов, которые необходимо учитывать при выборе того или иного метода, который позволит с высокой точностью определять содержание белка.
Ключевые слова: белок, определение содержания белка, метод Low-ry, метод Bradford.
У всех живых организмов белки – главнейшие работники, отвечающие за протекающие в клетке. Еще на ранних стадиях формирования биохимии и, тем более, по мере того, как исследователи научились выделять индивидуальные белки, определять их состав и структуру, выяснять, когда и как они синтезируются в клетках, определять, какие белки функционируют при разных условиях, сравнивать одинаковые белки из различных организмов, а также белки из клеток организмов дикого типа и мутантов и т.д., значение количественного определения содержания белка в исследуемом образце все возрастает.
Каждый метод, применяемый с целью определения белка в бесклеточных экстрактах, демонстрирует лишь общее содержание белка в образце. Чтобы получить представление о составе белков и их индивидуальных свойствах и функциях, необходимо фракционирование сложных протеиновых смесей посредством их хроматографического, либо электрофоретического разделения с целью дальнейшего анализа индивидуальных белков. Безусловно, при всех перечисленных ситуациях необходимо определять содержание белка. В настоящее время не существует какого-то одного конкретного метода определения белка, который удовлетворял бы одновременно все требования для количественного определения. У каждого метода есть свои плюсы и минусы.
Очевидно, что знание точной концентрации белка абсолютно необходимо для расчета, например, ферментативной активности. Погрешности в измерении концентрации белка приводят к накоплению общих ошибок в расчетах.
Рассмотрим наиболее часто и широко используемые методы определения белка: метод Lowry и метод Bradford. Помимо того, включена информация о некоторых приемах, использование которых по-
© Матюшина М.А., 2018.
Вестник магистратуры. 2018. № 5-4(80)
ISSN 2223-4047
могает преодолеть ограничения, инициированные либо несовместимостью буферов с выбранным методом определения белка, либо невысоким содержанием белка в исследуемом образце.
Выбор метода определения белка
Одним из наиболее важным фактором при определении концентрации белка является выбор совместимого с анализируемым образцом метода. Так как все описанные ниже методы базируются на специфических свойствах белков, то и структура белкового образца, и состав буфера являются основными определяющими пригодности метода.
Состав белкового образца является решающим при выборе метода. Если в пробе доминирут белки, обогащенные аминокислотными остатками аргинина, то в данном случаепри определении по Bradford результаты будут завышены, в то время как при использовании методов Lowry получаются наболее точные результаты. Пробы c цистеинбогатыми белками будут давать результаты близкие к истинным как при использовании метода Lowry, так и при использовании метода Bradford. В целом, если следует определить содержание белка в сложных белковых смесях, то предпочтительней использовать метод Lowry.
Состав буфера также очень важен. Метод Lowry высокочувствителен к такому часто используемому компоненту буферной смеси, как ЭДТА, которая мешает образованию хромофора. Метод Bradford не подходит для высоких концентраций детергентов, но вполне употребим для использования в присутствии восстановителей, таких как ДТТ или 2-меркаптоэтанол.
Калибровочный график
Как правило, для построения калибровочного графика используется один стандартный белок, и очень принципиально подобрать его верно. Если стандартный белок выбран неудачно, то это может привести к существенным погрешностям (как в сторону завышения, так и занижения) в расчетах абсолютного содержания белка. Однако это никак не помешает проводить сравнительные исследования содержания белков в разных образцах. Наиболее популярными стандартами являются бычий сывороточный альбумин (БСА) и овальбумин, хотя у них есть некоторые ограничения, которые необходимо принимать во внимание при проведении исследований. Если для определения используется кит, в составе которого имеется раствор стандартного белка (чаще всего, БСА) с известной концентрацией, собственно его и необходимо использовать для построения калибровочного графика.
Градуировочный график не обязательно должен быть линейным. Интервал концентраций белка для калибровки зависит от выбранного метода. Например, метод Bradford довольно чувствительный, но градуировочный график имеет линейный участок в достаточно узком интервале концентраций белка. В идеале градуировочный график необходимо строить в каждом опыте, что дает возможность добиться более точных результатов. Особенно это касается метода Lowry, развитие окраски в котором не терминируется. При использовании метода Bradford могут наблюдаться существенные сдвиги калибровочных кривых, поэтому рекомендуется хотя бы периодически строить градуировочные графики.
МЕТОД LOWRY
Этот метод основан на двух различных реакциях. Первая реакция образованиие комплекса катионов меди с амидными связями, с последующим восстановлением меди в щелочных условиях. Получаемый продукт – биуретовый хромофором. Вторая реакция – восстановление реагента Folin-Ciocateu комплексом восстановленной меди с амидными связями, а также аминокислотными остатками тирозина и триптофана. Реагент Folin-Ciocalteu в восстановленном виде имеет синий цвет, поэтому детектируется спектрофотометрически в диапазоне длин волн 500-750 нм. Сама по себе биуретова реакция не очень чувствительна. Использование реагента Folin-Ciocalteu повышает чувствительность метода почти в 100 раз.
Метод относительно чувствительный, но требует больше времени, чем другие, и чувствителен ко многим соединениям. Корректному определению мешают: детергенты, углеводы, глицерин, трицин, ЭДТА, Трис, соли калия, сульфгидрильные соединения, дисульфиды, фенолы, гуанин, ксантин, магний и кальций. Многие из этих веществ используются в буферах для гомогенизации или подготовки белковых проб. Это является одним из основных ограничений этого метода.
Также метод Lowry чувствителен к изменениям в содержании аминокислотных остатков тирозина и триптофана. Линейность калибровочного графика при использовании БСА в качестве стандарта наблюдается до концентрации белка в пределах 1500-2000 мкг/мл. Хотя спектр поглощения окрашенного продукта реакции приходится на 500-750 нм, обычно используют длину волны 660 нм. Другие длины волн также могут использоваться, и это позволяет уменьшить эффект от “загрязнения” пробы посторонними веществами.
МЕТОД BRADFORD
Это простой, быстрый, недорогой и чувствительный метод определения содержания белка, вследствие чего он является одним из наиболее популярных. Его основное достоинство – чувствительность; метод позволяет надежно определять от 10 до 100 мкг/мл белка. Метод основан на прямом связывании
Кумасси G-250 с аминокислотными остатками аргинина, триптофана, тирозина, гистидина и фенилала-нина в белке, причем с аргинином связывается в восемь раз чаще, чем с другими аминокислотными остатками. Поэтому, если известно, что белок обогащен остатками аргинина (например, гистоны), то в качестве стандарта необходимо также использовать аргинин – богатый белок. Комплекс Кумасси-аргинин имеет максимум поглощения при 595 нм, тогда как сам краситель в растворе – при 470 нм. Спектры поглощения комплекса и чистого красителя перекрываются, поэтому очень важно следить за соотношением объемов красителя и белка, так как их неконтролируемое изменение будет приводить к ошибкам измерения. Если по какой-то причине метод Bradford используется для определения белка в широком диапазоне концентраций (до 1500 мкг/мл), то очевидно, что калибровочный график не будет линейным. Однако им можно пользоваться, если “разбить” его на линейные отрезки с целью получения линейного уравнения для каждого линейного участка. Далее полученные уравнения можно будет применять при расчетах. Другой, вероятно, наиболее важный аспект, возникающий при использовании метода – это возможное взаимодействие компонентов буфера образца с красителем. Необходимо проверять реакцию буферной смеси, в которой находится белок, на взаимодействие с красителем.
Следует отметить, что для измерения лучше использовать стеклянные кюветы, так как на стенках кварцевых и, тем более, пластиковых кювет адсорбируется значительное количество красителя.
Приложение
Метод Lowry
Реактив Folin-Ciocalteu. 100 г вольфрамата натрия, 25 мг молибдата натрия, 700 мл воды, 50 мл 85% фосфорной кислоты и 100 мл соляной кислоты кипятить 10 ч с обратным холодильником. Добавить 150 г сульфата лития, 50 мл воды и 3-4 капли бромной воды, кипятить в течение 15 мин. После охлаждения разбавить водой до 1 л, профильтровать. Как видно, готовить реактив самим очень трудоемко. Дешевле и надежней купить готовый реактиву фирмы “Sigma” .
Реактив Lowry. 2% Na2CO3 (раствор 1), 2% K-Na тартрат (или 2% Na цитрат) (раствор 2), 1% CuSO4 (раствор 3). Все эти растворы можно хранить при комнатной температуре. Непосредственно перед определением приготовить рабочий раствор, для чего смешать 98 мл раствора 1, 1 мл раствора 2 и 1 мл раствора 3.
Протокол (время проведения 1.5-2.0 ч). К 100 мкл раствора белка в 0.5 M NaOH добавить 500 мкл свежеприготовленного реактива Lowry, инкубировать 10 мин, затем добавить 100 мкл разбавленного реактива Folin-Ciocalteu (разбавить исходный реактив дистиллированной водой в соотношении 1 : 1), инкубировать 1 ч в темноте. Измерить оптическую плотность полученного раствора при 750 нм.
Поскольку при этом реакция никак не останавливается, то следует помнить, что каждые 10 мин оптическая плотность будет увеличиваться. Поэтому необходимо контролировать время, прошедшее до спектрофотометрии.
Метод Bradford
Реагент: 0.5 мг/мл Кумасси (Coomassie Blue Brilliant) G-250, 25% метанол (этанол) и 42.5% H3PO4. Реагент стабилен в темноте при 4°C. Для приготовления рабочего раствора реагент разбавить в пять раз. Разбавленный рабочий раствор стабилен в течение недели в темноте при 4°C.
Хотя приготовить рабочий раствор не составляет большого труда, но его можно купить у фирмы “Sigma” .
Описание анализа. К 50 мкл раствора белка добавить 450 мкл рабочего раствора, перемешать, инкубировать при комнатной температуре 5 мин, измерить оптическую плотность полученного раствора при 595 нм.
МАТЮШИНА МАРИЯ АЛЕКСЕЕВНА – магистрант, РГУ им. С.А. Есенина, Россия.
Лабораторная работа №7
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ БЕЛКА МЕТОДОМ ЛОУРИ
Принцип метод. Метод основан на образовании окрашенных продуктов ароматических аминокислот с реактивом Фолина в сочетании с биуретовой реакцией на пептидные связи. Метод характеризуется высокой чувствительностью (10 — 100 мкг белка в пробе). Ha развитие окраски влияет большое количество веществ: компоненты буферных систем (трис-буфер в концентрации0,2 мМ, глицилглицин), восстановители (цистеин, дитиотреитол в концентрации 0,01 —0,4 мМ, аскорбиновая кислота), комплексоны (ЭДТА в концентрации0,5 мМ), детергенты (тритон X100 в концентрации 0,1 — 0,2 % вызывает выпадение осадка), сернокислый аммоний в концентрации 0,15 %, сахароза в концентрации 10 % и др. В связи с этим при построении калибровочного графика для определения белка по методу Лоури в растворитель для стандартного белка необходимо включать все компоненты, содержащиеся в анализируемых пробах. B некоторых случаях целесообразно предварительное осаждение белков из растворов, например трихлоруксусной кислотой, с последующим растворением их в щелочных растворах, или очистка белковых растворов от низкомолекуляриых компонентов путем диализа или гель-фильтрации на сефадексе G-25.
Интенсивность окраски комплекса, которая пропорциональна количеству белка в исследуемой пробе, измеряется спектрофотометрически.
Для исключения случайных ошибок, которые могут возникать в процессе измерения, рекомендуется не ограничиваться одним измерением (готовят 2 ряда пробирок)
При определении концентрации вещества в растворе следует соблюдать следующую последовательность в работе:
а) построение калибровочной кривой для данного вещества;
б) измерение оптической плотности исследуемого раствора и определение концентрации вещества в растворе по калибровочной кривой.
Реактивы:
Реактив №1: 2 %-й раствор Na2CO3 в 0,1 н. растворе NaOH.
Реактив №2: 0,5 %-й раствор CuSO4 * 5H2O в 1%-м цитрате натрия.
Реактив №3 готовится непосредственно перед работой: 15 мл реактива I + 0,3 мл реактива №2.
Реактив №4 Реактив Фолина — Чокальтеу: 10 гNa2Wo4*2H2O (перекристаллизованный) и 2,5 г Na2MoO4*2H20 помещают в круглодонную колбу на 200 — 250 мл, приливают 70 мл воды и хорошо перемешивают. K полученному раствору добавляют 5 мл 85 %-го раствора фосфорной кислоты и 10 мл концентрированной HCl (x.ч.). Колбу присоединяют к обратному холодильнику (на шлифе), ставят на сетку и кипятят в течение 10 ч. Затем в раствор добавляют 15 г Li2SO4, 5 мл воды и одну каплю брома. Раствор перемешивают и нагревают для удаления брома. После охлаждения доводят водой до 100 мл, фильтруют и разводят водой с таким расчетом, чтобы получился 1 н раствор кислоты (т.е. приблизительно вдвое). Кислотность определяют титрованием разведенного в 10 раз реактива 0,1 н. щелочью в присутствии фенолфталеина. Реактив может храниться в темной склянке длительное время.
Реактив №5: стандартный раствор белка, содержащий 0,25 мг в 1 мл раствора.
Реактив №6: раствор белка концентрации Х.
Оборудование: пробирки; кюветы, спектрофотометр.
Ход работы
Используя стандартный раствор белка и дистиллированную воду в 4 пробирках готовят растворы белка различной концентрации. Пятая проба не содержит белка и служит контролем на реактивы. В шестую пробирку помещают 0,4 мл р-ра белка неизвестной концентрации-Х (см. таблицу).
|
№ пробы |
Концентра- ция белка, мг/мл |
Объем стандартного раствора белка, мл |
Объем дистиллированной воды, мл |
Общий объем исследуемой пробы , мл |
|
1 |
0,063 |
0,1 |
0,3 |
0,4 |
|
2 |
0,120 |
0,2 |
0,2 |
0,4 |
|
3 |
0,183 |
0,3 |
0,1 |
0,4 |
|
4 |
0,250 |
0,4 |
0 |
0,4 |
|
5(К) |
0 |
0 |
0,4 |
0,4 |
|
6(Х) |
х |
0,4(мг х) |
0 |
0,4 |
Во все пробирки добавляем по 2 мл реактива №3, смесь тщательно перемешивают. Через 10 мин добавляют 0,2 мл реактива №4 Фолина — Чокальтеу. Реакционную смесь перемешивают и оставляют при комнатной температуре на 30 мин.
Интенсивность развившейся окраски измеряют спектрофотометрически (при длине волны 750 или 500 нм) Построение калибровочной кривой производят следующим образом. Измеряют оптические плотности каждого из этих растворов и строят график (калибровочную кривую), откладывая по горизонтальной оси (ось абсцисс) известные концентрации, а по вертикальной оси (ось ординат) —соответствующие им значения оптической плотности.
Пользуясь калибровочной кривой, определяют неизвестную концентрацию белка в исследуемом растворе, соответствующую измеренному значению оптической плотности.
B случае предварительного осаждения белка к исследуемому раствору добавляют CCl3COOH из такого расчета, чтобы конечная концентрация ее была равна 3 — 4 %. Раствор тщательно перемешивают и оставляют на 10—20 мин. Выпавший осадок белка отделяют центрифугированием и промывают 2%-ным раствором CCl3COOH. K осадку добавляют 1 — 2 мл 1 н. раствора щелочи и осторожно подогревают до растворения осадка белка. Раствор белка количественно переносят в мерную колбу на 25 — 50 мл, доводят водой до метки, тщательно перемешивают и проводят определение белка.
Спектрофотометрический метод
Метод основан на способности ароматических аминокислот (триптофана, тирозина и в меньшей степени фенилаланина) поглощать ультрафиолетовый свет с максимумом при 280 нм. Измеряя величину оптической плотности при этой длине волны, находят количество белка в растворе. Поскольку белки отличаются по содержанию ароматических аминокислот, их поглощение в ультрафиолетовой области спектра может сильно различаться. Условно считают, что при концентрации «усредненного» белка в растворе, равной 1 мг/мл, величина оптической плотности при 280 нм равна 1,0 (при толщине слоя жидкости в1 см).
Определению белка данным методом мешает присутствие нуклеиновых кислот и нуклеотидов.
Реактивы: растворы сывороточного альбумина, яичного альбумина концентрация белка 1 мг/мл.
Оборудование: пробирки; кюветы, спектрофотометр.
Ход работы
Измеряя оптическую плотность раствора при 260 нм (для учета поглощения соединений нуклеотидной природы) и 280 нм (в качестве кюветы сравнения используют кювету с дистиллированной водой), содержание белка рассчитывают с помощью номограммы: экспериментально полученные величины оптической плотности при 260 и 280 нм находят в соответствующих столбцах номограммы и соединяют их прямой линией; точка пересечения этой прямой со шкалой, на которой дана концентрация белка, определяет содержание белка в исследуемом растворе.
Содержание белка можно найти по формуле Калькара на основе данных определения оптической плотности при 280 и 260 нм:
Содержание белка =1,45 •λ 280—0,74 • λ 260 (мг/мл).
Рис. 1. Номограмма для определения белка

Определение белка (ОФС.1.2.3.0012.15)
Государственная фармакопея 13 издание (ГФ XIII)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ст. ГФ XII, ч.1, ОФС 42-0053-07
Определение содержания белка проводят в лекарственных средствах, выделенных из природных источников или полученных биотехнологическими методами.
Для таких лекарственных средств могут использоваться модифицированные методики определения белка, указанные в фармакопейных статьях, в которых могут быть изменены рекомендуемые области концентраций белка и/или объемы испытуемого раствора и реактивов и некоторые другие условия в соответствии с индивидуальными свойствами определяемого компонента.
Колориметрические и некоторые спектрофотометрические методы требуют использования стандартного образца. В качестве стандартного образца белка используют: стандартный образец присутствующего в препарате белка, или бычий сывороточный альбумин, или сывороточный альбумин человека, высушенные перед испытанием до постоянной массы (стандартный образец и условия высушивания указывают в фармакопейной статье).
Для количественного определения белка используют спектрофотометрические, колориметрические и спектрофлуориметрические методы.
Метод 1 (Спектрофотометрический). Определение белка
Метод основан на способности ароматических аминокислот (тирозина, триптофана и, в меньшей степени, фенилаланина), входящих в последовательность молекулы белка, поглощать ультрафиолетовый свет при длине волны около 280 нм.
Для растворения молекул белка используют различные растворители: воду, натрия хлорид раствор 0,9 %, различные буферные растворы и др.
При использовании буферного раствора для растворения молекул белка, имеющего высокое значение оптической плотности по отношению к воде, свидетельствует о присутствии в белковой молекуле интерферирующего вещества. Для устранения влияния интерферирующего вещества на результаты анализа следует использовать в качестве раствора сравнения вместо воды буферный раствор. Если интерферирующие вещества имеют высокую оптическую плотность, результаты анализа могут быть подвергнуты сомнению.
При низких концентрациях белок адсорбируется на стенках кюветы, что может приводить к заниженным результатам содержания белка в растворе. В этом случае испытуемый раствор препарата предварительно концентрируют или используют при приготовлении испытуемого раствора неионные детергенты.
Испытуемый раствор. Готовят раствор испытуемого вещества в буферном растворе, указанном в фармакопейной статье, с концентрацией белка от 0,2 мг/мл до 2,0 мг/мл.
Стандартный раствор. Готовят раствор соответствующего стандартного образца в том же буферном растворе и с той же концентрацией белка, что и в испытуемом растворе.
Методика. Испытуемый раствор, стандартный раствор и раствор сравнения выдерживают при одинаковой температуре. Температуру и время инкубации указывают в фармакопейной статье. Определяют оптические плотности испытуемого и стандартного растворов в кварцевых кюветах при длине волны 280 нм, используя тот же буферный раствор в качестве раствора сравнения.
Для получения достоверных и точных результатов значения оптической плотности растворов должны удовлетворять требованиям линейности в интервале определяемых концентраций белка.
Для высокоочищенных белков концентрацию белка в растворе вычисляют с использованием удельного показателя поглощения.
Рассеяние света. Точность определения содержания белка в ультрафиолетовой области снижается, если белки в растворе существуют в виде частиц, сравнимых по размеру с длиной волны измеряемого света (250 – 300 нм). Рассеяние светового потока приводит к увеличению оптической плотности испытуемого раствора. При расчете оптической плотности испытуемого раствора при длине волны 280 нм, обусловленной рассеянием света, определение проводят при длинах волн 320 нм, 325 нм, 330 нм, 335 нм, 340 нм и 350 нм. Строят график зависимости десятичного логарифма (lg) оптической плотности от lg соответствующей длины волны. Экстраполируют кривую методом линейной регрессии для определения логарифма оптической плотности при длине волны 280 нм. Антилогарифм этого значения соответствует оптической плотности за счет рассеяния света. Для расчета истинного содержания белка в испытуемом растворе оптическую плотность раствора, полученную при 280 нм, корректируют, вычитая оптическую плотность, относящуюся к рассеянному свету.
Снизить эффект рассеянного света в опалесцирующих растворах можно фильтрованием через фильтр с размером пор 0,2 мкм, не адсорбирующим белок, или центрифугированием. Условия фильтрования и центрифугирования указывают в фармакопейной статье.
Расчеты. Концентрацию белка в испытуемом растворе (С) в мг/мл вычисляют по формуле:
С = С0 ∙ А/А0,
где
С0 — концентрация белка в растворе стандартного образца, в мг/мл;
А и А0 – скорректированные значения оптической плотности испытуемого раствора и раствора стандартного образца соответственно.
Метод 2 (Метод Лоури, колориметрический). Определение белка
Метод основан на реакции белков с солями меди (II) в щелочном растворе и восстановлении фосфорномолибдено-вольфрамового реактива (реактив Фолина) с образованием окрашенных продуктов, интенсивность окраски которых определяют по оптической плотности при длине волны 750 нм. Реактив Фолина взаимодействует с остатками ароматических аминокислот белка, главным образом тирозина, а также триптофана и фенилаланина и, в меньшей степени, цистеина. Развитие окраски достигает максимума через 20 – 30 мин при комнатной температуре, в дальнейшем идет уменьшение ее интенсивности. Степень окрашивания зависит от природы белка. Поскольку различные виды белков могут давать цветные реакции различной интенсивности, испытуемый белок должен соответствовать стандартному образцу.
Определению мешают некоторые соли, тиоловые соединения, углеводы, липиды, неионные детергенты, органические растворители, комплексоны и некоторые другие соединения. Большинство мешающих веществ дает слабое окрашивание, однако применение некоторых детергентов приводит к значительному увеличению окраски. Высокая концентрация соли может являться причиной образования осадка. Для уменьшения влияния веществ, мешающих определению, проводят дополнительное разведение раствора, обеспечивающее концентрацию испытуемого белка на уровне, достаточном для проведения точных измерений, или осаждение белков растворами натрия дезоксихолата и трихлоруксусной кислоты.
Стандартные растворы. Растворяют соответствующий стандартный образец белка в буферном растворе, указанном в фармакопейной статье. Части полученного раствора разводят в том же буферном растворе для получения не менее чем пяти стандартных растворов, имеющих концентрации белка, равномерно распределенные в интервале между 5 мкг/мл и 100 мкг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в буферном растворе, указанном в фармакопейной статье, с концентрацией белка, находящейся в пределах интервала концентраций калибровочного графика.
Контрольный раствор. Используют буферный раствор, применяемый для приготовления стандартных и испытуемого растворов.
Метод А (без предварительного осаждения белка).
К 1,0 мл каждого из стандартных растворов, испытуемого раствора и к 1,0 мл контрольного раствора, прибавляют по 5,0 мл реактива В. Содержимое пробирок перемешивают и оставляют на 10 — 30 мин при комнатной температуре. Затем в каждую пробирку прибавляют 0,5 мл реактива Фолина, разбавленного перед употреблением водой в 2 раза, быстро и тщательно перемешивают и оставляют на 30 мин при комнатной температуре. Измеряют оптическую плотность испытуемого и стандартных растворов на спектрофотометре при длине волны 750 нм (или указанной в фармакопейной статье), используя контрольный раствор в качестве раствора сравнения. Окраска остается стабильной в течение 2 часов. Допускается использование коммерческого реактива Фолина-Чокалтеу.
Зависимость оптической плотности от концентрации белка носит нелинейный характер, тем не менее, если интервал концентраций, используемых для построения калибровочного графика, небольшой, то она приближается к линейной. Строят зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Калибровочный график строят каждый раз при приготовлении новых реактивов или использовании другого спектрофотометра, но не реже 1 раза в 3 мес.
Примечания:
- Приготовление реактива А. В мерную колбу вместимостью 100 мл помещают 2 г натрия карбоната, растворяют в 0,1 М растворе натрия гидроксида и доводят объем до метки этим же раствором, перемешивают.
Срок годности раствора 1 мес.
- Приготовление реактива Б. В мерную колбу вместимостью 100 мл помещают 0,5 г меди сульфата, 1 г калия-натрия тартрата, растворяют в воде и доводят до метки.
Срок годности раствора: 2 мес.
- Приготовление реактива В. Перед анализом смешивают 50,0 мл реактива А и 1,0 мл реактива Б.
Метод Б (с натрия додецилсульфатом).
Определение проводят, как описано в методе А, но вместо 5 мл реактива В к растворам прибавляют по 1 мл щелочного реактива меди и по 0,5 мл разведенного реактива Фолина.
Примечания:
- Приготовление сульфатного реактива меди. В мерной колбе вместимостью 100 мл растворяют в воде 0,2 г меди сульфата и 0,4 г натрия тартрата, доводят объем раствора водой до метки и перемешивают. В мерной колбе вместимостью 100 мл растворяют в воде 10 г натрия карбоната, доводят объем раствора водой до метки и перемешивают. Медленно приливают раствор натрия карбоната к раствору меди сульфата при перемешивании. Раствор используют в течение 24 часов.
- Приготовление щелочного реактива меди. 1 объем полученного раствора сульфатного реактива меди смешивают с 2 объемами 5 % раствора натрия додецилсульфата (50 г/л) и 1 объемом 3,2 % раствора натрия гидроксида
(32 г/л).
Срок годности раствора: 2 недели при комнатной температуре.
- Приготовление разведенного реактива Фолина. Смешивают 5 мл реактива Фолина с 55 мл воды.
Раствор хранят в банках темного стекла при комнатной температуре.
Метод В (с предварительным осаждением белка).
Методика. К 1,0 мл испытуемого раствора прибавляют 0,1 мл раствора натрия дезоксихолата. Раствор перемешивают на вихревой мешалке и выдерживают при комнатной температуре в течение 10 мин. Прибавляют 0,1 мл 72 % раствора трихлоруксусной кислоты и перемешивают на вихревой мешалке. Осадок отделяют центрифугированием в течение 30 мин при 3000 g. Осторожно удаляют надосадочную жидкость, оставшийся осадок растворяют в 1 мл щелочного реактива меди. Далее поступают, как описано выше в методе Б.
При построении калибровочного графика стандартные растворы белка следует обрабатывать аналогичным способом.
В качестве раствора сравнения используют пробу, содержащую 0,1 мл 0,1 М раствора натрия гидроксида, 0,9 мл воды, 5,0 мл реактива В и 0,5 мл разбавленного в 2 раза реактива Фолина.
Примечания:
- Приготовление 0,15 % раствора натрия дезоксихолата. В мерную колбу вместимостью 100 мл помещают 0,15 г натрия дезоксихолата и растворяют в воде. Объем раствора доводят до метки водой и тщательно перемешивают.
- Приготовление 72 % раствора трихлоруксусной кислоты. В мерную колбу вместимостью 500 мл помещают 360 г трихлоруксусной кислоты и растворяют в воде. Объем раствора доводят до метки водой и тщательно перемешивают.
Срок годности 72 % раствора трихлоруксусной кислоты 1 мес.
Метод 3 (Метод Бредфорд, колориметрический). Определение белка
Данный метод основан на смещении максимума поглощения оптической плотности красителя кислотного синего 90 (Кумасси бриллиантовый синий R-250) от 470 нм до 595 нм, наблюдаемой вследствие связывания белка с красителем. Краситель наиболее активно связывается с остатками аргинина и лизина белка, что может приводить к погрешности при количественном определении различных видов белков. Белок, используемый в качестве стандартного образца, должен быть таким же, как испытуемый белок.
Существует относительно небольшое влияние интерферирующих веществ, которого можно избежать, не используя детергенты и амфолиты в испытуемом образце. Сильнощелочные образцы могут взаимодействовать с кислотным реактивом.
Стандартные растворы. Растворяют соответствующий стандартный образец белка в буферном растворе, указанном в фармакопейной статье. Части полученного раствора разводят в том же буферном растворе для получения не менее чем пяти стандартных растворов, имеющих концентрации белка, равномерно распределенные в интервале между 0,1 мг/мл и 1 мг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в буферном растворе, указанном в фармакопейной статье, с концентрацией белка, находящейся в пределах интервала концентраций калибровочного графика.
Контрольный раствор. Используют буферный раствор, применяемый для приготовления стандартных и испытуемого растворов.
Методика. Прибавляют 5 мл реактива Бредфорд к 0,1 мл каждого стандартного раствора, испытуемого раствора и контрольного раствора. Тщательно перемешивают, переворачивая. Избегают образование пены, приводящей к плохой воспроизводимости. Выдерживают при комнатной температуре в течение 10 мин и измеряют оптические плотности стандартных растворов и испытуемого раствором на спектрофотометре при длине волны 595 нм, используя контрольный раствор в качестве раствора сравнения, содержащего растворитель и реактив Бредфорд. При определении не следует использовать кварцевые спектрофотометрические кюветы, поскольку краситель связывается с этими материалами. Окраска остается стабильной в течение 1 ч.
Зависимость оптической плотности от концентрации белка носит нелинейный характер, тем не менее, если интервал концентраций, используемых для построения калибровочного графика, небольшой, то она приближается к линейной. Строят зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
В нормативных документах допускается изменение объемов испытуемого раствора и реактива Бредфорд при соблюдении линейной зависимости оптической плотности от концентрации белка при построении калибровочного графика.
Калибровочный график строят каждый раз при приготовлении новых реактивов или использовании другого спектрофотометра, но не реже 1 раза в 3 мес.
Примечание:
Приготовление реактива Бредфорд. В мерную колбу вместимостью 500 мл помещают 0,05 г кислотного синего 90 (Кумасси бриллиантовый синий R-250), растворяют в 25 мл спирта 96%, прибавляют 50 мл фосфорной кислоты концентрированной, доводят объем раствора водой до метки и тщательно перемешивают. Фильтруют и хранят в банках темного стекла при комнатной температуре. Если при хранении выпадает осадок красителя, перед использованием реактив необходимо профильтровать.
Срок годности 2 недели.
Метод 4 (Метод с бицинхониновой кислотой, колориметрический). Определение белка
Метод основан на восстановлении ионов меди Cu2+ до ионов меди Cu1+ при взаимодействии с остатками цистеина, цистина, триптофана, тирозина, пептидной связью белка и образовании окрашенного комплекса Cu+ с бицинхониновой кислотой (2,2’-бихинолин-4,4’-дикарбоновая кислота). Определению мешают восстанавливающие вещества: сахара, аскорбиновая кислота, тиоловые соединения, этилендиаминтетраацетат. Влияние мешающих веществ может быть минимизировано путем разведения, обеспечивающего концентрацию белка на уровне, достаточном для проведения точных измерений. В качестве альтернативы можно использовать методику осаждения белка, описанную в определении белка по методу Лоури. Поскольку интенсивность окраски образующегося комплекса зависит от природы белка, белок стандартного образца должен быть тот же, что и в испытуемом образце.
Стандартные растворы. Соответствующий стандартный образец белка растворяют в буферном растворе, указанном в фармакопейной статье. Части полученного раствора разводят в том же буферном растворе для получения не менее чем пяти стандартных растворов, имеющих концентрации белка, равномерно распределенные в интервале между 10 мкг/мл и 1200 мкг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в буферном растворе, указанном в фармакопейной статье, с концентрацией белка, находящейся в пределах интервала концентраций калибровочного графика.
Контрольный раствор. Используют буферный раствор, применяемый для приготовления стандартных и испытуемого растворов.
Методика. Прибавляют к 0,1 мл каждого стандартного раствора, испытуемого раствора и контрольного раствора 2,0 мл реактива медно- бицинхониновой кислоты. Растворы выдерживают при температуре 37 ºС в течение 30 мин, засекают время и охлаждают смесь до комнатной температуры. Через 60 мин после окончания инкубации при 37 ºС измеряют оптические плотности стандартных растворов и испытуемого раствора на спектрофотометре при длине волны 562 нм в кварцевых кюветах, используя контрольный раствор в качестве раствора сравнения.
Зависимость оптической плотности от концентрации белка носит нелинейный характер, тем не менее, если интервал концентраций, используемых для построения калибровочного графика, небольшой, то она приближается к линейной. Строят зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Примечания:
- Приготовление реактива бицинхониновой кислоты. В мерную колбу вместимостью 1 л помещают 10 г динатриевой соли бицинхониновой кислоты, 20 г натрия карбоната моногидрата, 1,6 г натрия тартрата, 4 г натрия гидроксида, 9,5 г натрия гидрокарбоната, растворяют в воде. При необходимости значение рН полученного раствора доводят до 11,25 раствором натрия гидроксида 10 % или натрия гидрокарбоната 5 %. Доводят объем раствора водой до метки и перемешивают.
- Приготовление реактива медно- бицинхониновой кислоты. Смешивают 1,0 мл 4 % раствора меди сульфата (40 г/л) и 50,0 мл реактива бицинхониновой кислоты.
Метод 5 (Колориметрический метод с биуретовым реактивом). Определение белка
Метод основан на взаимодействии ионов двухвалентной меди с пептидными связями молекулы белка в щелочной среде с образованием окрашенного комплекса, оптическая плотность которого измеряется при длине волны 540 нм. Этот метод показывает минимальные различия между равными количествами иммуноглобулиновых и альбуминовых белков.
Метод не рекомендован для проведения реакции в растворах, содержащих соли аммония, а также для мутных или образующих осадок растворов. Для устранения влияния мешающих веществ проводят осаждение белка из раствора испытуемого образца следующим образом: к 1 объему раствора испытуемого образца прибавляют 0,1 объем 50 % раствора трихлоруксусной кислоты, перемешивают на вихревой мешалке и выдерживают при комнатной температуре в течение 10 мин, центрифугируют при 3000 g в течение 30 мин. Удаляют надосадочную жидкость и растворяют осадок в небольшом объеме 0,5 М раствора натрия гидроксида. Полученный раствор используют для приготовления испытуемого раствора.
При построении калибровочного графика стандартные растворы белка следует обрабатывать аналогичным способом.
Стандартные растворы. Если иное не указано в фармакопейной статье, растворяют соответствующий стандартный образец белка в 0,9 % растворе натрия хлорида. Части полученного раствора разводят 0,9 % раствором натрия хлорида для получения не менее трех стандартных растворов с концентрациями в интервале от 2 мг/мл до 10 мг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в 0,9 % растворе натрия хлорида с концентрацией белка, находящейся в пределах интервала концентраций стандартных растворов.
Контрольный раствор. Используют 0,9 % раствор натрия хлорида.
Методика. К 1,0 мл испытуемого раствора, каждого из стандартных растворов и контрольного раствора прибавляют 4,0 мл биуретового реактива, перемешивают и оставляют при комнатной температуре на 30 мин. Измеряют оптическую плотность испытуемого и стандартных растворов при длине волны 540 нм, используя контрольный раствор в качестве раствора сравнения (или указанной в фармакопейной статье, в пределах 540 — 650 нм).
Зависимость оптической плотности от концентрации белка носит нелинейный характер. Однако в небольшом интервале концентраций, используемых для построения калибровочного графика, она приближается к линейной. Строят график зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Калибровочный график строят каждый раз при приготовлении новых реактивов или использовании другого спектрофотометра, но не реже 1 раза в 3 мес.
Примечание:
Приготовление 50 % раствора трихлоруксусной кислоты. В мерную колбу вместимостью 500 мл помещают 250 г трихлоруксусной кислоты и растворяют в воде. Объем раствора доводят до метки водой и тщательно перемешивают.
Срок годности 50 % раствора трихлоруксусной кислоты 1 мес.
Метод 6 (Флуорометрический метод с о-фталальдегидом). Определение белка
Метод основан на дериватизации белка о-фталальдегидом, который реагирует с первичными аминогруппами белка (N-концевая аминокислота и ε-аминогруппа остатков лизина) с последующим измерением флуоресценции полученного комплекса. Чувствительность количественного определения может быть увеличена гидролизом белка перед добавлением о-фталальдегида. Гидролиз делает α-аминогруппу, входящую в структуру аминокислот, доступной для взаимодействия с фталальдегидным реактивом. Метод является высокочувствительным и требует небольшого количества белка.
Определению мешают буферные растворы, содержащие первичные амины, такие как трис (гидроксиметил)аминометан, и аминокислоты, которые взаимодействуют с о-фталальдегидом. Аммиак в больших концентрациях также взаимодействует с о-фталальдегидом. Флуоресценция, полученная при взаимодействии аминов с о-фталальдегидом, может быть нестабильной. Использование автоматизированных методик для стандартизации данного метода позволяет повысить точность и воспроизводимость определения.
Стандартные растворы. Растворяют соответствующий стандартный образец белка в 0,9 % растворе натрия хлорида. Части полученного раствора разводят 0,9 % раствором натрия хлорида для получения не менее пяти стандартных растворов с концентрациями в интервале от 10 мкг/мл до 200 мкг/мл. Доводят значение рН раствора до 8,0 — 10,5 перед добавлением фталальдегидного реактива.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в 0,9 % растворе натрия хлорида с концентрацией белка, находящейся в пределах интервала концентраций стандартных растворов. Доводят значение рН раствора до 8,0-10,5 перед добавлением фталальдегидного реактива.
Контрольный раствор. Используют 0,9 % раствор натрия хлорида.
Методика. Смешивают 10 мкл испытуемого раствора, каждого из стандартных растворов и контрольного раствора с 0,1 мл фталальдегидного реактива и выдерживают при комнатной температуре в течении 15 мин. Прибавляют 3 мл 0,5 М раствора натрия гидроксида и перемешивают. Определяют интенсивность флуоресценции испытуемого раствора и каждого из стандартных растворов при длине волны возбуждения 340 нм и длине волны испускания между 440 нм и 455 нм, используя контрольный раствор в качестве раствора сравнения. Измеряют интенсивность флуоресценции указанных растворов только один раз, поскольку излучение снижает интенсивность флуоресценции.
Зависимость интенсивности флуоресценции от концентрации белка носит линейный характер. Строят график зависимости интенсивностей флуоресценции стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и интенсивности флуоресценции испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Калибровочный график строят каждый раз при приготовлении новых реактивов или использовании другого спектрофлуориметра, но не реже 1 раза в 3 мес.
Примечания:
Приготовление боратного буферного раствора. В мерную колбу вместимостью 1000 мл помещают 61,83 г борной кислоты и растворяют в воде и доводят рН до значения 10,4 при помощи раствора калия гидроксида. Объем раствора доводят до метки водой и тщательно перемешивают.
Приготовление исходного раствора фталальдегида. 1,20 г фталальдегида растворяют в 1,5 мл метанола, прибавляют 100 мл боратного буферного раствора и перемешивают. Прибавляют 0,6 мл 30 % раствора макрогол 23 лаурилового эфира (300 г/л) и перемешивают. Хранят при комнатной температуре и используют в течение 3 недель.
Приготовление фталальдегидного реактива. К 5 мл исходного раствора фталальдегида прибавляют 15 мкл 2-меркаптоэтанола. Раствор следует готовить не менее чем за 30 мин перед использованием. Используют в течение 24 часов.
Метод 7 (Определение белка по содержанию азота)
Определение белка по содержанию азота основано на том, что содержание азота в большинстве белков практически одинаково и может быть принято равным 16 %. По количеству найденного азота во взятой пробе рассчитывают содержание белка в лекарственном средстве, используя коэффициент пересчета азота на белок, равный 6,25.
На результаты определения будут оказывать влияние другие азотсодержащие вещества, присутствующие в испытуемом образце.
Методика определение белка по содержанию азота основана на разложении испытуемого образца в ходе проведения анализа, но не лимитирована содержанием белка в водной среде. При нагревании азотсодержащего органического соединения с серной кислотой концентрированной, азот превращается в аммония сульфат, который можно определить количественно.
Метод А (Метод Къельдаля)
Определение проводят в соответствии с требованиями, указанными в ОФС «Определение азота в органических соединениях» (метод 2 – микрометод Къельдаля) из точной навески препарата, содержащей 10 – 20 мг белка. После минерализации азотсодержащего органического соединения с серной кислотой концентрированной азот превращается в аммония сульфат, который можно определить количественно.
Метод Б
Большинство приборов для определения азота используют пиролиз, то есть сжигание образца в кислороде при температуре приблизительно 1000 °С, в ходе которого выделяется азота монооксид (NO) и другие оксиды азота (NOx), из азота присутствующего в испытуемом веществе. Некоторые приборы преобразуют оксиды азота в азот, который количественно определяется с помощью детектора по теплопроводности. В других приборах азота монооксид (NO) смешивается с озоном (О3) для получения азота диоксида (NO2 *) в возбужденном состоянии, испускающего свет при распаде, который может быть количественно определен с помощью хемилюминесцентного детектора. Для оптимизации навески и параметров пиролиза и обеспечения стабильности показателей при проведении анализа используется стандартный образец соответствующей чистоты и подходящий по составу с исследуемому белку.
Расчеты. Концентрацию белка рассчитывают путем деления содержания азота в испытуемом образце на известное содержание азота в исследуемом белке. Известное содержание азота в белке можно определить исходя из химического состава белка или путем сравнения с подходящим стандартным образцом.
