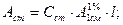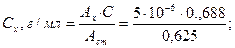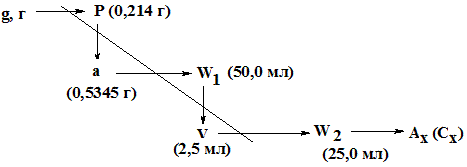Макеты страниц
Определение концентрации вещества методом сравнения оптических плотностей эталонного и исследуемого растворов
Для определения готовят эталонный раствор определяемого вещества известной концентрации, которая приближается к концентрации исследуемого раствора. Определяют оптическую плотность этого раствора при определенной длине волны 


где 

Оптическая плотность исследуемого раствора выражается такой же формулой:

где 

Отсюда

и

Количество 

где 




Определение к онцентраци и вещества в растворе по значению молярного коэффициента поглощения
Определив значение оптической плотности 





Количество 

где 
Значение молярного коэффициента поглощения 




Если вещество трудно получить в чистом виде, то можно пользоваться табличным значением 
Определение концентрации вещества с помощью калибровочного графика
Функциональная зависимость 


Определив значение 



Определение концентрации вещества методом «уравнивания» или методом изменения толщины поглощающего слоя
Оптическую плотность исследуемого раствора 

где 




Рис. 96. Оптическая схема колориметра погружения: 1 – зеркало; 2, 3 – кюветы; 4, 5 — стеклянные цилиндры; 6, 7— призмы; 8,9 — линзы.
Оптическую плотность эталонного раствора определяют по формуле

где 

Изменяя толщину слоя исследуемого раствора и эталонного раствора, можно установить тождественность цвета исследуемого раствора с цветом эталонного. Тогда оба раствора будут иметь одинаковую оптическую плотность:

Отсюда

На использовании этого равенства основано устройство колориметра погружения (колориметр Дюбоска), в котором тождественность цвета достигается изменением толщины слоя растворов. Оптическая схема колориметра погружения дана на рис. 96. Один световой поток от зеркала 1 проходит через слой исследуемого раствора в кювете 2, цилиндр 4, призму 6, линзы 8 и 9 и попадает в окуляр, освещая правую половину оптического поля. Другой световой поток проходит через слой стандартного раствора в кювете 3, цилиндр 5, призму 7, линзы 8 и 9, попадает в окуляр, освещая левую половину оптического поля. Кюветы 2 и 3 установлены на держателях, которые при помощи шестеренок и реек передвигаются вертикально. Стеклянные цилиндры 4 и 5 с отшлифованными концами укреплены неподвижно. Перемещая кюветы 2 и 3 по вертикали, меняют высоту столбов раствора и добиваются исчезновения границ раздела в окуляре оптического поля. Высоты столбов эталонного раствора и исследуемого раствора отсчитывают по миллиметровой шкале.
Содержание
- Способы расчета концентрации в фотометрии.
- Теоретические основы определения оптической плотности раствора
- Основной закон светопоглощения
- Закон Бугера-Ламберта-Бера
- Ограничения применения закона
- Методы определения концентрации
- Условия проведения исследования
- Способ расчета количественного содержания действующего вещества по оптической плотности стандартного образца
Способы расчета концентрации в фотометрии.
Метод градуировочного графика. В соответствии с законом Бугера — Ламберта — Бера график зависимости оптической плотности от концентрации должен быть линейным и проходить через начало координат.
Готовят серию стандартных растворов различной концентрации и измеряют оптическую плотность в одинаковых условиях. Для повышения точности определения число точек на графике должно быть не меньше трех — четырех. Затем определяют оптическую плотность исследуемого раствора Ах и по графику находят соответствующее ей значение концентрации Сх (рис. 11.1.).
Интервал концентраций стандартных растворов подбирают таким образом, чтобы концентрация исследуемого раствора соответствовала примерно середине этого интервала.
Метод является наиболее распространенным в фотометрии. Основные ограничения метода связаны с трудоемким процессом приготовления эталонных растворов и необходимостью учитывать влияние посторонних компонентов в исследуемом растворе. Чаще всего метод применяется для проведения серийных анализов.

Рис.11.1. Градуировочный график зависимости оптической плотности от концентрации.
Метод добавок. Этот метод применяют для анализа сложных растворов, т. к. он позволяет автоматически учитывать влияние посторонних компонентов анализируемого образца. Сначала измеряют оптическую плотность исследуемого раствора с неизвестной концентрацией
А х = 

затем в анализируемый раствор добавляют известное количество стандартного раствора определяемого компонента (Сст) и измеряют оптическую плотность А х+ст:
А х+ст = 

С х = С ст · 
Для повышения точности добавку стандартного раствора определяемого компонента делают дважды и полученный результат усредняют.
Концентрацию анализируемого вещества в методе добавок можно найти графическим путем (рис.11.2.).
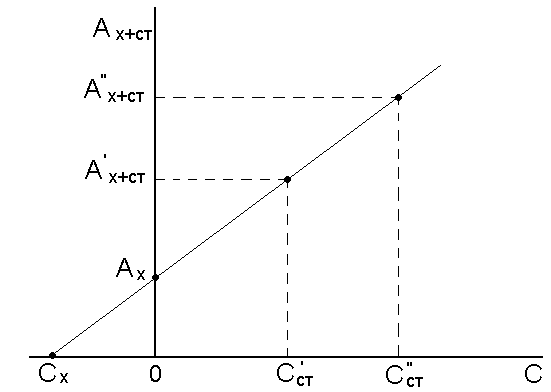
Рис.11.2. Градуировочный график для определения концентрации вещества по методу добавок.
167. Стандартный и реальный потенциал.
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активностиа всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 10 5 Па (1 атм). Для водных р-ров в качестве стандартного электрода используют водородный электрод (Pt; H2 [1,01·10 5 Па], Н + [a=1]), потенциал к-рого при всех т-рах принимается равным нулю (см. Электроды сравнения): стандартный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схематич. изображении цепи (гальванич. ячейки) водородный электрод всегда записывается слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным, если в режиме «источник тока» слева направо во внеш. цепи движутся электроны, а в р-ре — положительно заряженные частицы. Напр., стандартный потенциал хлорсеребряного электрода равен эдс гальванич. ячейки
Для любой электродной р-ции, включающей перенос n электронов, электродный потенциал определяется ур-нием:
где Е°-стандартный потенциал электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная Фарадея, аi-термодинамич. активность частиц (как заряженных, так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич. коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят в левую часть ур-ния, напр. AgCl + е : Ag + С1 — ). Значения стандартных потенциалов для ряда электродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют электрохимический ряд напряжений.
Стандартный потенциал определяется либо непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией на бесконечно разб. р-ры, либо расчетом — по данным о стандартных значениях изменения энергии Гиббса хим. р-ции DG 0 . В последнем случае р-цию представляют в виде суммы двух (или более) электродных р-ций, одна из к-рых -окис-лит.-восстановит. р-ция с искомым стандартным потенциалом 

Источник
Теоретические основы определения оптической плотности раствора
Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
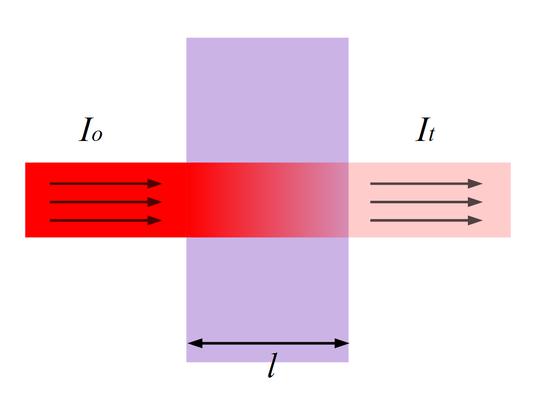
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.
Основной закон светопоглощения
Суть фотометрического определения заключается в двух процессах:
- перевод определяемого вещества в поглощающее электромагнитные колебания соединение;
- замер интенсивности поглощения этих самых колебаний раствором исследуемого вещества.
Изменения в интенсивности потока света, проходящего через светопоглощающее вещество, будут вызываться также потерями света из-за отражения и рассеяния. Чтобы результат был достоверным, проводят параллельные исследования по замеру параметров при той же толщине слоя, в идентичных кюветах, с тем же растворителем. Так снижение интенсивности света зависит главным образом от концентрации раствора.
Уменьшение интенсивности света, пропущенного через раствор, характеризуют коэффициентом светопропускания (также принято называть его пропусканием) Т:
- I — интенсивность света, пропущенного через вещество;
- I0 — интенсивность падающего пучка света.
Таким образом, пропускание показывает долю непоглощенного светового потока, проходящего через изучаемый раствор. Обратный алгоритм значения пропускания называют оптической плотностью раствора (D): D = (-lgT) = (-lg) * (I / I0) = lg * (I0 / I).
Это уравнение показывает, какие параметры являются главными для исследования. К ним относится длина волны света, толщина кюветы, концентрация раствора и оптическая плотность.
Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I0 = 10 -ε·С·ι .
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.
Ограничения применения закона
Этот раздел включает следующие пункты:
- Он справедлив исключительно для монохроматического света.
- Коэффициент ε связан с показателем преломления среды, особенно сильные отклонения от закона могут наблюдаться при анализе высококонцентрированных растворов.
- Температура при измерении оптической плотности должна быть постоянной (в рамках нескольких градусов).
- Световой пучок должен быть параллельным.
- рН среды должен быть постоянным.
- Закон применим для веществ, светопоглощающими центрами которых являются частицы одного вида.
Методы определения концентрации
Стоит рассмотреть метод градуировочного графика. Для его построения готовят ряд растворов (5-10) с различной концентрацией исследуемого вещества и замеряют их оптическую плотность. По полученным значениям выстраивают график зависимости D от концентрации. График является прямой линией, идущей от начала координат. Он позволяет легко определить концентрацию вещества по результатам проведенных измерений.
Также существует метод добавок. Применяется реже, чем предыдущий, но позволяет проанализировать растворы сложного состава, поскольку учитывает влияние дополнительных компонентов. Суть его состоит в определении оптической плотности среды Dx, содержащей определяемое вещество неизвестной концентрации Сх, с повторным анализом того же раствора, но с добавлением определенного количества исследуемого компонента (Сст). Величину Сх находят, используя расчеты или графики.
Условия проведения исследования
Чтобы фотометрические исследования давали достоверный результат, необходимо соблюдать несколько условий:
- реакция должна заканчиваться быстро и полностью, избирательно и воспроизводимо;
- окраска образующегося вещества должна быть устойчива во времени и не изменяться под действием света;
- исследуемое вещество берут в количестве, которого достаточно для перевода его в аналитическую форму;
- замеры оптической плотности проводят в том интервале длин волн, при котором различие в поглощении исходных реагентов и анализируемого раствора наибольшее;
- светопоглощение раствора сравнения принято считать оптическим нулем.
Источник
Способ расчета количественного содержания действующего вещества по оптической плотности стандартного образца
В НД для количественного определения фармацевтических субстанций и ингредиентов лекарственных форм наиболее часто используется способ расчета, основанный на сравнении поглощения раствора анализируемого образца с поглощением раствора ГСО (РСО) субстанции аналогичного наименования, измеренных в одинаковых условиях. Такой подход позволяет учитывать влияние многочисленных факторов (погрешности разведения, установки длины волны, влияние температуры и т.д.). Это приводит к более высокой точности данного способа расчета по сравнению с двумя предыдущими (по градуировочному графику и по удельному показателю поглощения).
Для анализа готовых лекарственных форм (ГЛФ) в качестве рабочих стандартных образцов (РСО) разрешено использовать образцы серийных фармацевтических субстанций, удовлетворяющие требованиям соответствующих ФС. Однако для фармацевтических субстанций способ расчета по оптической плотности стандартного образца предусматривает обязательное использование Государственного стандартного образца (ГСО) соответствующего наименования. Перечень необходимых ГСО фармацевтических субстанций включен в ГФ.
Способ расчета по оптической плотности раствора стандартного образца основан на использовании следующей зависимости оптической плотности анализируемого (Ах) и стандартного образца (Аст):
Преобразование этой системы уравнений приводит к соотношению:

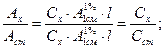

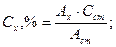
Содержание ЛВ в субстанции (g, %) рассчитывают, учитывая разведения, в зависимости от способа выражения концентрации фотометрируемого стандартного раствора (см. раздел 3.2.1.):
♦ если концентрация раствора стандартного образца выражена в г/мл (формула 3.31):

♦ если концентрация раствора стандартного образца выражена в процентах (формула 3.32):
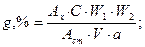
♦ если концентрация раствора стандартного образца выражена в г/W, мл (формула 3.33):

♦ если фотометрируемые растворы анализируемого и стандартного образцов приготовлены по аналогичной схеме и концентрация исходного раствора стандартного образца (Сст) выражена в процентах, содержание испытуемого вещества (g,%) рассчитывают по формуле 3.34:

где Ах; Аст – соответственно оптическая плотность анализируемого и стандартного растворов; W1;W2 – вместимость мерных колб для приготовления анализируемых растворов, мл; а – навеска испытуемого образца, взятая на анализ, г; V – аликвота, взятая для приготовления фотометрируемого раствора, мл.
Содержание действующих веществ в ГЛФ или лекарственных формах индивидуального изготовления (g, г) рассчитывают по формулам (например, формула 3.35), аналогичным формулам 3.31–3.33, в пересчете на массу (Р) лекарственной формы по прописи:
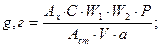
где Р равно в случае анализа:
♦ порошков, суппозиториев – массе одной дозы, г;
♦ мазей – массе мази по прописи, г;
♦ растворов для инъекций – 1 мл;
♦ глазных капель, микстур, растворов для внутреннего употребления – объему
лекарственной формы по прописи, мл;
♦ таблеток – средней массе одной таблетки или массе одной таблетки, г; и т.д.:
ПРИМЕР: Оцените качество таблеток феназепама по 0,001 г по количественному содержанию действующего вещества (согласно ФС должно быть 0,0009–0,0011 г в пересчете на среднюю массу таблетки).
Согласно методике ФС 0,5345 г (а) порошка растертых таблеток феназепама поместили в мерную колбу вместимостью 50 мл (W1), добавили 30 мл 95% этанола, взболтали в течение 10 минут для растворения феназепама. Довели объем раствора до метки, профильтровали.
2,5 мл (V) фильтрата довели до метки 95% этанолом в мерной колбе вместимостью 25,0 мл (W2) (анализируемый раствор).
Оптическая плотность анализируемого раствора, измеренная относительно этанола на спектрофотометре при длине волны 231 нм в кювете с толщиной слоя 1,0 см, составила 0,688 (Ах).
Оптическая плотность стандартного раствора, содержащего в 1 мл 0,000005 г (0,000005 г/мл) феназепама, измеренная в аналогичных условиях, равна 0,625 (Аст). Средняя масса одной таблетки 0,214 г (Р).
РЕШЕНИЕ: Содержание феназепама в фотометрируемом растворе (Сх) рассчитывают по формуле:
Содержание феназепама (g,г) в пересчете на среднюю массу одной таблетки (Р), учитывая схему разведения раствора, равно:
ЗАКЛЮЧЕНИЕ: Таблеткифеназепама соответствуют требованиям ФС по количественному содержанию (0,0011 г/таб).
Источник
Способы определения концентрации неизвестного вещества по величине оптической плотности
Ученик
(122),
на голосовании
10 лет назад
Голосование за лучший ответ
Влад
Знаток
(427)
10 лет назад
По закону Бугера-Ламберта-Бера, концентрация прямо пропорциональна оптической плотности. А=К*С.
А-оптическая плотность, К-коэффициент звукопоглощения (в него входит толщина слоя поглощающего соединения) , С-концентрация вещества.
1) Градуировочный график (зависимость А от С) Приготовить несколько растворов известной концентрации и определить их оптическую плотность. График получится в виде прямой, каждому значению А соответствует определённая концентрация.
2) Метод стандартной добавки. Добавить определённое количество вещества известной концентрации, потом всё также.
Цель работы.
Освоить
методику работы на рефрактометре,
научиться определять показатели
преломления веществ и составы растворов.
Приборы и реактивы.
Рефрактометр.
Индивидуальные вещества. Фильтровальная
бумага. Пипетки.
Порядок выполнения
работы
1.
Ознакомиться
с устройством рефрактометра и порядком
определения показателя преломления.
2. Определить
показатели преломления растворенного
вещества (nD,А),
растворителя (nD,Б),
раствора (nD,А+Б).
Провести по три замера и вычислить
среднее значение по формуле:
,
где m
– число измерений.
3. Определить
плотности раствора (ρА+Б),
растворенного вещества (ρА)
и растворителя (ρБ)
при помощи набора ареометров.
4. Вычислить массовую
долю растворенного вещества (w)
по формуле:

где nD,А+Б
– показатель преломления раствора;
nD,А
– показатель преломления растворенного
вещества;
nD,Б
– показатель преломления растворителя;
ρА+Б
– плотность раствора при температуре
измерения показателя преломления;
ρА
– плотность растворенного вещества
при температуре измерения показателя
преломления;
ρБ
– плотность растворителя при температуре
измерения показателя преломления;
w
– массовая доля вещества А в растворе.
5. По полученным
результатам заполнить таблицу.
|
Вещество |
Показатель |
Плотность ρ, |
Массовая |
|||
|
1 |
2 |
3 |
среднее |
|||
|
А |
||||||
|
Б |
||||||
|
А |
*
Указать,
что использовалось в качестве растворенного
вещества (А), растворителя (Б) и название
полученного раствора (А + Б).
8. Оптические методы. СветопоглОщение
Методы анализа,
основанные на поглощении электромагнитного
излучения анализируемыми веществами,
составляют обширную группу оптических
методов. При поглощении света атомы и
молекулы анализируемых веществ переходят
в новое возбужденное состояние. В
зависимости от вида поглощающих частиц
и способа трансформирования поглощенной
энергии различают:
1. Атомно-абсорбционный
анализ,
основанный на поглощении световой
энергии атомами анализируемых веществ.
2. Молекулярный
абсорбционный анализ,
основанный на изучении поглощения света
молекулами анализируемого вещества в
ультрафиолетовой, видимой и инфракрасной
областях спектра (спетрофотометрия,
фотоколориметрия, фотометрия,
ИК-спектроскопия).
3. Анализ поглощения
и рассеяния световой энергии взвешенными
частицами анализируемого вещества
(турбидиметрия,
нефелометрия).
4. Люминесцентный
(флуорометрический) анализ,
основанный на измерении излучения,
возникающего в результате выделения
энергии возбужденными молекулами
анализируемого вещества.
Все эти методы
иногда объединяют в одну группу
спектрохимических или спектроскопических
методов анализа, хотя они и имеют
существенные различия.
Из вышеперечисленных
методов чаще других находит применение
группа фотометрических
методов анализа,
в которую входят: спектрофотометрия,
фотоколориметрия, фотометрия.
В фотометрических
методах используют избирательное
поглощение света молекулами анализируемого
вещества. Согласно квантовой механике,
свет представляет собой поток частиц,
называемых квантами, или фотонами.
Энергия каждого кванта определяется
длиной волны излучения. В результате
поглощения излучаемого светового потока
молекула поглощающего вещества переходит
из основного состояния с минимальной
энергией E1
в более высокое энергетическое состояние
Е2.
Электронные переходы, вызванные
поглощением строго определенных квантов
световой энергии, характеризуются
наличием строго определенных полос
поглощения в электронных спектрах
поглощающих молекул. Причем поглощение
света происходит только в том случае,
когда энергия поглощаемого кванта
совпадает с разностью энергий ΔЕ
между квантовыми энергетическими
уровнями в конечном (E2)
и начальном (E1)
состояниях поглощающей молекулы:
hv
= ΔЕ
= Е2
– E1.
Здесь h
– постоянная Планка (h
= 6,625×10–34
Дж·с); v
– частота поглощаемого излучения,
которая определяется энергией поглощенного
кванта и выражается отношением скорости
распространения излучения с
(скорость
световой волны в вакууме с
= 3×1010 см/с)
к длине волны λ:
v
= с/λ.
Частота излучения
v
измеряется в обратных секундах (с–1)
или герцах (Гц). 1 Гц = 1 с–1.
Длина волны λ
измеряется в ангстремах (1 Å = 1×10–8
см), микрометрах или микронах (1 мкм = 1
мк = 1×10–6
м), нанометрах или миллимикронах (1 нм =
1 ммк = 1×10–9
м).
Энергия излучения
характеризуется электромагнитным
спектром, охватывающим область от
километровых радиоволн до десятых долей
ангстрема γ-излучения
и космических лучей. Для характеристики
участка спектра часто используют также
волновое число θ, которое показывает,
какое число длин волн приходится на 1
см пути излучения в вакууме, и определяется
соотношением: θ = 1/λ.
Природа полос
поглощения в ультрафиолетовой (10-400 нм)
и видимой (400-760 нм) областях спектра
одинакова и связана главным образом с
числом и расположением электронов в
поглощающих молекулах и ионах. В
инфракрасной области (0,8–1000 мкм) она в
большей степени связана с колебаниями
атомов в молекулах поглощающего вещества.
В зависимости от
используемой аппаратуры в фотометрическом
анализе различают спектрофотометрический
метод –
анализ по поглощению монохроматического
света – и фотометрический
– анализ по
поглощению полихроматического
(немонохроматического) света в видимой
области спектра. Оба метода основаны
на пропорциональной зависимости между
светопоглощением и концентрацией
поглощающего вещества.
Фотометрические
методы подразделяют на прямые и косвенные.
В прямых методах определяемый ион М с
помощью реагента R переводят в
светопоглощающее соединение MR, а затем
измеряют интенсивность светопоглощения
раствора этого соединения. При косвенных
определениях используют вспомогательные
соединения, которые при взаимодействии
с определяемым веществом либо разрушаются
сами, либо образуют новые светопоглощающие
соединения.
Данная группа
методов основана на количественном
определении компонентов, способных
поглощать свет. Хорошо поглощают свет
окрашенные растворы. Поэтому при
выполнении фотометрического анализа
определяемые компоненты при помощи
химических реакций переводят в соединения,
дающие стойкие цветные реакции.
Различают три
группы способов измерения концентрации
окрашенного соединения в растворе:
-
визуальный,
путем сравнения интенсивности окраски
исследуемого раствора с эталонными
растворами, концентрации которых
известны; -
поглощение света
измеряют при помощи приборов с
фотоэлементами – фотометрами
(ФЭК); -
поглощение света
измеряют при помощи приборов –
спектрофотометров.
В них кроме фотоэлемента, с помощью
которого измеряют ослабление интенсивности
светового потока, имеется призма или
дифракционная решетка, а также щель,
что позволяет выделить узкий участок
спектра, а именно тот, с которым оптически
реагирует окрашенное вещество.
Основные
закономерности светопоглощения
При прохождении
через слой вещества (раствора) светового
потока с интенсивностью Iо
его интенсивность в результате поглощения
в окрашенном растворе уменьшается до
значения I.
Интенсивности падающего светового
потока Iо
и светового потока I,
прошедшего через раствор, можно определить
экспериментально.
Связь между
интенсивностями световых потоков Iо
и I
устанавливается законом
Бугера – Ламберта,
согласно которому однородные
слои одного и того же вещества одинаковой
толщины поглощают одну и ту же долю
падающей на них световой энергии (при
постоянной концентрации растворенного
вещества).
Характер и величина
поглощения света зависят от природы
вещества и его концентрации в растворе.
Эта зависимость определяется законом
Бугера – Ламбера – Бера.
Математически
этот закон выражается уравнением:
I
= Iо10–ε·C·l,
где I
– интенсивность
прошедшего через раствор света;
Iо
– интенсивность
падающего на раствор света;
l
–толщина светопоглощающего слоя, см;
С – молярная
концентрация раствора, моль/л (М);
ε
– молярный коэффициент светопоглощения,
const
для конкретного соединения. Он показывает,
чему равна оптическая плотность 1М
раствора при толщине слоя в 1 см.
Отношение
называют пропусканием;
его значения могут изменяться от 0 до
1. Часто эту величину выражают в процентах.
Если величина Т отнесена к толщине слоя
в 1 см, то ее называют коэффициентом
пропускания.
Десятичный логарифм
величины, обратной пропусканию, носит
название оптической
плотности
(D)
.
Связь между
концентрацией светопоглощающего
раствора и его оптической плотностью
D
выражается законом
Бера, согласно
которому оптическая
плотность
раствора
прямо пропорциональна концентрации
растворенного вещества при постоянной
толщине слоя:
.
Как видно из
уравнения, оптическая плотность раствора
прямо пропорциональна концентрации
светопоглощающего вещества в растворе
и толщине слоя раствора. Другими словами,
при определённой толщине слоя раствора
оптическая плотность будет тем больше,
чем больше концентрация вещества в
растворе. Отсюда следует, что, определяя
оптическую плотность раствора, мы можем
напрямую определять концентрацию
вещества в растворе. При помощи современной
техники оптическая плотность может
быть измерена очень точно. Увеличивая
толщину слоя lможно
измерять очень малые концентрации
веществ.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Многие соединения поглощают свет в видимой или ультрафиолетовой части электромагнитного спектра. Используя закон Бера, вы можете рассчитать концентрацию раствора на основе того, сколько света он поглощает.
Используя Закон Бера
Закон Бера определяет количество поглощаемой радиации и указывает, что поглощение прямо пропорционально концентрации. Таким образом, когда концентрация соединения, растворенного в данном растворителе, увеличивается, оптическая плотность раствора также должна увеличиваться пропорционально. Химики используют это соотношение для определения концентрации неизвестных растворов. Для этого сначала необходимы данные о поглощении для ряда растворов известной концентрации, называемых стандартными растворами. Данные об абсорбции и концентрации затем наносятся на калибровочную кривую для установления их математической зависимости. Концентрация неизвестного образца может быть определена путем измерения его оптической плотности.
Расчет концентрации раствора
Шаг 1. Постройте калибровочный график поглощения по оси Y и концентрации по оси X для стандартных растворов. Точки данных должны располагаться вдоль достаточно прямой линии. Две точки данных представляют абсолютный минимум, а чем больше, тем лучше.
Шаг 2. Нарисуйте «наиболее подходящую» прямую линию через точки данных и вытяните линию, чтобы пересечь ось Y. Выберите на линии две случайные точки, а не точки данных, и определите их координаты x и y. Пометьте эти координаты как (x1, y1) и (x2, y2).
Шаг 3. Вычислить наклон m линии по формуле m = (y1 – y2) / (x1 – x2). Определите точку пересечения y, сокращенно b, отметив значение y, где линия пересекает ось y. Например, для двух случайных точек на линии в координатах (0, 050, 0, 105) и (0, 525, 0, 315) наклон определяется как:
m = (0, 105-0, 315) / (0, 050-0, 525) = 0, 440.
Если линия пересекает ось Y в точке 0, 08, то это значение представляет точку пересечения y.
Шаг 4. Напишите формулу линии калибровочного графика в виде y = mx + b. Продолжая пример с шага 3, уравнение будет иметь вид y = 0, 440x + 0, 080. Это представляет уравнение калибровочной кривой.
Шаг 5. Подставьте поглощение раствора неизвестной концентрации в уравнение, определенное как y, и решите для x, где x представляет концентрацию. Если, например, неизвестное решение имеет поглощающую способность 0, 330, уравнение даст:
х = (у – 0, 080) / 0, 440 = (0, 330 – 0, 080) / 0, 440 = 0, 568 моль на литр.
Теория против практика
Хотя закон Бера гласит, что поглощение и концентрация прямо пропорциональны, экспериментально это справедливо только в узких диапазонах концентраций и в разбавленных растворах. Таким образом, стандартные растворы, концентрация которых варьируется, например, от 0, 010 до 0, 100 моль на литр, будут демонстрировать линейность. Диапазон концентраций от 0, 010 до 1, 00 моль на литр, однако, вероятно, не будет.