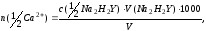Метод
основан на способности ионов кальция
образовывать устойчивые комплексы с
трилоном Б в сильнощелочной среде
(рН = 12 − 13). Подобный комплекс
ионов магния в этой среде разрушается
с выделением гидроксида магния. При
титровании раствором трилона Б
изменение окраски индикатора (мурексида)
от лиловой до красно-малиновой
свидетельствует о полном связывании
ионов кальция:
H2Ind3-
+ Са2+
↔ СаH2Ind–;
красно-малиновый
лиловый
СаH2Ind–
+ Na2H2Y
↔ Na2СаY
+ H2Ind3-
+ 2H+.
лиловый
Титрование
ионов кальция возможно при совместном
присутствии ионов тяжелых металлов в
концентрациях, не превышающих значений:
для меди – 0,2 мг/дм3;
цинка, свинца, никеля, марганца, железа,
алюминия – 1 мг/дм3
и магния – 3 мг в определяемом объеме.
При более высоких концентрациях ионов
тяжелых металлов в пробу добавляют
сульфид натрия. Мешающее влияние ионов
магния устраняют или уменьшением объема
пробы, взятого для анализа, или при
высоком содержании магния (соотношение
Mg:Ca
более 1), осаждением ионов магния раствором
едкого натра, имеющим концентрацию
2 моль/дм3
(рН 12 − 13) в мерной колбе
вместимостью 100 см3.
Для этого 20−40 см3
пробы разбавляют дистиллированной
водой до 90 см3
и медленно по каплям добавляют раствор
NaOH,
хорошо перемешивают, при этом незначительное
количество ионов кальция соосаждается
с Mg(OH)2.
Объем раствора доводят до метки
дистиллированной водой и после отстаивания
осадка в течение 1,5 – 2 часов
отбирают прозрачную аликвоту для
титрования. Для уменьшения потерь
кальция время отстаивания не должно
превышать 2 часа.
Ход
определения.
В коническую колбу вместимостью 250 см3
отмеряют требуемый объем пробы, доводят,
если необходимо, до 100 см3
дистиллированной водой, добавляют 2 см3
раствора NaOH
с массовой долей 0,08 (8 %), 0,1 – 0,2 г
индикатора мурекида и медленно титруют
раствором трилона Б при интенсивном
перемешивании до перехода окраски от
красно-малинового цвета к лиловому.
Повторяют титрование и, если расхождение
между параллельными титрованиями не
превышает приведенных в табл. 13.2, за
результат принимают среднее значение
трилона Б. В противном случае повторяют
титрование до получения допустимого
расхождения результатов.
Расчет.
Массовую концентрацию и количество
вещества эквивалента ионов кальция в
анализируемой пробе воды находят по
формулам:
где
m(Ca2+)
– массовая концентрация ионов кальция
в воде, мг/дм3;

– количество вещества эквивалента
ионов кальция в воде, ммоль/дм3;

концентрация эквивалента трилона Б,
моль/дм3;
V(Na2H2Y)
– объем раствора трилона Б, пошедшего
на титрование пробы, см3;
M(1/2Ca2+) − молярная
масса эквивалента ионов кальция,
мг/ммоль;
V
– объем пробы воды, взятый для определения,
см3.
Массовую
концентрацию ионов магния в мг/дм3
в анализируемой пробе воды определяют
по формуле
где
m(Mg2+)
− массовая концентрация ионов магния
в воде, мг/дм3;
X
– общая жесткость воды, ммоль/дм3;
n(1/2Ca2+)
− количество вещества эквивалента
ионов кальция в воде, ммоль/дм3;
M(1/2Mg2+) – молярная
масса эквивалента Mg2+,
мг/ммоль.
Таблица
13.2
Допустимые
расхождения между параллельными
титрованиями в зависимости от объема
раствора трилона Б
|
Объем |
<2 |
2−5 |
5−10 |
10−15 |
>15 |
|
Допустимое |
0,04 |
0,05 |
0,1 |
0,2 |
0,3 |
В
соответствии с ГОСТ Р 52029-2003 жесткость
воды выражается в градусах жесткости
(ºЖ).
Градус
жесткости соответствует концентрации
щелочноземельного элемента, численно
равной 1/2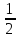
(г/м3).
Жесткость
воды Ж, ºЖ, при раздельном количественном
определении ионов щелочноземельных
элементов вычисляют по формуле
где
m(Ca2+)
– масса кальция в пробе воды, мг/дм3;
m(Mg2+)
– масса магния в пробе воды, мг/дм3;
M(Ca2+)
− молярная масса кальция, мг/моль;
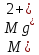
− молярная масса магния, мг/моль.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
The premise of your question is weird. $pu{50 mg}$ of calcium ion and $pu{50 mg}$ of carbonate ion are not equimolar. However, let’s assume that they have appropriate counterions somewhere. This problem can be approached two ways.
Limiting reactant
We have a precipitation reaction between the calcium and the carboncate ions, as calcium carbonate is nearly insoluble in water:
$$ce{Ca^2+ (aq) + CO3^2- (aq) -> CaCO3 (s) v}$$
Convert your masses of ions to amount of substance and figure out which ion is in excess. If calcium ion is in excess, then use the amount of substance in excess to determine the remaining calcium concentration.
For example: Let’s say you determined that your solution has $pu{0.1663 mol}$ of $ce{Ca^2+}$ and $pu{0.1221 mol}$ of $ce{CO3^2-}$. The maximum amount of $ce{CaCO3}$ that could precipitate is $pu{0.1221 mol}$, because we would run out of carbonate ion. Then there would be $pu{0.0442 mol}$ of calcium ion left in $pu{1 L}$ of solution for a concentration of $pu{0.0442 M}$.
Solubility product
Calcium carbonate is not completely insoluble. It’s solubility product constant is $4.8times 10^{-9}$. Thus we can set this up as an ICE equilibrium problem. I’ll use the same fake amount of substances from the previous example:
begin{align}
ce{CaCO3 (s) &<=> Ca^2+ (aq) + CO3^2- (aq)}\
K_mathrm{sp}&=[ce{Ca^2+}][ce{CO3^2-}]
end{align}
begin{array}{lcc}
hline
& text{calcium}/pu{mol} & text{carbonate}/pu{mol}\
hline
text{Initial} & 0.1663 & 0.1221 \
text{Change} & -x & -x \
text{Equilibrium} & 0.1663 – x & 0.1221 – x \
hline
end{array}
begin{align}
4.8times 10^{-9}&=(0.1663-x)(0.1221-x)
end{align}
Solving for $x$ gives you $x=0.1221,0.1663$ and only the first number makes sense. In this case the final calcium amount in solution would still be $pu{0.0442 mol}$. The carbonate amount in solution is not actually zero. It is $pu{1.09E-7 M}$, but that is for another day.
4. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ИОНОВ КАЛЬЦИЯ
4.1. Сущность метода
Метод основан на прямом определении ионов кальция с использованием ионоселективного кальциевого электрода.
Метод позволяет определять от 4 до 100 мг ионов кальция в пробе. В диапазоне 4 – 20 мг – с пределом погрешности измерений ; в диапазоне 20 – 100 мг – с пределом погрешности измерений
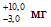
4.2. Аппаратура, материалы, реактивы
Прибор для измерения величины потенциала, типа pH-метр-милливольтметр (pH-340, pH-121) или иономер типа ЭВ-74.
Электрод сравнения хлорсеребряный насыщенный образцовый 2-го разряда по ГОСТ 17792-72.
Электрод “Квант” ионоселективный кальциевый.
Весы лабораторные не ниже второго класса точности с наибольшим пределом взвешивания до 200 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Весы лабораторные не ниже четвертого класса точности с наибольшим пределом взвешивания до 500 г по ГОСТ 24104-80 или другие весы, обеспечивающие необходимую точность взвешивания.
Шкаф сушильный.
Секундомер механический по ГОСТ 5072-79.
Стаканы лабораторные по ГОСТ 25336-82, вместимостью 250 см3.
Колбы конические по ГОСТ 25336-82, вместимостью 500 см3.
Колбы мерные по ГОСТ 1770-74, вместимостью 100, 1000 см3.
Цилиндры мерные с притертой пробкой по ГОСТ 1770-74, вместимостью 50 см3 (исполнения 2 или 4).
Пипетки мерные по ГОСТ 20292-74, вместимостью 1, 5, 10, 25 см3.
Палочки стеклянные.
Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82.
Бутыль полиэтиленовая.
Анионит АВ-17 по ГОСТ 20301-74.
Натрий уксуснокислый 3-водный по ГОСТ 199-78.
Кальций углекислый по ГОСТ 4530-76.
Кислота соляная по ГОСТ 3118-77.
Бумага фильтровальная лабораторная по ГОСТ 12026-76.
Бумага индикаторная универсальная.
Все реактивы должны быть квалификации х.ч. или ч.д.а.
4.3. Подготовка к анализу
4.3.1. Приготовление основного стандартного раствора хлористого кальция
Углекислый кальций прокаливают в сушильном шкафу при температуре (110 +/- 2) °C до постоянной массы. 10,000 г прокаленного углекислого кальция взвешивают с погрешностью не более +/- 0,0002 г.
Навеску переносят в стакан вместимостью 250 см3 и растворяют в 216 см3 раствора соляной кислоты концентрацией 1 моль/дм3, затем содержимое стакана перемешивают стеклянной палочкой и после растворения соли раствор количественно переносят в мерную колбу вместимостью 1 дм3 и доводят объем раствора до метки дистиллированной водой. Полученный раствор хранят в полиэтиленовой бутыли.
1 см3 раствора содержит молей хлористого кальция.
4.3.2. Приготовление раствора хлористого кальция концентрацией 0,001 моль/дм3
В мерную колбу вместимостью 100 см3 приливают 1 см3 основного стандартного раствора, отмеренного пипеткой вместимостью 1 см3 и объем раствора доводят дистиллированной водой до метки.
1 см3 раствора содержит молей хлористого кальция.
4.3.3. Приготовление буферного раствора
136,00 г трехводного уксуснокислого натрия взвешивают с погрешностью не более +/- 0,01 г. Навеску помещают в колбу вместимостью 1000 см3, растворяют в 100 – 150 см3 дистиллированной воды и объем раствора доводят дистиллированной водой до метки.
4.3.4. Подготовка прибора к испытанию
Новый измерительный ионоселективный кальциевый электрод перед работой выдерживают в основном стандартном растворе не менее 24 ч. Перед началом работы ионоселективный электрод присоединяют к клемме прибора для измерения величины потенциала “Изм.”, промывают дистиллированной водой, а остатки воды с электрода удаляют фильтровальной бумагой. В качестве электрода сравнения используют хлорсеребряный электрод.
По окончании работы ионоселективный электрод и наконечник электролитического ключа обмывают дистиллированной водой.
Между анализами ионоселективный кальциевый электрод хранят в стаканчике с раствором хлористого кальция концентрацией 0,001 моль/дм3.
4.3.5. Подготовка анионита – по ГОСТ 10896-78.
4.4. Проведение анализа
На характер градуировочного графика влияют ионная сила раствора и присутствующие в воде гидрокарбонат-ионы. Влияние ионной силы устраняют добавлением буферного раствора. Для устранения влияния гидрокарбонат-ионов анализируемую воду пропускают через колонку, наполненную ионообменной смолой марки АВ-17 в Cl-форме. Первые 10 – 20 см3 фильтрата для анализа не используют.
В мерный цилиндр с притертой пробкой вместимостью 50 см3 отмеривают пипетками от 5 до 25 см3 фильтрата для того, чтобы в отобранной пробе содержалось от 4 до 100 мг ионов кальция, пробу фильтрата разбавляют дистиллированной водой до 25 см3 и добавляют 25 см3 буферного раствора. Раствор перемешивают. Подготовленную пробу используют для трех параллельных измерений. Для этого в стаканчик вместимостью 50 см3 отливают около одной трети полученного раствора, погружают в него ионоселективный кальциевый электрод и наконечник электролитического ключа. Потенциал электрода измеряют при помощи прибора для измерения величины потенциала. Показания прибора снимают через 30 с после погружения электрода.
4.4.1. Построение градуировочного графика
В мерные цилиндры с притертыми пробками вместимостью по 50 см3 каждый вносят при помощи пипеток вместимостью 1, 5, 10, 15, 25 см3 соответственно 1, 5, 10, 15, 25 см3 основного стандартного раствора и доводят растворы до 25 см3 дистиллированной водой. Полученные эталонные растворы содержат соответственно ионов кальция 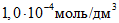
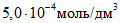
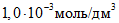
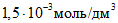
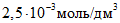
На основании полученных данных строят градуировочный график зависимости потенциала электрода, mV, от концентрации ионов кальция. Для его построения на миллиметровой бумаге на оси абсцисс откладывают отрицательные логарифмы значений концентраций ионов кальция в эталонных растворах, выраженные в г·моль/дм3, а на оси ординат – величины измеренных потенциалов.
Логарифмы значений концентраций ионов кальция, г·моль/дм3, приведены в таблице. Градуировочный график проверяют ежедневно.
4.5. Обработка результатов
Отрицательный логарифм значения концентрации ионов кальция (pC) находят по градуировочному графику, используя среднее арифметическое значение трех параллельных измерений потенциала, проведенных из одной пробы. Концентрацию ионов кальция (C) находят по таблице.
Соотношение между – lgC (pC) и массовой концентрацией
ионов кальция (C)
|
– lg, C (pC) |
C, г·моль/дм3 |
C, мг/дм3 |
|
2,60 |
2,51·10-3 |
100,5 |
|
2,61 |
2,46·10-3 |
98,2 |
|
2,62 |
2,40·10-3 |
96,0 |
|
2,63 |
2,34·10-3 |
93,8 |
|
2,64 |
2,30·10-3 |
91,6 |
|
2,65 |
2,24·10-3 |
89,6 |
|
2,66 |
2,19·10-3 |
87,5 |
|
2,67 |
2,14·10-3 |
85,5 |
|
2,68 |
2,09·10-3 |
83,6 |
|
2,69 |
2,04·10-3 |
81,7 |
|
2,70 |
1,99·10-3 |
79,8 |
|
2,75 |
1,80·10-3 |
72,0 |
|
2,80 |
1,60·10-3 |
64,0 |
|
2,85 |
1,40·10-3 |
56,0 |
|
2,90 |
1,30·10-3 |
52,0 |
|
2,95 |
1,10·10-3 |
44,0 |
|
3,00 |
1,00·10-3 |
40,0 |
|
3,05 |
9,00·10-4 |
36,0 |
|
3,10 |
8,00·10-4 |
32,0 |
|
3,15 |
7,00·10-4 |
28,0 |
|
3,20 |
6,30·10-4 |
25,2 |
|
3,25 |
5,60·10-4 |
22,4 |
|
3,30 |
5,00·10-4 |
20,0 |
|
3,35 |
4,50·10-4 |
18,0 |
|
3,40 |
4,00·10-4 |
16,0 |
|
3,45 |
3,50·10-4 |
14,0 |
|
3,50 |
3,20·10-4 |
12,8 |
|
3,55 |
2,80·10-4 |
11,2 |
|
3,60 |
2,50·10-4 |
10,0 |
|
3,65 |
2,20·10-4 |
8,8 |
|
3,70 |
2,00·10-4 |
8,0 |
|
3,75 |
1,80·10-4 |
7,2 |
|
3,80 |
1,60·10-4 |
6,4 |
|
3,85 |
1,40·10-4 |
5,6 |
|
3,90 |
1,30·10-4 |
5,2 |
|
3,95 |
1,10·10-4 |
4,4 |
|
4,00 |
1,00·10-4 |
4,0 |
При составлении таблицы использована зависимость
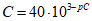
C – концентрация ионов кальция, моль/дм3;
40 – молярная масса иона кальция, г/моль;
pC – отрицательный логарифм концентрации ионов кальция, выраженной в моль/дм3.
Если при подготовке пробы к анализу минеральную воду разбавляют дистиллированной водой, то массовую концентрацию ионов кальция , мг/дм3 вычисляют по формуле
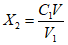
где – массовая концентрация ионов кальция в разбавленной пробе, мг/дм3,
V – объем разбавленного раствора, см3,
– объем минеральной воды, взятый на анализ, см3.
Скачать документ целиком в формате PDF