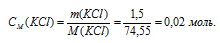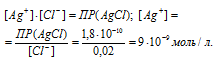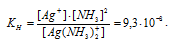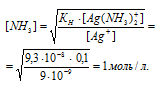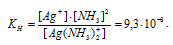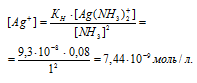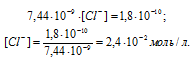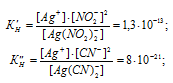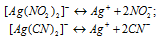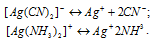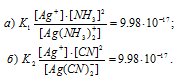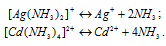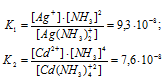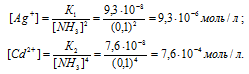Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
Как рассчитывают концентрацию ионов в растворах солей? Поясните на примере, пожалуйста: рассчитать концентрацию катионов в 0,2 М растворе Na2SO4
Ссылка на комментарий
–>
- Решение
- Решение
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
Ссылка на комментарий
- Автор
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
спасибо
Ссылка на комментарий
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 – 0.2 моль
Ответ 0.65 моль/литр
Ссылка на комментарий
- Автор
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 – 0.2 моль
Ответ 0.65 моль/литр
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Ссылка на комментарий
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона – два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
Ссылка на комментарий
- Автор
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона – два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
поняла, спасибо за помощь)
Ссылка на комментарий
-
- Поделиться
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Верный.
Для чего находить массу, и строить какие-то дикие пропорции, если вам нужна молярная концентрация,
когда ответ виден сразу из формулы соли – непонятно
Изменено 10 Апреля, 2016 в 12:45 пользователем M_GM
Ссылка на комментарий
-
- Поделиться
Черт! Я решал как процентную концентрацию!
Например. Берем 20 % раствор сульфата натрия. Определяем конц ионов натрия по верхним 《диким пропорциям》 и вуаля процентная конц катиона равна 6.2%.
Извиняюсь за дезинформацию.
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
Концентрация ионов натрия в растворе хлорида натрия
Вычислите концентрацию ионов натрия (Na+) (в моль/л) в 1,17-процентном растворе хлорида натрия (NaCl), приняв плотность раствора равной 1 г/см3.
Решение задачи
Вычислим массу раствора хлорида натрия по формуле, устанавливающей связь между массой и объемом:
Получаем:
m = 1000 мл ∙ 1 г/мл = 1000 (г).
Найдем массу хлорида натрия (NaCl), содержащегося в 1 л раствора, для этого составим пропорцию:
в 100 г раствора содержится 1,17 г NaCl
в 1000 г раствора содержится г NaCl
Откуда:
Учитывая, что молярная масса хлорида натрия (NaCl) равна 58,5 г/моль, рассчитаем химическое количество хлорида натрия (NaCl), используя формулу, устанавливающую связь между химическим количеством вещества и массой:
Получаем:
Из уравнения диссоциации хлорида натрия (NaCl) (отмечу, что соли в разбавленных растворах диссоциируют полностью):
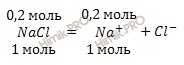
Найдем молярную концентрацию ионов натрия по формуле:
Получаем:
Ответ: концентрацию ионов натрия 0,2 моль/л.
Как найти концентрацию ионов в растворе? При известных концентрации самого вещества, его массе и объеме раствора
Мастер
(1225),
на голосовании
10 лет назад
Голосование за лучший ответ
Харон Гребущий
Профи
(760)
10 лет назад
0) Если известна концентрация вещества и объём раствора, то масса вещества — это лишние данные, её можно посчитать.
1) Сначала нужно узнать, сколько молекул вещества диссоциировало, для этого нам нужно значение степени диссоциации (“альфа”) электролита. Но “альфа” зависит от концентрации электролита, поэтому в таблицах для данного вещества мы найдём только константу диссоциации электролита, связанную с “альфа” и концентрацией вещества по закону разведения Оствальда (см. Вики) .
2) Зная степень диссоциации, находим количество вещества диссоциированных частиц: n=[С (в-ва) *V(р-ра)] *альфа
3) Ну а дальше по уравнению реакции.. .
З. ы. забыл сказать самое главное: если электролит сильный (мин. кислоты, большинство раств. солей, щёлочи) , то он в растворе диссоциирован нацело и значение “альфа” можно брать равным единице.
|
|
Макеты страниц
Вычисление 

Гидролиз по катиону. Соли типа 

В ионной форме это можно записать:

или

Константа гидролиза. Применив к уравнению, выражающему в ионной форме гидролиз соли типа 

Произведение (

Поэтому в общем виде для солей типа 

При математических расчетах, связанных с применением констант равновесия, взаимодействие и образование воды не принимают в расчет, так как 


Умножив и разделив левую часть уравнения (23) на 

Но

а

Подставляя эти значения в уравнение (24), получим:

Например, для случая гидролиза 

Следовательно, константа гидролиза бинарной соли, образованной катионом слабого основания и анионом сильной кислоты, представляет собой отношение ионного произведения воды к константе электролитической диссоциации слабого основания, образующегося в процессе гидролиза.
Вычисление концентрации гидролизованной части соли. Обозначим через 

Согласно уравнению реакции гидролиза:


Подставив в уравнение (23) значения [КЮН], 


Если концентрацию исходной соли принять за 0,01 М, то

Поэтому, пользуясь уравнением (26), можем написать:

откуда

Следовательно, концентрация гидролизованной части соли равна 
Вычисление концентрации ионов водорода. Так как 








Уравнение (27) показывает, что концентрация ионов водорода в водном, растворе бинарных солей (типа 
Вычисление степени гидролиза. Степень гидролиза (для соли типа 

Уравнение (28) показывает, что степень гидролиза солей, образованных катионами слабых оснований и анионами сильных кислот пропорциональна корню квадратному из константы гидролиза и обратно пропорциональна корню квадратному из молярной концентрации соли.
Для двух сравниваемых солей указанного типа степень гидролиза будет тем выше, чем меньше величина константы диссоциации слабого основания 
При концентрации 

б) Вычисление 
Гидролиз по аниону. Соли типа 

в ионной форме:

или в общем виде:

Раствор имеет щелочную реакцию.
Такой случай гидролиза называется гидролизом по аниону.
Константа гидролиза. Применив закон действия масс к уравнению, выражающему в ионной форме гидролиз соли типа 

или в общем виде:

Умножив и разделив левую часть уравнения (29) на 

но

а

откуда

Следовательно, константа гидролиза бинарной соли, образованной катионом сильного основания и анионом слабой кислоты, представляет собой отношение ионного произведения воды к константе электролитической диссоциации слабой кислоты, образующейся в процессе гидролиза. Например, для случая гидролиза KCN можно написать:

Вычисление концентрации гидролизованной части соли. Так как при гидролизе соли 



откуда

Решая это квадратное уравнение, получим:

Вычисление концентрации ионов гидроксила. Подставляя значения 


Так как 


Уравнение (31) показывает, что концентрация ионов гидроксила в водном растворе бинарных солей (типа 
Чтобы найти 



Например, если концентрация раствора KCN равна 0,01 М, то концентрация ионов водорода в этом растворе будет равна

Вычисление степени гидролиза. Из уравнения

следует, что степень гидролиза бинарных солей, образованных анионами слабых кислот и катионами сильных оснований, пропорциональна корню квадратному из константы гидролиза и обратно пропорциональна корню квадратному из молярной концентрации соли.
Для двух сравниваемых солей указанного типа степень гидролиза будет тем больше, чем меньше величина 

Вычисление степени гидролиза солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот. Вычисление степени гидролиза солей типа 



Пример. Вычислить степень гидролиза 0,1 М раствора 
Решение. Гидролиз карбоната натрия протекает согласно следующим уравнениям:

Не принимая в расчет вторую ступень гидролиза, можно написать:

в) Вычисление 
Гидролиз соли такого типа, как, например, 

в ионной форме:

или в общем виде:

Такой случай гидролиза называют гидролизом по катиону и аниону. Водные растворы таких солей имеют нейтральную, кислую или щелочную реакцию в зависимости от величины констант электролитической диссоциации кислот и оснований 
Константа гидролиза. Применив закон действия масс к уравнению, выражающему в ионной форме гидролиз соли типа 

или в общем виде для солей типа 

Умножив числитель и знаменатель уравнения (34) на произведение 

Однако

откуда

Следовательно, константа гидролиза бинарной соли, образованной катионом слабого основания и анионом слабой кислоты, представляет собой отношение ионного произведения воды к произведению констант электролитической диссоциации слабого основания и слабой кислоты, образующихся в процессе гидролиза.
Например, для случая гидролиза 

Вычисление концентрации гидролизованной части соли. Обозначим через 


следует, что 
Равновесные концентрации катиона и аниона равны между собой т. е.

Подставив значения равновесных концентраций в уравнение (34), получим:

Если концентрация гидролизованной части соли относительно невелика, т. е. если данная соль гидролизуется относительно слабо, то 


Например, для 0,01 М раствора 

Вычисление концентрации ионов водорода и гидроксила. Подставив в уравнение (36) значение 



или

Уравнение (38) показывает, что концентрация ионов водорода в водном растворе бинарных солей (типа 
Аналогично поступают при вычислении концентрации ионов гидроксила:

Умножим числитель и знаменатель на величину 

Из уравнений (37) и (39) следует, что растворы бинарных солей слабых кислот и слабых оснований, характеризующихся равными значениями 


Например, для 0,1 н. раствора 

и, соответственно,

Следовательно, в растворе 
Как видно из уравнения (38), 
Вычисление степени гидролиза. Степень гидролиза представляет собой отношение концентрации гидролизованной соли к ее общей концентрации, поэтому, пользуясь приближенной формулой для вычисления 


Из этого уравнения следует, что степень гидролиза бинарных солей, образованных катионами слабых оснований и анионами слабых кислот, пропорциональна корню квадратному из константы гидролиза.
Например, для 

или в процентах: 
Все приближенные формулы для вычисления 
Вычисление степени гидролиза сильно гидролизующихся солей. В случае сильно гидролизующейся соли концентрация ее гидролизованной части 


В аналитической практике имеет большое значение расчет степени гидролиза ряда сильно гидролизующихся солей, образованных катионами слабых оснований и анионами слабых кислот, например 

или

Вычисление проводят по более точной формуле.
Так как степень гидролиза представляет собой отношение 


Другие равновесные концентрации можно представить в следующем виде:

Подставив эти значения равновесных концентраций в уравнение (34), получим:

откуда

Эту формулу и применяют для вычисления степени гидролиза указанных выше солей с той лишь разницей, что вместо 

Таблица 11. Формулы для вычисления 

Пример. Вычислите степень гидролиза растворов 


Для 

Оглавление
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Понятие о количественном анализе
- § 2. Классификация методов количественного анализа
- § 3. Характеристика методов количественного анализа
- § 4. Анализ больших и малых количеств вещества
- § 5. Отбор средней пробы
- § 6. Подготовка вещества для взвешивания
- § 7. Взвешивание
- § 8. Техника взвешивания на аналитических весах
- § 9. Правила обращения с аналитическими весами
- § 10. Приготовление раствора для анализа
- § 11. Запись результатов анализа
- Часть первая. Объемный анализ
- § 1. Сущность объемного анализа
- § 2. Общее уравнение реакции титрования и выводы из него
- Б. ТЕХНИКА ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ОБЪЕМНОМ АНАЛИЗЕ
- § 3. Измерение объемов растворов
- § 4. Посуда, применяемая для измерения объемов растворов
- § 5. Работа с мерными колбами
- § 6. Работа с пипетками
- § 7. Работа с бюретками
- § 8. Приготовление стандартных растворов
- В. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ
- § 9. Концентрация растворов и способы ее выражения
- § 10. Способы вычисления в объемном анализе
- § 11. Связь между точностью измерений и точностью вычислений
- § 12. Краткие сведения о статистической обработке экспериментальных данных
- Г. ПОЛУМИКРООБЪЕМНЫЙ МЕТОД АНАЛИЗА
- § 13. Понятие о полумикрообъемном анализе
- § 14. Особенности техники измерения объемов растворов в полумикрометоде
- Д. БЕЗБЮРЕТОЧНЫЕ МЕТОДЫ ТИТРОВАНИЯ
- § 15. Понятие о безбюреточных методах титрования
- § 16. Классификация методов безбюреточного титрования
- Е. АВТОМАТИЧЕСКИЕ МЕТОДЫ
- § 17. Химико-аналитический контроль производства
- § 18. Автоматические методы титрования
- ГЛАВА II. МЕТОДЫ НЕЙТРАЛИЗАЦИИ, ИЛИ МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
- § 1. Характеристика метода
- § 2. Установление точки эквивалентности
- § 3. Графический метод изображения процесса нейтрализации
- § 4. Вычисление концентрации ионов водорода в водных растворах сильных кислот и оснований
- § 5. Вычисление активности ионов водорода в водных растворах сильных кислот и оснований
- § 6. Титрование сильной кислоты сильным основанием
- § 7. Вычисление концентрации ионов водорода в растворах слабых кислот и оснований
- § 8. Вычисление активности ионов водорода в водных растворах слабых кислот и оснований
- § 9. Равновесия в водных буферных растворах слабых кислот в присутствии солей этих кислот
- § 10. Равновесия в водных буферных растворах слабых оснований в присутствии солей этих оснований
- § 11. Вычисление концентрации ионов водорода в водных буферных растворах
- § 12. Вычисление активности ионов водорода в водных буферных растворах
- § 13. Вычисление концентрации ионов водорода и степени гидролиза в водных растворах гидролизующихся бинарных солей
- § 14. Вычисление активности ионов водорода в водных растворах гидролизующихся бинарных солей
- § 15. Титрование слабой кислоты сильным основанием
- § 16. Титрование слабого основания сильной кислотой
- § 17. Титрование многоосновных кислот
- § 18. Титрование солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот
- § 19. Изменение активности и показателя активности ионов водорода в процессе титрования водных растворов кислот и оснований
- § 20. Выводы, вытекающие из рассмотрения кривых нейтрализации
- § 21. Индикаторы
- § 22. Интервал перехода индикатора
- § 23. Выбор индикатора
- § 24. Ошибки титрования
- Б. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 25. Организация рабочего места
- § 26. Приготовление стандартных (титрованных) растворов
- § 27. Приготовление 0,1 н. раствора хлористоводородной кислоты
- § 28. Установка титра 0,1 н. раствора хлористоводородной кислоты
- § 29. Приготовление 0,1 н. раствора едкого натра
- § 30. Установка титра 0,1 н. раствора едкого натра
- § 31. Определение карбонатов
- § 32. Определение содержания H2SO4 в технической серной кислоте
- § 33. Определение содержания уксусной кислоты
- § 34. Определение содержания Na2CO3 и NaOH при их совместном присутствии
- § 35. Определение содержания Na2CO3 и NaHCO3 при их совместном присутствии
- § 36. Определение жесткости воды
- § 37. Определение аммонийного азота в солях аммония
- § 38. Определение содержания фосфорной кислоты
- В. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ
- § 39. Неводные растворы
- § 40. Современные представления о кислотах и основаниях
- § 41. Диссоциация электролитов в неводных растворах
- § 42. Влияние неводных растворителей на силу кислот и оснований
- § 43. Применение закона действия масс к растворам сильных электролитов
- § 44. Титрование кислот и оснований в неводных растворах
- § 45. Методы кислотно-основного титрования в неводных средах
- § 46. Примеры практических определений в неводных растворах
- ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ)
- § 1. Значение окислительно-восстановительных потенциалов
- § 2. Реакции окисления—восстановления и комплексообразования
- § 3. Примеры окислительно-восстановительного титрования
- § 4. Константы равновесия окислительно-восстановительных реакций
- § 5. Связь между константами равновесия окислительно-восстановительных реакций и нормальными потенциалами
- § 6. Вычисление констант равновесия окислительно-восстановительных реакций
- § 8. Зависимость скорости реакций окисления—восстановления от различных факторов
- § 9. Графический метод изображения процесса окисления—восстановления
- § 10. Фиксирование точки эквивалентности в методах окисления—восстановления
- § 11. Окислительно-восстановительные индикаторы (ред-окс-индикаторы)
- Б. ПЕРМАНГАНАТОМЕТРИЯ
- § 12. Основы перманганатометрии
- § 13. Титрование перманганатом в кислой среде
- § 14. Титрование перманганатом в щелочной среде
- § 15. Приготовление стандартного (титрованного) раствора перманганата калия
- § 16. Установка титра стандартного раствора перманганата калия
- § 17. Установка титра и нормальности раствора перманганата калия по оксалату аммония
- § 18. Вещества, определяемые методом перманганатометрии
- ОПРЕДЕЛЕНИЕ ВОССТАНОВИТЕЛЕЙ
- § 19. Определение щавелевой кислоты и оксалатов
- § 20. Определение соединений железа (II)
- § 21. Определение содержания металлического железа в присутствии окислов железа
- § 22. Определение азотистой кислоты и нитритов
- § 23. Определение содержания марганца (II) в рудах
- ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ
- § 24. Определение соединений железа (III)
- § 25. Определение нитратов
- § 26. Определение бихроматов
- § 27. Определение содержания MnO2 в пиролюзите
- ОПРЕДЕЛЕНИЕ ДРУГИХ ВЕЩЕСТВ
- § 28. Определение ионов кальция
- В. ИОДОМЕТРИЯ
- § 29. Основы иодометрии
- § 30. Методы иодометрического титрования
- § 31. Преимущества и недостатки иодометрического метода
- § 32. Приготовление стандартного (титрованного) раствора тиосульфата и установка его титра
- § 33. Приготовление стандартного (титрованного) раствора иода и установка его титра
- МЕТОДЫ ПРЯМОГО ТИТРОВАНИЯ
- § 34. Определение мышьяка (III)
- МЕТОДЫ ОБРАТНОГО ТИТРОВАНИЯ
- § 35. Определение сульфита натрия
- § 36. Определение содержания формальдегида в формалине
- МЕТОДЫ КОСВЕННОГО ОПРЕДЕЛЕНИЯ
- § 37. Определение ионов меди (II)
- § 38. Определение двуокиси свинца в сурике
- МЕТОД ТИТРОВАНИЯ ЗАМЕСТИТЕЛЕЙ
- § 39. Определение содержания двуокиси марганца в пиролюзите
- МЕТОД ОПРЕДЕЛЕНИЯ КИСЛОТ
- § 40. Определение хлористоводородной кислоты
- § 41. Определение воды по Фишеру
- Г. ПОНЯТИЕ О ДРУГИХ МЕТОДАХ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ
- § 42. Хроматометрия
- § 43. Определение содержания железа (II)
- § 44. Цериметрия
- § 45. Броматометрия
- § 46. Ванадатометрия
- § 47. Аскорбинометрия
- § 48. Титанометрия
- ГЛАВА IV. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ
- § 1. Общая характеристика методов
- § 2. Классификация методов осаждения и комплексообразования
- § 3. Применение теории осаждения к объемному анализу
- § 4. Вычисление растворимости электролитов в воде с учетом коэффициентов активности
- § 5. Влияние одноименных ионов на растворимость малорастворимого электролита
- § 6. Солевой эффект
- § 7. Влияние концентрации ионов водорода на растворимость малорастворимых соединений
- § 8. Кривые титрования в методе осаждения
- § 9. Общие выводы, вытекающие из рассмотрения кривых осаждения
- § 10. Адсорбционные явления, наблюдаемые при титровании по методу осаждения
- Б. АРГЕНТОМЕТРИЯ
- § 11. Характеристика метода
- § 12. Приготовление 0,1 н. раствора нитрата серебра
- § 13. Приготовление стандартного раствора хлорида натрия
- § 14. Установка титра 0,1 н. раствора нитрата серебра по точной навеске хлорида натрия
- §15. Определение ионов хлора в техническом хлориде натрия по методу Мора
- § 16. Определение хлоридов по методу Фаянса
- В. РОДАНОМЕТРИЯ
- § 17. Характеристика метода
- § 18. Приготовление 0,1 н. раствора роданида аммония
- § 19. Определение ионов хлора в растворимых хлоридах по методу Фольгарда
- § 20. Определение серебра в сплавах
- Г. МЕРКУРИМЕТРИЯ
- § 21. Характеристика метода
- § 22. Приготовление 0,1 н. раствора нитрата ртути (II)
- § 23. Установка титра раствора нитрата ртути (II)
- § 24. Определение ионов хлора в воде меркуриметрическим методом
- Д. МЕРКУРОМЕТРИЯ
- § 25. Краткая характеристика метода
- Е. КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ)
- § 26. Характеристика метода
- § 27. Теоретические основы комплексонометрического титрования
- § 28. Классификация методов комплексонометрического титрования
- § 29. Установка титра раствора комплексона III
- § 30. Определение содержания кальция
- § 31. Определение жесткости воды комплексонометрическим методом
- § 32. Анализ смеси ионов кальция и магния
- § 33. Определение содержания алюминия
- § 34. Раздельное определение ионов кальция и алюминия
- § 35. Раздельное определение ионов алюминия и железа
- Часть вторая. Весовой анализ
- § 1. Сущность весового анализа
- § 2. Классификация методов весового анализа
- § 3. Расчеты в весовом анализе
- Б. ТЕХНИКА ВЕСОВОГО АНАЛИЗА
- § 4. Взятие и растворение навески
- § 5. Техника осаждения
- § 6. Фильтрование и промывание осадков
- § 7. Получение весовой формы
- § 8. Взвешивание весовой формы
- В. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
- § 9. Теоретические основы выделения осадков из растворов с помощью специфических неорганических и органических реактивов
- § 10. Требования, предъявляемые к осадкам
- § 11. Методы повышения точности весовых определений
- § 12. Теоретические обоснования выбора оптимальных условий для весового определения
- Г. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 13. Определение кристаллизационной воды в BaCl2 2H2O
- § 14. Определение сульфат-ионов или серы
- § 15. Определение ионов железа (III)
- § 16. Определение содержания кальция в карбонате кальция
- § 17. Определение содержания магния
- § 18. Определение ионов хлора в растворимых хлоридах или в хлористоводородной кислоте
- § 19. Анализ силикатов
- § 20. Анализ доломита
- § 21. Анализ бронзы и латуни
- Д. МЕТОДЫ ВЕСОВЫХ ОПРЕДЕЛЕНИЙ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ РЕАКТИВОВ
- § 22. Определение никеля
- § 23. Определение алюминия
- Часть третья. Понятие о физических и физико-химических (инструментальных) методах анализа
- § 1. Электрохимические методы
- § 2. Спектральные (оптические) методы
- § 3. Хроматографические методы
- § 4. Радиометрические методы
- § 5. Масс-спектрометрические методы
- ГЛАВА VII ЭЛЕКТРОВЕСОВЫЕ МЕТОДЫ АНАЛИЗА
- § 1. Характеристика методов электроанализа
- § 2. Химические процессы, протекающие при электролизе
- § 3. Методы электроанализа
- § 4. Электровесовой анализ
- § 5. Метод внутреннего электролиза
- § 6. Определение меди в растворе сульфата меди с применением платиновых сетчатых электродов
- § 7. Определение меди и свинца в латуни с применением платиновых сетчатых электродов
- § 8. Определение малых количеств меди методом внутреннего электролиза
- ГЛАВА VIII. ОБЪЕМНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Особенности объемных электрохимических методов анализа
- § 2. Кондуктометрическое титрование
- § 3. Высокочастотное титрование
- § 4. Потенциометрическое титрование
- § 5. Полярографический метод анализа
- § 6. Амперометрическоб титрование
- § 7. Кулонометрическое титрование
- ГЛАВА IX. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Понятие об эмиссионном спектральном анализе
- Б. КОЛОРИМЕТРИЯ
- § 2. Особенности колориметрических методов анализа
- § 3. Характеристика колориметрических методов анализа
- В. ОПТИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
- § 4. Спектрофотометрическое титрование
- § 5. Фототурбидиметрическое и фотонефелометрическое титрование
- Г. ЛАБОРАТОРНЫЕ РАБОТЫ
- § 6. Определение содержания ионов железа методом колориметрического титрования
- § 7. Определение содержания титана
- ГЛАВА X. МЕТОДЫ РАЗДЕЛЕНИЯ, ВЫДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ ОТДЕЛЬНЫХ КОМПОНЕНТОВ АНАЛИЗИРУЕМЫХ СМЕСЕЙ
- § 1. Определение следов элементов (микропримесей)
- § 2. Метод осаждения малорастворимых соединений
- § 3. Электрохимические методы разделения
- § 4. Метод экстрагирования
- § 5. Методы отгонки летучих соединений
- § 6. Хроматографические методы разделения
- § 7. Метод флотации
Расчет концентрации ионов металлов и условия протекания реакций комплексных соединений
Задача 734.
Сколько молей аммиака должно содержаться в 1 л 0,1 М раствора [Ag(NH3)2]NO3, чтобы прибавление 1,5 г КСI к 1 л раствора не вызвало выпадения АgС1? ПР(AgCl) = 1,8 . 10-10.
Решение:
М(KCl) = 74,55г/моль. Находим концентрацию хлорида калия:
Теперь рассчитаем концентрацию ионов Ag+ из произведения растворимости AgCl, учитывая, что концентрация ионов равна концентрации KCl, получим:
Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 . 10-9. Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag+ + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
Выражение константы нестойкости комплексного иона [Ag(NH3)2]+ имеет вид:
Отсюда выражаем концентрацию в 0,1 М растворе комплексной соли [Ag(NH3)2]NO3:
Ответ: Чуть больше 1 моль/л.
Задача 735.
Какова концентрация ионов серебра в 0,08 М растворе [Ag(NH3)2]NO3, содержащем 1 моль/л аммиака? Сколько граммов NаСI можно прибавить к 1 л этого раствора до начала выпадения осадка АgС1? ПР(AgCl) = 1,8 . 10-10.
Решение:
М(NaCl) = 58,43г/моль. Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 . 10-9. Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag+ + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда
[NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ может быть приравнена общей концентрации комплексной соли (0,08 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
Для того чтобы начал выпадать осадок соли AgCl при реакции:
[Ag(NH3)2]NO3 + NaCl = AgCl↓ + NaNO3 + 2NH3
необходимо чтобы произведение концентраций ионов Ag+ и Cl– было равно или больше ПР(AgCl), т.е. [Ag+] . [Cl–] = ПР(AgCl). Исходя из этого выражения, рассчитаем концентрацию ионов хлора, получим:
Следовательно, концентрация ионов хлора будет численно равна концентрации хлорида натрия ([Cl–] = [NaCl] = 2,4 . 10-2 моль/л), добавленного к раствору комплексной соли. Отсюда можно рассчитать массу хлорида натрия, получим:
m(NaCl) = [NaCl] . M(NaCl) = (2,4 . 10-2) . 58,43 = 1,4г.
Ответ: 1,4г.
Задача 736.
Константы нестойкости ионов [Ag(NO2)2]– и [Ag(CN)2]– соответственно равны 1.3 . 10-13 и 8 . 10-21. Каково соотношение равновесных концентраций ионов в растворах K[Ag(NO2)2](С1) и K[Ag(CN)2](Сl2) одинаковой молярной концентрации: а) С1 > С2; б) С1= С2; в) С1 < С2?
Решение:
Выражения констант нестойкости ионов имеют вид:
Вторичная диссоциация комплексных ионов:
Так как молярные концентрации комплексных солей одинаковы, то концентрационными величинами можно пренебречь, тогда
[Ag+](C1) = 1.3 . 10-13 моль/л); [Ag+](C2) = 8 . 10-21 моль/л).
Следовательно, С1 > С2.
Ответ: а).
Задача 737.
Иодид калия осаждает серебро в виде АgI из раствора [Ag(NH3)2]NO3, но не осаждает его из раствора K[Ag(CN)2] той же молярной концентрации. Каково соотношение между значениями констант нестойкости ионов[Ag(NH3)2]+(К1) и [Ag(CN)2]–(К2): а) К1 > К2; б) К1 = К2; в) К1 < К2?
Решение:
ПР(АgI) = 9,98 . 10-17.
Вторичная диссоциация комплексных ионов протекает по схемам:
Условие образование осадка АgI может быть записан следующим образом:
[Ag+] . [I–] = ПР(AgI) = 9,98 . 10-17.
В растворе комплексной соли при заданных условиях концентрации ионов Ag+ вычисляются из уравнения выражения констант нестойкости комплексных ионов, получим:
Концентрация ионов I– в обоих случаях одинакова, но в первом случае (К1 образуется осадок, а во втором случае (К2) – осадок не образуется. Поэтому можно записать:
K1 > ПР(АgI) – садок образуется;
K2 < ПР(АgI) – садок не образуется.
Отсюда К1 > K2.
Ответ: а).
Задача 738.
Константы нестойкости ионов [Ag(NH3)2]+ и [Сd(NH3)2+ близки по значению (соответственно 9,3 . 10-8 и 7,6 . 10-8). Указать правильные соотношения концентраций свободного иона металла С(Ag+) и С(Cd2+) в растворах [Ag(NH3)2]Cl и [Сd(NH3)Cl2 одинаковой молярной концентрации, содержащих, кроме того, 0,1 моль/л МН3: а) С(Ag+) > С(Cd2+); б) С(Ag+) = С(Cd2+); в) С(Ag+) < С(Cd2+).
Решение:
Вторичная диссоциация комплексных ионов протекает по следующим уравнениям:
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ и [Сd(NH3)2+ может быть приравнена общей концентрации комплексной соли, т.е. ими можно пренебречь.
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+ и Cd2+:
Так как 9,3 . 10-8 < 7,6 . 10-8, то К1 < K2.
Ответ: в).