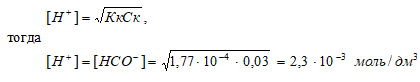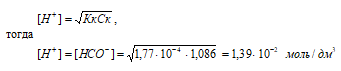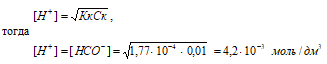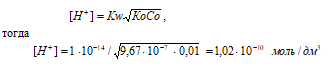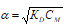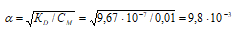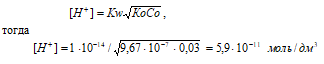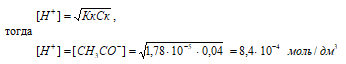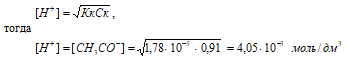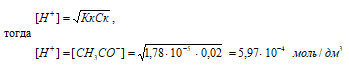Расчет концентрации ионов в растворе одного вещества
Концентрация
ионов определяется степенью диссоциации
()
и молярной концентрацией вещества (См).
Случай
А. Сильные электролиты
Здесь
достаточно хорошим приближением является
= 1, т.е. все молекулы полностью диссоциированы
на ионы.
Пример
1
Рассчитать
концентрацию всех ионов в 1 М растворе
Al2(SO4)3.
Решение
Al2(SO4)3
– соль, т. е. сильный электролит. Она
диссоциирует в одну ступень нацело и
необратимо:
Al2(SO4)3
2Al3+
+ 3SO42-.
Из
уравнения диссоциации видно, что из
одной молекулы соли образуются 2 иона
алюминия и 3 сульфат-иона
[Al3+]=2Cм
= 2 моль/л; [SO42-]=
3См
= 3 моль/л.
Пример
2
Рассчитать
рН 0.1 М раствора NaOH.
Решение
Гидроксид
натрия – щелочь (сильное основание),
следовательно, диссоциирует необратимо
и полностью:
NaOH
Na++OH–
;
при
диссоциации из его одной молекулы
образуется один гидроксид-ион,
следовательно,
[OH–]=
См = 0.1 моль/л,
рОН
= – lg
[OH–]=
1,
pH=
14- рОН = 13.
Случай
В. Несильные электролиты
Соли,
как правило, являются сильными
электролитами, поэтому этот случай
относится к несильным кислотам и
основаниям.
Пример
3
Рассчитать
концентрацию всех ионов в 0.2 М растворе
сернистой кислоты и ее степень диссоциации
по первой и второй ступеням.
Решение
Здесь
,
диссоциация обратима:
первая
ступень H2SO3
HSO3–
+ H+,
Ка1=
[HSO3–][H+]/[H2SO3]=
1.610-2
; (1)
вторая
ступень HSO3–
SO32-
+ H+,
Ka2=
[SO32-][H+]/[HSO3–]=
6.310-8
. (2)
Из
уравнений диссоциации следует, что
образование одного иона HSO3–
сопровождается образованием одного
иона H+,
а образование одного иона SO32-
сопровождается образованием двух H+,
следовательно, концентрации всех ионов
связаны уравнением
[HSO3–]+
2[SO32-]=
[H+],
(3)
а
равновесная концентрация кислоты
определяется уравнением
[H2SO3]=
Cм
– [HSO3–]-
[SO32-].
(4)
Решая
систему уравнений (1)-(4) можно рассчитать
концентрации всех ионов, однако следует
обратить внимание на то, что Ka1Ka2.
Отсюда следует, что концентрации ионов
Н+
и HSO3–
определяются, главным образом, диссоциацией
по первой ступени. Вторая ступень
диссоциации играет главную роль лишь
в образовании ионов SO32-.
Расчет
[Н+],
[HSO3–]
и [H2
SO3]
Из
уравнения (1) следует, что при распаде
одной молекулы кислоты образуется один
ион Н+
и один ион HSO3–,
следовательно, концентрации этих ионов
равны х = [Н+]
= [HSO3-2],
а равновесная концентрация [H2
SO3]=
См – х.. Подставляя эти выражения в закон
действия масс для первой ступени, получим
Ка1=
х2
/(См – х)= 1.610-2
или
х2
/(0.2- х)= 1.610-2,
откуда
х1
= -6.510-2
и х2
= 4.910-2.
Концентрация не может быть отрицательной
величиной, поэтому решением является
второй корень уравнения. Окончательно
можно записать
[Н+]
= [HSO3–]
= 4.910-2
моль/л, [H2
SO3]=
0.151 моль/л,
1
= [Н+]/См
= 4.910-2
моль/л/0.2 моль/л = 0.245, или 24.5%.
Расчет
[SO32-]
Из
равенства значений [Н+]
и [HSO3–]
в соответствии с уравнением (2) следует
[SO32-][H+]/[HSO3–]=
[SO32-]
= Ка2
= 6.310-8
моль/л,
2
= [SO32-]/[HSO3–]=
6.310-8
моль/л./ 4.910-2
моль/л = 1.29 10-6.
ВЫВОД:
при расчете рН растворов слабых
электролитов достаточно рассмотреть
первую ступень диссоциации.
Пример
4
Рассчитать
степень диссоциации гидроксида аммония
и рН его 5%- раствора (плотность раствора
=0.97
г/мл).
Решение
1).
Для решения задачи необходимо знать
молярную концентрацию вещества. Для ее
расчета удобно исходить из 1 литра
раствора:
его
масса mp=
V
= 1000 мл0.97
г/мл = 970 г;
масса
растворенного вещества m=
mp
= 970 г0.05
= 48.5 г;
количество
растворенного вещества =
m/М
= 48.5 г/35г/моль =1.39 моль;
молярная
концентрация См=/
V=
1.39 моль/1 л = 1.39 моль/л.
2).
Рассмотрим равновесие:
NH4OH
NH4+
+
OH–.
Кв=
[NH4+][OH–]/[NH4OH]=
1.810-5
.
Воспользуемся
законом разбавления Оствальда
=
(К/См)
= =(1.810-5
/1.39) = 3.6 10-3
;
1,
следовательно, применение этого закона
допустимо. При диссоциации одной молекулы
исходного вещества образуется 1 ион
ОН–;
в одном литре раствора диссоциирует
См
молекул, следовательно, образуется
столько же ионов ОН–,
тогда
[ОН–]=
См
=3.6 10-3
1.39 моль/л = 5.0010-3
моль/л,
рОН
= – lg[ОН–]
= – lg
5.0010-3
= 2.30,
pH
= 14-pOH=
14 -2.30 = 11.70.
Замечание:
если результатом расчета по закону
разбавления оказывается, что
0.1, то для расчета
необходимо воспользоваться более точным
уравнением К=2См/(1-)
или сначала рассчитать равновесные
концентрации ионов (см. пример 3), а затем
..
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как найти концентрацию ионов в растворе? При известных концентрации самого вещества, его массе и объеме раствора
Мастер
(1225),
на голосовании
10 лет назад
Голосование за лучший ответ
Харон Гребущий
Профи
(760)
10 лет назад
0) Если известна концентрация вещества и объём раствора, то масса вещества — это лишние данные, её можно посчитать.
1) Сначала нужно узнать, сколько молекул вещества диссоциировало, для этого нам нужно значение степени диссоциации (“альфа”) электролита. Но “альфа” зависит от концентрации электролита, поэтому в таблицах для данного вещества мы найдём только константу диссоциации электролита, связанную с “альфа” и концентрацией вещества по закону разведения Оствальда (см. Вики) .
2) Зная степень диссоциации, находим количество вещества диссоциированных частиц: n=[С (в-ва) *V(р-ра)] *альфа
3) Ну а дальше по уравнению реакции.. .
З. ы. забыл сказать самое главное: если электролит сильный (мин. кислоты, большинство раств. солей, щёлочи) , то он в растворе диссоциирован нацело и значение “альфа” можно брать равным единице.
Как вычислить концентрацию ионов в растворе электролита и рН раствора
Задача 73.
Вычислите концентрацию ионов НСОО–, Н+ и рН в: а) 0,03 М НСООН; б) растворе (w% = 5,0%); в) растворе, содержащем 4,6 г/дм3 НСООН.
Решение:
KD(НСООН) = 1,77 · 10–4;
CM(HCOOH) = 0,03 M;
w%(HCOOH) = 5,0%;
M(НСООН) = 46,03 г/моль.
а) 0,03 М НСООН
Диссоциация муравьиной кислоты: HCOOH = Н+ + НСОО–;
[H+] = [HCOO–].
НСООН – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
рН = –lg[H+] = –lg2,3 · 10–3 = 3 – lg2,3 = 2,64.
Ответ: [H+] = [HCOO–] = 2,3 · 10–3 моль/ дм3; рН = 2,64.
б) растворе (w% = 5,0%)
Концентрацию кислоты находим из вычисления: CM(HCOOH) = [(w% · 1000г)/100%]/M(НСООН); CM(HCOOH) = [(5% · 1000г)/100%]/46,03 г/моль = 1,086 моль.
Рассчитаем [H+] и [HCOO–]
рН = –lg[H+] = –lg1,39 · 10–2 = 2 – lg1,39 = 1,86.
Ответ: [H+] = [HCOO–] = 1,39 · 10–2 моль/дм3; рН = 1,86.
в) растворе, содержащем 4,6 г/дм3 НСООН
Концентрацию кислоты находим из вычисления: CM(HCOOH) = m(HCOOH)/М(HCOOH) = 4,6/46,03 = 0,01 M.
Рассчитаем [H+] и [HCOO–]
рН = –lg[H+] = –lg4,2 · 10–3 = 3 – lg4,2 = 2,38.
Ответ: [H+] = [HCOO–] = 4,2 · 10–3 моль/дм3; рН = 2,38.
Задача 74.
Вычислите концентрацию ионов ОН–, Н+ и рН в: а) 0,01 М NH2OH; б) растворе NH2OH (w% = 0,1%).
Решение:
KD(NH2OH) = 9,67 · 10–7;
CM(NH2OH) = 0,01 M;
w%(NH2OH) = 0,1%;
M(NH2OH) = 33 г/моль. NH2OH + H2O = NH3OH+ + OH–
а) 0,01 М NH2OH
Диссоциация гидроксиламина: NH2OH + H2O = NH3OH+ + OH–
[OH–] = СМ(NH2OH) = 1 · 10–2 моль/дм3.
NH2OH – слабое основание. Для слабых оснований [H+] вычисляется по формуле:
рН = –lg[H+] = –lg1,02 · 10–10 = 10 – lg1,02 = 9,99.
Так как гидроксиламин (NH2OH) является слабым электролитом, то для расчета применяют упрощенную формулу закона разбавления Оствальда:
где: α – степень диссоциации; KD – константа диссоциации; CM – молярная концентрация электролита.
Подставим данные задачи в уравнение Оствальда, получим:
Теперь рассчитаем концентрацию гидроксид ионов, получим:
[OH–] = СМ · α = 0,01 · (9,80 · 10–3) = 9,80 · 10–5 моль/дм3.
Ответ: а) [H+] = 1,02 · 10–10 моль/дм3; [ОН–] = 9,80 · 10–5 моль/дм3; рН = 9,99.
б) растворе NH2OH (w% = 0,1%)
Концентрацию гидроксиламина находим из вычисления:
СМ(NH2OH) = [(w% . 1000г)/100%]/M(NH2OH); СМ(NH2OH) = [(0,1% . 1000г)/100%]/33 г/моль = 0,03 моль.
Рассчитаем [H+], получим:
рН = –lg[H+] = –lg5,9 · 10-11 = 11 – lg5,9 = 10,24.
Ответ: [H+] = 5,9 · 10-11 моль/дм3; рН = 10,24.
Задача 75.
Вычислите концентрацию ионов СН3СОО–, Н+ и рН в: а) 0,04 М СН3СООН; б) растворе (w% = 5,5%); в) растворе, содержащем 1,2 г/дм3 CН3СООН.
Решение:
KD(СН3СООН) = 1,78 · 10–5;
CM(СH3COOH) = 0,04 M;
w%(СH3COOH) = 5,5%;
M(СН3СООН) = 60 г/моль.
а) 0,04 М СН3СООН
Диссоциация уксусной кислоты: СH3COOH ⇔ Н+ + СН3СОО–;
[H+] = [СH3COO–].
СН3СООН – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
рН = –lg[H+] = –lg8,4 · 10–4 = 4 – lg8,4 = 3,08.
Ответ: [H+] = [HCOO–] = 8,4 · 10–4 моль/ дм3; рН = 3,08.
б) растворе (w% = 5,5%)
Концентрацию кислоты находим из вычисления:
СМ(СH3COOH) = [(w% . 1000г)/100%]/M(СН3СООН); СМ(СH3COOH) = [(5,5% . 1000г)/100%]/60 г/моль = 0,92 моль.
Рассчитаем [H+] и [СH3COO–]
рН = –lg[H+] = –lg4,05 · 10–3 = 3 – lg4,05 = 2,39.
Ответ: [H+] = [СH3COO–] = 4,05 · 10–3 моль/дм3; рН = 2,39.
в) растворе, содержащем 1,2 г/дм3 CН3СООН
Концентрацию кислоты находим из вычисления: (CM(СH3COOH) = m(СH3COOH)/М(СH3COOH) = 1,2/60 = 0,02 M.
Рассчитаем [H+] и [СH3COO–]
рН = –lg[H+] = –lg5,97 · 10–4 = 4 – lg5,97 = 3,22.
Ответ: [H+] = [СH3COO–] = 5,97 · 10–4 моль/дм3; рН = 3,22.
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
Как рассчитывают концентрацию ионов в растворах солей? Поясните на примере, пожалуйста: рассчитать концентрацию катионов в 0,2 М растворе Na2SO4
Ссылка на комментарий
–>
- Решение
- Решение
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
Ссылка на комментарий
- Автор
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
спасибо
Ссылка на комментарий
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 – 0.2 моль
Ответ 0.65 моль/литр
Ссылка на комментарий
- Автор
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 – 0.2 моль
Ответ 0.65 моль/литр
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Ссылка на комментарий
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона – два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
Ссылка на комментарий
- Автор
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона – два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
поняла, спасибо за помощь)
Ссылка на комментарий
-
- Поделиться
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Верный.
Для чего находить массу, и строить какие-то дикие пропорции, если вам нужна молярная концентрация,
когда ответ виден сразу из формулы соли – непонятно
Изменено 10 Апреля, 2016 в 12:45 пользователем M_GM
Ссылка на комментарий
-
- Поделиться
Черт! Я решал как процентную концентрацию!
Например. Берем 20 % раствор сульфата натрия. Определяем конц ионов натрия по верхним 《диким пропорциям》 и вуаля процентная конц катиона равна 6.2%.
Извиняюсь за дезинформацию.
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти