Расчет концентрации ионов в растворе одного вещества
Концентрация
ионов определяется степенью диссоциации
()
и молярной концентрацией вещества (См).
Случай
А. Сильные электролиты
Здесь
достаточно хорошим приближением является
= 1, т.е. все молекулы полностью диссоциированы
на ионы.
Пример
1
Рассчитать
концентрацию всех ионов в 1 М растворе
Al2(SO4)3.
Решение
Al2(SO4)3
– соль, т. е. сильный электролит. Она
диссоциирует в одну ступень нацело и
необратимо:
Al2(SO4)3
2Al3+
+ 3SO42-.
Из
уравнения диссоциации видно, что из
одной молекулы соли образуются 2 иона
алюминия и 3 сульфат-иона
[Al3+]=2Cм
= 2 моль/л; [SO42-]=
3См
= 3 моль/л.
Пример
2
Рассчитать
рН 0.1 М раствора NaOH.
Решение
Гидроксид
натрия – щелочь (сильное основание),
следовательно, диссоциирует необратимо
и полностью:
NaOH
Na++OH–
;
при
диссоциации из его одной молекулы
образуется один гидроксид-ион,
следовательно,
[OH–]=
См = 0.1 моль/л,
рОН
= – lg
[OH–]=
1,
pH=
14- рОН = 13.
Случай
В. Несильные электролиты
Соли,
как правило, являются сильными
электролитами, поэтому этот случай
относится к несильным кислотам и
основаниям.
Пример
3
Рассчитать
концентрацию всех ионов в 0.2 М растворе
сернистой кислоты и ее степень диссоциации
по первой и второй ступеням.
Решение
Здесь
,
диссоциация обратима:
первая
ступень H2SO3
HSO3–
+ H+,
Ка1=
[HSO3–][H+]/[H2SO3]=
1.610-2
; (1)
вторая
ступень HSO3–
SO32-
+ H+,
Ka2=
[SO32-][H+]/[HSO3–]=
6.310-8
. (2)
Из
уравнений диссоциации следует, что
образование одного иона HSO3–
сопровождается образованием одного
иона H+,
а образование одного иона SO32-
сопровождается образованием двух H+,
следовательно, концентрации всех ионов
связаны уравнением
[HSO3–]+
2[SO32-]=
[H+],
(3)
а
равновесная концентрация кислоты
определяется уравнением
[H2SO3]=
Cм
– [HSO3–]-
[SO32-].
(4)
Решая
систему уравнений (1)-(4) можно рассчитать
концентрации всех ионов, однако следует
обратить внимание на то, что Ka1Ka2.
Отсюда следует, что концентрации ионов
Н+
и HSO3–
определяются, главным образом, диссоциацией
по первой ступени. Вторая ступень
диссоциации играет главную роль лишь
в образовании ионов SO32-.
Расчет
[Н+],
[HSO3–]
и [H2
SO3]
Из
уравнения (1) следует, что при распаде
одной молекулы кислоты образуется один
ион Н+
и один ион HSO3–,
следовательно, концентрации этих ионов
равны х = [Н+]
= [HSO3-2],
а равновесная концентрация [H2
SO3]=
См – х.. Подставляя эти выражения в закон
действия масс для первой ступени, получим
Ка1=
х2
/(См – х)= 1.610-2
или
х2
/(0.2- х)= 1.610-2,
откуда
х1
= -6.510-2
и х2
= 4.910-2.
Концентрация не может быть отрицательной
величиной, поэтому решением является
второй корень уравнения. Окончательно
можно записать
[Н+]
= [HSO3–]
= 4.910-2
моль/л, [H2
SO3]=
0.151 моль/л,
1
= [Н+]/См
= 4.910-2
моль/л/0.2 моль/л = 0.245, или 24.5%.
Расчет
[SO32-]
Из
равенства значений [Н+]
и [HSO3–]
в соответствии с уравнением (2) следует
[SO32-][H+]/[HSO3–]=
[SO32-]
= Ка2
= 6.310-8
моль/л,
2
= [SO32-]/[HSO3–]=
6.310-8
моль/л./ 4.910-2
моль/л = 1.29 10-6.
ВЫВОД:
при расчете рН растворов слабых
электролитов достаточно рассмотреть
первую ступень диссоциации.
Пример
4
Рассчитать
степень диссоциации гидроксида аммония
и рН его 5%- раствора (плотность раствора
=0.97
г/мл).
Решение
1).
Для решения задачи необходимо знать
молярную концентрацию вещества. Для ее
расчета удобно исходить из 1 литра
раствора:
его
масса mp=
V
= 1000 мл0.97
г/мл = 970 г;
масса
растворенного вещества m=
mp
= 970 г0.05
= 48.5 г;
количество
растворенного вещества =
m/М
= 48.5 г/35г/моль =1.39 моль;
молярная
концентрация См=/
V=
1.39 моль/1 л = 1.39 моль/л.
2).
Рассмотрим равновесие:
NH4OH
NH4+
+
OH–.
Кв=
[NH4+][OH–]/[NH4OH]=
1.810-5
.
Воспользуемся
законом разбавления Оствальда
=
(К/См)
= =(1.810-5
/1.39) = 3.6 10-3
;
1,
следовательно, применение этого закона
допустимо. При диссоциации одной молекулы
исходного вещества образуется 1 ион
ОН–;
в одном литре раствора диссоциирует
См
молекул, следовательно, образуется
столько же ионов ОН–,
тогда
[ОН–]=
См
=3.6 10-3
1.39 моль/л = 5.0010-3
моль/л,
рОН
= – lg[ОН–]
= – lg
5.0010-3
= 2.30,
pH
= 14-pOH=
14 -2.30 = 11.70.
Замечание:
если результатом расчета по закону
разбавления оказывается, что
0.1, то для расчета
необходимо воспользоваться более точным
уравнением К=2См/(1-)
или сначала рассчитать равновесные
концентрации ионов (см. пример 3), а затем
..
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как найти концентрацию ионов в растворе? При известных концентрации самого вещества, его массе и объеме раствора
Мастер
(1225),
на голосовании
10 лет назад
Голосование за лучший ответ
Харон Гребущий
Профи
(760)
10 лет назад
0) Если известна концентрация вещества и объём раствора, то масса вещества — это лишние данные, её можно посчитать.
1) Сначала нужно узнать, сколько молекул вещества диссоциировало, для этого нам нужно значение степени диссоциации (“альфа”) электролита. Но “альфа” зависит от концентрации электролита, поэтому в таблицах для данного вещества мы найдём только константу диссоциации электролита, связанную с “альфа” и концентрацией вещества по закону разведения Оствальда (см. Вики) .
2) Зная степень диссоциации, находим количество вещества диссоциированных частиц: n=[С (в-ва) *V(р-ра)] *альфа
3) Ну а дальше по уравнению реакции.. .
З. ы. забыл сказать самое главное: если электролит сильный (мин. кислоты, большинство раств. солей, щёлочи) , то он в растворе диссоциирован нацело и значение “альфа” можно брать равным единице.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Как вычислить концентрацию ионов в растворе электролита и рН раствора
Задача 73.
Вычислите концентрацию ионов НСОО–, Н+ и рН в: а) 0,03 М НСООН; б) растворе (w% = 5,0%); в) растворе, содержащем 4,6 г/дм3 НСООН.
Решение:
KD(НСООН) = 1,77 · 10–4;
CM(HCOOH) = 0,03 M;
w%(HCOOH) = 5,0%;
M(НСООН) = 46,03 г/моль.
а) 0,03 М НСООН
Диссоциация муравьиной кислоты: HCOOH = Н+ + НСОО–;
[H+] = [HCOO–].
НСООН – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
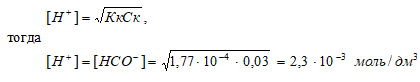
рН = –lg[H+] = –lg2,3 · 10–3 = 3 – lg2,3 = 2,64.
Ответ: [H+] = [HCOO–] = 2,3 · 10–3 моль/ дм3; рН = 2,64.
б) растворе (w% = 5,0%)
Концентрацию кислоты находим из вычисления: CM(HCOOH) = [(w% · 1000г)/100%]/M(НСООН); CM(HCOOH) = [(5% · 1000г)/100%]/46,03 г/моль = 1,086 моль.
Рассчитаем [H+] и [HCOO–]
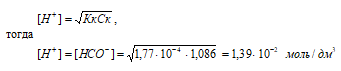
рН = –lg[H+] = –lg1,39 · 10–2 = 2 – lg1,39 = 1,86.
Ответ: [H+] = [HCOO–] = 1,39 · 10–2 моль/дм3; рН = 1,86.
в) растворе, содержащем 4,6 г/дм3 НСООН
Концентрацию кислоты находим из вычисления: CM(HCOOH) = m(HCOOH)/М(HCOOH) = 4,6/46,03 = 0,01 M.
Рассчитаем [H+] и [HCOO–]
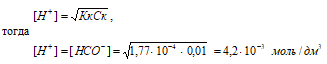
рН = –lg[H+] = –lg4,2 · 10–3 = 3 – lg4,2 = 2,38.
Ответ: [H+] = [HCOO–] = 4,2 · 10–3 моль/дм3; рН = 2,38.
Задача 74.
Вычислите концентрацию ионов ОН–, Н+ и рН в: а) 0,01 М NH2OH; б) растворе NH2OH (w% = 0,1%).
Решение:
KD(NH2OH) = 9,67 · 10–7;
CM(NH2OH) = 0,01 M;
w%(NH2OH) = 0,1%;
M(NH2OH) = 33 г/моль. NH2OH + H2O = NH3OH+ + OH–
а) 0,01 М NH2OH
Диссоциация гидроксиламина: NH2OH + H2O = NH3OH+ + OH–
[OH–] = СМ(NH2OH) = 1 · 10–2 моль/дм3.
NH2OH – слабое основание. Для слабых оснований [H+] вычисляется по формуле:
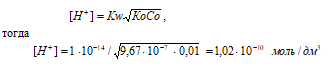
рН = –lg[H+] = –lg1,02 · 10–10 = 10 – lg1,02 = 9,99.
Так как гидроксиламин (NH2OH) является слабым электролитом, то для расчета применяют упрощенную формулу закона разбавления Оствальда:
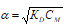
где: α – степень диссоциации; KD – константа диссоциации; CM – молярная концентрация электролита.
Подставим данные задачи в уравнение Оствальда, получим:
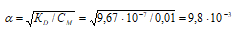
Теперь рассчитаем концентрацию гидроксид ионов, получим:
[OH–] = СМ · α = 0,01 · (9,80 · 10–3) = 9,80 · 10–5 моль/дм3.
Ответ: а) [H+] = 1,02 · 10–10 моль/дм3; [ОН–] = 9,80 · 10–5 моль/дм3; рН = 9,99.
б) растворе NH2OH (w% = 0,1%)
Концентрацию гидроксиламина находим из вычисления:
СМ(NH2OH) = [(w% . 1000г)/100%]/M(NH2OH); СМ(NH2OH) = [(0,1% . 1000г)/100%]/33 г/моль = 0,03 моль.
Рассчитаем [H+], получим:
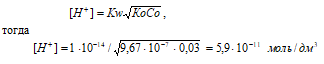
рН = –lg[H+] = –lg5,9 · 10-11 = 11 – lg5,9 = 10,24.
Ответ: [H+] = 5,9 · 10-11 моль/дм3; рН = 10,24.
Задача 75.
Вычислите концентрацию ионов СН3СОО–, Н+ и рН в: а) 0,04 М СН3СООН; б) растворе (w% = 5,5%); в) растворе, содержащем 1,2 г/дм3 CН3СООН.
Решение:
KD(СН3СООН) = 1,78 · 10–5;
CM(СH3COOH) = 0,04 M;
w%(СH3COOH) = 5,5%;
M(СН3СООН) = 60 г/моль.
а) 0,04 М СН3СООН
Диссоциация уксусной кислоты: СH3COOH ⇔ Н+ + СН3СОО–;
[H+] = [СH3COO–].
СН3СООН – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
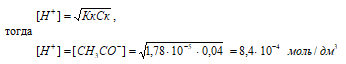
рН = –lg[H+] = –lg8,4 · 10–4 = 4 – lg8,4 = 3,08.
Ответ: [H+] = [HCOO–] = 8,4 · 10–4 моль/ дм3; рН = 3,08.
б) растворе (w% = 5,5%)
Концентрацию кислоты находим из вычисления:
СМ(СH3COOH) = [(w% . 1000г)/100%]/M(СН3СООН); СМ(СH3COOH) = [(5,5% . 1000г)/100%]/60 г/моль = 0,92 моль.
Рассчитаем [H+] и [СH3COO–]
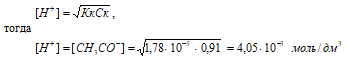
рН = –lg[H+] = –lg4,05 · 10–3 = 3 – lg4,05 = 2,39.
Ответ: [H+] = [СH3COO–] = 4,05 · 10–3 моль/дм3; рН = 2,39.
в) растворе, содержащем 1,2 г/дм3 CН3СООН
Концентрацию кислоты находим из вычисления: (CM(СH3COOH) = m(СH3COOH)/М(СH3COOH) = 1,2/60 = 0,02 M.
Рассчитаем [H+] и [СH3COO–]
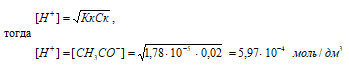
рН = –lg[H+] = –lg5,97 · 10–4 = 4 – lg5,97 = 3,22.
Ответ: [H+] = [СH3COO–] = 5,97 · 10–4 моль/дм3; рН = 3,22.

Электролитическая диссоциация
Задача 53
Указать электролиты среди следующих веществ: 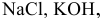
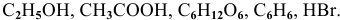
Решение:
К электролитам относятся основания, кислоты и соли. Среди вышеперечисленных веществ электролитами являются: КОН — основание, 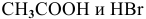 — кислоты и NaCl — соль.
— кислоты и NaCl — соль.
Задача 54
Среди следующих электролитов указать сильные и слабые электролиты: 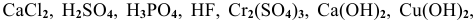
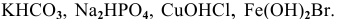 Написать уравнения электролитической диссоциации.
Написать уравнения электролитической диссоциации.
Решение:
При написании уравнений электролитической диссоциации пользуются следующими правилами:
1. Для сильных электролитов условно пишем одну стрелку 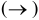 .
.
Например: 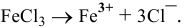 .
.
2. Для слабых и средних электролитов пишем две стрелки в обратных направлениях 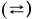 . Диссоциация этих электролитов протекает ступенчато.
. Диссоциация этих электролитов протекает ступенчато.
Например:
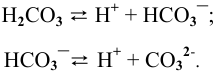
Диссоциация кислых и основных солей происходит следующим образом:
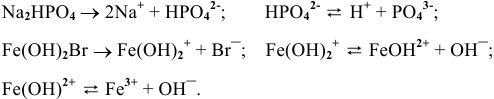
Задача 55
Написать математическое выражение констант диссоциации следующих веществ: 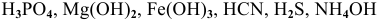
Решение: 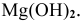 .
.
Диссоциация 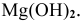 протекает ступенчато. Для каждой ступени запишем выражение константы диссоциации:
протекает ступенчато. Для каждой ступени запишем выражение константы диссоциации:
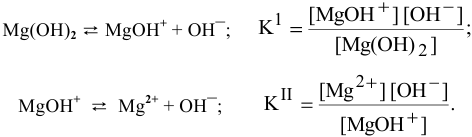
Для суммарного уравнения диссоциации слабого электролита 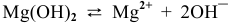 выражение константы диссоциации будет следующим:
выражение константы диссоциации будет следующим:
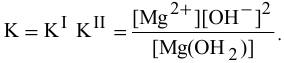
Задача 56
Какова концентрация ионов 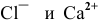 в 0,1 М растворе
в 0,1 М растворе 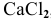 , если степень диссоциации
, если степень диссоциации 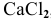 0,65 (65 %)?
0,65 (65 %)?
Решение:
Степень диссоциации определяется по формуле
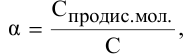
где С — молярная концентрация растворенных молекул,
отсюда
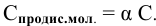
Концентрация ионов определяется по формуле
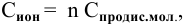
где n — число ионов, образующихся из 1 молекулы. Таким образом,
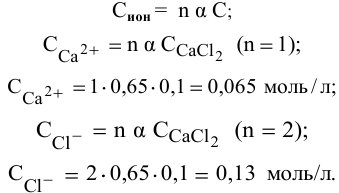
Задача 57
Рассчитать концентрацию раствора 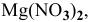 зная, что степень диссоциации равна 0,60, а концентрация ионов
зная, что степень диссоциации равна 0,60, а концентрация ионов 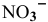 равна 0,16 моль/л.
равна 0,16 моль/л.
Решение:
Воспользуемся формулой
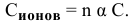
Отсюда 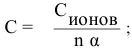
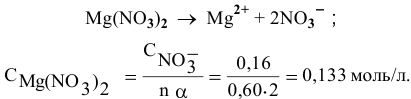
Раствор 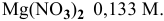
Задача 58
В каком из растворов концентрация ионов водорода выше: 0,001 М раствор 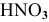 , 1 М раствор
, 1 М раствор 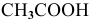 ?
?
Решение:
Для сильных электролитов расчет концентрации ионов производят по степени диссоциации. В справочнике по химии находим степень диссоциации 0,001 М раствора 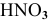 :
:
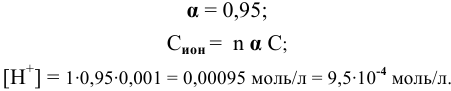
Для слабых электролитов расчет концентрации ионов производят по константе диссоциации.
В справочнике по химии находим константу диссоциации уксусной кислоты:
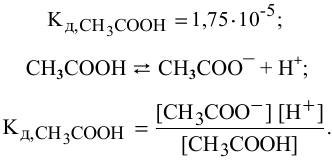
Так как 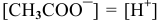 (молекула
(молекула 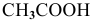 дает равное количество ионов), то
дает равное количество ионов), то
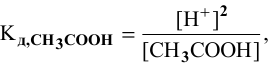
где [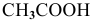 ] — равновесная концентрация непродиссоциированных молекул.
] — равновесная концентрация непродиссоциированных молекул.
Но так как константа диссоциации — очень малая величина, то концентрацией продиссоциированных молекул можно пренебречь и принять концентрацию непродиссоциированных молекул равной концентрации растворенного вещества, т.е. концентрации молекул, внесенных в раствор.
Из предыдущей формулы находим:
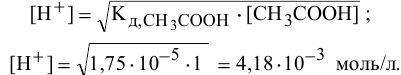
Таким образом, в данном растворе уксусной кислоты, несмотря на то, что она слабая, концентрация ионов 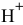 выше, чем в данном растворе
выше, чем в данном растворе 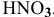 .
.
Задача 59
Рассчитать концентрацию ионов 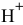 в 0,4 М растворе
в 0,4 М растворе 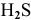 .
.
Решение:
Диссоциация 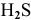 происходит в два этапа:
происходит в два этапа:
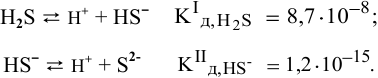
Концентрация ионов водорода, создаваемая по первой стадии диссоциации, во много раз выше концентрации ионов, создаваемой по второй стадии, так как по первой стадии диссоциация намного интенсивнее, чем по второй (см. величины констант диссоциации). По этой причине расчет концентрации ионов производят по константе диссоциации первой стадии:
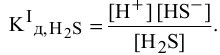
Если пренебречь тем фактом, что незначительная часть ионов 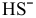 диссоциирует по второй стадии, в результате чего концентрация ионов
диссоциирует по второй стадии, в результате чего концентрация ионов 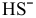 незначительно уменьшается, а концентрация ионов
незначительно уменьшается, а концентрация ионов 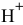 незначительно увеличивается, т.е.
незначительно увеличивается, т.е. 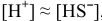 , то можно записать:
, то можно записать:
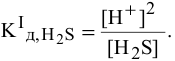
Отсюда
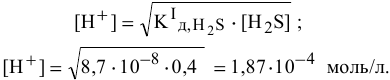
Задача 60
Рассчитать константу диссоциации HCN, зная степень ее диссоциации, равную 0,00007 в 0,1 М растворе.
Решение:
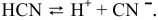
Согласно уравнению 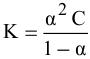 находим значение константы диссоциации:
находим значение константы диссоциации:
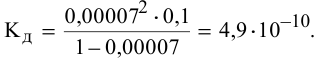
Задача 61
Во сколько раз уменьшится концентрация ионов водорода, если добавить 41 г ацетата натрия в 1 л 0,1 М раствора уксусной кислоты (увеличением объема раствора при добавлении ацетата натрия можно пренебречь) ?
Решение:
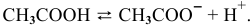
Выражение константы электролитической диссоциации уксусной кислоты —
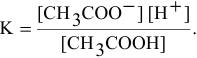
Находим в справочнике значение константы диссоциации уксусной кислоты:
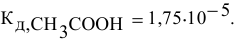
Прежде всего, вычисляем концентрацию ионов водорода в исходном растворе уксусной кислоты.
Так как 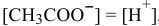 , имеем:
, имеем:
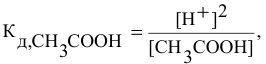
отсюда
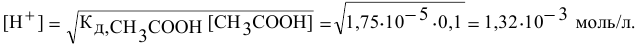
Когда растворяют ацетат натрия, концентрация ионов 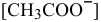 значительно увеличивается, так как ацетат натрия является сильным электролитом:
значительно увеличивается, так как ацетат натрия является сильным электролитом: 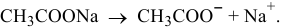
Молярная концентрация ацетата натрия, в предположении, что объем раствора остается равным 1 л, будет следующей:
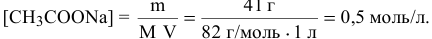
В справочнике находим степень электролитической диссоциации 0,5 М раствора ацетата натрия:
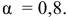
Определяем концентрацию ионов 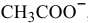 , полученных в результате
, полученных в результате
диссоциации ацетата натрия:
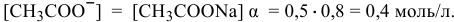
Концентрация ионов 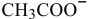 в исходном растворе уксусной кислоты
в исходном растворе уксусной кислоты 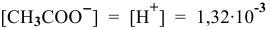 моль/л, намного меньше, чем концентрация ионов
моль/л, намного меньше, чем концентрация ионов 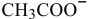 , полученных при диссоциации ацетата натрия, поэтому ею можно пренебречь. В выражение константы диссоциации уксусной кислоты подставляем величину концентрации ионов
, полученных при диссоциации ацетата натрия, поэтому ею можно пренебречь. В выражение константы диссоциации уксусной кислоты подставляем величину концентрации ионов 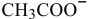 , равную 0,4 моль/л.
, равную 0,4 моль/л.
Находим концентрацию ионов водорода для вновь установившегося равновесия:
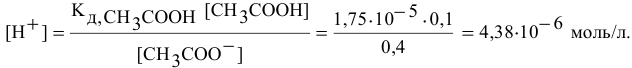
Таким образом, после добавления в раствор уксусной кислоты ацетата натрия концентрация ионов водорода становится равной 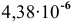 моль/л, а значит, она уменьшается в
моль/л, а значит, она уменьшается в
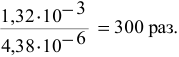
Задача 62
Написать молекулярные и ионные уравнения следующих ионообменных реакций:
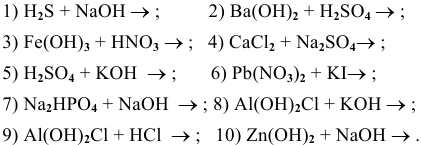
Решение:
Вначале записывается уравнение реакции в молекулярном виде.
Для написания уравнения ионообменной реакции в ионном виде малодиссоциируемые молекулы или ионы, а также молекулы нерастворимых в воде и газообразных веществ записывают как единое целое, тогда как молекулы сильных электролитов записывают в виде ионов, из которых они состоят. Записанное в таком виде уравнение ионообменной реакции представляет собой полное ионное уравнение.
Исключив из этого уравнения ионы, не участвующие в самом ионообменном процессе, получают краткое ионное уравнение ионообменной реакции.
Краткое ионное уравнение ионообменной реакции является выражением реального процесса, происходящего в растворе.

Задача 63
Рассчитать энтальпию растворения электролита 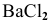 , если энтальпия кристаллической решетки
, если энтальпия кристаллической решетки 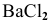 равна
равна 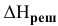 =468 ккал/моль, а энтальпии гидратации ионов равны:
=468 ккал/моль, а энтальпии гидратации ионов равны:
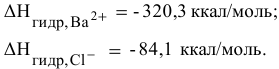
Решение:
Определяем энтальпию гидратации  :
:

Определяем энтальпию растворения  :
:

Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

