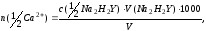Кальций – щелочноземельный металл. Это один из самых распространенных химических элементов (3-е место среди металлов, 5-е место среди всех элементов), на долю минерала приходиться 3,38 % веса земной коры. Из-за высокой химической активности кальций в чистом виде не встречается, его соединения присутствуют в 385 природных минералах.
Итак, в воде есть кальций – что же делать?!
Источники кальция в воде
Кальций в воде встречается в виде солей сильных и слабых кислот: карбонатов и гидрокарбонатов (CaCO3), сульфатов и сульфитов (CaSO4, CaSO3) фторидов (CaF2), фосфатов (Ca5(PO4)3), а также других солей. Основные источники кальция в воде:
- Горные породы, через которые проходит поток воды.
- Выбросы от промышленных предприятий.
- Удобрения отраслей сельского хозяйства, попадающие в воду напрямую или через слой почвы.
Соединения кальция присутствуют в большинстве горных пород и биогенных отложений. Металл также содержится во всех растительных и животных тканях. Его соединения – основа костного скелета, раковин и панцирей беспозвоночных. Давайте разберемся, как определить кальций в воде, и каким должно быть его содержание?
Содержание ионов кальция в воде
В растворенном виде соединения кальция содержатся в морской воде и воде из подземных источников и открытых водоемов. Наибольшее количество кальция присутствует воде из горных рек и источников, артезианских скважин. На высокое содержание кальция в водопроводной воде или воде из скважины указывает:
- Белый нерастворимый осадок, появляющийся после кипячения воды, содержащей кальций.
- Накипь на стенках чайника, резервуара посудомоечной машины, другой кухонной техники.
- Белый налет на кранах и насадках для душа.
- Ухудшение вкуса напитков и приготовленных блюд.
- Потеря цвета ткани после стирки.
- Увеличение расхода мыла и моющих средств.
Как определить количество кальция в воде
Наиболее точный метод определения количества кальция в воде – лабораторный анализ. Такие услуги предоставляют специализированные организации, компании, поставляющие фильтры для воды. Для приблизительной оценки концентрации ионов кальция в воде применяют специальные тестовые полоски, меняющие цвет в зависимости от доли кальция в воде. Также эффективным методом определения кальция в воде является метод титрования. Узнать сколько кальция в воде можно и путем наблюдений, которые мы указали выше.
Нормы по содержанию кальция в воде
Жесткость воды определяется содержанием в ней ионов кальция и магния. Это одна из самых важных характеристик. Различают временную и постоянную жесткость. Первая определяется долей гидрокарбонатов кальция. При нагреве и кипячении эти соединения разлагаются с выделением углекислого газа и нерастворимого осадка. Временная жесткость имеет второе название – гидрокарбонатная жесткость.
Постоянная жесткость зависит от содержания сульфатов, хлоридов магния и кальция. Эти соли не разлагаются при кипячении. Такая жесткость называется некарбонатной.
По катионному составу различают кальциевую и магниевую жесткость. Вода из источников, залегающих в известняковых породах, имеет высокое содержание ионов кальция. Вода из районов с залежами доломита имеет преимущественно магниевую жесткость.
Международная единица измерения жесткости – моль/м3. В технических и лабораторных измерениях используется миллиграмм-эквивалент на литр (мг-экв/л). Например, вода жесткостью 1 мг-экв/л содержит 20,04 кальция или 12,16 магния. Согласно ГОСТ на кальций в воде 31865-2012, действующему в РФ, жесткость измеряется в градусах. 1 Ж = 1 мг-экв/л.
Нормы для кальция в питьевой воде можно рассчитать с помощью специальных методик определения ионов кальция в воде.
Санитарные нормы для централизованного водоснабжения СанПиН 2.1.4.1074-01 определяют нормативы и предельно допустимую концентрацию солей жесткости. Согласно требованиям норма кальция в воде – 7 мг-экв./л, предельное содержание – до 10 мг-экв./л. Однако, по нормам ВОЗ оптимальная концентрация кальция в воде примерно 1,5-2,5Ж.
Но для чего определяют кальций в воде, и как он влияет на наш организм?
Влияние кальция на организм
Кальций – один из самых необходимых для жизни элементов. Его соединения оставляют основу опорно-двигательной системы, зубной ткани. Ионы кальция участвуют в передаче нервных импульсов, синтезе гормонов и ферментов, поддержании щелочно-кислотного баланса в организме.
От 10 до 20% кальция мы получаем из питьевой воды. Недостаток также как и переизбыток этого элемента приводит к ухудшению здоровья, а именно:
- К ухудшению состояния костной системы. Кости становятся хрупкими, появляется специфическое заболевание остеопороз.
- К медленному росту ногтей и волос, ухудшению их состояния. Недостаток кальция приводит к расслоению ногтей, ломкости и истончению волосяного покрова головы.
- К ухудшению общего состояния. Хроническая усталость, повышенная раздражительность также могут быть симптомами дефицита кальция.
В отдельных случаях возникают судороги, проблемы с сердечно-сосудистой системой, желудочно-кишечным трактом. При значительном избытке возникают нарушения сердечного ритма и работы центральной нервной системы. Избыток соединений кальция также является причиной ряда расстройств и заболеваний. Если в воде много кальция возникает:
- Почечно-каменная болезнь.
- Ускоренное развитие атеросклероза.
- Отложение солей в суставах.
- Превышение концентрации ионов кальция негативно влияет на бытовую технику и сантехнику:
- Трубы зарастают слоем отложений.
- На нагревательных элементах и стенках водонагревателей, котлов, откладываются нерастворимые соли.
Превышения кальция в водопроводной воде или воде из скважины приводит к увеличению расхода электроэнергии, снижению срока службы систем и техники. При избыточном содержании кальция и натрия в воде рекомендуются устанавливать ионообменные фильтры. Это поможет избежать проблем со здоровьем и продлит срок службы домашней техники и бытовых систем.
Необходимость дополнительной очистки воды от солей жесткости возникает при содержании солей Мg или Ca от 10 мг-экв./л. Для этого применяют ионообменные фильтры умягчения и установки обратного осмоса.
Определить необходимость установки фильтра для удаления кальция можно после анализа вода и определения химического состава примесей.
Метод
основан на способности ионов кальция
образовывать устойчивые комплексы с
трилоном Б в сильнощелочной среде
(рН = 12 − 13). Подобный комплекс
ионов магния в этой среде разрушается
с выделением гидроксида магния. При
титровании раствором трилона Б
изменение окраски индикатора (мурексида)
от лиловой до красно-малиновой
свидетельствует о полном связывании
ионов кальция:
H2Ind3-
+ Са2+
↔ СаH2Ind–;
красно-малиновый
лиловый
СаH2Ind–
+ Na2H2Y
↔ Na2СаY
+ H2Ind3-
+ 2H+.
лиловый
Титрование
ионов кальция возможно при совместном
присутствии ионов тяжелых металлов в
концентрациях, не превышающих значений:
для меди – 0,2 мг/дм3;
цинка, свинца, никеля, марганца, железа,
алюминия – 1 мг/дм3
и магния – 3 мг в определяемом объеме.
При более высоких концентрациях ионов
тяжелых металлов в пробу добавляют
сульфид натрия. Мешающее влияние ионов
магния устраняют или уменьшением объема
пробы, взятого для анализа, или при
высоком содержании магния (соотношение
Mg:Ca
более 1), осаждением ионов магния раствором
едкого натра, имеющим концентрацию
2 моль/дм3
(рН 12 − 13) в мерной колбе
вместимостью 100 см3.
Для этого 20−40 см3
пробы разбавляют дистиллированной
водой до 90 см3
и медленно по каплям добавляют раствор
NaOH,
хорошо перемешивают, при этом незначительное
количество ионов кальция соосаждается
с Mg(OH)2.
Объем раствора доводят до метки
дистиллированной водой и после отстаивания
осадка в течение 1,5 – 2 часов
отбирают прозрачную аликвоту для
титрования. Для уменьшения потерь
кальция время отстаивания не должно
превышать 2 часа.
Ход
определения.
В коническую колбу вместимостью 250 см3
отмеряют требуемый объем пробы, доводят,
если необходимо, до 100 см3
дистиллированной водой, добавляют 2 см3
раствора NaOH
с массовой долей 0,08 (8 %), 0,1 – 0,2 г
индикатора мурекида и медленно титруют
раствором трилона Б при интенсивном
перемешивании до перехода окраски от
красно-малинового цвета к лиловому.
Повторяют титрование и, если расхождение
между параллельными титрованиями не
превышает приведенных в табл. 13.2, за
результат принимают среднее значение
трилона Б. В противном случае повторяют
титрование до получения допустимого
расхождения результатов.
Расчет.
Массовую концентрацию и количество
вещества эквивалента ионов кальция в
анализируемой пробе воды находят по
формулам:
где
m(Ca2+)
– массовая концентрация ионов кальция
в воде, мг/дм3;

– количество вещества эквивалента
ионов кальция в воде, ммоль/дм3;

концентрация эквивалента трилона Б,
моль/дм3;
V(Na2H2Y)
– объем раствора трилона Б, пошедшего
на титрование пробы, см3;
M(1/2Ca2+) − молярная
масса эквивалента ионов кальция,
мг/ммоль;
V
– объем пробы воды, взятый для определения,
см3.
Массовую
концентрацию ионов магния в мг/дм3
в анализируемой пробе воды определяют
по формуле
где
m(Mg2+)
− массовая концентрация ионов магния
в воде, мг/дм3;
X
– общая жесткость воды, ммоль/дм3;
n(1/2Ca2+)
− количество вещества эквивалента
ионов кальция в воде, ммоль/дм3;
M(1/2Mg2+) – молярная
масса эквивалента Mg2+,
мг/ммоль.
Таблица
13.2
Допустимые
расхождения между параллельными
титрованиями в зависимости от объема
раствора трилона Б
|
Объем |
<2 |
2−5 |
5−10 |
10−15 |
>15 |
|
Допустимое |
0,04 |
0,05 |
0,1 |
0,2 |
0,3 |
В
соответствии с ГОСТ Р 52029-2003 жесткость
воды выражается в градусах жесткости
(ºЖ).
Градус
жесткости соответствует концентрации
щелочноземельного элемента, численно
равной 1/2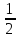
(г/м3).
Жесткость
воды Ж, ºЖ, при раздельном количественном
определении ионов щелочноземельных
элементов вычисляют по формуле
где
m(Ca2+)
– масса кальция в пробе воды, мг/дм3;
m(Mg2+)
– масса магния в пробе воды, мг/дм3;
M(Ca2+)
− молярная масса кальция, мг/моль;
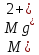
− молярная масса магния, мг/моль.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

Автоматические анализаторы воды, стоков и канализации
- Внесены в гос.реестр средств измерений РФ
- Автоматическая передача данных по GSM
- Автоматическая очистка датчика
- Не нужны реагенты для работы
ПЕРЕЙТИ К ВЫБОРУ АНАЛИЗАТОРОВ
О кальции
Кальций (Ca) – элемент № 20 второй группы четвертого периода таблицы Д. И. Менделеева.
Щелочноземельный металл Са характеризуется высокой химической активностью. В своей металлической форме кальций на Земле не существует. Пятый по распространенности элемент на планете образует соединения, встречаясь в составе горных пород (гранитов, гнейсов), в морской воде и коралловых рифах, в костях человека и животных (минерал гидроксиапатит). Кальцийсодержащие минералы кальцит и арагонит формируют раковины морских беспозвоночных, скорлупу яиц птиц и рептилий.
История открытия
Открыл кальций в 1808 году британский химик Гемфри Дэви. Ученый подверг электролизу влажную гашеную известь, смешанную с оксидом ртути, и получил амальгаму неизвестного металла. Дэви назвал обнаруженное веществом «кальций» от латинского «calx» – известняк, известь. Выделить чистый металл электролитическим методом из расплава хлорида кальция удалось позднее. Это сделал в 1855 году немецкий химик Роберт Бунзен.
Химические и физические свойства
В природе кальций обнаруживается в составе минералов-карбонатов – солей угольной кислоты. Если прокалить карбонаты и затем растворить получившиеся оксиды («земли» на языке алхимиков) в воде, рН раствора будет щелочным.
Кальций – белый блестящий металл, с температурой плавления 780 ⁰С, легко поддающийся обработке. Замечательное свойство этого щелочноземельного элемента – легкость. Кальций в пять раз легче железа и только в полтора раза тяжелее воды.
Влияние на организм человека
Содержание кальция в питьевой воде важно удерживать в оптимальном диапазоне, потому что этот элемент оказывает двойственное влияние на здоровье. Одинаково неполезно длительное время пить воду как с повышенной концентрацией кальция, так и умягченную, освобожденную от солей.
Постоянное употребление воды с большим содержанием кальция (100-500 мг/дм3) влияет на организм человека в отдаленной перспективе и способствует:
- нарушению обмена веществ;
- накоплению солей в костях скелета;
- развитию атеросклероза;
- формированию камней в почках;
- усугублению хронических заболеваний пищеварительной системы;
- закупорке пор эпидермиса, образованию сыпи на коже.
Концентрация кальция в воде от 350-450 мг/дм3 делает питье горьким на вкус, поэтому риск самостоятельно нанести вред здоровью минимален.
Недостаток ценного макроэлемента в воде приводит к дефициту кальция в организме, который проявляется:
- судорожными фибрилляциями сердца;
- увеличением проницаемости капилляров и нарушением свертываемости крови;
- неконтролируемым сокращением мышц тела;
- стимуляцией симпатоадреналовой системы;
- нарушением процессов образования и формирования костной ткани.
Влияние кальция на заболеваемость человека
| Фактор | Заболевания
(источник литературы) |
Нижняя допустимая граница фактора | Верхняя допустимая граница фактора |
| Кальций | Желчнокаменная болезнь (Бышевский, Терсенов, 1994) | — | 100-500 мг/дм3
(Ливчак, Воронов, 2000) |
| Сердечно-сосудистые заболевания, в частности, атеросклероз
(Голубев, 1992; Зубарева и др., 2002) |
— | ||
| Злокачественные опухоли (Бышевский, Терсенов, 1994) | — | ||
| Нарушения в адреналовой системе и проницаемости капилляров, ослабление окислительно-восстановительного потенциала в миокарде (Ливчак, Воронов, 2000) | — |
Фактор износа водопроводных коммуникаций
Если рассмотреть на просвет старые водопроводные трубы, можно увидеть внутри плотные отложения накипи. В её составе обнаруживается в основном карбонат кальция.
При нагревании водопроводной воды растворенная в ней углекислота распадается на углекислый газ и воду:
2НСО3 <=> СО32- + СО2 + H2O
Кальций, присутствующий в воде, вступает в реакцию с углекислым газом с образованием малорастворимого карбоната кальция:
2Ca + 3CO2 → 2CaCO3
К поверхности труб вместе с карбонатом кальция «прикипают» взвешенные частицы, усиливая мощность наслоений, снижая пропускную способность коммуникаций.
Сточные воды – что это?
Четкое определение понятию «сточные воды» дает Водный кодекс Российской Федерации.
Под водосборной площадью здесь подразумевается территория, задействованная человеком в его промышленной и бытовой деятельности. То есть, дождевые потоки, омывшие городские парки, скверы или карьеры и ушедшие в ливневую канализацию, относятся к сточным водам. А воды, выпавшие в виде осадков над природными лесными массивами, не будут считаться таковыми.
Сточные воды подразделяются на три класса по происхождению:
- Поверхностные. Атмосферные осадки выпадают над территориями, занятыми под хозяйственно-бытовую деятельность человека, собирают пыль различного состава, нефтепродукты, тяжелые металлы, и уносят собранное в поверхностные водоемы.
- Хозяйственно-бытовые стоки, образованные человеком. Это биогенные элементы (пищевые отходы, отмершие покровы, экскременты) и сопутствующие быту загрязнения, к примеру, ПАВ моющих средств.
- Промышленные. Состав сточных вод, идущих с производств, разнообразен и зависит от рода деятельности. Сочетания загрязнителей в таких стоках самые причудливые, а взаимодействия между компонентами зачастую непредсказуемые и потенциально опасные.
Откуда берётся в стоках?
В сточных водах кальций появляется в результате деятельности человека и в процессе вымывания из природных объектов. К примеру, накопленные отложения СаСО3 в виде известняков лежат на большей части России, Европы и Северной Америки.
Природные источники
В природе кальций входит в состав метаморфических и осадочных пород, среди которых силикаты и алюмосиликаты, известняки, минералы (алебастр, апатит, гипс, доломит, кальцит).
Эрозивные процессы, особенно с участием подкисленной двуокисью углерода воды, высвобождают кальций из связанной формы.
Катионы кальция, взаимодействуя с молекулами воды, спускаются с гор и попадают в океаны. В морской воде кальций по распространенности занимает пятую позицию после хлорида, натрия, сульфата и магния.
В реки и озера кальций попадает в результате выщелачивания поверхностного слоя почв и эрозии кальцийсодержащих пород.
CaCO3 + CO2 + H2O ↔ Са (HCO3)2 <=> Ca2+ + 2HCO3-
Естественное присутствие кальция в поверхностных водоемах зависит от сезона, но обычно не превышает 1 г Са2+/дм3. Весной в период таяния снегов выщелачивание почв происходит интенсивнее, поэтому в реках фиксируют повышение уровня кальция.
Антропогенные
Основные источники кальция в сточной воде – это горнодобывающая промышленность, предприятия, производящие неорганические химические вещества, силикатные заводы. Вносит свой вклад в загрязнение вод соединениями кальция и пищевая промышленность.
Оксид кальция СаО в качестве разрешенной пищевой добавки Е 529 применяется в производстве муки, изготовлении сахара и при хранении колбас. Оксид кальция попадает в стоки при изготовлении солидола на предприятиях нефтехимии, производстве огнеупорного материала и тормозных колодок.
Гашеная известь Са (ОН)2 незаменима при производстве:
- бетона, силикатного кирпича в строительстве;
- известковых удобрений;
- кормов для животных.
Методы определения кальция в воде
В воде минеральной питьевой лечебной, лечебно-столовой и природной столовой концентрацию кальция определяют по ГОСТ 3268.5-78. Нормативный документ предлагает определять кальций в пробе титриметрическим и потенциометрическим методами.
Титриметрический метод
Метод основан на способности динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА), которую иначе называют комплексоном III или трилоном Б, образовывать при рН 12-13 комплексные соединения с ионами кальция.
Точно отмеренный объем минеральной воды предварительно нейтрализуют соляной кислотой в присутствии индикатора, добиваясь розовой окраски раствора. Затем, добавив еще один миллилитр HCL, пробу кипятят для удаления двуокиси углерода. Далее прибавляют гидроокись натрия для установления необходимого pH – 12-13.
Пробу медленно тируют раствором трилона Б в присутствии индикатора (кальконкарбоновой кислоты) до перехода окраски из вишневого в синий.
Для определения кальция по ГОСТ 23268.5-78 можно также использовать заранее подготовленный индикатор мурексид, небольшое количество которого на кончике шпателя вносят в пробу воды перед титрованием. В этом случае титрование продолжают до перехода цвета анализируемого раствора из малинового в фиолетово-красный.
Титриметрический метод также подходит для определения массовой концентрации кальция в пробах природных и сточных вод по ПНД Ф 14.1:2:3.95-97
| Нормативный документ | Природные
(поверхностных и подземных) |
Сточные | Очищенные сточные |
| РД 52.24.403-2018
Диапазон определения: от 1,0 до 2000 мг/дм3 |
+ | — | + |
| ПНД Ф 14.1:2:3.95-97
Диапазон определения: от 1,0 до 2000 мг/дм3 |
+ | + | + |
Потенциометрический
Потенциометрический метод основан на измерении электродвижущей силы (ЭДС) электрохимической цепи, образованной ионоселективным и вспомогательным электродами, погруженными в анализируемую среду.
Ионоселективные электроды – это электрохимические преобразователи, в которых возникает потенциал, зависящий от активности ионов в данной среде, по отношению к которым селективен (избирателен) данный электрод.
Мембрана, проницаемая только для ионов кальция, разделяет растворы электролитов – внутренний стандартный (с точно известной концентрацией ионов Ca2+) и анализируемый внешний. Во внутренний раствор погружен внутренний электрод сравнения. Растворы контактируют через полупроницаемую мембрану, на ее поверхностях возникают граничные потенциалы Е1 и Е2.
Между ними возникает стабильная разность потенциалов, пропорциональная логарифму определяемого иона кальция.
Для измерения ЭДС понадобится иономер – электронный высокоомный вольтметр.
Определив электродвижущую силу гальванического элемента, получится измерить концентрацию ионов Ca2+ в исследуемом растворе.
подходит для измерения ионов Ca2+ в технологических растворах и сточных водах любой отрасли промышленности.
Можно ли определить в быту?
Из-за повышенного содержания кальция в воде население испытывает ряд досадных трудностей в быту, среди которых:
- накипь в чайнике;
- плотные отложения в водопроводных трубах;
- известковый налет на нагревательных элементах стиральных машин, электрочайников, посудомоечных агрегатов;
- трудноудаляемые разводы на одежде;
- искажение вкуса приготовляемой пищи;
- неидеальный вид сантехники.
Определить точную концентрацию кальция в воде из-под крана можно только в химическом анализе с применением специальных реактивов, но в быту можно обойтись и без них.
О высоком содержании кальция судят по ряду признаков, а именно:
- душевая насадка и краны в белом налете;
- мыло и стиральный порошок почти не образуют пену, их расход возрастает;
- нагревательные элементы бытовых приборов покрыты желтоватой муфтой из накипи;
- чай долго заваривается и неприятен на вкус;
- мясо плохо разваривается.
На стеклянной посуде или зеркальной поверхности хорошо просматриваются белые разводы, если вода недостаточно очищена от примесей кальция.
В продаже встречаются тест-полоски для оперативного контроля показателей качества воды (в отделе товаров для аквариумистов, в фирменных салонах бытовой техники, кофемашин) или специальные наборы для определения кальция в воде, укомплектованные всем необходимым для проведения химического анализа в домашних условиях
Содержание кальция в воде жестко нормируется только для рыбохозяйственных водоемов, в которых предельная его концентрация установлена на уровне 180 мг/мд3.
В питьевой воде контролируется показатель «общей жесткости», определяемой в том числе и ионами кальция. Строгие нормативы в отношении содержания кальция выставлены для питания котлоагрегатов, в частности паросиловых установок. Это сделано с целью защитить оборудование от трудноудаляемой накипи, образованной в ходе химических реакций кальция и карбонатов, сульфатов и других анионов, присутствующих в природной воде.
Анализы воды «на кальций» делают аккредитованные лаборатории, куда при необходимости можно доставить воду из любого источника.

Автоматические анализаторы воды, стоков и канализации
- Внесены в гос.реестр средств измерений РФ
- Автоматическая передача данных по GSM
- Автоматическая очистка датчика
- Не нужны реагенты для работы
ПЕРЕЙТИ К ВЫБОРУ АНАЛИЗАТОРОВ
Жесткая вода — это вода с избытком солей кальция или магния. С ней связан целый букет бытовых проблем: в чайнике накипь, на кране и мойке — известковый налет, на посуде — белые разводы, а на поверхности чая — радужная пленка.
Жесткость бывает временной и постоянной – первая почти полностью устраняется при кипячении, а вторая нет. Накипь – это результат временной жесткости: во время кипячения соединения кальция и магния образуют нерастворимый осадок.
Жесткая вода подрывает в основном бюджет, а в некоторых случаях еще и здоровье. Так что умягчать ее очень желательно и не так уж сложно.
От чего зависит жесткость воды?
Все зависит от источника. В некоторых местностях вода изначально мягкая (как, например, в Санкт-Петербурге), а в других жесткая (как в Москве). Чем больше в почве известковых пород, тем выше жесткость воды: с этим ничего не поделать. На водоканалах умягчением не занимаются, однако сделать воду мягкой и «сговорчивой» у себя дома — вполне решаемая задача для любого жильца квартиры или коттеджа. Просто нужно знать, как сделать это правильно.

Что дает мягкая вода
- Нужно в 3–4 раза меньше моющих средств;
- Лучше смывается грязь с тканей и посуды;
- Трубы остаются чистыми изнутри;
- Меньше счет за электричество (накипь мешает теплопередаче);
- Водонагревательные элементы не требуют ремонта до 15 лет, а в жесткой воде служат в 3–5 раз меньше.

Для здоровья и красоты важна мягкая вода
- Снижает риск образования камней в почках;
- Не перегружает сердечно-сосудистую систему;
- Волосы не тускнеют и легко расчесываются;
- Чувствительная кожа защищена от раздражений;
- Снижается риск аллергии и экземы у детей.
Единицы измерения жесткости воды
Жесткость воды в цифрах — это концентрация ионов кальция и магния. Международная система единиц рекомендует измерять жесткость в молях на кубический метр, но на практике применяют более удобные единицы.
В России для измерения жесткости используются градусы (1°Ж) — миллиграмм-эквиваленты на литр (мг-экв/л или мэкв/л).
- 1°Ж = 1 мг-экв/л. Для сравнения: 1°Ж = 2,8 dH (Германия).
- 1 мг-экв/л = 20,04 мг Ca2+ или 12,16 мг Mg2+ в литре воды.
Таблица жесткости
| Характер воды | Жесткость в мг-экв/л | Градусы dH |
|---|---|---|
| Очень мягкая | до 1,5 мг-экв/л | 0–4° |
| Мягкая | 1,5–3 мг-экв/л | 5–8° |
| Средней жесткости | 3–8 мг-экв/л | 9–12° |
| Жесткая | 8–12 мг-экв/л | 13–22° |
| Очень жесткая | выше 12 мг-экв/л | 23–34° |

Норма жесткости
По уровню жесткости вода делится на 3 категории (возьмем за основу «родные» градусы жесткости, °Ж):
- мягкая: до 3°Ж
- средняя по жесткости: 3–6°Ж
- жесткая: >6°Ж
Как определить в воде кальций
Соли кальция в воде — основные «виновники» ее жесткости. Технически к солям жесткости также относятся соли магния и железа, однако их количество, как правило, незначительно, и известковые отложения провоцирует именно кальций. Поэтому вопрос «как определить кальций» — это, по сути, вопрос того, как определить жесткость.
Зачем определять жесткость воды?
Есть несколько причин узнать точное значение жесткости воды:
1 Правильно запрограммировать кофемашину на чистку;
2 Не ошибиться с дозировкой средства от накипи для стиральной и посудомоечной машины.
3 Создать комфортную среду обитания для рыб в аквариуме.
4 Подобрать подходящую модель фильтра для воды.
И вот какие для этого есть способы.

Определение жесткости воды в лаборатории
Это лучший способ узнать состав воды, ведь в лаборатории вам предоставят максимально точные данные. Например, в исследовательском центре АКВАФОР, который вошел в тройку лидеров среди сотен лабораторий России.
Методы определения жесткости воды в домашних условиях
Вариант «Быстро»: тест-полоски для оценки жесткости воды
Специальные тест-полоски продаются в зоомагазине (их используют для измерения жесткости воды в аквариумах) или в точках продаж кофемашин и другой бытовой техники. На бумагу нанесен реагент, который при контакте с водой меняет цвет — интенсивность окраски различается в зависимости от концентрации вещества в воде.
Основные недостатки такого метода: невысокая точность и сложности с интерпретацией результата теста. Сначала придется на глаз определить оттенок, сравнив с палитрой возможных результатов, а затем указанные на палитре значения жесткости перевести из европейских градусов в российские.
Вариант «Что-то я запутался»: можно ли использовать TDS-метр для определения жесткости?
Часто для определения чистоты и жесткости воды ошибочно используется TDS-метр. Но для этих целей он бесполезен. Этот прибор измеряет электропроводность воды. На нее влияет концентрация не только солей жесткости, но и любых других ионов, и даже температура. Например, если взять дистиллированную воду и от души посолить ее, TDS-метр покажет высокое значение. Общее солесодержание высокое, но вода при этом мягкая, потому что именно солей жесткости в ней нет. Так что TDS-метр скорее запутает, чем даст верный ответ об уровне жесткости.
Как определить жесткость воды для посудомоечной машины
Чтобы уберечь дорогую бытовую технику от поломки, нужно «поить» ее качественной, мягкой водой.
Механизм вычисления жесткости воды для посудомоечной машины точно такой же, как и для «универсальных» целей: это можно сделать в лаборатории, а можно дома — но в этом случае результаты будут весьма приблизительными, как мы и предупреждали выше.
Как умягчить воду
Есть несколько действительно эффективных способов, которые мы подробно осветили в статье «Как снизить жесткость воды?».
Ну а максимально эффективная очистка воды в квартире — это «миссия» обратноосмотического фильтра. С ним анализ воды можно «пропустить»: специальная мембрана полностью устраняет жесткость и любые вредные примеси.
Если по каким-либо причинам обратноосмотический фильтр вам не подходит, и вода не слишком жесткая (до 4–5 мг-экв/л), можно выбрать сорбционный фильтр с умягчающим картриджем. Нужно только помнить о том, что умягчающий модуль придется периодически регенерировать обычной поваренной солью. Чем больше солей жесткости, тем чаще нужна регенерация. «Распознать» умягчающий модуль в фильтрах АКВАФОР помогает пометка «Н» в названии.

АКВАФОР DWM-101S Морион — абсолютная защита от любых вредных примесей, включая тяжелые металлы, нитраты и нитриты. Аналог бутилированной воды. Подходит аллергикам и новорожденным.
АКВАФОР Baby H Pro — система глубокой очистки и умягчения с абсолютной защитой от антибиотиков и гормонов.
АКВАФОР S800 (А800) — умягчение воды, удаление высоких концентраций железа и марганца.
Похожие статьи
Жёсткостью воды называется совокупность свойств, обусловленных концентрацией в ней щелочноземельных элементов, преимущественно ионов кальция (Са2+) и магния (Mg2+). При этом общее (суммарное) содержание растворимых солей только кальция и магния образует важный показатель качества воды, называемые общей жёсткостью.
Ввиду того, что солями жёсткости являются соли разных катионов, имеющие разную молекулярную массу, концентрация солей жёсткости, или жёсткость воды, измеряется в единицах эквивалентной концентрации, т.е. количеством моль/л или ммоль/л.
С 2003 г. в Российской Федерации жёсткость воды обозначается как (Ж) и выражается в градусах жёсткости (°Ж). Градус жёсткости соответствует концентрации щелочноземельного элемента, преимущественно кальция (Ca2+) и магния (Mg2+), численно равной 1/2 его моля, выраженной в мг/л (ГОСТ 31865). Таким образом, вместо использовавшейся ранее размерности общей жёсткости ммоль/л эквивалента следует использовать °Ж, при этом численные значения величины жёсткости не изменяются. 1°Ж = 20,04 мг/л [Ca2+] или 12,15 мг/л [Mg2+].
Допустимая величина общей жёсткости для питьевой воды и источников централизованного водоснабжения составляет не более 7°Ж (в отдельных случаях — до 10°Ж), лимитирующий показатель вредности − органолептический.
Метод определения
Определение общей жёсткости как суммарной эквивалентной концентрации катионов кальция и магния проводится широко распространённым титриметрическим методом (ГОСТ 31954, ИСО 6058, РД 52.24.395 и др.). Метод пригоден для анализа питьевой и природной воды, очищенных сточных вод, и может быть использован для оценки общей жёсткости водных почвенных вытяжек.
Определение основано на реакции солей кальция и магния с реагентом — трилоном Б (двунатриевой солью этилендиамин − N, N, N’, N’−тетрауксусной кислоты, или сокращённо ЭДТА):
Ca2+ + Na2H2R → Na2CaR + 2H+,
Mg2+ + Na2H2R→ Na2MgR + 2H+,
где R — радикал этилендиаминтетрауксусной кислоты — (OCCH2)2NCH2CH2N(CH2CO)2
Анализ проводят при рН 10-10,5 титриметрическим методом в присутствии индикатора хромового тёмно-синего кислотного (кислотного хромового синего Т). Роль индикатора в определении общей жёсткости состоит в том, что при его добавлении в анализируемую воду первоначально происходит реакция, в результате которой весь кальций и магний связываются индикатором с образованием соединения, окрашенного в красный цвет (на примере реакции с кальцием):
2HInd + Ca2+ → Ca(Ind)2 + 2H+
синий красный
Далее, при титровании, по мере добавления ЭДТА образуется более прочный бесцветный комплекс с кальцием (магнием), комплекс с индикатором разрушается и высвобождается индикатор, окрашивающий раствор в синий цвет:
Ca(Ind)2 + Na2H2R = Na2CaR + 2HInd
красный синий
Анализу не мешают катионы железа (до 10 мг/л), а также никеля, кобальта и меди (до 0,1 мг/л). При анализе загрязнённых вод возможен нечёткий переход окраски при титровании, а также обесцвечивание раствора из-за присутствия в воде некоторых примесей.
В настоящей статье метод определения общей жёсткости приводится в двух модификациях — капельного и объёмного титрования. Эти модификации реализованы ГК «Крисмас» в ряде производимых компанией лабораторий для анализа воды и тест-комплектов.



Метод А — капельный метод, представляет собой упрощённую модификацию широко распространённого титриметрического метода. Данный метод реализован в производимом ГК «Крисмас» тест-комплекте ОЖ-1.

Титрование проводится добавлением к пробе каплями объединённого реагента, содержащего индикатор и ЭДТА. Капля реагента содержит определённое количество эквивалентов титранта. Использование для титрования мерной склянки с разными значениями объёма (2,5; 5,0; 10 мл) позволяет охватить широкий концентрационный диапазон значений общей жёсткости — от 0,5 до 20 °Ж.
Метод Б предусматривает классическое проведение анализа, т.е. раздельное добавление индикатора и ЭДТА и объёмное титрование с использованием стандартной градуированной пипетки или бюретки и расчётом значения общей жёсткости по объёму титранта. В данном варианте метод соответствует ГОСТ 31954, РД 52.24.395. Этот метод реализован в производимом ГК «Крисмас» тест-комплекте «Общая жесткость».

Диапазон измеряемых величин общей жёсткости — от 0,5 до 10 °Ж и более. При общей жёсткости более 10 °Ж необходимо проводить разбавление пробы дистиллированной водой.
Объём пробы, необходимой для анализа, составляет для указанного диапазона концентраций 10 мл, но может быть увеличен до 250 мл при анализе растворов с пониженной величиной общей жёсткости. Содержание общей жёсткости методами А и Б может определяться также в водной почвенной вытяжке. При этом определяются суммарно водорастворимые соли кальция и магния.
Метод определения массовой концентрации катиона кальция (метод В) аналогичен методу определения общей жёсткости с реагентом трилоном Б с той разницей, что анализ проводится в сильнощелочной среде (рН 12–13) в присутствии индикатора мурексида. Данный метод реализован в производимых ГК «Крисмас» лабораториях для анализа воды (см. выше) и в производимом ГК «Крисмас» тест-комплекте «Кальций».

В данном варианте метод аналогичен РД 52.24.403, ИСО 6058. Конечная точка титрования определяется по изменению окраски индикатора мурексида из розово-оранжевой в сине-фиолетовую.
Продолжительность анализа — не более 20 мин.
Диапазон измеряемых концентраций кальция составляет от 2 до 500 мг/л при объёме пробы 10 мл.
Молярную концентрацию эквивалента кальция рассчитывают по результатам титрования по аналогичной формуле, приведённой для расчёта общей жёсткости. Определению кальция мешают карбонаты и диоксид углерода, удаляемые из пробы при её подкислении.
На изделия ГК «Крисмас» имеются сертификаты соответствия, в частности на тест-комплект ОЖ-1 и тест-комплект «Общая жесткость» (см. ниже), их серийный выпуск осуществляется по ТУ 26.51.53-600-82182574-18.

Тест-комплекты ГК «Крисмас» представляют собой удобные для переноски, транспортирования и хранения корпуса-укладки, в которых компактно размещены необходимые средства измерения, готовые растворы и реагенты, посуда и оборудование, документация. Тест-комплекты максимально просты и удобны в использовании, экономичны, т.е. позволяют осуществлять экспресс-определения при минимальных затратах.
Определение концентрации ионов магния приведено расчётным методом (метод Г). Расчёт выполняется на основе выполненных экспериментальных определений значения общей жёсткости и концентрации ионов кальция, при этом концентрация магния рассчитывается как разность результатов определения общей жёсткости и кальция. Для анализа загрязнённых вод на содержание магния необходимо применять прямое определение магния соответствующим титриметрическим методом.
При определении содержания кальция и магния в почвенной вытяжке их сначала извлекают из почвы водой (соотношение сухая почва – вода — 1:5) и далее анализируют почвенную вытяжку тем же методом, выражая суммарную концентрацию ионов в ммоль эквивалента на 1 кг почвы.
Отбор проб
Для отбора проб при анализе общей жёсткости и кальция используются пробоотборники (бутыли, батометры) из полимерного материала или стекла. Отобранные пробы следует анализировать в течение не более 24 ч, без проведения консервации. Пробы могут быть консервированы подкислением до рН менее 2 добавлением 1,0 мл раствора соляной кислоты 1:2 на 100 мл воды. Не допускается применять серную кислоту для консервации.
Максимальный рекомендуемый срок хранения консервированных проб — 1 месяц.
Примечание. ГК «Крисмас» подставляет специальный набор реагентов для консервации проб воды.

При определении кальция допускается хранение проб до 1 месяца при условии их подкисления до рН менее 2 добавлением 1,0 мл раствора соляной кислоты 1:2 на 100 мл воды. Перед выполнением анализа подкисленную пробу воды доводят до нейтральной реакции по индикаторной бумаге (рН 6-7) раствором гидроксида натрия 0,2 моль/л.
А. Определение общей жёсткости, капельное титрование
Оборудование и реагенты из состава
тест-комплекта ОЖ-1
:
- склянка с метками и пробкой, пипетка полимерная;
- раствор титранта (объединённого реагента) во флаконе-капельнице;
- контрольная шкала образцов окраски начала и окончания титрования.
Выполнение определения
1.
Ополосните калиброванную мерную склянку несколько раз анализируемой водой. Налейте в склянку до метки определённый объём пробы воды, в зависимости от предполагаемой жёсткости:
- для мягкой воды (1,5 – 3,0 °Ж) — до метки «10 мл»;
- для воды средней жёсткости (3,0 – 6,0 °Ж) и жёсткой (6,0 – 10,0 °Ж) — до метки «5 мл»;
- для очень жёсткой воды (более 10,0 °Ж) — до метки «2,5 мл».
Примечание. При анализе водных растворов с величиной общей жёсткости менее 0,5 °Ж и более 10 °Ж рекомендуется отбирать анализируемую пробу в количестве, обратно пропорциональном величине общей жёсткости, но не более 20 мл. В данном случае пробы отбирайте с помощью пипетки (менее 2,5 мл) или мерного цилиндра (более 10 мл).
Примечание. Мерный цилиндр в основной состав тест-комплекта ОЖ-1 не входит, но его можно заказать отдельно.
2.
Расположите склянку с раствором на белом фоне при достаточной освещённости. Добавляйте к пробе из флакона-капельницы раствор титранта, считая капли и перемешивая раствор. Обратите внимание на цвет раствора после добавления первых капель титранта — розовый (окраска образца «Начало титрования»).
3.
Продолжайте добавлять раствор титранта по каплям, непрерывно перемешивая содержимое склянки и сравнивая окраску раствора с контрольной шкалой, до изменения цвета раствора от розового до сиренево-синего. Вблизи точки эквивалентности, после добавления очередной капли, наблюдайте за окраской раствора не менее 10–20 с (окраска образца «Окончание титрования»). Для уточнения количества капель раствора титранта, израсходованных на титрование (N), анализ рекомендуется повторить, при этом для анализа отбирайте пробы в объёме согласно меткам на мерной склянке (см. п.1 данного определения).
4.
Рассчитайте величину общей жёсткости воды в пробе CОЖ в °Ж (ммоль/л эквивалента) в зависимости от объёма пробы (VПР) и количества капель израсходованного раствора титранта (N), используя данные табл. 1.
Таблица 1
Данные для расчёта общей жёсткости
| Объём пробы VПР , мл | Расчётная формула для определения CОЖ в °Ж |
| 2,5 | 2 × N |
| 5,0 | 1 × N |
| 10,0 | 0,5 × N |
Примечание. Данные в табл.1 приведены из условия, что одна капля раствора титранта эквивалентна 1°Ж при титровании пробы объёмом 5 мл.
Пример. При определении общей жёсткости лечебно-минеральной воды на титрование пробы объёмом 2,5 мл израсходовано 7 капель раствора титранта. Значение общей жёсткости воды рассчитываем по табл.1 как:
CОЖ = 2 × N = 2,0 × 7 = 14 °Ж.
Б. Определение общей жёсткости, объёмное титрование
Оборудование и реагенты из состава тест-комплекта «Общая жесткость»:
- пипетка полимерная, пипетка градуированная для титрования с соединительной трубкой и шприцем-дозатором, склянка с метками и пробкой;
- раствор буферный аммиачный, раствор индикатора хромового тёмно-синего, раствор трилона Б.
Выполнение определения
1.
Ополосните калиброванную мерную склянку несколько раз анализируемой водой. Налейте в склянку пробу воды до метки «10 мл».
Примечание. Для точных анализов объём пробы отмерьте с помощью градуированной пипетки.
2.
Добавьте в склянку 2–3 капли раствора буферного аммиачного и 1–2 капли раствора индикатора хромового тёмно-синего.
3.
Закройте склянку пробкой и встряхните для перемешивания.
4.
Постепенно перемешивая титруйте содержимое склянки раствором трилона Б с помощью пипетки и шприца до перехода окраски в точке эквивалентности из винно-красной в ярко-голубую, наблюдая окраску на белом фоне при достаточной освещённости. Периодически встряхивайте склянку для перемешивания пробы. Определите объём раствора, израсходованный на титрование общей жёсткости (VОЖ, мл).
Примечание. После изменения окраски пробу необходимо выдержать ещё 0,5 мин для полного протекания реакции. В случае, если окраска раствора восстановится, необходимо продолжить титрование по каплям до устойчивого изменения окраски.
5.
Рассчитайте значение общей жёсткости (CОЖ ) в °Ж по формуле:
где:
VОЖ — объём раствора трилона Б, израсходованного на титрование, мл;
Н — концентрация титрованного раствора трилона Б, 0,05 моль/л экв.;
VПР — объём пробы воды, взятой на анализ, 10 мл;
1000 — коэффициент пересчёта единиц измерения из моль в ммоль.
При необходимости выполнения более точных определений, либо анализа растворов с пониженной величиной общей жёсткости (менее 0,5 °Ж), рекомендуется отбирать анализируемую пробу в количестве, обратно пропорциональном величине общей жёсткости, но не более 250 мл. Титрование проводите в конической колбе подходящего размера. Расчёт проводите по той же формуле с использованием фактического объёма пробы.
Контроль точности анализа
Контроль точности анализа при определении общей жёсткости может быть выполнен путём анализа растворов, имеющих известную концентрацию катиона кальция или магния, либо соответствующего стандартного образца общей жёсткости воды.
В. Определение кальция
Оборудование и реагенты из состава
тест-комплекта «Кальций»
:
- пипетка полимерная на 1 мл, пипетка градуированная для титрования с соединительной трубкой и шприцем–дозатором, палочка стеклянная, склянка с метками и пробкой;
- бумага универсальная индикаторная, индикатор мурексид в капсулах, раствор гидроксида натрия, раствор соляной кислоты, раствор трилона Б.
Выполнение определения
1.
Ополосните калиброванную мерную склянку несколько раз анализируемой водой. Налейте в склянку пробу воды до метки «10 мл».
Примечание. Для точных анализов объём пробы отмерьте с помощью градуированной пипетки.
2.
Прибавьте по каплям раствор соляной кислоты до рН 4–5, помешивая стеклянной палочкой (при этом из пробы удаляется гидрокарбонат-ион в виде CO2). Величину рН контролируйте по универсальной индикаторной бумаге.
3.
К пробе прибавьте полимерной пипеткой 13–14 капель (около 0,5 мл) раствора гидроксида натрия и содержимое одной капсулы (0,02–0,03 г) индикатора мурексида. Раствор перемешайте стеклянной палочкой.
4.
Проведите титрование раствором трилона Б, используя шприц и градуированную пипетку, до перехода окраски в точке эквивалентности из розово-оранжевой в сине-фиолетовую. Изменение окраски наблюдайте на белом фоне при достаточной освещенности. Периодически встряхивайте склянку для перемешивания пробы. Определите объём раствора трилона Б, израсходованный на титрование кальция (VКА , мл).
Примечание. После изменения окраски пробу необходимо выдержать ещё 0,5 мин для полного протекания реакции. В случае, если окраска раствора восстановится, необходимо продолжить титрование по каплям до устойчивого изменения окраски.
5.
Рассчитайте молярную концентрацию эквивалента кальция (СКА) в ммоль/л по формуле:
где,
VКА — объём раствора трилона Б, израсходованного на титрование, мл;
Н — концентрация титрованного раствора трилона Б, 0,05 моль/л экв.;
VПР — объём пробы воды, взятой на анализ, 10 мл;
1000 — коэффициент пересчёта единиц измерения из моль в ммоль.
Массовая концентрация катиона кальция может быть рассчитана умножением полученного значения СКА на молярную массу эквивалента кальция (20,04 г/моль).
Г. Определение магния
Массовую концентрацию катиона магния (СМГ) в мг/л определите расчётным методом, произведя вычисления по формуле:
CМГ= (CОЖ – CКА) × 24,3
где:
CОЖ и CКА — результаты определения общей жёсткости и молярной концентрации эквивалента катиона кальция соответственно;
24,3 — молярная масса эквивалента магния.
Полученный результат округлите до целых чисел (мг/л).
Тест-комплекты ГК «Крисмас» эффективно используются в составе мобильных (передвижных) лабораторий санитарно-химического, экологического и водно-химического контроля.
ГК «Крисмас» комплектует мобильные лаборатории на базе различных автомобилей, под конкретные задачи потребителей.
Большинство анализов с применением тест-комплектов ГК «Крисмас» могут выполнять операторы (инженеры, лаборанты, техники), не имеющие специального химико-аналитического образования, но ознакомленные с правилами техники безопасности, освоившие приведенные методики, имеющие навыки выполнения основных операций (отбора и подготовки проб, приготовления растворов из готовых компонентов, проведения титрования, использования шкал для визуального колориметрирования и др.). С изделиями, разработанными и производимыми ГК «Крисмас», может работать и менее квалифицированный персонал при условии обязательного практического обучения методикам и технологиям такой работы. При необходимости в учебном центре ГК «Крисмас» можно пройти краткосрочные курсы по работе с разработанным и производимым компанией оборудованием. По результатам обучения выдается специальный сертификат.
Тест-комплект успешно используется при выполнении проектных и учебно-исследовательских работ в курсах химии, биологии, факультативно в экологии, а также в специализированных образовательных организациях при изучении методов и средств водно-химического анализа.
По материалам издания: Под редакцией к.х.н. Муравьёва А.Г. / Руководство по анализу воды. Питьевая и природная вода, почвенные вытяжки/— Изд. 5-е, перераб. и дополн. — СПб.: «Крисмас+», 2021. — 360 с., илл. ISBN 978-5-89495-268-0.
Подробная информация:
Общая информация
Оборудование для анализа воды
Тест-комплекты для анализа воды
Тест-комплект «ОЖ-1»
Тест-комплект «Общая жесткость»
Тест-комплект «Кальций»
Для консультации и по вопросам приобретения просьба обращаться:
voda@christmas-plus.ru
8 (800) 302-92-25 (звонок по РФ бесплатный)
8 (812) 575-54-07, 575-55-43
Подписывайтесь на наш канал в Ютюбе!
Вы всегда будете в курсе наших последних новостей и сможете наглядно познакомиться с нашей продукцией.