Методом титрования
определить нормальную концентрацию
полученного в опыте 2 раствора и вычислить
абсолютную и относительную ошибки
эксперимента.
Определение
концентрации, посредством измерения
объемов растворов реагирующих веществ
называется титрованием. Окончание
реакции определяется индикаторами,
имеющими разную окраску в кислом и
щелочном растворах. С их помощью
устанавливается момент нейтрализации
кислоты щелочью, или наоборот (табл. п.
3.4).
При титровании
удобно пользоваться растворами нормальной
концентрации, так как растворы с
одинаковой нормальной концентрацией
реагируют в равных объемах.
Выполнение опыта.
Для выполнения
опыта необходимо подготовить пипетку
на 10 мл, бюретку на 25 мл (см. рис.
3 б, в), три конические колбы (рис. 4)
и стакан на 50 мл.
1) Подготовить
0,1н раствор щелочи (NaOH)
к титрованию.
Для этого предварительно сполоснуть
бюретку 0,1 н. раствором щелочи (для
удаления влаги). Закрепить бюретку
вертикально в зажиме штатива и с помощью
воронки заполнить ее раствором щелочи
до нулевого деления. Заполнить раствором
конец бюретки так, чтобы в нем не
содержалось воздуха. Если на кончике
бюретки остается капля раствора, ее
надо снять прикосновением кончика к
стенке стакана. Довести уровень раствора
до нулевого деления бюретки (нижняя
часть мениска должна касаться этой
черты). При отсчете глаз должен находиться
на уровне мениска.

Рис. 4. Коническая
колба для титрования
2. Взять
3 пробы приготовленного в опыте 2 раствора.
Для этого взять пипетку емкостью 10 мл,
промыть небольшой порцией определяемого
раствора кислоты, затем заполнить ее
приготовленным в опыте 2 раствором до
метки. Поместить отмеренное количество
раствора кислоты в коническую колбу
для титрования. Так же взять еще две
пробы раствора кислоты во вторую и
третью конические колбы. В каждую колбу
прибавить по 2 – 3 капли индикатора –
спиртового раствора метилового оранжевого
— раствор кислоты приобретет красную
окраску.
3. Провести
титрование 3-х проб раствора кислоты
0,1н раствором щелочи. Три
пробы исследуемого раствора кислоты
(п. 2) титровать предварительно
подготовленным в бюретке раствором
щелочи (п. 1),. Титрование проводить на
белом фоне. Кончик бюретки ввести до
зажима в колбу для титрования. Пользуясь
зажимом, медленно выливать правой рукой
раствор из бюретки, делая левой рукой
непрерывные круговые движения колбы
для перемешивания раствора. Титрование
закончить, когда от прибавления 1 капли
щелочи красная окраска раствора перейдет
в оранжевую, не исчезающую в течение
1 мин. Отметить по бюретке с точностью
до 0,1 мл объем раствора щелочи(V1(щ)).,
пошедший на титрование кислоты .
Описанным способом
провести титрование кислоты во второй
и третьей колбах(V2(щ);
V3(щ))..
Каждый раз титрование начинать от
нулевой отметки. Если объемы израсходованной
щелочи во всех трех титрованиях не
различаются более чем на 0,1 мл, то
титрование выполнено правильно. Найти
среднее арифметическое из результатов
трех титрований (V(щ)).
4. Рассчитать
нормальную концентрацию полученного
раствора, пользуясь законом эквивалентов.
Согласно следствию из закона эквивалентов,
произведение объемов взаимодействующих
растворов на их нормальные концентрации
есть величина постоянная (равная
количеству эквивалентов):
Сн(к-ты)·V(к-ты)
= Сн(щ)·V(щ)
или
![]() ,
,
где СН (к-ты)
и СН (щ)
– нормальная концентрация соответственно
растворов кислоты и щелочи, V щ
и V к-ты
– объемы соответственно растворов
щелочи и кислоты.
Зная СН (щ)=
0,1н, V щ
по результатам титрования и V к-ты
=10мл, можно найти Сн(к-ты):
![]()
5. Определить
абсолютную и относительную ошибки
эксперимента:
абс = | СН (теор) – СН (эксп) |;
![]() .
.
6. Полученные
результаты записать в рабочую тетрадь.
При сдаче
лабораторной работы ответьте на следующие
вопросы
1. Перечислите
способы выражения концентрации растворов.
Дайте их определения.
2. Напишите формулы
для определения эквивалентных масс
гидроксидов (кислот и оснований), солей.
3. Напишите формулы,
по которым можно вычислить: а) массовую
долю, б) молярную концентрацию, в)
нормальную (эквивалентную) концентрацию,
г) моляльность, д) титр, зная:
– массы растворенного
вещества и растворителя;
– массу растворенного
вещества;
– объем и плотность
раствора.
4. Вычислите, сколько
граммов растворенного вещества содержит
1 л следующих растворов: а) 0,1 н.
H2SO4,
б) 0,5 н. Na2CO3,
в) 0,3 н. H3PO4,
г) 0,2 М MgSO4,
д) 0,3 н. AlCl3?
Ответ:
а) 4,9 г, б) 26,5 г, в) 9,8 г, г) 24,0 г,
д) 13,35 г.
5. Определите, какой
объем 1 н. раствора можно приготовить:
а) из 1 кг 63 %-ного
раствора HNO3.
Ответ
– 10 л;
б) из 20 мл 20%-ного
раствора HCl
( = 1,1 г/мл).
Ответ
– 120 мл;
в) из 120 мл
30%-ного раствора H3PO4
( = 1,19
г/мл). Ответ
– 1,3 л.
6. Определите
молярность растворов:
а)
1 н.
NaOH; б)
2 н.
H2SO3;
в)
6 н.
HCl; г)
3 н.
Cr2(SO4)3.
Ответ:
а) 1 М; б) 1 М; в) 6 М; г) 0,5 М.
7. Определите объем
воды, необходимый для приготовления
200 г 20%-ного раствора поваренной соли
NaCl.
Ответ 40г.
8. Определите
нормальную концентрацию раствора
сульфата калия, в 20 мл которого
содержится 1,74 г растворенного
вещества. Ответ 1н
9. Определите объем
воды, который нужно прибавить к 100 мл
0,1 н. раствора гидроксида калия, чтобы
получить 0,05 н. раствор. Ответ 100мл
10. Определите
молярность 20%-ного раствора хлорида
цинка, плотность которого 1,186 г/мл.
Ответ 1,74 моль/л
11. На нейтрализацию
40 мл 2 М раствора серной кислоты
израсходовано 20 мл раствора гидроксида
натрия. Определите нормальность раствора
гидроксида натрия. Ответ 8н
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить концентрацию кислоты
Концентрация — размерная величина, посредством которой выражается состав раствора (в частности, содержание в нем растворенного вещества). Порой случается такое, что эта самая величина неизвестна. К примеру, в лаборатории среди множества бутылей может оказаться один, подписанный просто — HCl (соляная кислота). Для проведения же многих опытов информации требуется гораздо больше, нежели только название. Поэтому приходится задействовать экспериментальные методы, такие как титрование или определение плотности.

Вам понадобится
- -раствор щелочи точной коцентрации
- -бюретка
- -конические колбы
- -мерные пипетки
- -индикатор
- -набор ареометров
Инструкция
Одним из наиболее простых способов определения концентрации кислоты является прямое титрование (процесс постепенного добавления раствора с известной концентрацией(титранта) к раствору определяемого вещества с целью зафиксировать точку эквивалентности (конец реакции)). В данном случае удобно использовать нейтрализацию щелочью. Завершение ее можно легко определить с помощью добавления индикатора (к примеру, в кислоте фенолфталеин прозрачен, а при добавлении щелочи становится малиновым; метиловый оранжевый в кислой среде — розовый, а в щелочной — оранжевый).
Возьмите бюретку (объемом 15-20 мл), установите ее в штативе с помощью лапки. Она должна быть четко зафиксирована, иначе с раскачивающего кончика могут упасть несколько лишних капель, которые испортят вам весь процесс. Порой одна капелька меняет цвет индикатора. Этот момент необходимо засечь.
Запаситесь посудой и реактивами: коническими колбами для титрования (4-5 штук небольшого объема), несколькими пипетками (как Мора — без делений, так и размерными), мерной колбой на 1 л, фиксаналом щелочи, индикатором, дистиллированной водой.
Приготовьте раствор щелочи точной концентрации (к примеру, NaOH). Для этого лучше используйте фиксанал (ампула с запаянным в нее веществом, при разведении которого в 1л воды получается 0,1 нормальный раствор). Конечно, можно пустить в ход точную навеску. Но первый вариант точнее и надежнее.
Далее заполните бюретку раствором щелочи. В коническую колбу поместите 15 мл кислоты неизвестной концентрации (возможно, HCl), в нее же добавьте 2-3 капли индикатора. И приступайте непосредственно к титрованию. Как только индикатор изменит цвет и примерно 30 с будет таким оставаться, прекращайте процесс. Запишите, сколько ушло щелочи (к примеру, 2,5 мл).
Затем выполните данный ход работы еще 2-3 раза. Это делается для получения белее точного результата. После подсчитайте средний объем щелочи. Vср = (V1+V2+V3)/3, V1 — результат первого титрования, мл, V2 — результат второго, мл, V3 — объем третьего, мл, 3 — количество проделанных реакций. Например, Vср = (2,5+2,7+2,4)/3 = 2,53 мл.
После проведения эксперимента, можно приступить к основным подсчетам. В данной ситуации справедливо соотношение: C1*V1 = C2*V2, где C1 — концентрация раствора щелочи, нормальная (н), V1 — средний объем израсходованной на реакцию щелочи, мл, С2 — концентрация раствора кислоты, н, V2 — объем кислоты, участвующей в реакции, мл. С2 — величина неизвестная. Значит, ее необходимо выразить через известные данные. С2 = (C1*V1)/V2, т.е. С2 = (0,1 * 2,53)/ 15 = 0,02 н. Вывод: при титровании HCl раствором 0,1 н NaOH, была выяснена концентрация кислоты — 0,02 н.
Еще одним распространненым способом выяснить концентрацию кислоты — это, для начала, узнать ее плотность. Для этого приобретите набор ареометров (в специализированном химическом или магазине, также можно заказать по интернету или посетить точки торговли принадлежностей для автомобилистов).
Налейте кислоту в химический стакан и помещайте в него ареометры до тех пор, пока они не престанут тонуть или выталкиваться на поверхность. Когда же прибор станет, как поплавок, отметьте числовое значение на нем. Данная цифра и есть плотность кислоты. Далее, используя соответствующую литературу (можно справочник Лурье), не составит труда определить по таблице нужную концентрацию.
В независимости от того, какой способ вы выберите, не забывайте про соблюдение техники безопасности.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В уроке 18 «Кислотно-основное титрование» из курса «Химия для чайников» дадим определение процессу титрования; выясним что такое точка эквивалентности; выполним разбор задач на титрование. Для понимания материала данного урока Вам следует внимательно изучить уроку 16 «Кислоты и основания» и урок 17 «Реакция нейтрализации».

Титрование это
Титрование является очень популярной процедурой определения относительных концентраций химических эквивалентов в кислотных или основных растворах. И если Вам не приходилось выполнять лабораторные работы по титрованию в школе, то в университете или колледже титровать Вы будете не раз! Итак, переходим к определению:
Титрование — это способ определения концентрации кислоты или основания в растворе, путем измерения объема титранта (основания или кислоты с заданной концентрацией) необходимого для полной нейтрализации имеющегося реагента.
Точка эквивалентности
Поговорим о сущности процесса кислотно-основного титрования. Из необходимого оборудования, грубо говоря, вам понадобится лишь бюретка (стеклянная трубка с краником) и колба. Бывают два случая:
- Когда нужно определить концентрацию основания в колбе путем добавления из бюретки кислоты известной концентрации.
- Наоборот, когда необходимо определить концентрацию кислоты в колбе путем добавления основания известной концентрации.
Рассмотрим титрование в первом случае, когда титруемый раствор — основание, а титрант — кислота. Начинаем к анализируемому образцу основания постепенно добавлять раствор кислоты с заранее определенной концентраций до тех пор, пока число эквивалентов кислоты не будет равно числу эквивалентов основания. Продолжая титровать, в конце концов мы достигнем конечной точки титрования, или, как ее еще называют, точки эквивалентности — момент титрования, когда число эквивалентов титранта и титруемого раствора будут точно равны.
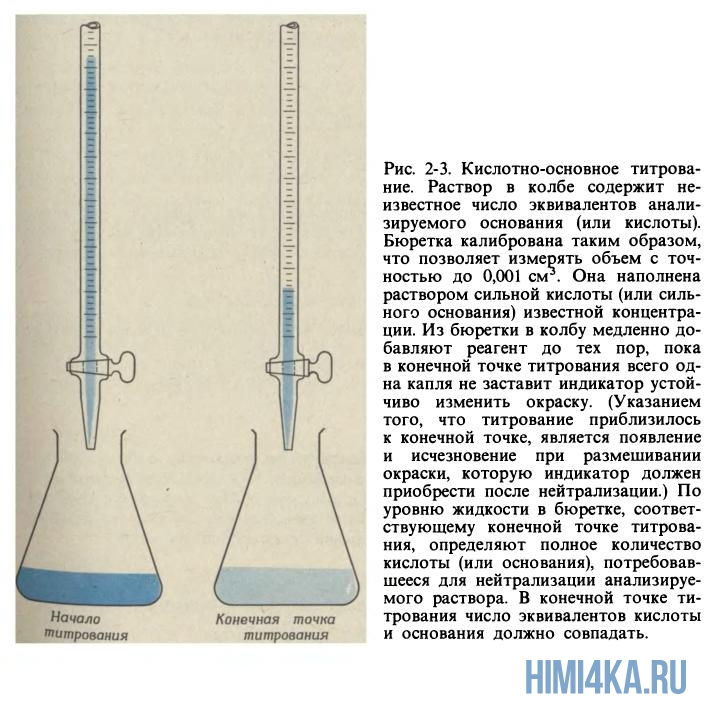
Чтобы понять, достигнута точки эквивалентности или еще нет, обычно используют различные кислотно-основные индикаторы. Для этого перед непосредственным титрованием в колбу с анализируемым раствором добавляют пару капель необходимого индикатора, и в момент достижения точки эквивалентности раствор начинает менять свой цвет.
Зная использованный объем титранта и его концентрацию, можно вычислить число эквивалентов основания в анализируемом образце. Если NA и NB — нормальности растворов кислоты и основания, а VA и VB — их объемы в момент нейтрализации, то:
- Число эквивалентов = NAVA = NBVB
С теорией покончено, переходим к решению задач на титрование.
Задачи на титрование
Пример 1. Допустим, химичка потребовала, чтобы вы нейтрализовали 25,00 мл раствора кислоты H3PO4. На титрование у вас ушло 30,25 мл раствора NaOH. Вычислите отношение нормальных и молярных концентраций обоих растворов.
Решение:
- NH3PO4 / NNaOH = VNaOH/ VH3PO4 = 30,25 мл / 25,00 мл = 1,210
Нормальная концентрация NaOH совпадает с молярной, а у H3PO4 нормальность в три раза больше молярной концентрации, поэтому:
- cH3PO4/ cNaOH = NH3PO4/3 / NNaOH = 0,403
Пример 2. Вы израсходовали 10,81 мл 0,1 н раствора HCl на титрование 25,00 мл раствора Ca(OH)2. Какую нормальность и молярность имеет анализируемый раствор? Сколько граммов Ca(OH)2 содержится в растворе?
Решение:
Первым делом вычислим нормальную концентрацию анализируемого раствора Ca(OH)2:
- NCa(OH)2 = ( VHCl/ VCa(OH)2) × NHCl = ( 10,81 мл / 25,00 мл ) × 0,1 н = 0,0432 н
Молярная концентрация Ca(OH)2 вдвое меньше его нормальной концентрации, так как химический эквивалент Ca(OH)2 равен 2. Поэтому анализируемый раствор имеет молярность 0,0216 М Ca(OH)2. Чтобы ответить на вопрос, сколько граммов Ca(OH)2 содержится в растворе, необходимо найти его количество вещества в растворе, для этого следует множить молярность на объем:
- 0,0216 моль/л × 0,025 л = 0,000514 моля
По таблице Менделеева определяем, что молекулярная масса Ca(OH)2 равна 74,1 г/моль, а значит в растворе содержится:
- 0,000541 моля × 74,1 г/моль = 0,0401 г Ca(OH)2
Пример 3. Химик-органик синтезирует новую кислоту. Он растворяет 0,5 г этой кислоты в определенном объеме воды и устанавливает, что для нейтрализации полученного раствора требуется 15,73 мл 0,437 н. раствора NaOH. Чему равен грамм-эквивалент синтезированной им кислоты? Если известно, что эта кислота содержит три ионизуемые группы –COOH, чему равна ее молекулярная масса?
Решение
Число эквивалентов основания, понадобившееся для нейтрализации, равно:
- 0,01573 л × 0,437 экв/л = 0,00687 экв
Грамм-эквивалент кислоты определяется из соотношения:
- 0,500 г / 0,00687 экв. = 72,8 г/экв
Так как грамм-эквивалент кислоты равен 72,8 г, а каждый ее моль высвобождает 3 эквивалента ионов водорода H+, молекулярная масса кислоты должна быть равна 3·72,8 г = 218 г.
Надеюсь урок 18 «Кислотно-основное титрование» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
