Насыщенный пар
-
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
-
Испарение и конденсация
-
Динамическое равновесие
-
Свойства насыщенного пара
-
Влажность воздуха
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.

Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
к оглавлению ▴
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Давление и плотность насыщенного пара обозначаются и
. Очевидно,
и
— это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
к оглавлению ▴
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
(1)
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Это следует из того, что плотность насыщенного пара не зависит от объёма, а давление однозначно связано с плотностью уравнением (1).
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.

Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
к оглавлению ▴
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1), напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Насыщенный пар» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
| Концентрация | |
|---|---|
 |
|
| Размерность | L−3 |
| Единицы измерения | |
| СИ | м−3 |
| СГС | см−3 |
Концентра́ция части́ц — физическая величина, равная отношению числа частиц N к объёму V, в котором они находятся:
Размерность в СИ [n] = 1/м3, в системе СГС — [n] = 1/см3.
Если концентрация является функцией координаты 
Таким образом,
Однако такое представление является в некоторой степени условным, поскольку концентрация (как, например, и температура) относится к макропараметрам и при переходе к бесконечно малому объёму, по большому счёту, теряет смысл. Бесконечно малый объём в данном случае должен определяться как объём, число частиц в котором велико, однако изменение макропараметров в пределах объёма мало́.
Концентрация имеет следующую связь с плотностью и насыщенностью:
Формулы, в которых присутствует концентрация[править | править код]
[1] — давление идеального газа (см. уравнение Клапейрона).
— средняя длина свободного пробега молекулы газа (здесь D — эффективный диаметр молекулы).
— число ударов молекул газа о единицу поверхности стенки за единицу времени (здесь
— средняя скорость молекул).
— плотность тока (здесь q — заряд носителя,
— средняя скорость носителей заряда в данной точке).
См. также[править | править код]
- Концентрация смеси
Примечания[править | править код]
- ↑ Клапейрона уравнение // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1990. — Т. 2: Добротность — Магнитооптика. — С. 371. — 704 с. — 100 000 экз. — ISBN 5-85270-061-4.
Содержание
- § 20. Атомы и молекулы, их характеристики (окончание)
- Концентрация молекул
- Молекулярная физика
§ 20. Атомы и молекулы, их характеристики (окончание)
Концентрация молекул
7. Постоянная Авогадро. Поскольку молекулы имеют малые размеры, их число в любом макроскопическом теле очень велико.
Число молекул в единице объёма называют концентрацией. Концентрация n вычисляется по формуле
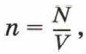
где N — число молекул в теле, V — его объём.
Концентрацию молекул в теле также можно определить, зная плотность вещества ρ и массу молекулы этого вещества m0. Поскольку 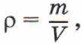 где m — масса тела, и m = m0N, то
где m — масса тела, и m = m0N, то
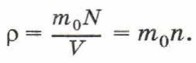
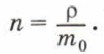
Если плотность воды ρ = 1000 кг/м 3 , а масса молекулы воды m0 = 3 • 10 -26 кг, то концентрация молекул воды равна:
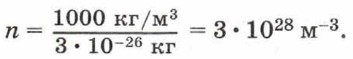
Плотность газов существенно меньше, чем плотность жидкостей, поэтому и концентрация молекул газов меньше, чем концентрация молекул жидкости. Так, если плотность водорода 9 • 10 -2 кг/м 3 , масса молекулы водорода 3,3 • 10 -27 кг, то концентрация молекул водорода равна 2,68 • 10 25 м -3 . Концентрация молекул любого газа при нормальных условиях (нормальном атмосферном давлении и температуре 0 °С) одинакова и равна приведённому для водорода значению. Это число называют постоянной Лошмидта: L = 2,68 • 10 25 м -3 .
Чтобы представить себе, насколько велико это число, предположим, что в воздушном шаре сделали настолько тонкий прокол, что за каждую секунду через него проходит 10 молекул. В этом случае, для того чтобы вышли все молекулы, потребуется 30 миллиардов лет.
Из определения моля следует, что 1 моль любого вещества содержит одинаковое число молекул (атомов). Это число называют постоянной Авогадро.
Постоянная Авогадро NА — число молекул или атомов в количестве вещества 1 моль.
Постоянную Авогадро можно рассчитать, зная, что углероду количеством вещества 1 моль соответствует масса 0,012 кг, а масса одной молекулы углерода m 0С = 1,995 • 10 -26 кг. Тогда в одном моле углерода содержится число молекул:
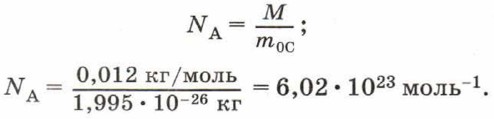
Поскольку в одном моле любого вещества содержится одинаковое число молекул, то при одинаковых условиях 1 моль любого газа занимает одинаковый объём.
Объём, занимаемый при нормальном атмосферном давлении любым газом количеством вещества 1 моль, равен 0,0224 м 3 .
1. Сформулируйте первое положение молекулярно-кинетической теории строения вещества.
2. Поясните выражение: «Молекула — мельчайшая частица вещества, сохраняющая его химические свойства».
3. Опишите опыт, позволяющий оценить размеры молекулы. Предложите способ измерения объёма капли масла.
4. Что называют относительной молекулярной массой; количеством вещества; молярной массой; концентрацией молекул; постоянной Авогадро?
6. Каков порядок значений размеров, массы молекул, их концентрации, числа молекул в одном моле вещества?
1Д. Подготовьте краткое сообщение об исследованиях М. В. Ломоносова, результаты которых внесли вклад в развитие учения о строении вещества. Воспользуйтесь для этого интернет-ресурсами и другими источниками информации. Докажите, что результаты исследований М. В. Ломоносова имели принципиальное значение для развития взглядов на строение вещества.
2. Сравните количество вещества, содержащееся в телах равной массы из алюминия и железа.
3. Найдите число атомов в алюминиевой ложке массой 30 г.
4. Деталь площадью 30 см 2 покрыли слоем серебра толщиной 2 мкм. Сколько атомов серебра содержится в покрытии?
5. Сравните массы и объёмы двух тел, сделанных из свинца и меди, если в них содержатся равные количества вещества.
6. Вычислите постоянную Авогадро, если известно, что масса молекулы кислорода 5,312 • 10 -26 кг.
Почему мы уверены в существовании молекул и атомов, ведь мы их не видим?
Источник
Молекулярная физика
Формулы молекулярной физики
Формула концентрации молекул

Здесь n — концентрация  , N — количество молекул (безразмерное), V — объем
, N — количество молекул (безразмерное), V — объем  .
.
Формула плотности

Здесь  — плотность вещества
— плотность вещества  , m — масса вещества (кг), V — объем
, m — масса вещества (кг), V — объем  .
.
Формула относительной молекулярной массы

Здесь  — относительная молекулярная масса (безразмерная),
— относительная молекулярная масса (безразмерная),  — масса одной молекулы (кг),
— масса одной молекулы (кг),  — масса атома углерода (кг).
— масса атома углерода (кг).
Формула количества вещества (количества молей)

Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы

Здесь  — масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль),
— масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль),  — число Авогадро,
— число Авогадро,  — плотность вещества
— плотность вещества  , n — концентрация молекул
, n — концентрация молекул  .
.
Формулы количества молекул

Здесь A — количество молекул (безразмерное), п — концентрация молекул  , V— объем
, V— объем  , v — количество вещества (количество молей) (моль),
, v — количество вещества (количество молей) (моль),  — число Авогадро
— число Авогадро  , m — масса вещества (кг),
, m — масса вещества (кг),  — масса одной молекулы.
— масса одной молекулы.
Формулы средней квадратичной скорости молекул

Здесь  — средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль),
— средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль),  Дж/К — постоянная Больцмана,
Дж/К — постоянная Больцмана,  — масса одной молекулы (кг).
— масса одной молекулы (кг).
Основное уравнение кинетической теории идеального газа

Здесь р — давление газа (Па),  — масса одной молекулы (кг), n — концентрация молекул
— масса одной молекулы (кг), n — концентрация молекул  ,
,  — средняя квадратичная скорость молекул (м/с),
— средняя квадратичная скорость молекул (м/с),  — средняя кинетическая энергия молекул (Дж).
— средняя кинетическая энергия молекул (Дж).
Формула средней кинетической энергии молекул

Здесь  — средняя кинетическая энергия молекул (Дж),
— средняя кинетическая энергия молекул (Дж),  — масса одной молекулы (кг),
— масса одной молекулы (кг),  — средняя квадратичная скорость молекул (м/с).
— средняя квадратичная скорость молекул (м/с).
Связь шкал Цельсия и Кельвина

Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой

Здесь  — средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
— средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева

Здесь р — давление газа (Па), V — объем  , т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль),
, т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль),  — объем моля
— объем моля  .
.
Объединенный газовый закон — уравнение Клапейрона
при 
Здесь  — давление (Па), объем
— давление (Па), объем  и абсолютная температура (К) газа в первом состоянии,
и абсолютная температура (К) газа в первом состоянии,  — давление (Па), объем
— давление (Па), объем  и абсолютная температура (К) газа во втором состоянии.
и абсолютная температура (К) газа во втором состоянии.
Закон Бойля — Мариотта (изотермический процесс)
при 

Здесь Т — абсолютная температура газа (К), m — масса газа (кг),  — давление (Па) и объем газа
— давление (Па) и объем газа  в первом состоянии,
в первом состоянии,  — давление (Па) и объем
— давление (Па) и объем  газа во втором состоянии.
газа во втором состоянии.
Закон Гей-Люссака (изобарный процесс)
при 

Здесь р — давление газа (Па), m — масса газа (кг),  и
и  — объем
— объем  и абсолютная температура (К) газа в первом состоянии,
и абсолютная температура (К) газа в первом состоянии,  — объем
— объем  и абсолютная температура (К) газа во втором состоянии.
и абсолютная температура (К) газа во втором состоянии.
Закон Шарля
при 

Здесь V — объем газа  , m — масса газа (кг),
, m — масса газа (кг),  — давление (Па) и абсолютная температура (К) газа в первом состоянии,
— давление (Па) и абсолютная температура (К) газа в первом состоянии,  — давление (Па) и абсолютная температура (К) газа во втором состоянии.
— давление (Па) и абсолютная температура (К) газа во втором состоянии.
Связь давления идеального газа с концентрацией его молекул и температурой

Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа  , абсолютная температура Т (К).
, абсолютная температура Т (К).
Формулы относительной влажности

Здесь  — относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре
— относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре  — плотность насыщенного водяного пара при той же температуре
— плотность насыщенного водяного пара при той же температуре  — давление водяного пара в воздухе при данной температуре (Па),
— давление водяного пара в воздухе при данной температуре (Па),  — давление насыщенного водяного пара в воздухе при той же температуре (Па).
— давление насыщенного водяного пара в воздухе при той же температуре (Па).
Работа при изобарном изменении объема газа

Здесь А — работа (Дж), р — давление газа (Па),  — изменение объема газа
— изменение объема газа  — соответственно начальный и конечный объемы газа
— соответственно начальный и конечный объемы газа  .
.
Внутренняя энергия идеального одноатомного газа

Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль),  — изменение внутренней энергии (Дж),
— изменение внутренней энергии (Дж),  — изменение температуры (К).
— изменение температуры (К).
Первый закон термодинамики

Здесь Q — количество теплоты, переданное термодинамической системе (Дж),  — изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
— изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при 

к изохорному: при V = const

к изобарному: при р = const


Здесь Т — абсолютная температура (К),  — изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем
— изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем  , р — давление (Па).
, р — давление (Па).
Формулы количества теплоты при нагревании или охлаждении тел

Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг),  — изменение температуры тела по шкале Цельсия,
— изменение температуры тела по шкале Цельсия,  и
и  — температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия,
— температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия,  — изменение абсолютной температуры тела (К),
— изменение абсолютной температуры тела (К),  — абсолютные температуры тела в начале и в конце процесса передачи теплоты (К),
— абсолютные температуры тела в начале и в конце процесса передачи теплоты (К),  — теплоемкость тела (Дж/К).
— теплоемкость тела (Дж/К).
Формула количества теплоты при плавлении или кристаллизации

Здесь Q — количество теплоты (Дж), т — масса тела (кг),  — удельная теплота плавления вещества (Дж/кг).
— удельная теплота плавления вещества (Дж/кг).
Формула количества теплоты при парообразовании или конденсации

Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива

Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя

Здесь  — коэффициент полезного действия (безразмерный или в %),
— коэффициент полезного действия (безразмерный или в %),  — работа, совершенная двигателем (Дж),
— работа, совершенная двигателем (Дж),  — количество теплоты, полученное рабочим веществом от нагревателя (Дж),
— количество теплоты, полученное рабочим веществом от нагревателя (Дж),  — количество теплоты, отданное рабочим веществом холодильнику (Дж).
— количество теплоты, отданное рабочим веществом холодильнику (Дж).
Коэффициент полезного действия идеального теплового двигателя

Здесь  — коэффициент полезного действия идеального теплового двигателя (безразмерный или в %),
— коэффициент полезного действия идеального теплового двигателя (безразмерный или в %),  — абсолютная температура нагревателя (К),
— абсолютная температура нагревателя (К),  — абсолютная температура холодильника(К).
— абсолютная температура холодильника(К).
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Возможно вам будут полезны эти страницы:






















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:

- p – давление молекул газа на границы емкости,
- m0 – масса одной молекулы,
- n — концентрация молекул, число частиц N в единице объема V;
- v2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ

Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
![]()
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:

- S – площадь этой стенки
- n — концентрация частиц
- Давление p равно отношению силы F к площади S, на которую действует эта сила:

Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:

Исходя из вышенаписанного получаем:

Тогда

Если заменить среднее значение кинетической энергии поступательного движения молекул — E:

и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:

Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Источник: https://people-ask.ru/nauki/fizika/osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-mkt-s-vivodom
II. Молекулярная физика
Вещество состоит из частиц.
Молекула — это самая маленькая частица вещества, которая обладает его основными химическими свойствами.
Молекула состоит из атомов. Атом — наименьшая частица вещества, которая не делится при химических реакциях.

Многие молекулы состоят из двух или больше атомов, удерживаемых вместе химическими связями. Некоторые молекулы состоят из сотен тысяч атомов.
Второе положение молекулярно-кинетической теории
Молекулы находятся в непрерывном хаотическом движении. Это движение не зависит от внешних воздействий. Движение происходит в непредсказуемом направлении из-за столкновения молекул. Доказательством является броуновское движение частиц (открыто Р.Броуном 1827г). Частицы помещают в жидкость или газ и наблюдают их непредсказуемое движение из-за соударений с молекулами вещества.

Броуновское движение
Доказательством хаотического движения является диффузия — проникновение молекул одного вещества в промежутки между молекулами другого вещества. Например, запах освежителя воздуха мы ощущаем не только в том месте, где его распылили, но он постепенно перемешивается с молекулами воздуха во всей комнате.
Агрегатное состояние вещества
В газах среднее расстояние между молекулами в сотни раз превышает их размеры. В основном молекулы движутся поступательно и равномерно. После столкновений начинают вращаться.

В жидкостях расстояние между молекулами значительно меньше. Молекулы совершают колебательное и поступательное движения. Молекулы через малые промежутки времени скачкообразно переходят в новые положения равновесия (мы наблюдаем текучесть жидкости).

В твердых телах молекулы колеблются и очень редко перемещаются (только при увеличении температуры).

Третье положение молекулярно-кинетической теории
Между молекулами существуют силы взаимодействия, которые имеют электромагнитную природу. Эти силы позволяют объяснить возникновение сил упругости. Когда вещество сжимают, молекулы сближаются, между ними возникает сила отталкивания, когда внешние силы отдаляют молекулы друг от друга (растягивают вещество), между ними возникает сила притяжения.
Плотность вещества
Это скалярная величина, которая определяется по формуле


Плотность веществ — известные табличные значения
Химические характеристики вещества
Постоянная Авогадро NA — число атомов, содержащихся в 12г изотопа углерода

Количество вещества — это отношение числа элементов этого вещества к постоянной Авогадро

- 1 моль любого вещества содержит одинаковое число частиц, это число равно постоянной Авогадро.
- Молярная масса M — это масса одного моля вещества
- Если тело состоит из N молекул массой m0, то масса тела
- Концентрация частиц — это количество частиц в объеме
- Можно вывести формулы
Источник: http://fizmat.by/kursy/molekuljarnaja/polozhenija_mkt
Молекулярно-кинетическая теория идеального газа. Основные положения
Молекулы в идеальном газе движутся хаотически. Движение одной молекулы характеризуют микроскопические параметры (масса молекулы, ее скорость, импульс, кинетическая энергия).
Свойства газа как целого описываются с помощью макроскопических параметров (масса газа, давление, объем, температура).
Молекулярно-кинетическая теория устанавливает взаимосвязь между микроскопическими и макроскопическими параметрами.
Число молекул в идеальном газе столь велико, что закономерности их поведения можно выяснить только с помощью статистического метода. Равномерное распределение в пространстве молекул идеального газа является наиболее вероятным состоянием газа, т. е. наиболее часто встречающимся.
Распределение молекул идеального газа по скоростям при определенной температуре является статистической закономерностью.
Наиболее вероятная скорость молекул — скорость, которой обладает максимальное число молекул. Стационарное равновесное состояние газа — состояние, в котором число молекул в заданном интервале скоростей остается постоянным.
Температура тела — мера средней кинетической энергии поступательного движения его молекул:

- где черта сверху — знак усреднения по скоростям, k = 1,38 • 10-23 Дж/К — постоянная Больцмана.
- Единица термодинамической температуры — кельвин (К).
- При абсолютном нуле температуры средняя кинетическая энергия молекул равна нулю.
- Средняя квадратичная (тепловая) скорость молекул газа

где М — молярная масса, R = 8,31 Дж/(К • моль) — молярная газовая постоянная.
Давление газа — следствие ударов движущихся молекул:

где n — концентрация молекул (число молекул в единице объема), Ek — средняя кинетическая энергия молекулы.
Давление газа пропорционально его температуре:

Постоянная Лошмидта — концентрация идеального газа при нормальных условиях (атмосферное давление р= 1,01 • 105 Па и температура Т = 273 К):

Уравнение Клапейрона—Менделеева — уравнение состояния идеального газа, связывающее три макроскопических параметра (давление, объем, температуру) данной массы газа.

Изопроцесс — процесс, при котором один из макроскопических параметров состояния данной массы газа остается постоянным. Изотермический процесс — процесс изменения состояния определенной массы газа при постоянной температуре.
Закон Бойля—Мариотта: для газа данной массы при постоянной температуре:

где р1, р2, V1, V2 — давление и объем газа в начальном и конечном состояниях
Изотерма — график изменения макроскопических параметров газа при изотермическом процессе. Изобарный процесс — процесс изменения состояния определенной массы газа при постоянном давлении.
Закон Гей-Люссака: для газа данной массы при постоянном давлении

- где V1, V2, T1, Т2— объем и температура газа в начальном и конечном состояниях.
- Изобара — график изменения макроскопических параметров газа при изобарном процессе.
- Изохорный процесс — процесс изменения состояния определенной массы газа при постоянном объеме. Закон Шарля: для газа данной массы при постоянном объеме

где p1, р2, T1, Т2 — давление и температура газа в начальном и конечном состояниях.
Изохора — график изменения макроскопических параметров газа при изохорном процессе.
Источник: https://5terka.com/molekulyarno-kineticheskaya-teoriya-idealnogo-gaza-osnovnye-polozheniya
Идеальный газ. Формула концентрации молекул газа. Пример задачи :
В физике текучих субстанций большое внимание уделяется изучению газов, которое осуществляют при помощи использования модели идеального газа. В этой области было открыто много законов. В приведенной ниже статье изучим формулу концентрации молекул газа (идеального) и покажем, как ее следует применять при решении практической проблемы.
Идеальный газ

Что же это такое? Прежде чем записать формулу концентрации молекул газа, расскажем, что собой представляет модель идеального газа. В соответствии с кинетической теорией текучих субстанций, в таких веществах молекулы и атомы движутся хаотически по прямым траекториям. Расстояния между ними намного больше, чем их собственные линейные размеры, поэтому последними пренебрегают при выполнении вычислений. Кроме того, считают, что взаимодействий между молекулами не существует, поскольку их кинетическая энергия слишком велика по сравнению со слабыми потенциальными взаимодействиями.
Любые реальные газы, которые находятся при низких давлениях и достаточно высоких абсолютных температурах, по своему поведению приближаются к описанной модели.
Тем не менее существуют текучие субстанции, у которых помимо ван-дер-ваальсовых взаимодействий между частицами действуют взаимодействия более сильного характера.
Примером является водяной пар, у которого молекулы друг с другом связаны водородными (полярными) связями. Для описания поведения таких субстанций нельзя использовать модель идеального газа.

Универсальное уравнение
- Модель идеального газа удобна при выполнении практических расчетов тем, что уравнение состояния вещества, полученное на ее основе, связывает три термодинамических параметра: температуру T, объем системы V и абсолютное давление P. Это уравнение записано ниже:
- P * V = n * R * T.
- Где R — постоянная, равная 8,314 Дж/(моль*К), n — количество вещества.
Современная молекулярно-кинетическая теория газов позволяет путем несложных рассуждений и математических выкладок получить теоретически это уравнение.
Впервые же оно было записано в результате анализа многочисленных экспериментов, которые в течение двух веков выполняли европейские ученые, начиная от Роберта Бойля (вторая половина XVII века) и заканчивая Амедео Авогадро (начало XIX века).
Считается, что уравнение состояния идеального газа первым получил Эмиль Клапейрон, а к современной форме его привел русский химик Дмитрий Менделеев, поэтому его часто называют законом Клапейрона-Менделеева.

Понятие о концентрации молекул: виды концентраций
Когда изучают текучие субстанции, то знать концентрации компонентов, которые их образуют, является важным при решении многих практических задач.
Например, от этого показателя и размеров молекул зависит общая площадь поверхности активного вещества, а значит, его реакционная способность.
Другой пример, концентрация некоторых веществ в воздухе определяет допустимые их пределы для нормального протекания жизненно необходимых процессов в организме человека.
В случае газов, как правило, пользуются тремя следующими концентрациями:
- Атомная. Она определяется, как процентное содержание количества атомов или молекул компонента по отношению к объему всей системы.
- Массовая. Показывает отношение массы компонента к объему газа.
- Молярная. Она равна отношению количества вещества изучаемого компонента к объему системы.
Заметим, что все виды концентраций вычисляются по отношению к объему системы. Справедливость этих величин действительна, поскольку каждый компонент системы полностью заполняет ее объем.
Среди всех типов концентраций наиболее удобной на практике является молярная. Ниже в статье приведем формулу именно для нее.
Формула концентрации молекул газа
В соответствии с приведенным в предыдущем пункте определением, молярная концентрация i-го компонента системы cn(i) вычисляется так:
cn(i) = ni / V.
Предположим, что мы имеем однокомпонентный (чистый) газ. Это может быть кислород, азот, гелий и так далее. В этом случае можно применить формулу Клапейрона-Менделеева и выразить из нее молярную концентрацию молекул. Имеем:
- P * V = n * R * T =>
- cn = n / V = P / (R * T).
- Из записанной формулы концентрации молекул газа легко получить атомную (молекулярную) концентрацию. Покажем, как это делается:
- cn = n / V = N / (NA * V) = cN / NA =>
- cN = cn * NA = NA * P / (R * T) = P / (kB * T).
Здесь NA и kB — число Авогадро и постоянная Больцмана. Соответственно, N — число молекул в системе. Поскольку величина kB имеет маленькое значение (1,38 * 10-23), то cN принимает огромные значения, что неудобно для ее практического использования.
Пример задачи
В результате изобарного нагрева закрытой системы с идеальным газом его температура увеличилась на 100 К и стала равной 400 К. Как изменится концентрация молекул газа, если давление в системе составляет 1,5 атмосферы.

- Поскольку давление в процессе нагрева не изменилось, а температура была равна 300 К согласно условию задачи, то молярная концентрацию молекул до нагрева системы составляла:
- cn1 = 1,5 * 101 325 / (8,314 * 300) = 60,9 моль/м3.
- Число молекул в системе не изменилось при нагреве, так как система является закрытой. После нагрева газа его концентрация составила:
- cn2 = 1,5 * 101 325 / (8,314 * 400) = 45,7 моль/м3.
- Изменение концентрации составило:
- Δcn = cn2 — cn1 = 45,7 — 60,9 = -15,2 моль/м3.
- Отрицательный знак говорит, что концентрация уменьшилась, что является очевидным, поскольку увеличился объем системы после нагрева, а число частиц в ней осталось прежним.
Источник: https://www.syl.ru/article/459392/idealnyiy-gaz-formula-kontsentratsii-molekul-gaza-primer-zadachi
Урок 15. Моляльность и молярность – HIMI4KA
Архив уроков › Основные законы химии
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.

Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом.
Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом.
В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций.
Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости.
В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество.
Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора.
Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным.
Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным.
Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л.
Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.

Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (NH4)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора.
Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m.
Формула для вычисления моляльной концентрации:
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.

Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:

Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-15-moljalnost-i-moljarnost.html
ФизМат
Основные положения молекулярно-кинетической теории и их экспериментальное обоснование.
Молекулярно-кинетическая теория — это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениях о существовании молекул и атомов как мельчайших частиц вещества. В основе МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов.
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Основные положения МКТ подтверждаются многими опытными фактами. Существование молекул, атомов и ионов доказано экспериментально, молекулы достаточно изучены и даже сфотографированы с помощью электронных микроскопов. Способность газов неограниченно расширяться и занимать весь предоставленный им объем объясняется непрерывным хаотическим движением молекул. Упругость газов, твердых и жидких тел, способность жидкостей смачивать некоторые твердые тела, процессы окрашивания, склеивания, сохранения формы твердыми телами и многое другое говорят о существовании сил притяжения и отталкивания между молекулами. Явление диффузии — способность молекул одного вещества проникать в промежутки между молекулами другого — тоже подтверждает основные положения МКТ. Явлением диффузии объясняется, например, распространение запахов, смешивание разнородных жидкостей, процесс растворения твердых тел в жидкостях, сварка металлов путем их расплавления или путем давления. Подтверждением непрерывного хаотического движения молекул является также и броуновское движение — непрерывное хаотическое движение микроскопических частиц, нерастворимых в жидкости.
Движение броуновских частиц объясняется хаотическим движением частиц жидкости, которые сталкиваются с микроскопическими частицами и приводят их в движение. Опытным путем было доказано, что скорость броуновских частиц зависит от температуры жидкости. Теорию броуновского движения разработал А. Эйнштейн. Законы движения частиц носят статистический, вероятностный характер. Известен только один способ уменьшения интенсивности броуновского движения — уменьшение температуры. Существование броуновского движения убедительно подтверждает движение молекул.
Любое вещество состоит из частиц, поэтому количество вещества v принято считать пропорциональным числу частиц, т. е. структурных элементов, содержащихся в теле.
Размеры и массы молекул.
Средняя масса молекул обычно определяется химическими методами, постоянная Авогадро с высокой точностью определена несколькими физическими методами. Массы молекул и атомов со значительной степенью точности определяются с помощью масс-спектрографа.
Массы молекул очень малы. Например, масса молекулы воды:
Молярная масса связана с относительной молекулярной массой Мг. Относительная молекулярная масса — это величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода С12. Если известна химическая формула вещества, то с помощью таблицы Менделеева может быть определена его относительная масса, которая, будучи выражена в килограммах, показывает величину молярной массы этого вещества.
Диаметром молекулы принято считать минимальное расстояние, на которое им позволяют сблизиться силы отталкивания. Однако понятие размера молекулы является условным. Средний размер молекул порядка 10^-10м.
Моль.
Единицей количества вещества является моль. Моль — это количество вещества, содержащее столько же структурных элементов любого вещества, сколько содержится атомов в 12 г углерода С12.
Число Авогадро.
Отношение числа молекул вещества к количеству вещества называют постоянной Авогадро:
Постоянная Авогадро показывает, сколько атомов и молекул содержится в одном моле вещества. Молярная масса — масса одного моля вещества, равная отношению массы вещества к количеству вещества:
М = m/v.
Молярная масса выражается в кг/моль. Зная молярную массу, можно вычислить массу одной молекулы:
Опыт Штерна.
Опыт Штерна — опыт, впервые проведённый немецким физиком Отто Штерном в 1920 году. Опыт являлся одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
Для проведения опыта Штерном был подготовлен прибор, состоящий из двух цилиндров разного радиуса, ось которых совпадала и на ней располагалась платиновая проволока с нанесённым слоем серебра. В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление.
При пропускании электрического тока через проволоку достигалась температура плавления серебра, из-за чего атомы начинали испаряться и летели к внутренней поверхности малого цилиндра равномерно и прямолинейно со скоростью v, соответствующей подаваемому на концы нити напряжению.
Во внутреннем цилиндре была проделана узкая щель, через которую атомы могли беспрепятственно пролетать далее. Стенки цилиндров специально охлаждались, что способствовало оседанию попадающих на них атомов.
В таком состоянии на внутренней поверхности большого цилиндра образовывалась достаточно чёткая узкая полоса серебряного налёта, расположенная прямо напротив щели малого цилиндра. Затем всю систему начинали вращать с некой достаточно большой угловой скоростью ω.
При этом полоса налёта смещалась в сторону, противоположную направлению вращения, и теряла чёткость. Измерив смещение sнаиболее тёмной части полосы от её положения, когда система покоилась, Штерн определил время полёта, через которое нашёл скорость движения молекул:
![]() ,
,
где s — смещение полосы, l — расстояние между цилиндрами, а u — скорость движения точек внешнего цилиндра.
Найденная таким образом скорость движения атомов серебра совпала со скоростью, рассчитанной по законам молекулярно-кинетической теории, а тот факт, что получившаяся полоска была размытой, свидетельствовал в пользу того, что скорости атомов различны и распределены по некоторому закону — закону распределения Максвелла: атомы, двигавшиеся быстрее, смещались относительно полосы, полученной в состоянии покоя, на меньшие расстояния, чем те, которые двигались медленнее.
Модель идеального газа.

Основные уравнения молекулярно-кинетической теории идеального газа.
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало.
— вводится для математического описания поведения газов. Реальные разреженные газы ведут себя как идеальный газ!
Свойства идеального газа:
— взаимодействие между молекулами пренебрежительно мало
— расстояние между молекулами много больше размеров молекул
— молекулы — это упругие шары
— отталкивание молекул возможно только при соударении
— движение молекул — по законам Ньютона
— давление газа на стенки сосуда — за счет ударов молекул газа
Скорость молекул газа
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
V^2 = (v1^2 + v2^2 +…+vn^2)/n
где
n — число молекул в газе
v — модули скоростей отдельных молекул в газе В теории газов часто используется понятие кинетической энергии молекул.
Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц ( массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Ниже приведены различные выражения для основного уравнения МКТ:
P=F/s=1/3 * n * m0 * V^2 = 1/3 * ρ * v^2 = 2/3*n*Ek
где P — давление газа на стенки сосуда(Па) n — концентрация молекул, т.е. число молекул в единице объема ( 1/м3) m0 — масса молекулы (кг) V^2 — средний квадрат скорости молекул ( м2/с2) ρ — плотность газа (кг/м3) Ek — средняя кинетическая энергия молекул (Дж)
Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
- Дополнительные расчетные формулы по теме
-
Формула для расчета концентрации молекул:
- n=N/V
где N — число молекул газа
V — объем газа (м3)
Формула для расчета плотности газа:
ρ = m0*n
где mo — масса молекулы (кг)
n — концентрация молекул (1/м3)
Закон Дальтона.
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
![]()
При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.
Источник: http://fizmatinf.blogspot.com/2013/05/20.html
Идеальный газ. Основное уравнение МКТ. Молекулярная физика — Класс!ная физика
Идеальный газ — это просто!
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало. Понятие «идеальный газ» вводится для математического описания поведения газов.
Реальные разреженные газы ведут себя как идеальный газ!
- Свойства идеального газа:
- — давление газа на стенки сосуда — за счет ударов молекул газа
- Скорость молекул газа
— взаимодействие между молекулами пренебрежительно мало — расстояние между молекулами много больше размеров молекул — молекулы — это упругие шары — отталкивание молекул возможно только при соударении — движение молекул — по законам Ньютона
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
![]()
- где n — число молекул в газе v — модули скоростей отдельных молекул в газе В теории газов часто используется понятие кинетической энергии молекул.
- Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура). Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
![]()
где р — давление газа на стенки сосуда(Па)
n — концентрация молекул, т.е. число молекул в единице объема ( 1/м3)
— масса молекулы (кг) — средний квадрат скорости молекул (м2/с2) ρ — плотность газа (кг/м3) — средняя кинетическая энергия молекул (Дж)
- Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
- Дополнительные расчетные формулы по теме
- Формула для расчета концентрации молекул:
- где N — число молекул газа
- V — объем газа (м3)
- Формула для расчета плотности газа:
где mo — масса молекулы (кг) n — концентрация молекул (1/м3)
Назад в раздел «10-11 класс»
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. — Взаимодействие молекул. Строение твердых тел, жидкостей и газов. — Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие.
Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
Источник: http://class-fizika.ru/10_27.html
Урок 18. основное уравнение мкт — Физика — 10 класс — Российская электронная школа
- Физика, 10 класс
- Урок 18. Основное уравнение МКТ
- Перечень вопросов, рассматриваемых на уроке:
- 1) средняя кинетическая энергия молекулы;
- 2) давление газа;
- 3) основное уравнение МКТ;
- Глоссарий по теме:
- Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
- Средняя кинетическая энергия молекул – усреднённая величина, равная половине произведения массы молекулы на среднюю величину квадрата её скорости.
- Концентрация – число молекул в единице объёма.
- Масса молекулы (или атома) – чрезвычайно маленькая величина в макроскопических масштабах (граммах и килограммах), вычисляется через отношение массы вещества к количеству содержащихся в ней молекул (или атомов).
Изменение импульса тела – произведение силы на время действия силы. Импульс силы всегда показывает, как изменяется импульс тела за данное время.
Основная и дополнительная литература по теме урока:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. С. 188 – 192.
- Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. С. 111.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. С. 65 – 67.
Открытые электронные ресурсы по теме урока:
Теоретический материал для самостоятельного изучения
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами — массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа.
Давление газа на стенку сосуда обусловлено ударами молекул, давление газа пропорционально концентрации молекул: чем больше молекул в единице объема, тем больше ударов молекул о стенку за единицу времени. Каждая молекула при ударе о стенку передает ей импульс, пропорциональный импульсу молекулы m0v.
- Давление пропорционально второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:
- , где m0 — масса одной молекулы газа,
- n- концентрация молекул,
Средняя кинетическая энергия поступательного движения
тогда уравнение примет вид:
- Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
- Примеры и разбор решения заданий.
- 1. К каждой позиции первого столбца подберите соответствующую позицию второго:
| ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ | ФОРМУЛЫ |
| 1) импульс тела | А) |
| 2) средняя кинетическая энергия молекул | Б) |
| 3) давление газа на стенку сосуда | В) |
| 4) концентрация молекул | Г) |
Правильный ответ: вспомнив формулы величин, устанавливаем соответствие:
| ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ | ФОРМУЛЫ |
| 1) импульс тела | В) |
| 2) средняя кинетическая энергия молекул | А) |
| 3) давление газа на стенку сосуда | Г) |
| 4) концентрация молекул | Б) |
2. Кислород находится при нормальных условиях. Средняя квадратичная скорость молекул кислорода в этом случае равна ___ м/с.
- Решение:
- Ответ: 460 м/с.
Источник: https://resh.edu.ru/subject/lesson/6291/conspect/
Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Физика. 10 класс |
| Книга: | § 9. Испарение и конденсация. Насыщенный пар |
| Напечатано:: | Гость |
| Дата: | Среда, 17 Май 2023, 14:02 |
Почему в плотно закрытом сосуде горячая вода остывает медленнее, чем в открытом? Почему зимой на деревьях иногда появляется иней? Чем идеальный газ отличается от пара?
Испарение и конденсация. Из повседневного опыта мы знаем, что жидкости, например вода, находясь в открытых сосудах, с течением времени переходят в газообразное состояние — испаряются. Причём скорость испарения зависит от рода жидкости, её температуры, площади свободной поверхности и от притока воздуха. Вследствие испарения воды с поверхности водяной оболочки Земли (гидросферы), с поверхности почвы и растительного покрова в воздухе всегда находятся водяные пары, которые могут конденсироваться, образовывать облака, выпадать в виде осадков. Процессы испарения и конденсации распространены в природе и технике, и изучение их особенностей имеет большое практическое значение.
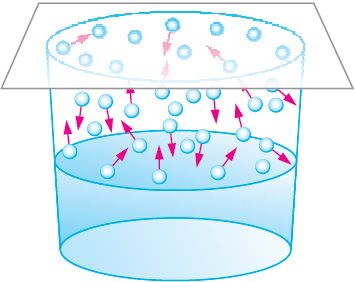
Рассмотрим плотно закрытый сосуд, в котором вода занимает нижнюю часть, а остальное пространство заполнено паром. Молекулы в воде и паре находятся в непрерывном движении и могут как вылетать из воды в пар, так и из пара возвращаться в воду. Таким образом, в сосуде одновременно протекают два противоположно направленных процесса — переход воды в газообразное состояние (испарение) и переход водяного пара в жидкость (конденсация) (рис. 58).
После герметизации сосуда в течение некоторого промежутка времени испарение жидкости преобладает над конденсацией её пара. Если при этом из окружающей среды к системе «жидкость — пар» не поступает энергия, то жидкость охлаждается. Это происходит вследствие того, что поверхностный слой жидкости покидают молекулы, обладающие наибольшей скоростью. Такие молекулы имеют и наибольшую кинетическую энергию теплового движения, что позволяет им преодолеть силы притяжения, действующие в поверхностном слое жидкости. Работа сил притяжения обеспечивает то, что скорость каждой вылетающей из жидкости молекулы уменьшается, а скорость каждой влетающей в неё молекулы, наоборот, увеличивается. Такие изменения скорости, а значит, и кинетической энергии молекул, пересекающих поверхность жидкости, позволяют системе «жидкость — пар» достичь состояния теплового равновесия, при котором температуры жидкости и её пара одинаковы.
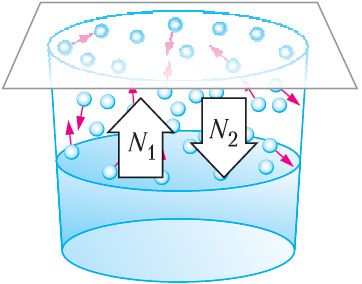
При испарении жидкости в плотно закрытом сосуде плотность пара над ней увеличивается, и одновременно растёт число молекул, влетающих обратно в жидкость. Концентрация молекул пара возрастает до тех пор, пока число N1 молекул, покидающих жидкость (рис. 59), не станет равным числу N2 молекул, возвращающихся в неё за тот же промежуток времени: N1 = N2. Уровень жидкости в сосуде при этом не изменяется с течением времени. Между жидкостью и её паром устанавливается состояние динамического равновесия. Оно будет существовать до тех пор, пока не изменится температура или объём системы.
От теории к практике
1. Обычно при испарении жидкость охлаждается. Когда возможно испарение жидкости при постоянной температуре?
2. Если сосуд с водой плотно закрыть, то сначала количество воды уменьшится, а затем будет оставаться постоянным. Почему?
Насыщенный пар.
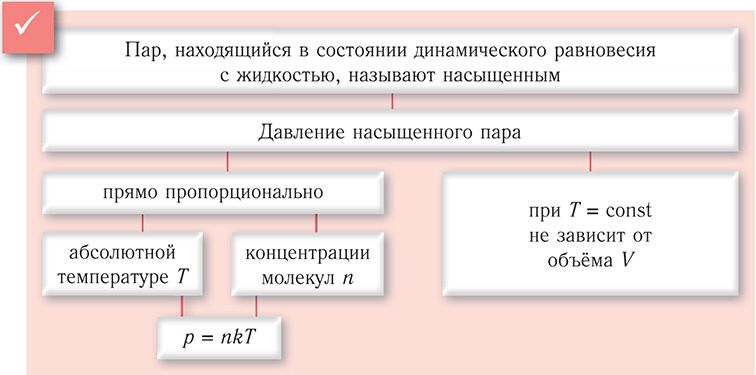
Пар, находящийся в состоянии динамического равновесия с жидкостью, называют насыщенным паром.
Давление такого пара называют давлением насыщенного пара.
Насыщенный пар обладает свойствами, отличающимися от свойств идеального газа.
Первое отличие состоит в том, что давление насыщенного пара не зависит от его объёма при постоянной температуре. Число молекул, переходящих из жидкости в пар через единичную площадку за единичный промежуток времени, зависит только от состава жидкости и её температуры. Число молекул, переходящих из пара в жидкость, зависит от концентрации пара, а значит, от его давления. Поэтому сразу при уменьшении объёма пара его давление увеличивается, что тут же приводит к возрастанию числа молекул, переходящих в жидкость. В результате число молекул пара уменьшается и спустя некоторый промежуток времени устанавливается прежнее давление, если температура жидкости сохранялась неизменной. При увеличении объёма пара его давление, наоборот, уменьшается. Вместе с этим уменьшается и число молекул, переходящих из пара в жидкость. В результате число молекул, которые покидают поверхность жидкости (оно не изменяется при T = const), превышает число молекул, возвращающихся в жидкость. Равновесие опять восстанавливается при достижении первоначального значения давления.
![]()
Второе отличительное свойство: при увеличении температуры давление pн насыщенного пара возрастает значительно быстрее, чем давление ри.г идеального газа. В случае идеального газа рост давления обусловлен только увеличением его температуры (p = nkT, V = const). В случае же насыщенного пара рост температуры приводит к увеличению числа молекул, переходящих из жидкости в пар, т. е. к росту концентрации молекул пара. В соответствии с формулой p = nkT давление пара увеличивается не только в результате непосредственного повышения температуры, но и в результате увеличения концентрации молекул пара, вызванного всё тем же повышением.
Давление насыщенного пара зависит также и от рода жидкости. Чем меньше силы взаимодействия между молекулами жидкости, тем больше концентрация молекул насыщенного пара, а значит, тем больше его давление и плотность.
При изменении объёма насыщенного пара его масса также изменяется. Поэтому законы идеального газа для изопроцессов можно применять к пару только в том случае, если он далёк от насыщения и его масса остаётся неизменной.
Однако уравнение Клапейрона–Менделеева можно использовать для нахождения любых параметров (p, V, T, m, ρ) насыщенного пара.
Давление (плотность) насыщенного пара при данной температуре — максимальное давление (плотность), которое может иметь пар, находящийся в состоянии динамического равновесия с жидкостью при этой температуре.
От теории к практике
1. В сосуде находится жидкость и её насыщенный пар. Зависит ли давление насыщенного пара от: а) рода жидкости; б) объёма сосуда; в) температуры жидкости; г) площади свободной поверхности жидкости?
![]()
2. Значение температуры жидкости, находящейся в динамическом равновесии со своим паром, t = 100 C°. Как изменится давление пара, если при неизменной температуре его объём медленно: а) вдвое увеличить; б) вдвое уменьшить?
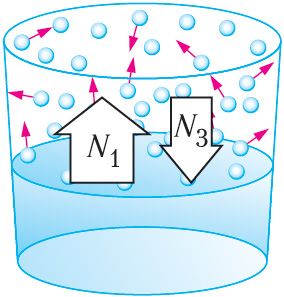
Ненасыщенный пар. Если сосуд с водой и её насыщенным паром открыть, то пар начнёт выходить наружу, и концентрация его молекул в сосуде уменьшится. Это приведёт к тому, что процесс испарения будет преобладать над процессом конденсации (рис. 60), и уровень жидкости в сосуде понизится. При этом нарушится динамическое равновесие (N1 > N3) между водой и её паром. Давление (плотность) пара уменьшится, и пар станет ненасыщенным.
Ненасыщенный пар — пар, давление (плотность) которого меньше давления (плотности) насыщенного пара при той же температуре.
Процесс испарения воды с поверхности морей и океанов, как правило, преобладает над процессом конденсации. Это означает, что над морями и океанами обычно находится ненасыщенный водяной пар, который, поднимаясь вверх, охлаждается и конденсируется, образуя облака и тучи.
Интересно знать
Воздушная оболочка Земли — атмосфера — представляет собой смесь газов. Атмосферный воздух всегда содержит водяной пар, концентрация молекул которого у поверхности Земли колеблется от 3% в тропиках до 2 · 10–5 % в Антарктиде. Из океанов, морей и рек, а также суши за год испаряется свыше 5 · 1014 м3 воды, что приблизительно равно объёму воды в чёрном море. На испарение затрачивается около половины всей поглощённой поверхностью Земли энергии солнечного излучения. При конденсации пара в атмосферу выделяется такое же количество теплоты, которое ранее потребовалось для испарения жидкости. Это приводит к нагреванию атмосферы и предотвращает резкие колебания температуры. При перемещении водяных паров в атмосфере на большие расстояния происходит их конденсация в областях с более низкой температурой, т. е. в одних областях поверхности и атмосферы Земли преобладают процессы испарения воды, а в других — процессы конденсации водяного пара.
![]()
1. Каковы общие черты процессов испарения и конденсации? Чем они отличаются?
2. Почему при испарении жидкость обычно охлаждается?
3. Какой пар называют насыщенным?
4. Какие физические процессы обусловливают состояние динамического равновесия между жидкостью и её паром?
5. Какие свойства насыщенного пара отличают его от идеального газа?





