Чему равна концентрация раствора уксусной кислоты, pH которого равен 3,2(Кд=1,8*10-5)?
Я решал так:
pH=-lg[H+], следовательно lg[H+]=-pH
[H+]=10-pH=10-3,2=6,3*10-4;
- [H+]=α*C, следовательноα=[H+]/С
- Кд=α2*C(так как CH3COOH-слабая кислота)
Из 1. и 2. следует: Кд=([H+]/С)2*C=[H+]2/С,следовательно С=[H+]2/Кд
С=6,32/1,8*10-5=0,022
ответ:0,022
Верно?если нет, то где ошибка?
Рассчитайте концентрацию уксусной кислоты (CH3COOH) в винном уксусе (рН=2,80), полагая, что кислотность определяется только уксусной кислотой (CH3COOH).
Решение задачи
Запишем уравнение диссоциации уксусной кислоты (CH3COOH):
![]()
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Используя, формулу, найдем концентрацию ионов водорода (H+):
-lg С(H+) = 2,8
С(H+) = 10-2,8 = 0,0016 (моль/л).
Учитывая, что концентрация уксусной кислоты (CH3COOH) равна концентрации ионов водорода (смотри уравнение диссоциации уксусной кислоты), следовательно, концентрация уксусной кислоты (CH3COOH) равна 0,0016 моль/л.
Ответ:
концентрация уксусной кислоты 0,0016 моль/л.
Вычисление концентрации электролита по значению его рН
Задача 545.
Чему равна концентрация раствора уксусной кислоты, рН которого равен 5,2?
Решение:
KD(CH3COOH) = 1,8 . 10-5.
Согласно условию задачи -lg[H+] = 5,2. Следовательно, -lg[H+] = 5,2 = 6,8. По таблице логарифмов находим:
[H+] = 6,31 . 10-5 моль/л.
Концентрации ионов [H+] и ионов [CH3COO–] в растворе CH3COOH равны:
CH3COOH ⇔ CH3COO– + H+
Обозначим искомую концентрацию уксусной кислоты через x и найдём его значение из выражения константы диссоциации, получим:
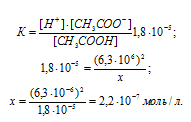
Ответ: CM = 2,2 . 10-7 моль/л.
Задача 546.
Вычислить значения  (OH–) и p
(OH–) и p (OH) в 0,2 н. растворе NaОН, считая f(OH–) = 0,80.
(OH) в 0,2 н. растворе NaОН, считая f(OH–) = 0,80.
Решение:
Для электролитов, состоящих из однозарядных ионов, значение ионной силы раствора численно равно концентрации раствора, в данном случае: I(NaOH) = 0,20. При ионной силе равной 0,2 и при коэффициенте активности иона равному 0,80 можно рассчитать значения активностей ионов по формуле  (ион) = fCM, получим:
(ион) = fCM, получим:
 (OH–) = 0,80 . 0,20 = 0,16 моль/л.
(OH–) = 0,80 . 0,20 = 0,16 моль/л.
Теперь рассчитаем значение p (OH–):
(OH–):
p (OH–) = –
(OH–) = – (OH–) = -lg1,6 . 10-1 = 1 – lg1,6 = 0,8.
(OH–) = -lg1,6 . 10-1 = 1 – lg1,6 = 0,8.
Ответ: p (OH-) = 0,8,
(OH-) = 0,8,  (OH–) = 1,6 . 10-1 моль/л.
(OH–) = 1,6 . 10-1 моль/л.
Задача 547.
Используя данные табл. 7 приложения, найти p (H+) 0,005 н. раствора НСI, содержащего, кроме того, 0,015 моль/л NаС1.
(H+) 0,005 н. раствора НСI, содержащего, кроме того, 0,015 моль/л NаС1.
Решение:
Для электролитов, состоящих из однозарядных ионов, значение ионной силы раствора численно равно концентрации раствора, в данном случае: I = 0,005 + 0,015 = 0,02.
При этой ионной силе коэффициент активности однозарядного иона равен 0,90. Активную концентрацию иона водорода рассчитаем по формуле  (ион) = fCM, где f – коэффициент активности иона, СМ – концентрация раствора, получим:
(ион) = fCM, где f – коэффициент активности иона, СМ – концентрация раствора, получим:
 (H+) = 0,02 . 0,9 = 1,8 . 10-2 моль/л.
(H+) = 0,02 . 0,9 = 1,8 . 10-2 моль/л.
Теперь находим значение p (H+):
(H+):
p (H+) = –
(H+) = – (H+) = -lg1,8 . 10-2 = 2 – lg1,8 = 2 – 0,255 = 1,75.
(H+) = -lg1,8 . 10-2 = 2 – lg1,8 = 2 – 0,255 = 1,75.
Ответ: p (H+) = 1,75.
(H+) = 1,75.
Задачи 548.
Степень диссоциации слабой одноосновной кислоты в 0,2 н. растворе равна 0,03. Вычислить значения [H+], [OH–] и pOH для этого раствора.
Решение:
Находим концентрацию ионов водорода:
[H+] =  . CM = 0,2 . 0,03 = 6 . 10-3 моль/л.
. CM = 0,2 . 0,03 = 6 . 10-3 моль/л.
Концентрацию гидроксид-ионов находим из соотношения:
pH2O = [H+] . [OH–] = 10-14; [OH–] = (10-14)/(6 . 10-3) = 1,7 . 10-12.
Отсюда
pОН = lg[OH–] = -lg1,7 . 10-12 = 12 – lg1,7 = 12 – 0,23 = 11,77.
Ответ: [H+] = 6 . 10-3 моль/л; [OH–] = 1,7 . 10-12; pОН = 11,77.
Растворы. Способы выражения концентрации растворов
Важной
характеристикой раствора является концентрация.
Концентрация – это величина, измеряемая количеством растворенного
вещества, содержащегося в определенной массе или объеме раствора или
растворителя.
Наиболее
часто применяемые способы выражения концентрации: массовая доля,
молярная концентрация, молярная концентрация эквивалента, моляльность,
молярная доля, объемная доля, титр.
Массовую
долю w(X) выражают в долях единицы, процентах (%), промилле (тысячная
часть процента) и в миллионных долях (млн–1) . Массовую долю
рассчитывают по формулам:
![]() ,
,
где m(X) – масса растворенного
вещества Х, кг (г);
mр-ра – масса
раствора, кг (г).
Например:
дан 0.85% раствор хлорида натрия. Это означает, что в 100 г раствора содержится
0.85 г NaCl.
Молярную
концентрацию с(Х) выражают в моль/л. Молярную концентрацию находят
по формуле:
![]() ,
,
где n(X) – количество
растворенного вещества, моль;
M(X) – молярная
масса растворенного вещества, кг/моль, или г/моль;
m(X) – масса
растворенного вещества, соответственно, кг или г;
Vр-ра – объем
раствора, л.
Например:
дан 0.2 М раствор BaCl2. Это означает, что в 1 л (1000 мл) раствора содержится 0.2
моль BaCl2 и масса хлорида бария m (BaCl2) = с·M·V = 0.2 моль/л·208
г/моль·1 л = 41.6 г.
Моляльность
сm(X) или b(X) выражают в единицах моль/кг. Рассчитываем моляльность по
формуле:
![]() ,
,
где m (р-ль) – масса
растворителя, кг.
Моляльность
показывает, сколько моль растворенного вещества Х приходится на 1 кг
растворителя.
В
химии широко используют понятие эквивалента и фактора
эквивалентности.
Эквивалентом называют реальную или условную частицу вещества Х, которая в
данной обменной реакции обменивает один однозарядный ион или в данной
окислительно–восстановительной реакции переносит один электрон.
Фактор эквивалентности fэкв(Х) – число, обозначающее, какая доля реальной частицы
вещества Х эквивалентна одному иону водорода в данной кислотно–основной реакции
или одному электрону в данной окислительно-восстановительной реакции.
Фактор
эквивалентности рассчитывают на основе стехиометрии данной реакции из
равенства:
fэкв(Х) = 1/z,
где z – основность кислоты или
кислотность основания данной кислотно-основной реакции, или число электронов,
присоединяемых или теряемых частицей в данной окислительно-восстановительной
реакции.
Фактор
эквивалентности зависит от реакции, в которой участвует данное вещество; так
для фосфорной кислоты в реакциях:
H3PO4 + NaOH → NaH2PO4 + H2O; fэкв = 1/1.
H3PO4 + 2 NaOH → Na2HPO4
+ 2H2O; fэкв = 1/2.
H3PO4 + 3 NaOH → Na3PO4
+ 3H2O; fэкв = 1/3.
Для
перманганата калия в реакциях:
MnO4– + 8H+ + 5ē → Mn2+ + 4 H2O; fэкв = 1/5.
MnO4– + 2 H2O + 3ē → Mno2 + 4 OH–; fэкв = 1/3.
MnO4– + 1ē → MnO42-; fэкв = 1/1.
Для
иодид-иона и иода в реакции:
2I–
– 2ē → I20; fэкв(I–) = 1/1; fэкв(I2) = 1/2.
Молярной массой эквивалента
вещества Х (масса одного моль эквивалента вещества) называют величину,
измеряемую произведением фактора эквивалентности на молярную массу вещества Х.
М(fэкв(Х)) = fэкв·М(Х),
где М(fэкв(Х)) – молярная масса эквивалента.
Единица
измерения молярной массы эквивалента – г/моль.
Соответственно
для растворов используют понятие молярной концентрации эквивалента (нормальная
концентрация).
Молярную
концентрацию эквивалента (нормальность) с(fэкв(Х)) рассчитывают
по формуле:
![]() ,
,
где n (fэкв (Х)) – количество
вещества эквивалента, моль;
Vр-ра – объем
раствора, л;
M (fэкв(Х)) – молярная масса эквивалента.
Молярную
концентрацию эквивалента (нормальную концентрацию) обозначают c(fэкв(Х)). Единицы ее измерения – моль/м3, моль/дм3,
моль/л. В медицине чаще используют единицу моль/л. Форма записи, например,
с KMnO4 (1/5) = 0.1 моль/л или 0.1 н. KMnO4. Это означает, что в 1 л раствора содержится 0.1 моль
эквивалента перманганата калия.
Молярная
концентрация эквивалента (нормальность) связана с молярной концентрацией
(молярностью) следующим выражением:
![]() .
.
Молярную
долю x(Xi) выражают в
долях единицы или в процентах. Молярную долю рассчитывают по формуле:
 ,
,
где n(Xi)– количество вещества данного компонента, моль;
![]() – суммарное количество всех компонентов раствора, моль.
– суммарное количество всех компонентов раствора, моль.
Объемную
долю φ(Х) выражают в долях единицы или в процентах, ее рассчитывают
по формуле
![]() ,
,
где V(Х)– объем данного
компонента Х, л;
Vр-ра – общий
объем раствора, л.
Титр
раствора обозначают T(X), единица
измерения – г/см3, г/мл. Титр раствора можно рассчитать по формуле:
![]() ,
,
где m(Х) – масса вещества,
обычно г;
Vр-ра – объем
раствора, мл.
Титр
показывает, какая масса вещества содержится в 1 мл его раствора.
В клинической практике нередко выражают концентрацию
ионов в миллиграмм–процентах (мг %). Это масса вещества, выраженная в
миллиграммах на 100 мл раствора.
Формулы перехода от одних способов выражения
концентрации к другим см. прил., табл. №2.
Задача 1.
В 180 г воды растворили H3PO4 массой 9.8 г. Определите молярную долю (Х) и моляльную
концентрацию (Сm)
ортофосфорной кислоты.
Решение:
![]()
![]() ;
;
n (H3PO4)= ![]() = 0.1 моль;
= 0.1 моль;
n (H2O) = ![]() = 10 моль;
= 10 моль;
Х (H3PO4) = ![]() = 0.0099;
= 0.0099;
Сm (H3PO4) = ![]() = 0.556 моль/кг.
= 0.556 моль/кг.
Ответ: Х (H3PO4) = 0.0099; Сm (H3PO4) = 0.0566 моль/кг.
Задача 2.
Массовая доля хлорида натрия в физиологическом растворе 0.9%
(ρ = 1 г/мл). Вычислите: а) молярную концентрацию и титр NaCl в этом растворе; б)
массу соли, веденной в организм при вливании 500 мл данного раствора.
Решение:
с(X) = ![]() ; T =
; T = ![]() ; Т =
; Т = ![]() ;
;
с(NaCl) = ![]() = 0.154 моль/л;
= 0.154 моль/л;
Т (NaCl) = ![]() = 0.00900 г/мл;
= 0.00900 г/мл;
m(NaCl) = 0.00900 г/мл · 500
мл = 4.5 г.
Ответ: с(NaCl) = 0.154 моль/л; Т(NaCl) = 0.00900 г/мл.
Задача 3.
Сколько мл
80% раствора CH3COOH (ρ = 1.070 г/см3)
необходимо для приготовления 500 мл 0.1 М раствора?
Решение:
Найдем, сколько граммов уксусной кислоты содержится в 500 мл
раствора:
![]()
![]() .
.
Определим, в какой массе 80% раствора уксусной кислоты
содержится 3.0 г CH3COOH:
![]() .
.
Найдем объем 80% раствора CH3COOH:
![]() .
.
Ответ:
V = 3.5 мл.
Считаем концентрацию ионов водорода
Из уравнения диссоциации концентрация ацетат-ионов, а значит и продиссоциировавшей кислоты такая же
Считаем равновесную концентрацию кислоты
Сложим равновесную концентрацию кислоты и концентрацию продиссоциировавшей кислоты
Отмена
Анатолий Чмыриков
Отвечено 27 июня 2019
-
Комментариев (0)
Добавить
Отмена
