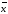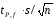Лабораторная
работа № 1
«Определение
концентрации раствора щелочи.
Статистическая
обработка
результатов анализа»
Цель работы:
– освоить методику
проведения титрования
– определить
нормальную концентрацию раствора щелочи
– освоить расчет
результатов прямого титрования
– произвести
обработку результатов анализа, полученных
группой,
методами
математической статистики
Краткая теория:
дайте
определения следующих понятий, используя
материалы ….
Титрование —
Титрование
– процесс постепенного контролируемого
приливания раствора с точно известной
концентрацией к определенному объему
другого раствора до т. эквивалентности
Точка эквивалентности
— момент
титрования, когда число эквивалентов
добавляемого титранта эквивалентно
или равно числу эквивалентов определяемого
вещества в образце.
Рабочий раствор
— концентр.
0.1-0.2% должна быть известна до 4х занч.
цифр.
рН – индикаторы
— органические
соединения, способные изменять цвет в
растворе при изменении кислотности
(pH).
«Нормальная
концентрация» — количество
эквивалентов данного вещества в 1 литре
раствора.
Закон эквивалентов
— число
моль эквивалентов для
всех веществ, участвующих в реакции,
одинаково.
Приборы и реактивы:
(зарисовать
и назвать посуду, указать правила
подготовки и работы с посудой)
Методика проведения
анализа
1.Бюретку заполнить
рабочим раствором кислоты, концентрация
которой известна с точностью до 4-х
значащих цифр и указана на колбе.
NHCl
= 0.0975
2.Чистую пипетку
объемом 10,00 или 15,00 мл (Vпип)
трижды ополоснуть раствором щелочи.
Vпип
=10
3. В две химически
чистые конические колбы для титрования
пипеткой отобрать аликвоты раствора
щелочи, добавить в каждую колбу по 1-2
капли индикатора метилоранжа.
4. Титровать раствор
щелочи в первой колбе раствором кислоты,
прикапывая ее из бюретки по каплям до
перехода желтой окраски в оранжевую.
Записать объем израсходованной кислоты
по бюретке (V1).
Оттитровать раствор щелочи во второй
колбе. Записать объем израсходованной
кислоты по бюретке (V2).
V1
= 9.65
V2
= 9.8
Объемы параллельных
титрований (V1
и V2)
не должны отличаться более чем на 0,20
мл. Если объемы параллельных титрований
значительно отличаются, необходимо
взять еще одну аликвоту раствора щелочи
и провести третье титрование.
5. Рассчитать
среднеарифметический объем кислоты,
пошедшей на титрование.
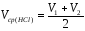
V=(9.65+9.8)/2=9.725
мл
Составить
уравнение реакции, протекающей
при титровании
НСl
+ NаОН
→
NaСl
+ Н2О
Расчет результатов
анализа
6. По результатам
титрования, используя закон эквивалентов,
рассчитать с точностью до
четырех значащих цифр
«нормальную» концентрацию щелочи:

где N=0.09795*9.725/10=0.09526
NNaOH
— нормальная концентрация раствора
щелочи NaOH,
моль(экв)/л;
NHCl
— нормальная концентрация раствора
кислоты HCl,
моль(экв)/л;
Vср(HCl)—
среднеарифметический объем кислоты,
пошедший на титрование, мл;
Vпип—
объем пипетки для отбора аликвоты
раствора щелочи NaOH,
мл;
7.Рассчитать с
точностью до
четырех значащих цифр
массу NaOH
(г), содержащуюся в 1
л раствора
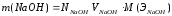
где m=0.09526*40=3.812
m(NaOH)
— масса NaOH,
г;
NNaOH
— нормальная концентрация раствора
щелочи NaOH,
моль(экв)/л;
VNaOH—
объем раствора щелочи NaOH,
л;
M(ЭNaOH)
— молярная масса эквивалента NaOH,
г/моль(экв).
Статистическая
обработка и представление результатов
анализа
8. Составить таблицу
по результатам титрования всех студентов
подгруппы.
|
№ |
Фамилия |
NNaOH |
m(NaOH) |
Примечание* |
|
1 |
Аль-Шишани |
0,09030 |
3,612 |
|
|
2 |
Бикбулатов |
0,08938 |
3,575 |
|
|
3 |
Валиева |
0,08889 |
3,556 |
|
|
4 |
Галин |
0,08864 |
3,544 |
|
|
5 |
Камалова |
0,08839 |
3,536 |
|
|
6 |
Корнаухова |
0,09526 |
3,810 |
Грубый |
|
7 |
Макашева |
0,08815 |
3,524 |
|
|
8 |
Рамазанов |
0,08941 |
3,575 |
|
|
9 |
Султанова |
0,08791 |
3,516 |
|
|
10 |
Таспаева |
0,08913 |
3,565 |
|
|
11 |
Фахрутдинова |
0,08718 |
3,487 |
|
|
12 |
Хлыбов |
0,08840 |
3,536 |
|
|
13 |
Чванова |
0,08791 |
3,516 |
|
|
14 |
||||
|
*укажите |
9. Произвести
статистическую обработку результатов,
полученных подгруппой, используя
материалы [].
Привести все расчеты, результаты
представить в виде итоговой таблицы.
Итоговая
таблица
|
Статистическая |
NNaOH |
m(NaOH) |
|
xi |
1.064 |
42.542 |
|
п |
12 |
12 |
|
|
0.08867 |
3.545 |
|
s |
0,0008403 |
0.03366 |
|
∆ |
0.0005337 |
0.02138 |
|
|
0.08867±0.0005337 |
3.545±0.02138 |
|
ε |
0.6019 |
0.60310 |
Полуширина
доверительного интервала 3.4641
3.4641
Коэф норм откл
2.2 2.2
Нормальная
концентрация.
-
X=1.15895
xср=1.15895/13=0.08915
xi
di di^2
|
0,09030 |
|
0,08938 |
|
0,08889 |
|
0,08864 |
|
0,08839 |
|
0,09526 |
|
0,08815 |
|
0,08941 |
|
0,08791 |
|
0,08913 |
|
0,08718 |
|
0,08840 |
|
0,08791 |
0,00115 1,3225E-06
0,00023 5,29E-08
0,00025 6,25E-08
0,00051 2,601E-07
0,00076 5,776E-07
0,00611 3,73321E-05
0,001
0,000001
0,00026 6,76E-08
0,00124 1,5376E-06
0,00002 4E-10
0,00197 3,8809E-06
0,00075 5,625E-07
0,00124 1,5376E-06
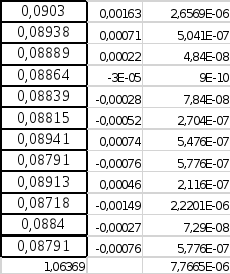
Сумма=4,81943E-05
2.
V=0.00004819/12=0,000004016
3.
S=(0,000004016)^0.5=0,0020040
4.
3s=0,006012
5.
d6>3s (грубый
промах)
6.
x(сумма)=1.064
7.

=1.064/12=0.08867
таблица
отклонений без гр промаха
Xi
di=xi-xср
di^2
|
8. S=(0.0000007061)^0.5=0,0008403 3s=0,002520
Промаха
∆
n=12
∆
E=
1 |
|||||||||||||||||||||||||||||||||||||||||||
|
2.
3.
Xi
4.
5.
6.
7.
8.
таблица
Xi |
|||||||||||||||||||||||||||||||||||||||||||
|
3,612 |
0,067 |
0,004489 |
|||||||||||||||||||||||||||||||||||||||||
|
3,575 |
0,03 |
0,0009 |
|||||||||||||||||||||||||||||||||||||||||
|
3,556 |
0,011 |
0,000121 |
|||||||||||||||||||||||||||||||||||||||||
|
3,544 |
-0,001 |
1E-06 |
|||||||||||||||||||||||||||||||||||||||||
|
3,536 |
-0,009 |
8,1E-05 |
|||||||||||||||||||||||||||||||||||||||||
|
3,524 |
-0,021 |
0,000441 |
|||||||||||||||||||||||||||||||||||||||||
|
3,575 |
0,03 |
0,0009 |
|||||||||||||||||||||||||||||||||||||||||
|
3,516 |
-0,029 |
0,000841 |
|||||||||||||||||||||||||||||||||||||||||
|
3,565 |
0,02 |
0,0004 |
|||||||||||||||||||||||||||||||||||||||||
|
3,487 |
-0,058 |
0,003364 |
|||||||||||||||||||||||||||||||||||||||||
|
3,536 |
-0,009 |
8,1E-05 |
|||||||||||||||||||||||||||||||||||||||||
|
3,516 |
-0,029 |
0,000841 |
|||||||||||||||||||||||||||||||||||||||||
|
42,542 |
0,01246 |
||||||||||||||||||||||||||||||||||||||||||
|
сумма |
9.
V=0,01246/11=0.001133
10.
S=(0.001133)^0.5=0.03366
11.
3s=0.1010
Di<3s
(гр промах устранен)
12.
∆
=
n=12
p=0.95
t=2.2
∆


13.
E=0.02138*100/
3.545=0.60310
Вывод:
Была освоена методика проведения
титрования, определена нормальная
концентрация раствора щелочи и масса,
а также проведена обработка анализов
результатов, полученных группой. В ходе
анализа была выявлена грубая ошибка и
устранена.
Соседние файлы в папке лабы
- #
- #
- #
- #
- #
- #
- #
- #
- #
- Авторы
- Файлы
Правилова С.Д.
1
Чаплинский Е.Ф.
1
Иванова Т.А.
1
1 Сургутский институт нефти и газа
Цель: определение возможности замены мерной пипетки на мерный цилиндр в студенческом лабораторном практикуме по химии для упрощения лабораторной работы по определению концентрации щелочи титрованием.
В работе использовался метод кислотно-основного титрования, основанный на применении реакции нейтрализации
2NaOH + H2SO4 = Na2SO4 + 2H2O.
К раствору определяемого вещества – гидроксида натрия – постепенно прибавляли раствор серной кислоты известной концентрации до тех пор, пока его количество не становилось эквивалентным количеству гидроксида натрия, вступившего в реакцию, т.е. до нейтрализации щёлочи. Момент нейтрализации устанавливали по изменению окраски индикатора, прибавляемого в титруемый раствор.
Молярную концентрацию эквивалента щелочи определяли из закона эквивалентов по уравнению
,
где Сн(NaOH) и Сн(H2SO4) – молярные концентрации эквивалента NaОН и H2SO4 в реагирующих растворах, моль/л; V(NaOH) и V(H2SO4) – объёмы реагирующих растворов щёлочи и кислоты, мл.
Для титрования использовалась установка, изображенная на рисунке.
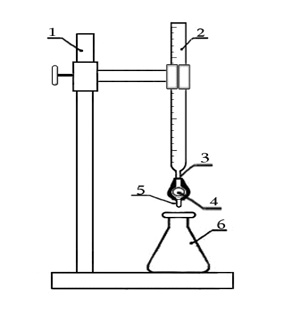
Установка для титрований: 1 – штатив; 2 – бюретка; 3 – резиновая трубка; 4 – олива; 5 – носик бюретки; 6 – колба
Провели 10 параллельных опытов. Результаты титрований занесены в табл. 1.
Таблица 1
Результаты титрования раствора гидроксида натрия
|
№ |
Объём пробы раствора щёлочи V(NaOH), мл |
Объём раствора кислоты V(H2SO4), мл |
Молярная концентрация эквивалента щёлочи Сн (NaOH), моль/л |
Среднее значение молярной концентрации эквивалента NaOH в анализируемом растворе, моль/л |
|
1 |
25 |
19,78 |
0,07912 |
0,79256 |
|
2 |
25 |
19,88 |
0,07952 |
|
|
3 |
25 |
19,77 |
0,07908 |
|
|
4 |
25 |
19,81 |
0,07924 |
|
|
5 |
25 |
19,83 |
0,07932 |
|
|
6 |
25 |
19,88 |
0,07952 |
|
|
7 |
25 |
19,79 |
0,07916 |
|
|
8 |
25 |
19,80 |
0,0792 |
|
|
9 |
25 |
19,76 |
0,07904 |
|
|
10 |
25 |
19,84 |
0,07936 |
Провели статистическую обработку результатов (табл. 2), определив значение выборочной дисперсии , среднеквадратичную ошибку (стандартное отклонение)
и доверительный интервал в виде
.
Таблица 2
Результаты статистической обработки экспериментальных данных титрования раствора гидроксида натрия. Доверительная вероятность a=0,95.
|
n |
|
|
Sx |
|
|
10 |
0,079256 |
0,0000025 |
0,00158 |
0,002 |
Доверительный интервал является достаточно узким, что показывают результаты статистической обработки. Доверительный интервал определен как
Сн(NaOH) = (0,079±0,002) моль/л; n=10; α=0,95.
В результате проведенных исследований можно сделать вывод, что замена мерной пипетки на более простой в работе мерный цилиндр является возможной.
Библиографическая ссылка
Правилова С.Д., Чаплинский Е.Ф., Иванова Т.А. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ЩЕЛОЧИ В ЛАБОРАТОРНОМ ПРАКТИКУМЕ ПО ХИМИИ // Современные наукоемкие технологии. – 2013. – № 9.
– С. 62-63;
URL: https://top-technologies.ru/ru/article/view?id=33203 (дата обращения: 24.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Для установления концентрации растворов едкого натра и едкого кали в качестве исходных веществ применяют кристаллогидрат щавелевой кислоты H2C2O4•2H2O, янтарную кислоту H2C4H4O4, сульфаминовую кислоту HSO3NH2 или титрованные растворы соляной и серной кислот (последние обычно используют для проверки концентрации растворов едких щелочей).
Концентрацию растворов гидроокиси бария или кальция и щелочной смеси устанавливают по титрованному раствору соляной кислоты.
Для определения концентрации 0,1 н. растворов едкого натра или едкого кали удобно пользоваться растворами щавелевой или соляной кислот, приготовленными из фиксаналов. Для приготовления раствора щавелевой кислоты применяют дистиллированную воду, не содержащую углекислого газа.
Титрование раствора щелочи раствором щавелевой кислоты ведут в присутствии 2—3 капель 0,1%-ного раствора фенолфталеина до обесцвечивания розовой окраски раствора.
Титрование раствора щелочи соляной кислотой ведут вначале в присутствии фенолфталеина, а после исчезновения розовой окраски добавляют 1—2 капли раствора метилового оранжевого и титруют до перехода желтой окраски раствора в оранжево-розовую.
Концентрацию раствора щелочи вычисляют по формулам:
по фенолфталеину:
N = NHClV1 / VNaOH ;
по метиловому оранжевому:
N = NHClV2 / VNaOH ;
где V1 — объем раствора кислоты, израсходованный на титрование с фенолфталеином;
V2 — суммарный объем раствора кислоты, израсходованный на титрование с фенолфталеином и метиловым оранжевым.
Разница в концентрации, установленной по фенолфталеину и метиловому оранжевому, указывает на загрязнение щелочи карбонатами. Эта разница не должна превышать 0,4%.
При установлении или при проверке концентрации раствора щелочи по раствору кислоты нормальные концентрации этих растворов должны быть близкими. В противном случае один из растворов (более концентрированный) перед титрованием разбавляют в мерной колбе.
При использовании титрованного раствора щелочи результаты анализа рассчитывают по концентрации щелочи, полученной при установлении титра ее с тем индикатором, который применяют при анализе.
Для определения концентрации раствора едкой щелочи по янтарной кислоте обычно пользуются методом титрования навесок янтарной кислоты. Эквивалент янтарной кислоты равен 59,05.
Пример 1. На титрование 15,00 мл раствора едкого натра израсходовано 16,20 мл 0,1000 н. раствора щавелевой кислоты (средний сходящийся результат титрования). Определить нормальную концентрацию раствора щелочи.
Нормальная концентрация раствора едкого натра:
0,1 • 16,2 / 15 = 1070 н.
Пример 2. На титрование 25,00 мл раствора едкого натра с фенолфталеином было израсходовано 24,80 мл 0,1000 н. раствора соляной кислоты, затем был добавлен раствор метилового оранжевого, после чего титрование продолжено.
При этом суммарный объем израсходованной соляной кислоты равен 24,88 мл. Определить нормальную концентрацию раствора щелочи и ее пригодность для анализа.
Нормальная концентрация едкого натра по фенолфталеину:
0,1 • 24,8 / 25 = 0,09920 н.
Нормальная концентрация едкого натра по метиловому оранжевому:
0,1 • 24,88 / 25 = 0,09952 н.
Разность концентраций в %:
(24,88 – 24,8) • 100 / 24,88 = 0,32 %,
т. е. меньше предельно допустимого. Раствор щелочи пригоден как рабочий раствор для анализа.
Пример 3. Определить массу отдельной навески янтарной кислоты для установления концентрации 0,1 н. раствора щелочи, если для титрования применяют бюретку емкостью 25 мл.
Предполагаем израсходовать на титрование 20 мл раствора щелочи.
Масса навески янтарной кислоты:
59,05 • 0,1 • 20 / 1000 = 0,12 г.
Пример 4. Навеска янтарной кислоты 1,064 г оттитрована 35,50 мл раствора едкого натра. Определить нормальную концентрацию раствора.
1000 • 1,064 / 59,05 • 35,5 = 0,5070 н.
Растворы щелочей хранят в склянках, закрытых резиновыми (кроме растворов аммиака) или полиэтиленовыми пробками. Для раствора аммиака обычно применяют стеклянные пробки. Если склянка для хранения сообщается с бюреткой, то в пробку вставляют хлоркальциевую трубку, заполненную натровой (натронной) известью для поглощения углекислоты воздуха.
При длительном хранении растворов щелочей внутреннюю поверхность склянок парафинируют.
Для определения процентного содержания щелочи в растворе необходимо провести щелочиметрическое титрование кислотой с известной концентрацией.
Шаги:
1. Взять измеренный объем раствора щелочи и перенести в колбу или пробирку. Объем щелочи необходимо знать, чтобы определить концентрацию раствора.
2. Добавить несколько капель индикатора. Обычно используют фенолфталеин или метилоранж.
3. Начать титрование раствора щелочи кислотой с известной концентрацией из бюретки.
4. Перед титрованием нужно установить точку эквивалентности, которая достигается в тот момент, когда количество щелочного раствора, добавленного кислоте, полностью нейтрализуется (перестает изменяться) и индикатор меняет цвет. После этого продолжительное добавление кислоты будет означать, что щелочь уже полностью опрокидана в кислоту, и возвратится к кислоте.
5. Записать объем кислоты, который был добавлен до достижения точки эквивалентности.
6. Известная концентрация кислоты поможет выполнить расчет и определить процентное содержание щелочи в растворе.
Формула расчет:
% концентрация NaOH = (Vb * Cb * 40) / Va
где Vb – объем кислоты, потребовавшейся для нейтрализации щелочи, Cb – концентрация кислоты в Н, Va – объем щелочного раствора в мл. 40 – молярная масса NaOH в г/моль.
Множитель 40 необходим, потому что количество NaOH, содержащееся в 1 моль раствора NaOH, равно 40 г.
Таким образом, определение процентного содержания щелочи в растворе основано на щелочиметрическом титровании кислотой, а концентрация определяется по формуле, используя объем и концентрацию кислоты.
Работа 2. Определение щелочи в растворе неизвестной концентрации
Оглавление
- 2.1 Определение методом пипетирования
- 2.2 Определение методом отдельных навесок
2.1 Определение методом пипетирования
Цель работы:
Научиться использовать теоретические основы метода кислотно-основного титрования для определения концентрации вещества в растворе.
Задачи:
Определить количество гидроксида натрия в растворе.
Реактивы:
Раствор гидроксида натрия, раствор НСl с известной концентрацией, дистиллированная вода, индикатор метиловый оранжевый.
Стандартизированный раствор хлороводородной кислоты служит для определения содержания (или) концентрации щелочей в растворах. Определение аналогично установлению молярной концентрации кислоты по тетраборату натрия.
Реакция титрования протекает согласно уравнению:
NaOH + HCl = NaCl + H2O
Порядок выполнения
В мерную колбу вместимостью 250 мл возьмите для анализа немного раствора NаОН. Доведите объем раствора до метки и тщательно перемешайте.
Подготовьте бюретку для титрования щелочи кислотой. Промойте пипетку анализируемым раствором щелочи. Затем по 10 мл исследуемого раствора перенесите пипеткой в три конические колбы для титрования. В каждую колбу добавьте 1-2 капли метилового оранжевого и титруйте раствором кислоты до перехода от одной капли желтой окраски индикатора в бледно-розовую.
Таблица 1. Результаты эксперимента.
|
№ анализа |
V(NaOH), мл |
V(HCl), мл |
Индикатор |
|
1 |
10 |
1-2 капли метилового оранжевого |
|
|
2 |
10 |
||
|
3 |
10 |
||
|
Среднее |
10 |
Титрование повторяют до трех сходящихся результатов. Молярную концентрацию раствора гидроксида натрия рассчитывают по формуле:
с(NaOH) = с(HCl)∙ V(HCl)/ V(NaOH)
Содержание гидроксида натрия в граммах (m) рассчитывается как
m = с(NaOH)∙ М(NaOH)·Vр-ра
2.2 Определение методом отдельных навесок
Цель работы: изучить теоретические основы титрования слабого электролита сильным электролитом, применение способа отдельных навесок для определения концентрации титрантов.
Умения и навыки: уметь рассчитать рН в точке стехеометричности при титровании слабой кислоты сильным основанием, выбрать индикатор, провести обработку результатов по способу отдельных навесок, освоить и закрепить методические приемы работы.
Задание:
Определить массу едкого натра, растворенного в мерной колбе, путем проведения титрования отдельных навесок щавелевой кислоты раствором едкого натра. Вычислить абсолютную и относительную погрешность (ошибку) определения.
Оборудование и реактивы:
Бюретка, колбы для титрования, штатив металлический; щавелевая кислота Н2С2О4 *2Н2О кристаллическая, фенолфталеин 0,1% раствор, раствор едкого натра в колбе (выдается).
Теоретическая часть
При титровании происходит реакция согласно уравнению:
Н2С2О4 + 2 NaOH ↔ Na2С2О4 + 2 Н2О
В точке стехиометричности (эквивалентности) рН определяется присутствием оксалата натрия.
рН (Na2С2О4 ) = ?
Na2С2О4 = 2 Na+ + С2О42-
С2О42- + Н2О ↔ НС2О4– + ОН–
рОН = 1/2 рК(С2О42-) – 1/2 lg c(С2О42-);
рК (С2О42-) = 14 – рК (НС2О4–) = 9,77
рОН = 1/2*9,77-1/2 lg 0,1 = 5,38;
рН = 8,62
Для титрования используют фенолфталеин, интервал перехода которого рН = 8,2-10,0
Расчет массы навески Н2С2О4 *2Н2О
Задача: рассчитать массу навески щавелевой кислоты Н2С2О4 *2Н2О, необходимой для определения щелочи в растворе, чтобы на титрование ее расходовался раствор едкого натра с концентрацией 0,1 моль/л в объеме примерно 10 мл.
Найти: Формулы и уравнения:
m(Н2С2О4 *2Н2О) = ? Н2С2О4 + 2 NaOH ↔ Na2С2О4 + 2 Н2О
___________________ ν(Н2С2О4 *2Н2О)/ ν(NaOH) =1/2
Дано: ν = с*V; ν = m/М;
V(NaOH) = 10,00мл
с (NaOH) = 0,1 моль/л
Решение:
ν(NaOH) = 2 ν(Н2С2О4 *2Н2О)
ν(NaOH)*с(NaOH) = 2* m(Н2С2О4 *2Н2О)/ М(Н2С2О4 *2Н2О)
m(Н2С2О4 *2Н2О) = V(NaOH)* с(NaOH)* М(Н2С2О4 *2Н2О)/2
m(Н2С2О4 *2Н2О) = 0,01л*0,1моль/л*126,07г/моль/2 = 0,0630 г
Порядок выполнения
На аналитических весах берут навеску щавелевой кислоты массой в 3-4 раза большую, чем теоретически рассчитанная.
В три конические колбы для титрования (должны быть пронумерованы) отсыпают примерно по 1/3 или 1/4 взятой навески в каждую колбу, взвешивая после каждого отсыпания массу бюкса с остатками навески, записывая эти данные в таблицу. По разности массы бюкса с навеской и массы бюкса с навеской после отсыпания вычисляют массу навески кислоты в каждой колбе для титрования. Каждую навеску растворяют в воде примерно одинакового объема, произвольно (V≈10мл). В каждую колбу добавляют индикатор фенолфталеин, в объеме 2 капель.
Готовят бюретку для титрования (ополаскивают раствором титранта, удаляют воздух из кончика, устанавливают уровень раствора на 0). Титруют едким натром до появления слабой розовой окраски фенолфталеина, устойчивой в течение 30 сек от одной капли щелочи. Титрование начинают с навески меньшей массы.
Обработка результатов
Таблица 2. Массы навесок Н2С2О4 *2Н2О
|
1 2 3 4 |
|
|
Масса бюкса с Н2С2О4 *2Н2О до отсыпания Масса бюкса с Н2С2О4*2Н2О после отсыпания |
|
|
Масса навески Н2С2О4 *2Н2О, г |
Таблица 3. Результаты титрования
|
m (Н2С2О4 *2Н2О), г |
V (NaOH), мл |
с(NaOH), моль/л |
Индикатор |
Расчет массы едкого натра проводится по среднему значению концентрации его раствора:
cсреднее =
Масса едкого натра, растворенного в колбе:
m (NaOH) =
Абсолютная погрешность:
Относительная погрешность:
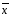
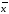

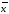
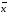
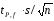
 =2.20*0,0008403/3.464=0.0005337
=2.20*0,0008403/3.464=0.0005337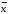 +-∆
+-∆ =0.08867+-0.0005337
=0.08867+-0.0005337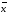 =xi/n
=xi/n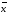 =xi/n
=xi/n