Разбавленная и концентрированная серная кислота – это настолько важные химические продукты, что в мире их вырабатывается больше, чем любых других веществ. Экономическое богатство страны может быть оценено по объему производимой в ней серной кислоты.
Процесс диссоциации
Серная кислота находит применение в виде водных растворов различной концентрации. Она подвергается реакции диссоциации в два этапа, производя H+-ионы в растворе.
H2SO4 = H+ + HSO4– ;
HSO4– = H + + SO4-2 .
Серная кислота является сильной, и первый этап ее диссоциации происходит настолько интенсивно, что практически все исходные молекулы распадаются на H+-ионы и HSO4 -1 -ионы (гидросульфата) в растворе. Последние частично распадаются дальше, выделяя другой H+-ион и оставляя сульфат-ион (SO4-2 ) в растворе. Однако гидросульфат, будучи слабой кислотой, все же превалирует в растворе над H+ и SO4-2 . Полная диссоциация его происходит только, когда плотность раствора серной кислоты приближается к плотности воды, т. е при сильном разбавлении.
Свойства серной кислоты
Она является особенной в том смысле, что может действовать как обычная кислота или как сильный окислитель – в зависимости от ее температуры и концентрации. Холодный разбавленный раствор серной кислоты реагирует с активными металлами с получением соли (сульфата) и выделением газа водорода. Например, реакция между холодной разбавленной Н2SO4 (в предположении ее полной двухэтапной диссоциации) и металлическим цинком выглядит так:
Zn + Н2SO4 = ZnSO4 + H2.
Горячая серная кислота концентрированная, плотность которой около 1,8 г/см3, может действовать в качестве окислителя, реагируя с материалами, которые обычно инертны к кислотам, такими, например, как металлическая медь. В процессе реакции медь окисляется, а масса кислоты уменьшается, образуется раствор сульфата меди (II) в воде и газообразная двуокись серы (SO2) вместо водорода, чего можно было бы ожидать при взаимодействии кислоты с металлом.
Cu + 2Н2SO4 = CuSO4 + SO2 + 2H2 O.
Как вообще выражается концентрация растворов
Собственно, концентрация любого раствора может быть выражена различными способами, но наиболее широко используется весовая концентрация. Она показывает количество граммов растворенного вещества в определенной массе или объеме раствора или растворителя (обычно 1000 г, 1000 см3, 100 см3 и 1 дм3). Вместо массы вещества в граммах можно брать его количество, выраженное в молях, – тогда получается молярная концентрация на 1000 г или 1 дм3 раствора.
Если молярная концентрация определена по отношению не к количеству раствора, а только к растворителю, то она носит название моляльности раствора. Для нее характерна независимость от температуры.
Зачастую весовую концентрацию указывают в граммах на 100 г растворителя. Умножая этот показатель на 100 %, получают ее в весовых процентах (процентная концентрация). Именно этот способ является наиболее часто употребляемым в применении к растворам серной кислоты.
Каждой величине концентрации раствора, определенной при данной температуре, соответствует вполне конкретная его плотность (например, плотность раствора серной кислоты). Поэтому иногда раствор характеризуют именно ею. Например, раствор Н2SO4, характеризующийся процентной концентрацией 95,72 %, имеет плотность 1,835 г/см3 при t = 20 °С. Как же определить концентрацию такого раствора, если дана только плотность серной кислоты? Таблица, дающая такое соответствие, является неотъемлемой принадлежностью любого учебника по общей или аналитической химии.
Пример пересчета концентрации
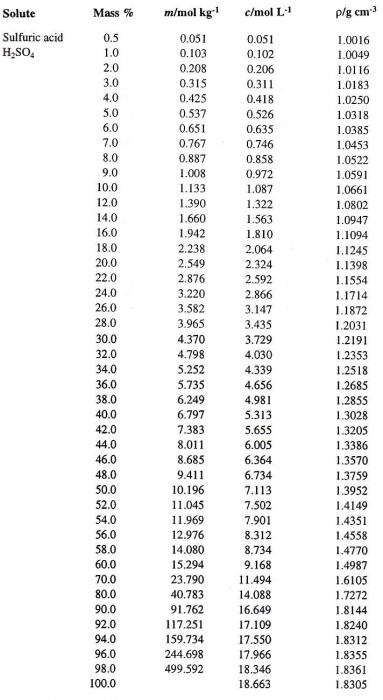
Попробуем перейти от одного способа выражения концентрации раствора к другому. Предположим, что мы имеем раствор Н2SO4 в воде с процентной концентрацией 60 %. Сначала определим соответствующую плотность серной кислоты. Таблица, содержащая процентные концентрации (первый столбец) и соответствующие им плотности водного раствора Н2SO4 (четвертый столбец), приведена ниже.
По ней определяем искомую величину, которая равна 1,4987 г/см3. Вычислим теперь молярность данного раствора. Для этого необходимо определить массу Н2SO4 в 1 л раствора и соответствующее ей число молей кислоты.
Объем, который занимают 100 г исходного раствора:
100 / 1,4987 = 66,7 мл.
Так как в 66,7 миллилитрах 60%-ного раствора содержится 60 г кислоты, то в 1 л ее будет содержаться:
(60 / 66,7) х 1000 = 899, 55 г.
Молярный вес серной кислоты равен 98. Отсюда число молей, содержащихся в 899,55 г ее граммах, будет равно:
899,55 / 98 = 9,18 моль.
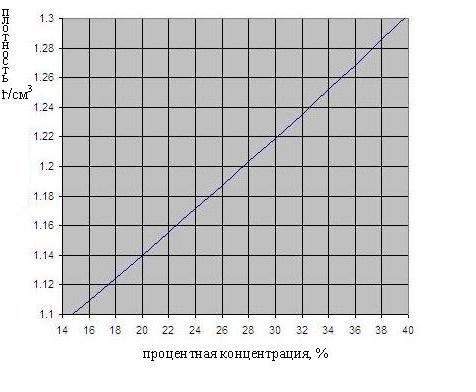
Зависимость плотности серной кислоты от концентрации приведена на рис. ниже.
Использование серной кислоты
Она применяется в различных отраслях промышленности. В производстве чугуна и стали она используется для очистки поверхности металла, прежде чем он покрывается другим веществом, участвует в создании синтетических красителей, а также других типов кислот, таких как соляная и азотная. Она также применяется в производстве фармпрепаратов, удобрений и взрывчатых веществ, а еще является важным реагентом при удалении примесей из нефти в нефтеперерабатывающей промышленности.
Это химическое вещество является невероятно полезным и в быту, и легко доступно как раствор серной кислоты, используемый в свинцово-кислотных аккумуляторных батареях (например, тех, что стоят в автомобилях). Такая кислота, как правило, имеет концентрацию примерно от 30% до 35% H2SO 4 по весу, остальное – вода.
Для многих бытовых приложений 30% Н2SO4 будет более чем достаточно, чтобы удовлетворить свои потребности. Однако в промышленности требуется и значительно более высокая концентрация серной кислоты. Обычно в процессе производства она сначала получается достаточно разбавленной и загрязненной органическими включениями. Концентрированную кислоту получают в два этапа: сначала ее доводят до 70 %, а затем – на втором этапе – поднимают до 96-98 %, что является предельным показателем для экономически рентабельного производства.
Плотность серной кислоты и ее сорта
Хотя почти 99%-ную серную кислоту можно получить кратковременно при кипении, но последующая потеря SO3 в точке кипения приводит к снижению концентрации до 98,3%. Вообще, разновидность с показателем 98% более устойчива в хранении.
Товарные сорта кислоты различаются по ее процентной концентрации, причем для них выбраны те ее значения, при которых минимальны температуры кристаллизации. Это сделано для уменьшения выпадения кристаллов серной кислоты в осадок при транспортировке и хранении. Основные сорта таковы:
- Башенная (нитрозная) – 75 %. Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.
- Контактная – 92,5-98,0 %. Плотность серной кислоты 98%-ной этого сорта равна 1836,5 кг/м3. Получают ее также из обжигового газа, содержащего SO2, причем процесс включает окисление двуокиси до ангидрида SO3 при ее контакте (отсюда и название сорта) с несколькими слоями твердого ванадиевого катализатора.
- Олеум – 104,5 %. Плотность его равна 1896,8 кг/м3. Это раствор SO3 в H2SO4, в котором первого компонента содержится 20 %, а кислоты – именно 104,5 %.
- Высокопроцентный олеум – 114,6 %. Его плотность – 2002 кг/м3.
- Аккумуляторная – 92-94 %.
Как устроен автомобильный аккумулятор
Работа этого одного из самых массовых электротехнических устройств полностью основана на электрохимических процессах, происходящих в присутствии водного раствора серной кислоты.
Автомобильный аккумулятор содержит разбавленный серно-кислотный электролит, а также положительный и отрицательный электроды в виде нескольких пластин. Положительные пластины выполнены из красновато-коричневого материала – диоксида свинца (PbO2), а отрицательные – из сероватого «губчатого» свинца (Pb).
Поскольку электроды изготовлены из свинца или свинцовосодержащего материала, то этот тип батареи часто называют свинцово-кислотным аккумулятором. Работоспособность его, т. е. величина выходного напряжения, напрямую определяется тем, какова в данный момент времени плотность серной кислоты (кг/м3 или г/см3), залитой в аккумулятор в качестве электролита.
Что происходит с электролитом при разряде аккумулятора
Электролит свинцово-кислотного аккумулятора представляет собой раствор аккумуляторной серной кислоты в химически чистой дистиллированной воде с процентной концентрацией по 30 % при полной зарядке. Чистая кислота имеет плотность 1,835 г/см3, электролит – около 1,300 г/см3. Когда аккумулятор разряжается, в нем происходят электрохимические реакции, в результате которых из электролита отбирается серная кислота. Плотность от концентрации раствора зависит практически пропорционально, поэтому она должна уменьшаться вследствие снижения концентрации электролита.
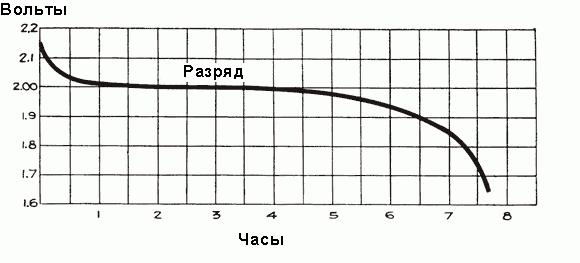
До тех пор, пока ток разряда протекает через аккумулятор, кислота вблизи его электродов активно используется, и электролит становится все более разбавленным. Диффузия кислоты из объема всего электролита и к электродным пластинам поддерживает примерно постоянную интенсивность химических реакций и, как следствие, выходное напряжение.
В начале процесса разряда диффузия кислоты из электролита в пластины происходит быстро потому, что образующийся при этом сульфат еще не забил поры в активном материале электродов. Когда сульфат начинает формироваться и заполнять поры электродов, диффузия происходит более медленно.
Теоретически можно продолжить разряд до тех пор, пока все кислота не будет использована, и электролит будет состоять из чистой воды. Однако опыт показывает, что разряды не должны продолжаться после того, как плотность электролита упала до 1,150 г/см3.
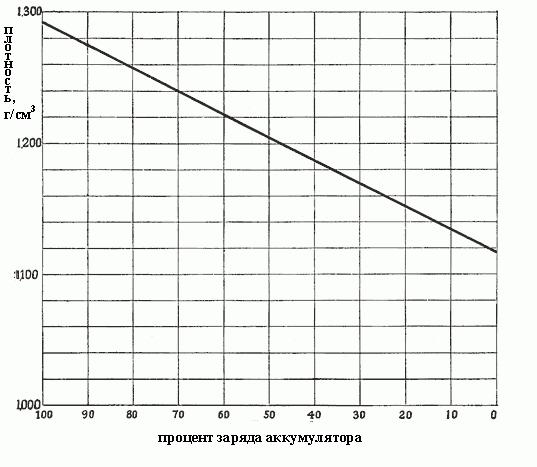
Когда плотность падает от 1,300 до 1,150, это означает, что столько сульфата было сформировано в процессе реакций, и он заполняет все поры в активных материалах на пластинах, т. е. из раствора уже отобрана почти вся серная кислота. Плотность от концентрации зависит пропорционально, и точно так же от плотности зависит заряд аккумулятора. На рис. ниже показана зависимость заряда аккумулятора от плотности электролита.
Изменение плотности электролита является лучшим средством определения состояния разряда аккумулятора, при условии, что он используется надлежащим образом.
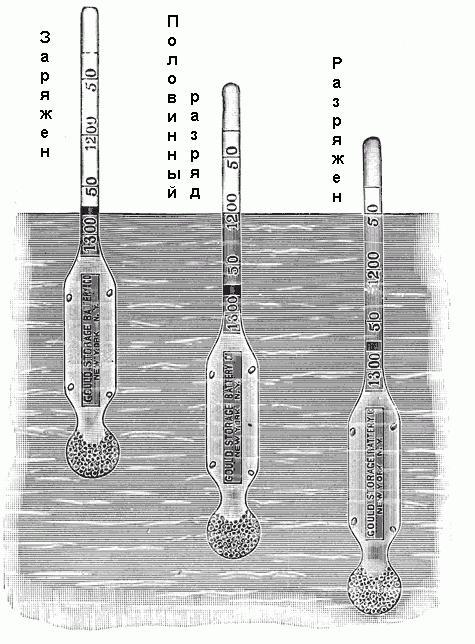
Степени разряда автомобильного аккумулятора в зависимости от плотности электролита
Плотность его должна измеряться каждые две недели и постоянно должна вестись запись показаний для использования в будущем.
Чем плотнее электролит, тем больше кислоты он содержит, и тем более заряжен аккумулятор. Плотность в 1,300-1,280 г/см3 указывает на полный заряд. Как правило, различаются следующие степени разряда аккумулятора в зависимости от плотности электролита:
- 1,300-1,280 – полностью заряжен:
- 1,280-1,200 – более чем наполовину разряжен;
- 1,200-1,150 – заряжен менее чем наполовину;
- 1,150 – практически разряжен.
У полностью заряженного аккумулятора перед подключением его автомобильной сети напряжение каждой ячейки составляет от 2,5 до 2,7 В. Как только подключается нагрузка, напряжение быстро падает примерно до 2,1 В в течение трех или четырех минут. Это происходит из-за формирования тонкого слоя сульфата свинца на поверхности отрицательных электродных пластин и между слоем перекиси свинца и металлом положительных пластин. Окончательное значение напряжения ячейки после подключения к автомобильной сети составляет около 2,15-2,18 вольт.
Когда ток начинает протекать через аккумулятор в течение первого часа работы, происходит падение напряжения до 2 В, объясняемое ростом внутреннего сопротивления ячеек из-за формирования большего количества сульфата, который заполняет поры пластин, и отбора кислоты из электролита. Незадолго до начала протекания тока плотность электролита максимальна и равна 1,300 г/см3. Поначалу его разрежение происходит быстро, но затем устанавливается сбалансированное состояние между плотностью кислоты вблизи пластин и в основном объеме электролита, отбор кислоты электродами поддерживается поступлением новых частей кислоты от основной части электролита. При этом средняя плотность электролита продолжает неуклонно уменьшаться по зависимости, показанной на рис. выше. После первоначального падения напряжение уменьшается более медленно, скорость его снижения зависит от нагрузки аккумулятора. Временной график процесса разряда показан на рис. ниже.
Контроль состояния электролита в аккумуляторе
Для определения плотности используется ареометр. Он состоит из небольшой запаянной стеклянной трубки с расширением на нижнем конце, заполненным дробью или ртутью, и градуированной шкалой на верхнем конце. Эта шкала помечена от 1,100 до 1,300 с различными промежуточными значениями, как показано на рис. ниже. Если этот ареометр помещается в электролит, то он будет опускаться до определенной глубины. При этом он будет вытеснять определенный объем электролита, и когда будет достигнуто равновесное положение, вес вытесненного объема просто будет равен весу ареометра. Поскольку плотность электролита равна отношению его веса к объему, а вес ареометра известен, то каждый уровень его погружения в раствор соответствует определенной его плотности.
Некоторые ареометры не имеют шкалы со значениями плотности, но помечены надписями: «Заряжен», «Половинный разряд», «Полный разряд» или им подобными.
Я все понимаю, я знаю, что там есть серная кислота и знаю концентрацию (высчитал по плотности), просто я люблю все проверять опытным путем, а не просто прочитать. Это же только частный случай, а значие и умение метода определения серной кислоты помогут мне определять ее в любых других растворах. Ладно это электролит, но если я захочу ее сделать какой нибудь реакцией в домашних условиях, то не факт, что она у меня будет после этой реакции и я смогу проверить – есть там она или нет. Я сейчас привел только часный случай с электролитом, а мне это нужно будет вообще, я с ней сейчас активно занимаюсь. Ну вот.
А как мне определить концентрачию серной кислоты в растворе? У меня есть метилвиолет (индикатор концентрации кислоты), у меня, когда я насыпал несколько кристалликов в серную к., он стал прозрачным белым. Это что нибудь значит? (я просто мерил с помощью метилвиолета только кислоты с концентрачией меньше 10 %, а с большими концентрациями у меня с ним опыта нет)
ПРОЦЕДУРА ОПРЕДЕЛЕНИЯ ПЛОТНОСТИ
И КОНЦЕНТРАЦИИ СЕРНОЙ КИСЛОТЫ
Плотность концентрированной серной кислоты устанавливают с помощью набора ареометров по ГОСТ 18481. Для определения плотности серную кислоту наливают в стеклянный цилиндр. Осторожно погружая в кислоту поочередно ареометры, подбирают такой из них, для которого уровень кислоты находится в пределах его шкалы. При этом ареометр не должен касаться стенок цилиндра. Показание шкалы ареометра на уровне поверхности жидкости отвечает плотности этой жидкости.
Объем серной кислоты V, см3, необходимый для приготовления раствора концентрации 5 моль-экв/дм3, вычисляют по формуле
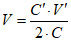
где C’ – концентрация раствора серной кислоты, который необходимо приготовить, 5 моль-экв/дм3;
V’ – объем мерной колбы, применяемой для приготовления раствора, см3;
C – концентрация концентрированной серной кислоты, установленная по значению плотности в соответствии с таблицей Б.1, моль/дм3.
Таблица Б.1
Зависимость плотности серной кислоты от концентрации
|
Плотность, г/см3 |
Концентрация H2SO4 |
|
|
Массовая концентрация W, % |
Молярная концентрация C, моль/дм3 |
|
|
1,800 |
87,69 |
16,09 |
|
1,805 |
88,43 |
16,27 |
|
1,810 |
89,23 |
16,47 |
|
1,815 |
90,12 |
16,68 |
|
1,820 |
91,11 |
16,91 |
|
1,821 |
91,33 |
16,96 |
|
1,822 |
91,56 |
17,01 |
|
1,823 |
91,78 |
17,06 |
|
1,824 |
92,00 |
17,11 |
|
1,825 |
92,25 |
17,17 |
|
1,826 |
92,51 |
17,22 |
|
1,827 |
92,77 |
17,28 |
|
1,828 |
93,03 |
17,34 |
|
1,829 |
93,33 |
17,40 |
|
1,830 |
93,64 |
17,47 |
|
1,831 |
93,94 |
17,54 |
|
1,832 |
94,32 |
17,62 |
|
1,833 |
94,72 |
17,70 |
|
1,834 |
95,12 |
17,79 |
|
1,835 |
95,72 |
17,91 |
|
УДК 662.62:006.354 |
ОКС 75.160.10 |
|
Ключевые слова: топливо твердое минеральное, мышьяк, метод испытания |
Скачать документ целиком в формате PDF
Относительная плотность водных растворов соляной кислоты при 20°С (d20)
Относительная плотность водных растворов серной кислоты при 20°С (d20)
Относительная плотность водных растворов ортофосфорной кислоты при 20°С (d20)
Относительная плотность водных растворов азотной кислоты при 20°С (d20)
Как найти концентрацию кислоты
Концентрация кислоты – величина, показывающая, какая доля этого вещества находится в определенном количестве или объеме его раствора. Она может выражаться по-разному: в виде массовой доли, молярности, моляльности и т.д. В лабораторной практике часто возникает необходимость определить концентрацию кислоты.

Вам понадобится
- – градуированный мерный стаканчик;
- – лабораторные весы;
- – стеклянная пипетка;
- – лакмус;
- – раствор щелочи.
Инструкция
Предположим, у вас есть емкость с этикеткой H2SO4. То есть сразу становится ясно: в ней содержится серная кислота. Но больше никакой информации нет. Как же определить ее концентрацию? Вы можете сделать это с помощью таблиц плотностей растворов. Существует множество справочников, где приведены значения плотности раствора химических веществ в зависимости от их концентрации.
Возьмите градуированный мерный стаканчик, взвесьте его на лабораторных весах. Обозначьте массу пустого стаканчика, как m1. С помощью стеклянной пипетки прилейте в него некоторый объем V серной кислоты. Снова взвесьте стаканчик, обозначьте его массу, как m2. Плотность кислоты находится по формуле: (m2 – m1)/V.
По таблице плотностей установите концентрацию раствора. Предположим, в ходе описанного опыта вы вычислили плотность серной кислоты: 1,303 грамм/миллилитр. Ей соответствует 40%-я концентрация.
Как еще определяется концентрация кислоты? Есть чувствительный и очень точный метод, который называется прямое титрование. Он основан на реакции нейтрализации кислоты раствором щелочи, концентрация которой известна. Например, в случае с серной кислотой: H2SO4 + 2NaOH = Na2SO4 + 2H2O.
По схеме реакции видно, что для нейтрализации одного моля кислоты понадобится два моля гидроксида натрия. Исходя из этого, зная объем исследуемого раствора кислоты, объем щелочи, пошедшей на ее нейтрализацию, а также концентрацию щелочи, можно вычислить и концентрацию кислоты.
Но как определить точный объем щелочи, необходимой для нейтрализации кислоты? С помощью индикатора, меняющего цвет. Например, лакмуса. Опыт проводится так. Над сосудом с известным объемом кислоты (куда также добавляют несколько капель индикатора) закрепите градуированную бюретку с раствором щелочи.
Запишите показание верхнего уровня щелочи, затем, осторожно отвернув кран бюретки, начните по каплям приливать ее к кислоте. Ваша задача – перекрыть кран в тот момент, когда красный цвет индикатора исчезнет. Запишите показание нижнего уровня щелочи и вычислите, какой ее объем ушел на нейтрализацию кислоты.
А дальше, зная величину этого объема и точную концентрацию щелочи, легко можно вычислить, сколько молей щелочи вступило в реакцию. Соответственно, количество молей кислоты было в 2 раза меньше. Зная первоначальный объем кислоты, вы найдете ее молярную концентрацию.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.