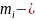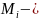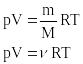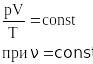Смесь кислорода и азота
при температуре T = 290 K и давлении p = 5,8 кПа имеет плотность ρ = 0,40 кг/м3 .
Определите концентрацию молекул кислорода в смеси.
Решение.
Давление смеси газов,
согласно закону Дальтона, равно сумме парциальных давлений.
Эти давления найдем из
уравнения Клапейрона-Менделеева.
Где ρ1 и ρ2
– парциальные плотности кислорода и азота, т.е. плотности, которые имели бы
газы, если бы каждый из них отдельности занимал весь этот объем.
Так как из основного
уравления молекулярно-кинетической теории следует, что p
= nkT, уравнения (1) можно записать в следующем виде.
Подставим их в
равенство (2).
Концентрация молекул
смеси газов равна сумме концентрация компонентов.
Решая совместо
уравнения уравнения (3) и (4), находим концентрацию молекул кислорода.
Ответ: n1 =
5,9•1025 м-3 .
Источник: Физика. Полный курс подготовки к ЦТ. Под общей редакцией проф. В.А. Яковенко.
Решение: давление смеси газов подчиняется закону Дальтона:
p = p1 +p2,
давление азота: p1 = n1kT, n1 – искомая концентрация азота, давление водорода: p2 = n2kT, n2 – искомая концентрация водорода, k = 1,38∙10-23 Дж/К – постоянная Больцмана. Получаем:
p = (n1 + n2)kT . (1)
С другой стороны нам известна плотность смеси, которая равна:
[ rho =frac{{{m}_{1}}+{{m}_{2}}}{V}=frac{{{m}_{1}}}{V}+frac{{{m}_{2}}}{V}=rho {}_{1}+{{rho }_{2}}, ]
Плотность можно связать с концентрацией: концентрация – число частиц в единице объёма, умножив её на массу частицы (молекулы), мы получим массу единицы объема, т.е. плотность:
[ rho =ncdot {{m}_{0}}=ncdot frac{M}{{{N}_{a}}}, ]
M – молярная масса, Na = 6,02∙1023моль -1 – постоянная Авогадро. Получаем (2):
[ rho =frac{1}{{{N}_{a}}}left( n{}_{1}cdot {{M}_{1}}+{{n}_{2}}cdot {{M}_{2}} right), ]
Получили систему двух уравнений (1) и (2), решая их совместно, например получим так:
[ {{n}_{1}}=frac{p}{kT}-{{n}_{2}}, ]
[ {{n}_{2}}=frac{rho {{N}_{a}}-frac{p{{M}_{1}}}{kT}}{{{M}_{2}}-{{M}_{1}}}. ]
Ответ: n1 = 2,55∙1024, n2 = 3,95∙1025.
Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 6.1. Молярная концентрация газа |
| Напечатано:: | Гость |
| Дата: | Понедельник, 15 Май 2023, 15:02 |
Газообразные вещества, в отличие от твёрдых и жидких, занимают весь предоставленный им объём. Поэтому в одном и том же сосуде может находиться разное количество газа. От этого количества будет зависеть давление в системе.
Определение количества газа и его доли в газовой смеси важно для разных практических целей. Например, следует выяснить, опасен ли для жизни уровень содержания метана или угарного газа в воздухе, пригоден ли для дыхания воздух в помещении с большим количеством углекислого газа или воздух на высоте 10 км, взрывоопасна ли данная смесь воздуха с водородом, в каком соотношении пары бензина должны смешиваться с воздухом в двигателе внутреннего сгорания.
Для решения подобных задач в качестве количественной характеристики используют молярную концентрацию газообразного вещества, которая показывает количество данного газообразного вещества в единице объёма.
Молярная концентрация газообразного вещества — величина, равная отношению его количества к объёму, который этот газ занимает:
Молярная концентрация газов измеряется в моль/дм3.
Например, молярная концентрация СО2 при нормальных условиях составляет:
Из приведённой выше формулы следует, что количество газообразного вещества в сосуде есть произведение молярной концентрации газа на объём сосуда, так как газ заполняет весь объём:
Понятие молярной концентрации газообразного вещества сходно с понятием молярной концентрации растворённого вещества, с которым вы ознакомились в курсе химии 8-го класса:
Причиной сходства является то, что растворённое вещество равномерно распределяется во всём объёме раствора, как и газообразное — во всём объёме сосуда.
Пример 1. Определите молярную концентрацию углекислого газа массой 3 г, находящегося в сосуде объёмом 4 дм3.
Дано:
m(CO2) = 3 г
V(сосуда) = 4 дм3
с(СО2) — ?
Решение
Ответ: с(СО2) = 0,017 моль/дм3.
Молярная концентрация газообразного вещества — величина, равная отношению его количества к объёму, который этот газ занимает:
Вопросы, задания, задачи
1. Установите соответствие между величинами.
|
1. Объём газа. 2. Молярная концентрация газа. 3. Количество вещества. 4. Молярная концентрация вещества в растворе |
А. с(NО2) = 0,15 моль/дм3. Б. с(NaOH) = 0,15 моль/дм3. В. V(H2S) = 4 дм3. Г. n(СО2) = 2 моль |
2. Определите молярную концентрацию аммиака количеством 0,7 моль в сосуде объёмом 14 дм3.
3. Определите массу сернистого газа в сосуде объёмом 400 см3, если молярная концентрация SO2 равна 0,5 моль/дм3.
4. Определите и сравните молярные концентрации трёх газов — водорода, азота и кислорода, если известно, что они находятся в сосудах объёмом по 5 дм3, а масса каждого из газов равна 7 г.
5. Сосуд объёмом 50 дм3 содержит гелий массой 10 г. В этот сосуд добавили гелий массой 8 г. Во сколько раз изменилась молярная концентрация газа? Как на исходную концентрацию гелия повлияет добавление аргона массой 8 г?
6. При газификации угля образовалась смесь газов, в которой на 1 дм3 СО приходится 4 дм3 Н2, 1 дм3 СН4, 3 дм3 СО2. Рассчитайте молярную концентрацию каждого газа в смеси.
7. Озон относится к веществам класса высокой опасности. Его предельно допустимая концентрация (ПДК) в воздухе рабочей зоны равна 0,1 мг/м3. При этом порог человеческого обоняния приблизительно равен 0,01 мг/м3. Рассчитайте молярную концентрацию озона в воздухе при его содержании 0,01 мг/м3.
8. Рассчитайте молярную концентрацию кислорода в воздухе (объёмная доля кислорода равна 21 %).
9. При действии соляной кислоты на твёрдое вещество выделился газ, относительная плотность которого по воздуху составляет 1,172. Какое из веществ использовал экспериментатор: СаС2, СаСО3, CaS, СаСl2?
10. Определите объём углекислого газа, выделившегося при действии соляной кислоты объёмом 0,5 дм3 на мрамор (карбонат кальция). Молярная концентрация кислоты составляет 2,7 моль/дм3.
Самоконтроль
1. Молярную концентрацию можно рассчитать по формулам:
а) ;
б) ;
в) ;
г) .
2. Молярная концентрация газообразного вещества имеет размерность:
- а) дм3/моль;
- б) моль/дм3;
- в) г/дм3;
- г) моль–1.
3. При н. у. объём 22,4 дм3 имеют вещества количеством 1 моль, формулы которых:
- а) СаС2;
- б) С2Н6;
- в) СО2;
- г) О3.
4. Молярная концентрация азота массой 5,6 г, находящегося в сосуде объёмом 20 дм3, равна (моль/дм3):
- а) 0,001;
- б) 0,01;
- в) 0,02;
- г) 0,1.
5. При нормальных условиях в сосуде объёмом 5 дм3 содержится газ массой 5,6 г. Его молярная концентрация составляет 0,04 моль/дм3. Этим газом может быть:
- а) С2Н4;
- б) С2Н6;
- в) N2;
- г) CО.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.

Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Билеты ггд.docx
Скачиваний:
1
Добавлен:
19.09.2019
Размер:
868.23 Кб
Скачать
Идеальный
газ
— математическая
модель
газа,
в которой предполагается, что потенциальной
энергией
взаимодействия молекул
можно пренебречь по сравнению с их
кинетической
энергией.
Между молекулами не действуют силы
притяжения или отталкивания, соударения
частиц между собой и со стенками сосуда
абсолютно
упруги,
а время взаимодействия между молекулами
пренебрежимо мало по сравнению со
средним временем между столкновениями.
|
Массовая |
||
|
||
|
где |
Мольная
(молярная) доля вещества
— концентрация,
выраженная отношением числа молей
вещества к общему числу молей всех
веществ, имеющихся в растворе.
![]()
где
![]()
—
мольная
доля вещества B в растворе
![]()
—
количество
вещества
B, содержащееся в растворе (измеряется
в молях)
![]()
—
сумма количества
вещества
всех компонентов раствора (измеряется
в молях)
|
Парциальное |
||
|
Парциальное |
||
|
||
|
Закон |
||
|
Давление |
||
|
27.
Параметры состояния смеси идеальных
газов.
|
В Мы |
|
|
Произведение – |
|
|
Таким
|
|
|
Другие |
|
Если Для
|
|
|
2. |
|
|
3. Часто |
|
|
Эта |
|
|
Для . |
|
20
билет
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #