Сильные
электролиты диссоциируют полностью и
необратимо, в их растворах содержатся
только ионы, и нет непродиссоциировавших
молекул. Расчёт концентраций ионов в
таких растворах не отличается от
расчётов для любых других реакций,
протекающих необратимо.
Пример
7.1 Рассчитать молярную концентрацию
ионов алюминия и сульфат-ионов в 0,2 М
растворе сульфата алюминия.
Из
уравнения необратимого процесса
диссоциации сульфата алюминия Al2(SO4)3
2 Al3+
+ 3 SO42–
видно, что из одного моля сульфата
алюминия получается 2 моль ионов Al3+
и 3 моль ионов SO42–
. Следовательно, молярная концентрация
ионов Al3+
в два раза больше молярной концентрации
Al2(SO4)3:
C(Al3+)
= 2·C(Al2(SO4)3)
= 2·0,2 моль/л
= 0,4 моль/л.
Молярная
концентрация ионов SO42–
в 3 раза больше молярной концентрации
Al2(SO4)3:
C(SO42–)
= 3·C(Al2(SO4)3)
= 3·0,2 моль/л = 0,6 моль/л.
Пример
7.2 Рассчитать молярную концентрацию
серной кислоты в растворе, если известно,
что концентрация ионов водорода в этом
растворе равна 0,02 моль/л.
Серную
кислоту в очень разбавленных растворах
можно считать сильным электролитом,
каждая молекула которого необратимо
и полностью диссоциирует на 2 иона
водорода и один сульфат-ион: H2SO4
2 H+
+ SO42–.
Из уравнения процесса диссоциации
видно, что число моль ионов водорода в
растворе после диссоциации кислоты
будет в два раза больше, чем число моль
молекул H2SO4.
Следовательно, молярная концентрация
H2SO4
будет в два раза меньше молярной
концентрации ионов H+
: C(H2SO4)
= ½ C(H+)
= ½ · 0,02 моль/л = 0,01 моль/л.
7.5 Расчёт концентраций ионов в растворах слабых электролитов
Расчёт
концентраций ионов в растворах слабых
электролитов сводится к решению задачи
на химическое равновесие для того
случая, когда известна константа
равновесия и необходимо найти равновесные
концентрации веществ, участвующих в
реакции.
Пример
7.3 Рассчитать концентрацию ионов
водорода в растворе слабой одноосновной
кислоты HA, молярная концентрация которой
равна C0
моль/л, и константа диссоциации равна
K .
Пусть
кислоты продиссоциировало x моль/л,
тогда из уравнения процесса диссоциации
HA ⇆
H+
+ A–
следует, что в результате диссоциации
образовалось x моль/л ионов H+,
x моль/л ионов A–,
и к моменту наступления равновесия
осталось в непродиссоциированом
состоянии (C0-x)
моль/л кислоты HA. Таким образом,
равновесные концентрации всех частиц
будут следующими:
С(H+)
= x моль/л; С(A–)
= x моль/л; С(HA) = C0-x
моль/л.
Далее
необходимо подставить выраженные через
x
«икс» значения равновесных концентраций
в выражение константы диссоциации.
(7.4)

Концентрацию
ионов водорода, равную x, можно найти,
решая полученное квадратное уравнение
относительно x. Расчёт можно значительно
упростить, пренебрегая «иксом» в
знаменателе полученного выражения.
Это можно сделать в том случае, если
электролит очень слабый, и вследствие
его очень малой диссоциации x
стремится к нулю. При решении задач
общей и неорганической химии «иксом»
можно пренебречь, если выполняется
условие K/C0
< 10–2;
допускаемая при этом погрешность
расчёта не превышает 1-2 % . При решении
задач аналитической химии, где требуется
большая точность, «иксом» пренебрегают
при выполнении условия K/C0
< 10–4
. В случае пренебрежения «иксом» в
знаменателе полученного выражения,
оно принимает следующий вид:
,
(7.5)
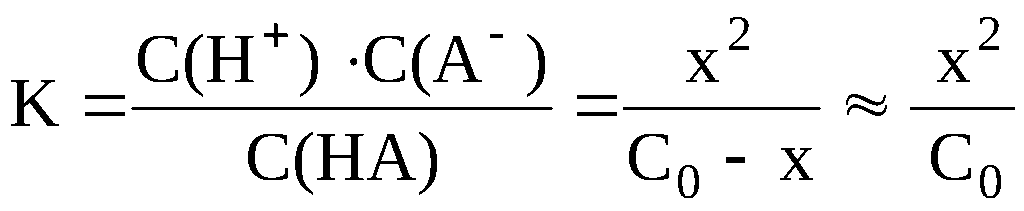
о![]()
ткуда
Таким
образом, концентрацию ионов водорода
в растворе слабой одноосновной кислоты
можно рассчитать по следующей приближённой
формуле:
![]()
.
(7.6)
Концентрацию
ионов OH–
в растворе слабого основания можно
рассчитать по аналогичной формуле
.![]()
(7.7)
Следует
ещё раз подчеркнуть, что формулы 7.6 и
7.7 являются приближёнными, вследствие
чего пользоваться ими можно только при
выполнении условия K/C < 10–2
. Если это условие не выполняется, нужно
решать квадратное уравнение 7.4.
Пример
7.4 Рассчитать концентрации ионов
водорода, дигидрофосфат-, гидрофосфат-
и фосфат-ионов в 0,1 М растворе фосфорной
кислоты. Константы диссоциации фосфорной
кислоты: K1
= 7,5·10–3,
K2
= 6,3·10–8,
K3
= 1,3·10–12.
Строго
говоря, общая концентрация ионов
водорода в растворе слабой многоосновной
кислоты равна сумме концентраций ионов
H+,
образовавшихся на каждой стадии
диссоциации. Например, для фосфорной
кислоты
C(H+)общая
= C(H+)по
1 стадии
+ C(H+)по
2 стадии
+ C(H+)по
3 стадии
.
Однако,
в связи с тем, что диссоциация слабых
электролитов протекает преимущественно
по первой стадии, а по второй и последующим
стадиям – лишь в незначительной степени,
то C(H+)по
2 стадии
0, C(H+)по
3 стадии
0. Поэтому, допустимо считать, что что
общая концентрация ионов водорода в
растворе слабой многоосновной кислоты
приблизительно равна концентрации
ионов водорода, образовавшихся в
результате диссоциации кислоты по
первой стадии.
C(H+)общая
C(H+)по
1 стадии
Пусть
фосфорной кислоты продиссоциировало
по первой стадии x
моль/л, тогда из уравнения диссоциации
H3PO4
⇆
H+
+ H2PO4–
следует, что в результате диссоциации
образовалось x
моль/л ионов H+
и x
моль/л ионов H2PO4–
; к моменту наступления равновесия в
недиссоциированном состоянии осталось
(0,1-x)
моль/л H3PO4.
Таким образом, равновесные концентрации
всех частиц будут следующими: С(H+)
= x моль/л; С(H2PO4–)
= x моль/л ; С(H3PO4)
= (0,1-x) моль/л.
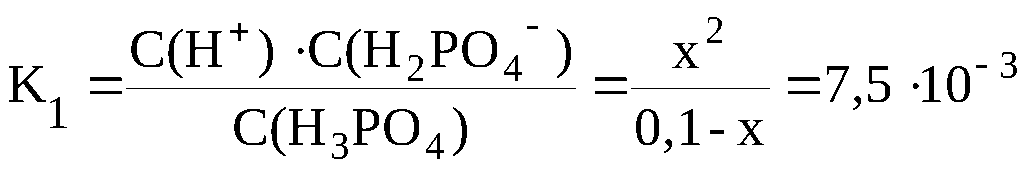
В
данном случае пренебрегать «иксом» в
знаменателе полученного уравнения
нельзя, поскольку условие K/C < 10–2
не выполняется:
K1/C
= 7,5·10–3
/ 0,1 = 7,5·10–2
> 10–2
.
Поэтому
x
находится решением квадратного
уравнения.
x2
+ 7,5·10–3·x
– 7,5·10–4
= 0
Из
двух корней этого уравнения (x1
= -3,139·10–3;
x2
= 2,389·10–2)
физический смысл имеет второй корень.
Таким образом, С(H+)
= С(H2PO4–)
≈ 0,024 моль/л.
Поскольку
гидрофосфат-ионы HPO42–
образуются в результате диссоциации
кислоты по второй стадии, для расчёта
их концентрации необходимо воспользоваться
выражением константы для второй стадии
диссоциации фосфорной кислоты H2PO4–
⇆
H+
+ HPO42–.
Здесь важно понимать, что в выражение
константы диссоциации любой стадии
входят общие концентрации ионов,
находящихся в растворе. Общая концентрация
ионов водорода была найдена в результате
расчёта по первой стадии, причём C(H+)
= С(H2PO4–).
Поэтому концентрация гидрофосфат-ионов
оказывается численно равной второй
константе диссоциации.

(моль/л)
Концентрацию
фосфат-ионов легко найти, подставляя
в выражение третьей константы диссоциации
найденные значения С(H+)
и С(HPO42–).

С(PO43–)
= 3,43·10–18
моль/л
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- Подробности
- Категория: Аналитическая химия
Рассчет содержания сульфат-ионов в пробе воды методом титрования
Задача 1
Рассчитать содержание сульфат-ионов (мг/л) в пробе воды: на титрование 100мл воды было израсходовано, 12.2 мл 0,1Н раствора Pb(NO3)2. =0,8875.
Дано:
V(Pb2+) = 12.2 мл;
k=0.8875;
V(SO42-) =100 мл;
Э(SO42-) = 48.г/моль;
N(Pb2+) =0.1 моль;
m(SO42-) = ?.
Решение:
Уравнение реакции имеет вид:
SO42- + Pb2+ = PbSO4
Для вычисления используем математическое выражение из закона эквивалентов (правило пропорциональности):
N(SO42-) * V(SO42-–) = N(Pb2+) * V(Pb2+),
Где (NSO42-) и N(Pb2+) – нормальные концентрации эквивалентов ионов (нормальности).
V((SO42-) и V(Pb2+) – объемы реагирующих ионов.
Отсюда
N(SO42-) = N(Pb2+) * V(Pb2+)/ V(SO42-) = 0,1 * 12,2/100 = 0,0122н
Вычислив эквивалент SO42-, можно вычислить массу SO42- по формуле:
N(SO42-) = m(SO42-) * 1000/Э (SO42-) * V(SO42-)
Тогда вычислим массу SO42- с учетом поправочного коэффициента, получим:
m(SO42-) = N(SO42- * Э(SO42-) * V(SO42-) * k/1000 =
= 0,012н * 48,03г/моль * 100мл * 0,8875/1000 =
= 0,052г/л или 52мг/л.
Ответ: m(SO42-) = 52мг/л.
Работа 1. Определение концентрации сульфат-иона [3] [c.138]
Определение концентрации сульфат-ионов, вызывающей помехи при определении содержания кальция. [c.382]
Сущность определения концентрации сульфат-ионов иодо-метрическим методом заключается в том, что сульфат-ионы сначала осаждают хлористым барием, добавляя раствор точно известной концентрации с избытком. А затем избыток ионов бария, оставшихся в растворе после связывания всех сульфат-ионов, в свою очередь осаждают хромат-ионами при это.м образуется труднорастворимая соль хромата бария [c.95]
ПРАКТИЧЕСКИЕ РАБОТЫ Работа 1. Определение концентрации сульфат-иона [c.122]
Практические работы Работа 1. Определение концентрации сульфат-иона [3 [c.138]
Во-вторых, коррозионный процесс можно ускорить путем изменения состава коррозионной среды. При этом, как уже указывалось, следует иметь в виду, что действие анионов является специфическим по отношению к каждому металлу. Например, ионы 50 – действуют на железо почти так же, как ионы хлора. В то же время сульфат-ионы не ускоряют коррозии алюминия и нержавеющих сталей. Более того, как показано одним из авторов работы [15], смесь ионов хлорида и сульфата играет пассивирующую роль и при определенном соотношении способна полностью подавить вредное влияние хлор-ионов. Поэтому при испытании нержавеющих сталей и алюминиевых сплавов увеличение концентрации сульфат-иона не приводит к ускорению коррозионного процесса. Такие сплавы надо испытывать в растворах, содержащих ионы хлора, и по возможности уменьшить концентрацию сульфат-ионов. Медные сплавы, наоборот, очень чувствительны к сульфат-ионам, поскольку растворимость сульфата меди выше хлорида. При испытании низколегированных и малоуглеродистых сталей применение смеси сульфата и хлорида также допустимо. [c.29]
Для определения концентрации сульфат-ионов в анализируемой пробе воды в систему ПИА инжектируют 30—200 мкл образца тем же способом и при тех же условиях, что и стандартные растворы, и измеряют высоту максимума пика выходного сигнала. По градуировочному графику находят концентрацию сульфат-ионов, соответствующую этой высоте. [c.49]
Однако достаточно ввести определенную концентрацию сульфат-ионов, чтобы потенциалы стали заметно сдвинулись в положительную сторону и активирующее влияние хлор-ионов было исключено. Хро- [c.318]
Электролиты для хромирования требуют поддерживания определенной концентрации сульфатов и регулирования содержания Сг +. На работе этих электролитов вредно сказывается загрязнение посторонними соединениями особенно вредны ионы железа, цинка, меди, хлора. Хлориды удаляются путем их анодного окисления. Удаление из электролита остальных ионов представляет собой весьма сложную проблему, поэтому следует стараться предотвратить их попадание в раствор. [c.229]
В этой группе методов определения сульфат-ионов могут быть использованы также соединения тория с ксиленоловым оранжевым, пирокатехиновым фиолетовым и некоторыми другими реагентами. Катионы, присутствующие в анализируемом растворе, удаляют с помощью ионообменной колонки. Анионы (РО4 , F ,WO МоО , AsO ) осаждают солями лантана. При использовании ксиленолового оранжевого определение проводят при pH 1,4 и % = 553 нм. Для построения калибровочного графика используют растворы, содержащие в 100 мл от О до 2,5 мг SO4 [554], С другим металлиндикатором — пирокатехиновым фиолетовым — образуется комплекс розового цвета состава Th R = 1 1. Определение сульфат-ионов проводят при pH 3,2 и X = 557 нм [5551, или 610 нм [556]. Калибровочный график строят для концентраций сульфат-ионов от 0,5 до 100 мкг мл. [c.56]
На основании динамики изменения концентрации сульфат ионов был установлен заброс смолы в реакторную воду из системы конденсатоочистки. Непрерывное определение сульфата позволило оценить и величину заброса (135 г). [c.22]
Вариант Б. К ЮО мл пробы (пропускать ее через колонку с катионитом нет необходимости) приливают 1 мл концентрированной соляной кислоты, 25 мл 0,05 М раствора хлорида бария и далее продолжают, как при определении общей серы по варианту Б (см. стр. 182). При определении малых концентраций сульфаТ-ионов вместо 0,05 М растворов комплексона III и хлорида магния можно применять 0,025 М растворы. [c.185]
На рис. 114, а представлены поляризационные кривые, полученные в растворах хромовой кислоты, содержащих различные концентрации сульфат-ионов [52]. Из этих данных следует, что с возрастанием концентрации сульфат-иона скорость реакции Сг —> увеличивается до определенного значения (участок /). С дальнейшим увеличением концентрации аниона скорость восстановления практически остается постоянной. При сдвиге потенциала в отрицательную сторону наступает торможение электрохимической реакции (участок //), вызванное образованием фазовой катодной пленки. Если увеличение концентрации ионов свыше 0,2 М не влияет на первую ветвь поляризационной кривой (участок /), то степень торможения электродной реакции на участке II зависит от концентрации сульфат-иона, причем [c.180]
В качестве приборов для определения дозы сернокислого алюминия по изменению концентрации сульфат-ионов в воде можно использовать преобразователи типа применяемых в рН-метрии (для потенциометрических измерений с индикаторными электродами ферро-ферриционидным, мембранным) и автоматические колориметры (для колориметрических измерений). [c.115]
Метод анализа солей прост, точен и осуществляется быстро. Поэтому предложены многочисленные методы определения различных солей и их смесей. Метод нашел применение при анализе природных вод. Общую солевую концентрацию вод, а также содержание хлоридов и сульфатов определяют после пропускания определенного объема воды через колонку с Н-катионитом, титруя одну порцию эффлюента щелочью, другую — нитратом серебра для определения хлорид-иона концентрацию сульфат-иона определяют по разности. Интересным и перспективным является анализ труднорастворимых солей. Если суспензию катионита в Н-форме привести в контакт с осадком труднорастворимой соли, то по- [c.53]
Методика определения. В кювету емкостью 20 мл помещают 1,00 мл анализируемого раствора с концентрацией сульфат-ионов 1— 100 мкг/мл, добавляют 1 мл ацетатной буферной смеси (pH = 3—4), 0,3 мл 0,1%-ного раствора нитхромазо, 12 мл ацетона. [c.285]
Вариант Б. К 100 мл пробы (пропускать ее через колонку с катионитом нет необходимости) приливают 1 мл концентрированной соляной кислоты, 25 мл 0,05 М раствора хлорида бария и далее продолжают, как при определении общей серы по варианту Б (см. стр. 181). При определении малых концентраций сульфат-ионов [c.184]
Метод основан на том, что в сильнокислых растворах между концентрацией сульфат-ионов С и временем достижения определенной величины оптической плотности в присутствии раствора хлорида бария с концентрацией существует логарифмическая зависимость выражаемая уравнением [c.185]
Через определенные промежутки времени пробы обеих фаз анализировали на содержание урана и (или) 5 5042-, На рис. 2 приведены типичные кривые распределения 5 504 -, а в табл. 2 — данные о концентрации сульфат-ионов в водных растворах, относительном содержании комплексов урана и относительной скорости перехода 535042-, При низкой концентрации сульфат-ионов в водном растворе, где уран находится главным образом в [c.321]
Для образования осадка с высокими защитными свойствами необходима определенная концентрация в воде кислорода 4-6 мг/л) и невысокое содержание хлоридов и сульфатов. В плотном защитном слое соотношение карбоната кальция к гидроокиси железа составляет от 1 9 до 3 7. Сульфаты и хлориды ухудшают сцепление защитного слоя с поверхностью трубы, увеличивают его пористость и способствуют образованию рыхлых пористых осадков. Образующийся в этих условиях осадок приводит к язвенной коррозии труб. В -растворах с положительным индексом насыщения защитное действие карбонатных осадков ухудшается при концентрации сульфат-ионов более 100 мг/л. [c.17]
Сульфаты не стимулируют коррозию алюминия, а в сочетании с хлоридами в определенных условиях (когда концентрация сульфатов превышает концентрацию хлоридов) являются даже ингибиторами. Поэтому в водах с высокой концентрацией сульфатов, где стойкость оцинкованной стали невелика, алюминированные трубы обладают высокой коррозионной стойкостью. При атом имеется много природных вод, в которых концентрация сульфат-ионов превышает концентрацию хлоридов. В таких водах алюминированные трубы также проявляют высокую стойкость против коррозии, несмотря на довольно высокую концентрацию хлоридов. [c.62]
Цель работы. Приготовление взвеси BaS04 и определение концентрации сульфат-иона. [c.138]
В мерную колбу емкостью 100 мл полг ещают 2 мл раствора ВаСЬ, разбавляют немного водой и прибавляют 3 мл 0,5%-ного раствора желатина, При помешивании вводят из микробюретки определенное количество эталонного раствора Н2504 (от 0,135 мг до 1,0 мг ЗОз в 100 мл). Через 3—5 мин заполняют кювету с толщиной слоя 20 мм и определяют оптическую плотность иа ФЭКН-57 кювету сравнения заполняют дистиллированной водой. По полученным данным строят калибровочный график. По оси абсцисс откладывают концентрацию сульфат-ионов вмг на 100 мл раствора, а по оси ординат — оптическую плотность. [c.273]
Для определения 1—100 мкг1л SO4 использована линейная зависимость потенциала, находяш егося в потоке сульфат-свин-цового электрода, от концентрации сульфат-ионов [500]. [c.95]
Проверка косвенных методов потенциометрического определения сульфатов с хингидронным и ферро-феррицианидным электродами показала, что они позволяют определять концентрацию сульфат-ионов с точностью 2,5 мг1л, в пересчете на технический сернокислый глинозем это соответствует примерно 10 мг/л. К недостаткам данных методов следует отнести [c.114]
Сопротивление электродиализуемого раствора возрастает со временем очистки (табл. 3). Концентрация сульфат-ионов к концу опыта снижается до знЕчения, лежащего в пределах чувствительности выбранного метода определения (рис. 4). [c.326]
При анализе большинства реальных образцов правильность определения содержания ионов снижается из-за присутствия некоторых ионов противоположного заряда. Например, концентрацию сульфат-ионов обычно определяют путем взвешивания осадка, образующегося при добавлении ионов бария, однако этот метод дает неудовлетворительные результаты в присутствии ионов железа (П1), хрома (П1) и алюминия, поскольку эти катионы соосаждаются с Ва504. В этом и других случаях устранения мешающего влияния можно достичь за счет пропускания раствора образца через катионит в Н+-форме. [c.487]
Определение урана по Арнфель ту. Анализируемая проба раствора может содерн ать от 1 до 20 мг урана ее объем не должен превышать 50 мл, а концентрация сульфат-ионов должна быть меньше 75 г л. [c.341]
Ржавчина, образующаяся на стали в промышленной атмосфере, как правило, содержит локальные образования — гнезда Ре304 [119—120]. Радиохимические методы дали возможность проследить за кинетикой образования сульфатных гнезд [121]. Количество сульфатных скоплений зависит от концентрации сульфат-ионов на поверхности образца. В области относительно малой поверхностной концентрации 504 (20—20 мг1см ) при определенной продолжительности коррозии наблюдалась прямая зависимость между концентрацией 5042″ и числом сульфатных гнезд. При больших концентрациях 804 сульфатные скопления сливаются. [c.180]
Ход определения. Из раствора, содержащего в каждых 10 мл 7 мг сульфат-ионов, осаждают обычным способом в центрифужной пробирке сульфат бария. После прибавления нескольких капель ацетона центрифугируют смесь в течение 3—5 мин. Раствор над осадком сливают и осадок Ва804 взбалтывают с горячей водой и опять центрифугируют. Эту операцию повторяют несколько раз. К осадку прибавляют 10 мл аммиачного раствора комплексона II и перемешивают в течение нескольких минут. В течение этого времени растворится весь сульфат бария. Раствор переносят в мерную колбу емкостью 50 мл, прибавляют 10 мл 1 н. раствора аммиака и доводят до метки дважды перегнанной водой. Часть раствора после продувания азота полярографируют в сосуде Колаусека. Таким же способом проводят холостой опыг в отсутствие сульфата бария и определяют основную волну электролита. Разность высот волн указывает концентрацию сульфат-ионов или бария. [c.240]
Сульфат-ионы. При фотометрическом определении сульфат-ионов в основном используют методы, основанные на вытеснении ионов хроматов, хлоранилата, или используют ослабление окраски комплексов. Определяют концентрацию сульфат-ионов в интервале 1 — 100 мкг/мл. Предложен косвенный метод, заключающийся в осаждении сульфат-иоиоп солянокислым 2-ампноппридинолг с последующим определением избытка реагента (но изменению опти- [c.121]
Кинетический хронофотометрический [45—49 ] метод определения сульфатов основан на том, что реакция взаимодействия ионов бария с сульфат-ионами в сильнокислой среде при избытке ионов бария протекает во времени при этом между концентрацией сульфат-ионов и временем, через которое достигается определенная оптическая плотность, существует линейная зависимость. [c.70]
Усоверщенствование электролитов хромирования с целью улучшения их эксплуатационных характеристик и свойств покрытий связано с введением в раствор активирующих ионов (фторидов, кремнефторидов) или легирующих металлов (кадмия, молибдена, ванадия), применением нестационарных режимов электролиза. Для поддержания требуемой концентрации в электролите ионов вводят сульфат стронция. Эта труднорастворимая соль, частично оставаясь в осадке на дне ванны, играет роль донора сульфат-ионов, постепенно отдавая их в раствор. Особенный интерес представляет такая система для разбавленного электролита, где, как указано выше, поддержание определенной концентрации сульфатов затруднено. Электролит содержит 140—170 г/л СгОз, 5—б г/л SrS04. Ре.жимы электролиза для получения различного типа покрытий декоративные — = = 60- 70 А/дм, / = 58- 60 °С, защитные — 4 = 20- 40 A/дм , / = 60- 65° , износостойкие — 4 = 80- 100 A/дм , / = 554-58 °С, твердые — / = 1004-120 А/дм / = 45- 50 °С. [c.152]
Весовой метод определения сульфат-ионов из-за своей длительности не удовлетворяет современным требованиям аналитичеСкога контроля. Для нахождения сульфат-ионов в фосфате хрома предлагается хронофотометрический метод, при этом возможные концентрации сульфат-ионов — 0,05—1,8%. [c.185]
При определении сульфат-ионов предложено использовать дегидратирующее действие серной кислоты на сахарозу [369]. Сульфат-ионы переводят в серную кислоту пропусканием раствора через колонку с катионообменной смолой в Н-форме и полученный элюат выпаривают досуха в присутствии сахарозы. При этом остаток окрашивается в зеленый цвет, а при растворении образуется коричнево-желтый раствор, интенсивность окраски которого пропорциональна концентрации сульфат-ионов. Определению мешают сильные минеральные и органические кислоты. 14—2 мкг/мл >0 определяют с ошибкой -3%. [c.35]
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
Как рассчитывают концентрацию ионов в растворах солей? Поясните на примере, пожалуйста: рассчитать концентрацию катионов в 0,2 М растворе Na2SO4
Ссылка на комментарий
–>
- Решение

- Решение
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
Ссылка на комментарий
- Автор
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
спасибо
Ссылка на комментарий

-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 – 0.2 моль
Ответ 0.65 моль/литр
Ссылка на комментарий
- Автор
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 – 0.2 моль
Ответ 0.65 моль/литр
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Ссылка на комментарий

-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона – два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче 
Ссылка на комментарий
- Автор
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона – два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
поняла, спасибо за помощь)
Ссылка на комментарий

-
- Поделиться
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Верный.
Для чего находить массу, и строить какие-то дикие пропорции, если вам нужна молярная концентрация,
когда ответ виден сразу из формулы соли – непонятно
Изменено 10 Апреля, 2016 в 12:45 пользователем M_GM
Ссылка на комментарий

-
- Поделиться
Черт! Я решал как процентную концентрацию!
Например. Берем 20 % раствор сульфата натрия. Определяем конц ионов натрия по верхним 《диким пропорциям》 и вуаля процентная конц катиона равна 6.2%.
Извиняюсь за дезинформацию.
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
