Чтобы знать наверняка несет ли пользу ваш водородный генератор, следует научиться определять концентрацию молекулярного водорода в воде, которую он генерирует. Именно по этой причине мы рассказываем о лучших способах измерить уровень H2.
Согласно International Hydrogen Standards Association, терапевтическим действием обладает вода при условии, что она насыщенная молекулярным водородом в концентрации не менее, чем 0.5 мл/л.
Все что ниже этого показателя не может считаться водородной водой, поскольку не несет существенной пользы для здоровья человека. Для того, чтобы на 100% быть уверенным в том, что вы действительно пьете водородную воду, необходимо наверняка знать уровень концентрации чистого H2 в воде после электролиза.
Как это сделать?
Существует несколько проверенных способов измерить концентрацию водорода в вашем генераторе:
- Титрование
- Электронный H2 тестер
Стоит отметить, что каждый из методов прост и доступен. Освоив хотя бы один из них, вы сможете определять концентрацию водорода в любое удобное для вас время и даже в домашних условиях.
Синие капли H2Blue
Измерение концентрации водорода с помощью синих капель H2Blue, по факту, самый простой и доступный способ, не требующий особых затрат и навыков. К тому же, это очень выгодно: бутылочки 10 мл хватит на более, чем 50 H2-тестов.
Капли H2Blue – это метиленовый синий реагент с коллоидной платиной. Следовательно, при взаимодействии с молекулярным водородом метиленовый реагент обесцвечивается. Таким образом биохимическая реакция в данном случае возможна благодаря присутствию в составе капель определенного катализатора – в данном случае, платины. Каждая капля раствора «реагирует» на 0.1 ppm газообразного водорода.
Более того, капли H2Blue – экологически безопасный реагент, изготовленный американской лабораторией H2 Sciences Inc, специализирующейся на производстве подобных жидкостей для тест-драйва концентрации водорода. В комплекте, дополнительно, у вас будет все необходимое: мензурка и палочка для размешивания капель в воде.
Как измерить концентрацию водорода с помощью капель:
- Наливаете воду в мензурку до отметки 6 мл.
- Добавляете по одной капле в мензурку, каждый раз размешивая палочкой жидкость. А также обязательно считаете капли.
- Когда вода приобретет светло-голубой оттенок, завершаем тест.
- Подсчитываем количество добавленных в воду капель и умножаем на 0.1 ppm. К примеру: 10 капель x 0.1 ppm = 1.0 мг/л.
- В итоге получаем показатель концентрации водорода в вашей воде – 1.0 ppm.
Напомним, водородной водой считается вода с минимальной концентрацией H2 0.5 мг/л.
Плюсы метода:
- Скорость. Вся процедура занимает, как правило, 2-3 минуты.
- Экономность. 10 мл капель хватит на 50 тестов.
- Безопасность. Капли прошли ряд тестов и признаны безопасными для человека и окружающей среды.
- Данный метод признан и сертифицирован IHSA.
Минусы метода:
Газообразный водород отличается крайней летучестью, поэтому быстро улетучивается из мензурки во время процедуры.
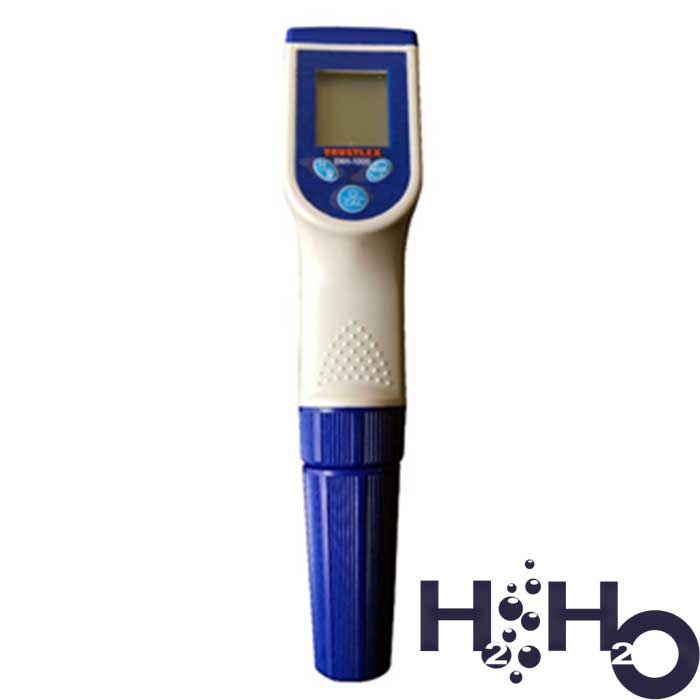
Электронный H2 тестер
Измерить уровень водорода в воде можно с помощью электронного измерителя Н2 – Trustlex. Позволяет измерить концентрацию водорода в диапазоне от 0 до 2 ppm.
Прибор вычисляет активность ионов водорода в жидкости с помощью встроенных электродов. Показатель концентрации водорода выводится на экран прибора. H2 метр портативен и прост в использовании. Как правило, в комплекте идет пара сменных электродов. Показатель водорода определяет точно, однако всего лишь в диапазоне до 2.0 ppm.
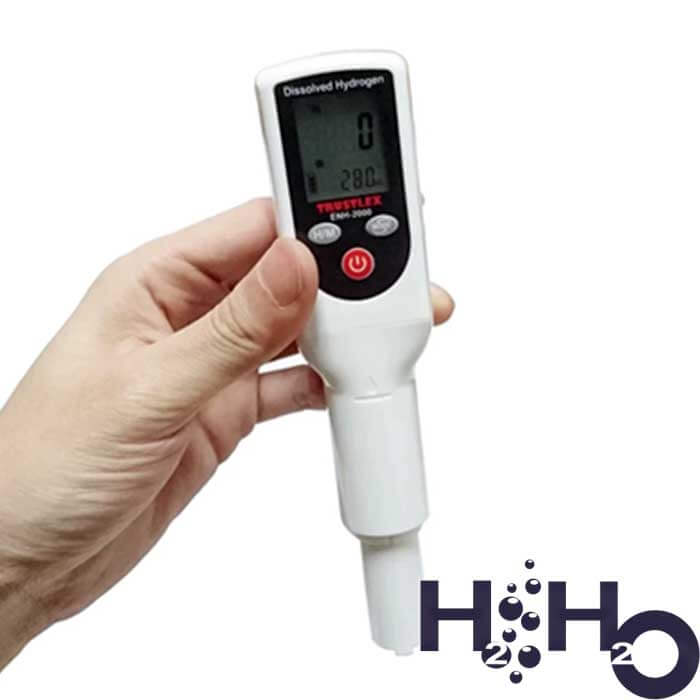
Как измерить концентрацию водорода с помощью электронного тестера:
- Активировать H2-метр кнопкой ON по центру. Опустить прибор электродами вниз в стакан/генератор с водородной водой.
- Через 10 секунд прибор выведет на экран показатель концентрации водорода в единицах измерения ppm/ppb. Зафиксируйте результат.
- Прибор отключается автоматически.
Плюсы метода:
- Скорость.
- Точность.
- Безопасность.
- Портативность.
Минусы метода:
- Ограниченность в диапазоне (эффективен при измерении H2 до 2.0 ppm).
- Стоимость. Цена H2 метра японского производителя Trustlex достигает 12 тыс. грн.
Какой способ предпочесть – решать вам. Мы лишь делимся своими знаниями, чтобы вам было легче ориентироваться в теме.
Нужна консультация по выбору подходящего водородного генератора?
Будем рады помочь вам! Пишите нам в чат!
Сложно сделать выбор? Напишите нам, и мы вместе определим, какой из наших приборов Вам подойдет больше.
ВЫБРАТЬ ГЕНЕРАТОР ВОДОРОДА

2в1 Настольный Генератор Водородной Воды – Пурифайер Olansi W11
18000грн. (461 €)

Генератор водородной воды Harmony с ингалятором Корея (black)
4500грн. (115 €)

Генератор водородной воды кувшин H2 Wellness
8000грн. (205 €)

H2 Life генератор водородной воды (white)
10500грн. 10000грн. (256 €)

Водородный генератор с мембраной Brilliance Lux
6500грн. (167 €)
Содержание:
- Измерители на основе пересчёта окислительно-восстановительного потенциала (ОВП).
- Измерение концентрации водорода методом газовой хромотографии
- Изменение концентрации водорода газоанализаторами с селективными элекродами
- Изменение концентрации водорода титрованием каплями метиленового синего с коллоидной платиной
Измерители на основе пересчёта окислительно-восстановительного потенциала (ОВП)
До 2018 года для измерения содержания водорода на рынке генераторов водородной воды применялись приборы типа Trustlex.
В январе 2022 года стоимость Trustlex составляла 43 000 – 48 000 руб.
Сейчас появились их дешевые аналоги. В России – порядок цен примерно 16 000 руб (январь 2022).
Принцип их работы – измерение окислительно-восстановительного потенциала (ОВП) раствора и автоматический пересчет в концентрацию водорода.
Действительно, между концентрацией водорода и ОВП есть взаимосвязь.
Это – уравнение Нернста для пары “молекулярный водород – ион водорода”. Оно показывает, что чем больше концентрация молекулярного водорода, (H2 в квадратных скобках), тем больше ОВП со знаком минус.
Но из этого же уравнения видно, что концентрация ионов водорода H+ влияет на ОВП гораздо больше – оно во 2й степени (квадрате). Ионы водорода H+ определяют кислотность, pH.
● Вывод – даже незначительное изменение pH гораздо больше влияет на ОВП, чем содержание водорода. Даже незначительный сдвиг pH от значения, на которое настроен прибор, приводит к значительным искажениям.
На ОВП может влиять множество факторов, не только водород и его ионы. Например, если аквариум долго не чистить, вода в нем тоже станет с отрицательным ОВП, машинное масло – тоже имеет отрицательным ОВП.
Trustlex и его аналоги, измеряющие концентрацию водорода на основе ОВП, – неизбирательны, они могут показывать наличие водорода, даже когда его нет.
Измерение концентрации водорода методом газовой хромотографии
Наиболее правильно измерять содержание водорода при помощи газовой хромотографии – масс спектрометрии. Этот метод часто применяли в научных исследованиях.
Компактный и недорогой газовый хроматограф российского производства “Кристалл 5000, на рынке с 2000 года, цена на январь 2022- от 700 000 руб + НДС.
Газовая хроматография (ГХ) – это метод, используемый для разделения соединений в смесях путем анализа взаимодействия, которое происходит между газом (подвижная фаза) и полимерным материалом (неподвижная фаза), содержащимся в длинной трубке, называемой колонкой.
Колонка используется для разделения отдельных компонентов, содержащихся в образце. Хотя ГХ может измерять многие другие газы и соединения, содержащиеся в образце, мы рассмотрим растворенный газ H2.
Образец для испытаний вводится в порт инжектора ГХ, и растворенный водород удаляется из воды с под действием тепла. Затем испарившийся газ нагнетается в колонку с использованием сжатого инертного газа-носителя (обычно аргона или азота). Пройдя по длине колонны, газ проходит через детектор теплопроводности (ДТП), его присутствие влияет на электрические характеристики вольфрам-рениевой нити. Отклик детектора будет пропорционален концентрации растворенного газообразного водорода, содержащегося в растворе пробы, и приведет к небольшому, но измеримому изменению падения напряжения. Сравнивая реакцию детектора во времени с сохраненным калибровочным стандартом, ГХ может определить неизвестную концентрацию водорода, присутствующего в исследуемой пробе.
Обычно производители тест- капель метиленового синего с коллоидной платиной калибруют их и проверяют характеристики с помощью ГХ.
Изменение концентрации водорода газоанализаторами с селективными элекродами
Ещё есть метод – газоанализаторы с селективными электродами.
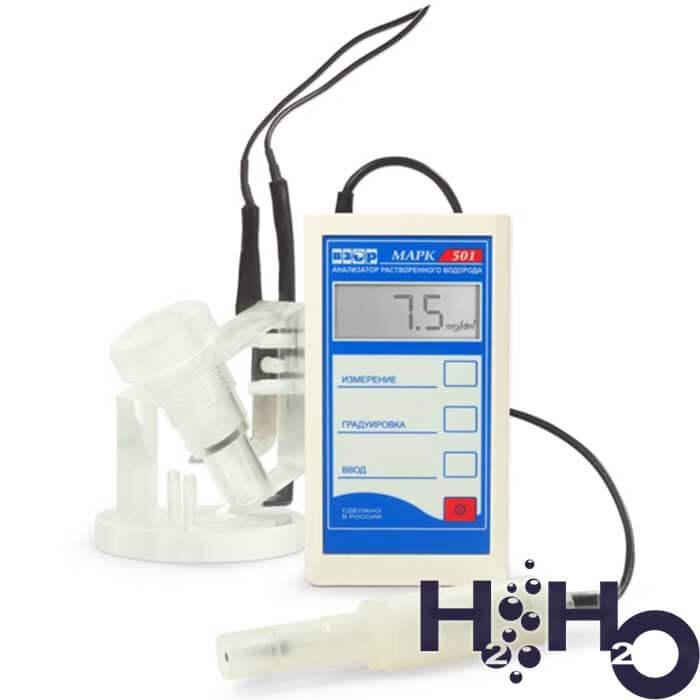
Анализатор растворенного водорода МАРК-501: (портативный). Цена на от 93600.00 руб. (без НДС) на январь 2022 года
Стационарный водородомер АВП-01Г. Цена без НДС на январь 2022 – 90 088 руб.
Принцип работы таких измерителей водорода
При измерениях электроды погружаются в раствор электролита, отделенного мембраной от анализируемой среды. Мембрана проницаема для водорода, но непроницаема для паров воды и жидкостей. Водород диффундирует из анализируемой среды через мембрану в расположенный между мембраной и анодом слой электролита. На поверхности анода возникает электрохимическая реакция, в которую и вступает водород.
В результате в датчике начинает вырабатываться сигнал постоянного тока, величина которого пропорциональна концентрации водорода, растворенного в анализируемых средах.
Далее этот сигнал преобразуется в данные.
По-научному это называется “амперометрический датчик, работающий по принципу полярографической ячейки закрытого типа”.
Изменение концентрации водорода титрованием каплями метиленового синего с коллоидной платиной
Наиболее простой и недорогой метод при помощи капель метиленового синегом с коллоидной платиной.
24 января 2012 года в научном журнале Medical gas research в статье “Удобный метод определения концентрации водорода в воде: использование метиленового синего с коллоидной платиной”. (“A convenient method for determining the concentration of hydrogen in water: use of methylene blue with colloidal platinum.” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3309943/) японскими учеными было предложено измерять количество водорода титрованием (последовательным добавлением капель до изменения цвета раствора).
“Метод определения концентрации водорода в воде очень желателен, особенно если он проще и дешевле, чем современный метод, включающий дорогие электрохимические датчики газа. Соответственно, мы исследовали простой метод оксидиметрии, который включает окислительно-восстановительную реакцию окислителя метиленового синего (МБ) в присутствии коллоидного платинового (Pt) катализатора. Хорошо известно, что МБ реагирует с эквимолярным количеством водорода в присутствии Pt или палладия с образованием бесцветного восстановленного (лейкометиленовый синий, лейко МБ) следующим образом MB (blue) + 2H+ + 2e– → leucoMB (бесцветный)” – говорится в статье
На основе этой методики делаются капли многими производителями.
Преимущества – удобство, простота, независимость от значения pH’. Кроме того, с его помощью можно измерять и водород, находящийся в микропузырьках в водородной воде в приборах, дающих сверх-высокую концентрацию.
Как проверить содержание водорода
- Газовая хроматография
- Микросенсорные датчики водорода
- Метод полярографической ячейки
- Метод Титрования
- Окислительно-восстановительный потенциал
С учетом возрастающей популярности водородной воды на рынке появляются различные приборы и изделия для получения молекулярного водорода. Однако, не все продукты могут производить достаточное количество Н2 и соответственно не будут иметь полезного влияния на организм человека. Концентрация Н2 имеющая терапевтический эффект составляет более 0,6 мг/л, при меньшей концентрации эффекты водорода будут малозаметны.
Основная проблема водородных продуктов – это сложность достоверного определения концентраций растворенного Н2 в воде. На рынке нет доступных анализаторов газообразного Н2, которые сможет купить себе пользователь генераторов водородной воды.
Соответственно мы будем часто встречаться с недобросовестными продавцами и не качественными водородными изделиями пока не придумают дешевых способов измерения Н2.
В этой статье мы расскажем о различных методах определения Н2 в воде, от самых точных и достоверных методов до способов с погрешностями показаний.
Газовая хроматография
Материал из Википедии
Газовая хроматография (ГХ) – это физико-химический метод разделения веществ, основанный на распределении компонентов анализируемой смеси между двумя несмешивающимися и движущимися относительно друг друга фазами, где в качестве подвижной фазы выступает газ (газ-носитель), а в качестве неподвижной фазы – твердый сорбент или жидкость, нанесенная на инертный твердый носитель или внутренние стенки колонки.
ГХ является основным методом разделения и анализа газообразных смесей для специалистов в химической отрасли. ГХ считается главным и самым точным способом измерения молекулярного водорода в жидкости. Этот методика определяет концентрацию водорода путем перемещения Н2 из водной фазы в газовую с использованием плотно закрытого сосуда.
Данное оборудование используется только в лабораторных или промышленных условиях, требует особых навыков и имеет высокую стоимость.
Микросенсорные датчики водорода
Высокочувствительный микродатчик водорода имеет исключительную чувствительность, которая позволяет измерять даже в естественных системах.
Микро- и минисенсоры водорода представляют собой датчики типа Кларка, измеряющие парциальное давление водорода. Принцип работы микродатчика водорода основан на диффузии водорода через силиконовую мембрану к платиновому аноду, окисляющему водород. Восстанавливающий анод поляризован относительно внутреннего катода Ag / AgCl. Результирующий сигнал датчика находится в диапазоне пА и измеряется высококачественным пикоамперметром.
Поскольку концентрации водорода в природных системах, как правило, очень низкие, очень важен низкий предел обнаружения датчика. Обычно предел обнаружения датчиков близок к 0,02% водорода (0,1 мкМ в воде), но датчики, можно сделать еще более чувствительными, если они оснащены большим наконечником мембраны.
Конструкция микродатчика позволяет использовать водородный микродатчик в самых разных областях исследований, где требуются высококачественные, неразрушающие, быстрые и точные измерения. Микросенсор водорода предназначен для исследовательских целей в следующих областях:
- Науки об окружающей среде
- Биомедицинские науки
- Биотехнологии
- Исследования фотохимического расщепления воды
- Влияние питьевой воды, обогащенной H 2
Метод полярографической ячейки.
Полярография – это метод количественного и качественного химического анализа, основанный на получении кривых зависимости величины тока от напряжения в цепи, состоящей из исследуемого раствора и погруженных в него электродов, один из которых сильно поляризующийся, а другой практически неполяризующийся.
Российский производитель в сфере приборов контроля параметров водных сред ООО «ВЗОР» создала высокоточный анализатор водорода МАРК-501 и 509. Анализатор измеряет содержание растворенного водорода в воде при помощи амперометрического датчика, который работает по принципу полярографической ячейки закрытого типа.
Анализируемая среда отделена от специального раствора электролита при помощи мембраны, которая пропускает через себя только водород и непроницаема для воды и паров жидкости. В электролит погружены электроды анод и катод на которые подается постоянный ток. Водород, проникая через мембрану, вступает в электрохимическую реакцию с поверхностью анода в результате вырабатывается сигнал, который пропорционален концентрации растворенного водорода.
Далее данные поступают в микроконтроллер, где происходит обработка информации и результаты выводятся на ЖК экран.
Метод Титрования при помощи метиленового синего
Информация из википедия
Титрование – это постепенное прибавление титрованного раствора реагента (титранта) к анализируемому раствору для определения точки эквивалентности. Титриметрический метод анализа основан на измерении объема реагента точно известной концентрации, затраченного на реакцию взаимодействия с определяемым веществом.
Японские ученые нашли удобный и недорогой метод определения концентрации водорода при помощи реагента метиленовый синий с добавлением коллоидной платины. Метод основан на окислительной реакции водорода с помощью метиленового синего в присутствии катализатора коллоидной платины.
Формула: MB (blue) + 2H+ + 2e- = leucoMB (colorless)
Метод определения концентрации водорода при помощи раствора метиленового синего очень прост. Необходимо капнуть синий раствор в воду и размешать, при наличии растворенного водорода метиленовый синий будет обесцвечиваться. Если же вода не содержит водород, то вода окраситься в синий цвет.
Одна капля этого реагента реагирует с 0,1 мг/л (ppm) молекулярного водорода, таким образом, посчитав количество капель, обесцветивших метиленовый синий, можно узнать приблизительное количество молекулярного водорода в воде.
Например, если 9 капель в жидкости обесцветились, а 10-я окрасила воду в синий цвет, то концентрация Н2 в данной жидкости составляет 0,9 мг/л (ppm).
Метод определения водорода раствором “метиленовый синий” не самый точный, но он является официальным методом и признан наукой.
Оригинал статьи: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3309943/
Окислительно-восстановительный потенциал
Окислительно-восстановительный потенциал можно измерить при помощи вольтметра или ОВП метра. Вода, которая подверглась электролизу (ионизированная вода) и другие формы водородной воды имеют отрицательный потенциал ОВП.
Однако отрицательный потенциал показывает не концентрацию водорода, а окислительно-восстановительные пары – пара концентрации молекулярного водорода (H2) и концентрация кислоты (ионы водорода H+), что соответствует стандартной окислительно-восстановительной полуреакции:
2H+ + 2e- => H2
Можно сделать отрицательный ОВП, уменьшив концентрацию H+ (повысив pH) и/или увеличив концентрацию растворенного молекулярного водорода Н2. И наоборот, вы можете сделать ОВП положительным, увеличив концентрацию H+ (понизив pH) и/или уменьшив концентрацию растворенного молекулярного водорода Н2.
Например, добавив в воду аскорбиновой кислоты (витамин С) мы получим отрицательный ОВП на основе отношения восстановленной аскорбиновой (НА) кислоты к окисленной аскорбиновой кислоте (DHA) в соответствии с уравнением Нернста.
DHA + 2e- => HA = -570 мВ
Напряжение можно сделать более отрицательным, увеличив концентрацию HA и/или уменьшив концентрацию DHA. И наоборот, можно сделать положительным ОВП, увеличив концентрацию DHA и/или уменьшив концентрацию HA.
Этот факт следует принимать во внимание при рассмотрении концентрации молекулярного водорода. Поскольку pH играет большую роль в ОВП, то может быть ситуация, где один стакан ионизированной воды с ОВП -800 мВ, а другой с ОВП -400 мВ, из-за разницы pH второй стакан будет иметь больше молекулярного водорода чем в первом, где ОВП – 800мВ. Отрицательный ОВП является скорее индикатором присутствия H2, чем мерой концентрации.
Таким образом, технологии, основанные на измерении ОВП, не должны использоваться в качестве точного метода измерения концентрации молекулярного водорода.
Статьи по теме
Заказать продукты VILOVIT
pH раствора 4,4. Определить концентрацию ионов водорода в этом растворе.
Решение задачи
Перед решением данной задачи хочу напомнить, водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе.
Пусть искомая концентрация . Тогда, учитывая, что pH раствора 4,4, найдем концентрацию ионов водорода в этом растворе:
Таким образом,концентрация ионов водорода в растворе равна 4 ∙ 10-5 моль/л.
Ответ: концентрация ионов водорода = 4 ∙ 10-5 моль/л.
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
Равновесие процесса диссоциации воды:
Н2О ↔ Н+ + ОН—
описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды равно:
Кw = [Н+] [ОН— ] (1)
Для разбавленных водных растворов ионное произведение воды не зависит от состава раствора и постоянно при данной температуре. Так, Кw=10— 14 для воды, миллимолярных растворов К2SO4, H2SO4 и KOH при Т=298 К. Строго говоря, постоянство Кw справедливо в случае, когда аналитические концентрации ионов заменены их активностями (лишь для малых концентраций Н+ и ОН— значения концентрации и активности практически совпадают).
Процесс диссоциации Н2О идет с поглощением теплоты, поэтому при повышении температуры в интервале от 0 до 100оС величина Кw увеличивается.
Для практических целей удобно пользоваться не концентрацией ионов водорода, а её водородным показателем – отрицательным десятичным логарифмом – рН. Величина рН равна:
рН = — lg[H+]. (2)
Как выше отмечалось, более строгим является уравнение рН = – lg aН+, где aН+ – активность ионов водорода. Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение (2).
При этом:
рН + рОН = 14, (3)
где рОН = — lg[ОH—].
Для нейтральных растворов рН = 7, для кислых растворов рН < 7, а для щелочных растворов рН > 7. В аналитической практике редко приходится работать с растворами, рН которых выходит из интервала 0 ÷14. Тем не менее, в сильнощелочной среде рН может быть немного больше 14, а в очень кислой среде может принимать отрицательные значения.
Примеры решения задач
Задача 1. Вычислите рН 0,001М растворов HСl и КОН.
Решение. HСl и КОН являются сильными электролитами и в разбавленных растворах практически полностью диссоциируют на ионы. В растворе НСl: [Н+] = 0,001 моль/л.
рН = –lg [H+] = –lg 0,001 = 3
В растворе КОН: [ОН–] = 0,001 моль/л. рОН = –lg [ОH—] = –lg 0,001 = 3. рН=14 – 3 = 11.
Задача 2. Рассчитайте рН раствора КОН, 350 мл которого содержат 0,0035 моль КОН.
Решение.
КОН → К+ + ОН—
См(КОН) = 0,0035:0,35 = 0,01М. см(КОН) = [ОН–].
рОН = –lg [ОH—] = –lg 0,01 = 2.
рОН + рН = 14. рН = 14 – 2 = 12
или [Н+] = 10–14/[ОН–] = 10–14/0,01 = 10–12 моль/л.
рН = –lg 10–12 = 12.
Задача 3. Вычислите молярную концентрацию раствора Ba(OH)2, если рН раствора составляет 12 при 298 К.
Решение.
Ba(OH)2 → Ва2+ + 2ОН–
рОН = 14 – 12 = 2
-lg [ОH–] = 2, откуда [ОH–] = 0,01 М.
Cм(Ba(OH)2) = [ОH—]/2 = 0,01/2 = 0,005М.
Задача 4. Рассчитайте степень диссоциации и рН 0,01 М водного раствора аммиака при 298 К, если константа диссоциации NH4OH при указанной температуре равна 1,76·10–5.
Решение.
NH3 H2O ⇔ NH4+ + OH— или упрощенно: NH4ОH ⇔ NH4+ + OH—
KД = [NH4+]·[OH–]/[NH4OH],
Поскольку [NH4+]=[OH–] и Cм(NH4OH) ≈ [NH4OH], то
KД = [OH–]2/Cм(NH4OH)
[OH–] = √(KД·Cм(NH4OH)) = 4,2·10-4 моль/л.
[Н+] = 10-14/[ОН—] = 10-14/4,2·10-4 = 2,4·10-11 моль/л.
рН = –lg [H+] = –lg 2,4·10–11 = 10,6.
или 4,2 %.
Задача 5. К 1 л 0,01М раствора CH3CОOH добавили 6 г СН3СООNa. Определите рН полученного раствора при Т = 298 К, если при указанной температуре Кд(CH3CОOH) = 1,75·10–5.
Решение.
Присутствие в растворе CH3CОOH сильного электролита СН3СООNa приводит к сдвигу равновесия диссоциации уксусной кислоты влево в силу действия принципа Ле Шателье. В результате степень диссоциации уксусной кислоты уменьшается.
n(СН3СООNa) = 6:82 = 0,073 моль.
См(СН3СООNa) = 0,073/1 = 0,073 М
(считаем, что объем раствора после добавления 6 г СН3СООNa не изменился).
Ацетат–ионы в растворе образуются как за счет диссоциации уксусной кислоты:
CH3CОOH ⇔ СН3СОО– + Н+,
так и за счет диссоциации СН3СООNa:
СН3СООNa → СН3СОО— + Na+
Поскольку СН3СООNa в растворе диссоциирует полностью, то концентрацией ацетат-ионов, образующихся при диссоциации уксусной кислоты можно пренебречь, так как она мала по сравнению с величиной 0,073 моль/л. Принимаем, что:
См(CH3CОONa) = [CH3CОO—];
[CH3CОOH] = См(CH3CОOН).
Cледовательно,
[H+] = Кд · См(CH3CОOН) / [CH3CОO—]
[H+] = 1,75·10–5 · 0,01 / 0,073 = 2,4·10–6 моль/л.
рН = –lg2,4·10–6 = 5,6.
Задачи для самостоятельного решения
1. Определите величину рН 0,0001 М раствора HCl.
2. Определите рН 0,01 М раствора KOH.
3. рН раствора гидроксида бария равен 11. Определите концентрацию этого раствора.
4. Степень диссоциации в 0,01 М растворе муравьиной кислоты при некоторой температуре составляет 10 %. Определите рН этого раствора.
5. Рассчитайте рН 1 М раствора азотной кислоты. Степень диссоциации кислоты примите равной 100 %.
6. Определите, сколько граммов Ba(OH)2 необходимо растворить в 5 л воды, чтобы рН раствора стал равен 10.
7. Определите рН раствора H2SO4, титр которого равен 0,005 г/см3. Степень диссоциации серной кислоты примите равной 100 % по двум ступеням.
14.8. Степень диссоциации муравьиной кислоты в 0,34 М растворе составляет 2,3 %. Определите константу диссоциации HCOOH и рН этого раствора.
9. Вычислите рН 0,01М раствора NH4OH, содержащего в 1 л 0,02 моль NH4Cl при 298 К, если при указанной температуре Кд(NH4OH) = 1,76·10–5.
10. Как изменится рН, если к 0,2М раствору циановодородной (синильной) кислоты добавить 5 мл 1 мас.% раствора KCN, плотность которого равна 1,01 г/см3? Константа диссоциации HCN при 298 К составляет 4,9·10–10.