Загрузить PDF
Загрузить PDF
В химии концентрация раствора показывает, как много растворенного вещества содержится в растворителе. Согласно стандартной формуле C = m/V, где C — концентрация, m — масса растворенного вещества и V — общий объем раствора. При малых концентрациях удобнее вычислять концентрацию в миллионных долях (ppm). Во время лабораторной работы вас могут попросить также вычислить молярность, или молярную концентрацию раствора.
-
1
Найдите массу растворенного вещества. Это вещество добавляют в растворитель, чтобы получить раствор. Если в условии дана масса растворенного вещества, запишите ее и укажите соответствующие единицы измерения. Если эту массу необходимо найти, взвесьте то вещество, которое вы собираетесь растворить, на лабораторных весах и запишите результат измерений.[1]
- Если растворенное вещество имеет жидкую форму, можно вычислить массу с помощью формулы для плотности D = m/V, где m — масса жидкости и V — ее объем. Чтобы найти массу, умножьте плотность жидкости на объем.
Совет: если необходимо использовать весы, вычтите из общей массы массу емкости, в которой находится взвешиваемая жидкость, чтобы получить правильный результат.
-
2
Запишите общий объем раствора. Этот объем равен сумме объема растворителя и растворенного вещества. Если необходимо измерить объем в лаборатории, приготовьте раствор в мерной пробирке или мензурке и определите объем. Чтобы получить более точный результат, определите объем по верхнему краю поверхности раствора (мениска). Запишите найденную величину.[2]
- Если вы не измеряете объем раствора самостоятельно, возможно, потребуется вычислить его по массе и плотности.
- Например, если следует найти концентрацию 3,45 грамма соли, растворенной в 2 литрах воды, можно определить объем по формуле для плотности. Найдите плотность соли в справочнике или интернете и решите уравнение относительно массы m. В данном случае плотность соли составляет 2,16 г/мл (грамма на миллилитр). Получаем 2,16 г/мл = (3,45 г)/V. Умножим обе части равенства на V и получим V(2,16 г/мл) = 3,45 г. После этого поделим каждую часть на 2,16 и найдем объем: V = (3,45 г)/(2,16 г/мл) = 1,60 мл.
- Прибавьте к объему растворенного вещества объем растворителя. В нашем примере имеем 2 л + 1,6 мл = 2000 мл + 1,6 мл = 2001,6 мл. Можно оставить найденный объем в миллилитрах или перевести его в литры: 2,002 л.
-
3
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора. Не забудьте записать в ответе правильные единицы измерения.[3]
- В нашем примере для концентрации 3,45 грамма соли в 2 литрах воды имеем C = (3,45 г)/(2,002 л) = 1,723 г/л.
- В некоторых задачах требуется найти концентрацию в определенных величинах. Не забудьте перевести значения в соответствующие единицы измерения, прежде чем подставлять их в конечную формулу.
Реклама
-
1
Найдите массу растворенного вещества в граммах. Измерьте массу того вещества, которое вы собираетесь добавить в раствор. Не забудьте вычесть массу емкости, если вы используете ее при взвешивании, чтобы получить правильный результат.[4]
- Если растворяемое вещество находится в жидкой форме, можно вычислить его массу с помощью формулы D = m/V, где D — плотность жидкости, m — ее масса и V — объем. Найдите плотность жидкости в справочнике или интернете и решите уравнение относительно массы.
-
2
Определите общую массу раствора в граммах. Общая масса равна сумме масс растворенного вещества и растворителя. Измерьте эти массы с помощью лабораторных весов или переведите объем растворителя в массу с помощью формулы для плотности D = m/V. Сложите массы растворенного вещества и растворителя, чтобы найти общую массу.[5]
- Например, если вы хотите найти концентрацию 10 граммов порошка какао в 1,2 литра воды, определите массу воды по формуле для плотности. Плотность воды составляет 1000 г/л, поэтому получаем 1000 г/л = m/(1,2 л). Умножим обе стороны равенства на 1,2 литра и найдем массу в граммах: m = 1,2 л×1000 г/л = 1200 г. Прибавим массу порошка какао и получим 1210 г.
-
3
Поделите массу растворенного вещества на общую массу раствора. Определим концентрацию как C = масса растворенного вещества/общая масса раствора. Подставьте в это уравнение значения, чтобы найти концентрацию раствора.[6]
- В нашем примере C = (10 г)/(1210 г) = 0,00826.
-
4
Умножьте ответ на 100, если хотите найти концентрацию в процентах. Если требуется определить концентрацию в процентах, умножьте найденный ответ на 100. Запишите полученный результат со знаком процентов.[7]
- В нашем примере концентрация в процентах составляет 0,00826×100 = 0,826 %.
-
5
Умножьте концентрацию на 1000000, чтобы найти миллионные доли. Возьмите найденное значение концентрации и умножьте его на 1000000, или 106. В результате вы найдете, сколько миллионных долей растворенного вещества содержится в растворе. Укажите в ответе единицы измерения в ppm.[8]
- В нашем примере количество миллионных долей ppm = 0,00826×1000000 = 8260 ppm.
Совет: миллионные доли обычно используют для очень малых концентраций, когда легче записать и понять ответ в них, а не в процентах.
Реклама
-
1
Сложите атомные массы растворенного вещества, чтобы найти молярную массу. Посмотрите, из каких химических элементов состоит данное растворенное вещество. Выпишите атомную массу каждого элемента, поскольку атомная и молярная массы равны. Сложите все атомные массы элементов растворенного вещества, чтобы найти общую молярную массу. Укажите в полученном результате, что это г/моль (количество граммов на моль).[9]
- Например, если в качестве растворенного вещества дан гидроксид калия, найдите атомные массы калия, кислорода и водорода и сложите их. В результате получится молярная масса = 39 +16 + 1 = 56 г/моль.
- Молярность используется в химии в основном тогда, когда известен химический состав растворенного вещества.
-
2
Поделите массу растворенного вещества на его молярную массу, чтобы определить количество молей. При необходимости измерьте массу растворенного вещества с помощью лабораторных весов. Не забудьте вычесть массу емкости, чтобы получить правильный результат. Поделите найденную массу на молярную массу, в результате вы узнаете количество молей. Укажите возле ответа «моль».[10]
- К примеру, если вы хотите найти, сколько молей содержится в 25 граммах гидроксида калия (KOH), уравнение будет выглядеть следующим образом: число молей = (25 г)/(56 г/моль) = 0,45 моль.
- Переведите массу растворенного вещества в граммы, если она указана в других единицах измерения.
- Моли показывают количество молекул в растворе.
-
3
Переведите объем раствора в литры. Определите объем растворителя, прежде чем приготовить раствор. Если объем не дан в условии задачи, используйте мерную пробирку или мензурку. Если вы получите результат в миллилитрах, поделите его на 1000, чтобы перевести в литры.[11]
- В рассматриваемом примере если вы используете 400 миллилитров воды, поделите эту величину на 1000, и у вас получится 0,4 литра.
- Если объем растворителя уже указан в литрах, данный шаг можно пропустить.
Совет: обычно нет необходимости учитывать объем растворенного вещества, так как он, как правило, не сильно влияет на общий объем. Однако если объем заметно изменится после того, как вы добавите растворимое вещество, используйте общий объем раствора.
-
4
Поделите количество молей растворенного вещества на объем раствора в литрах. Запишите молярность следующим образом: M = mol/V, где mol — количество молей растворенного вещества и V — объем растворителя. Найдите ответ и поставьте возле него букву «M».[12]
- В нашем примере M = (0,45 моль)/(0,4 л) = 1,125 M.
Реклама
Советы
- Если вы находитесь в лаборатории и не знаете, сколько растворенного вещества было добавлено, можно титровать раствор другими реактивами. При этом необходимо знать, как записывать химические уравнения в стехиометрическом виде.
Реклама
Об этой статье
Эту страницу просматривали 226 882 раза.
Была ли эта статья полезной?
Download Article
Download Article
In chemistry, a solution’s concentration is how much of a dissolvable substance, known as a solute, is mixed with another substance, called the solvent. The standard formula is C = m/V, where C is the concentration, m is the mass of the solute dissolved, and V is the total volume of the solution. If you have a small concentration, find the answer in parts per million (ppm) to make it easier to follow. In a lab setting, you may be asked to find the molarity, or molar concentration, of the solution instead.
-
1
Find the mass of the solute mixed in with the solvent. The solute is the substance that you’re mixing in to form your solution. If you’re given the mass of the solute in your problem, write it down and be sure to label it with the correct units. If you need to find the mass of the solute, then weigh it on a lab scale and record the measurement.[1]
- If the solute you’re using is a liquid, then you can also calculate the mass using the density formula, where density D = m/V, where m is the mass of the liquid and V is the volume. To find the mass, multiply the density of the liquid by the volume.
Tip: If you need to use a scale, subtract the mass of the container you’re using to hold the solute or else your calculations will be off.
-
2
Record the total volume of the solution. The total volume of the solution is the amount of solvent plus the amount of solute added to it. If you’re finding the volume in a lab, mix the solution in a graduated cylinder or beaker and look at the measurement. Measure the volume from the curve at the top of the solution, or the meniscus, to get the most accurate reading. Record the volume of the solution.[2]
- If you aren’t measuring the volume yourself, you may need to convert the mass of the solute into volume using the density formula.
- For example, if you’re finding the concentration of 3.45 grams of salt in 2 liters of water, you would find the volume of salt using the density formula. Look up the density of salt either in a textbook or online and solve the formula for m. In this case, the density of salt is 2.16 g/mL. The formula would read 2.16 g/mL = (3.45 g)/V. Multiply each side by V to get V(2.16 g/mL) = 3.45 g. Then divide the each side by 2.16 to find the volume, or V = (3.45 g)/(2.16 g/mL) = 1.60 mL.
- Add the volume of the solute to the volume of your solvent, ma. So in this example, 2 L + 1.6 mL = 2,000 mL + 1.6 mL = 2,001.6 mL. You can either leave the measurement in milliliters or convert it back to liters to get 2.002 L.
Advertisement
-
3
Divide the mass of the solute by the total volume of the solution. Write out the equation C = m/V, where m is the mass of the solute and V is the total volume of the solution. Plug in the values you found for the mass and volume, and divide them to find the concentration of your solution. Don’t forget to label to label your answer with the correct units.[3]
- In our example for the concentration of 3.45 grams of salt in 2 liters of water, your equation would be C = (3.45 g)/(2.002 L) = 1.723 g/L.
- Certain problems may ask for your concentration in specific units. Be sure to convert the units before putting them in your final formula.
Advertisement
-
1
Find the mass of the solute in grams. Measure out the mass of the solute that you plan on mixing with your solution. Be sure to subtract the weight of the container you’re using to measure the solute or else your concentration will be inaccurate.[4]
- If your solute is a liquid, you may need to calculate the mass using the formula D = m/V, where D is the liquid’s density, m is the mass, and V is the volume. Look up the density of the liquid in a textbook or online and then solve the equation for the mass.
-
2
Determine the total mass of the solution in grams. The total mass of the solution is the mass of the solvent plus the mass of the solute. Weight the masses using a lab scale or convert the volume of the solvent to mass by using the density formula D = m/V. Add the mass of the solute to the mass of the solvent to find your final volume.[5]
- For example, if you want to find the concentration of 10 g of cocoa powder mixed with 1.2 L of water, you would find the mass of the water using the density formula. The density of water is 1,000 g/L, so your equation would read 1,000 g/L = m/(1.2 L). Multiply each side by 1.2 L to solve the mass in grams, so m = (1.2 L)(1,000 g/L) = 1,200 g. Add the mass of the cocoa powder to get 1,210 g.
-
3
Divide the mass of the solute by the total mass of the solution. Set up your equation so the concentration C = mass of the solute/total mass of the solution. Plug in your values and solve the equation to find the concentration of your solution.[6]
- In our example, C = (10 g)/(1,210 g) = 0.00826.
-
4
Multiply your answer by 100 if you want to find the percent concentration. If you’re asked to list the concentration in a percentage, take the answer you just found and multiply it by 100. Label your final answer with a percentage sign.[7]
- In this example, the percent concentration is (0.00826)(100) = 0.826%.
-
5
Multiply the concentration by 1,000,000 to find the parts per million. Use the number you found for your concentration and multiply it by 1,000,000 or 106. The number will be how many parts per million the solute is. Label your final answer in ppm.[8]
- In our example, the ppm = (0.00826)(1,000,000) = 8,260 ppm.
Tip: Parts per million is usually used for very small concentrations since it’s easier to write and understand than a percentage.
Advertisement
-
1
Add the atomic masses of the solute together to find the molar mass. Look at the elements in the chemical formula for the solute you’re using. List the atomic mass for each element in the solute since atomic and molar mass are the same. Add together the atomic masses from your solute to find the total molar mass. Label the final measurement in g/mol.[9]
- For example, if your solute is potassium hydroxide (KOH), find the atomic masses for potassium, oxygen, and hydrogen and add them together. In this case molar mass = 39 +16 + 1 = 56 g/mol.
- Molarity is used mainly in chemistry when you know the chemical makeup of the solute you’re using.
-
2
Divide the mass of the solute by the molar mass to find the number of moles. Find the mass of the solute you’re adding into your solution using a lab scale if you need to.[10]
Be sure to subtract the mass of the container so you have an accurate reading. Divide the mass you found by the molar mass so you can find how many moles of the solute you’re using. Label your answer with “mol.”[11]
- For example, if you want to find the number of moles in 25 g of potassium hydroxide (KOH), then the equation is mol = (25 g)/(56 g/mol) = 0.45 mol
- Convert the mass of your solute to grams if it isn’t already listed in grams.
- Moles are used to represent the number of atoms in the solution.
-
3
Convert the volume of the solution to liters. Find the volume of the solvent before you mix in the solute.[12]
Use a flask or a graduated cylinder to find the measurement if you aren’t given it. If your measurement is in milliliters, then divide it by 1,000 to convert it to liters.[13]
- In this example, if you’re using 400 mL of water, then divide it by 1,000 to convert it to liters, which is 0.4 L.
- If your solvent is already listed in liters, then you can skip this step.
Tip: You don’t need to include the volume of the solute since it doesn’t usually affect the volume that much. If there is a visible change in volume when you mix the solute with the solvent, then use the total volume instead.
-
4
Divide the moles of solute by the volume of the solution in liters. Set up your equation so the molarity M = mol/V, where mol is the number of moles of the solute and V is the volume of the solvent. Solve the equation and label the answer M.[14]
[15]
- In this example, M = (0.45 mol)/(0.4 L) = 1.125 M.
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
How do I convert milligrams to moles?
First, calculate the molar mass of your substance. (Add the atomic masses of the constituent elements.) Then, convert milligrams to grams by dividing by 1000. Finally, divide the grams of your substance by the Molar Mass.
-
Question
If I have a solution with unknown mass, how do I calculate concentration?
Calculate the number of moles using the equation c=n/v for the first given solution.Then using the no of moles calculate the mass using equation n=m/Mr.
-
Question
If I am given two solutions, what is one way of knowing which one is more/less concentrated?
You can perform titrations. Under the Le Chatelier’s principle, the more concentrated one will have faster reacting time due to the fact that the more concentrated one has more molecules of that substance, leading to the ultimate truth that the chances of molecules meeting each other is bigger. Note that this method will not work if you are dropping Transition Metals into room-temperature, concentrated HNO3 or H2SO4 since Iron (and other metals) has the property called passivation. It happens when the metal reacts w/ the acid so quickly that the metal forms a salt, preventing the further reaction to the acid.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
If you are in a lab and don’t know how much of a solute was added, you can perform a titration test using other reactive chemicals. You do need to learn how to balance chemical equations with stoichiometry.
Advertisement
About This Article
Article SummaryX
To calculate the concentration of a solution, start by converting the solute, or the substance being dissolved, into grams. If you’re converting from milliliters, you may need to look up the solute’s density and then multiply that by the volume to convert to grams. Next, convert the solvent to liters. Finally, divide the solvent by the solute to find the concentration of the solution. To learn how to calculate the concentration of a solution as a percentage or parts per million, scroll down!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,974,040 times.
Did this article help you?
Концентрация растворов
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ивановский государственный политехнический университет» (ИВГПУ)
Кафедра химии, экологии и микробиологии
Общая химия
Методические указания к выполнению
контрольных заданий
для студентов первого курса всех специальностей
Иваново 2014
Методические указания предназначены для студентов очной формы обучения всех специальностей, изучающих химию. В них рассматриваются основные теоретические положения, необходимые для решения задач по разделам «Концентрация растворов», «Химическая термодинамика», «Растворы неэлектролитов и электролитов», «Электрохимия». Кроме этого приводится большое количество примеров решения разнообразных задач по указанным темам.
Методические указания могут быть использованы в процессе выполнения домашних заданий и при подготовке к экзамену по химии.
Составители: канд. хим. наук, проф. В.
В. Васильев, канд. техн. наук, доц. А.В. Кольчугин, канд. техн. наук, доц. В.Р. Ополовников, канд. техн. наук, проф. Г.М. Прияткин
Научный редактор канд. хим. наук, проф. В.В. Васильев Редактор Е.Л. Аверьянова Корректор А.В. Николаева
Подписано в печать 23.01.2014 Формат1/16 60 х 84. Бумага писчая
Плоская печать. Усл. печ. л. 3,26. Уч.-изд. л. 3,0 Тираж 100 экз. Заказ №
Редакционно-издательский отдел Ивановского государственного политехнического университета
Отдел оперативной полиграфии Текстильного института ИВГПУ 153000 г.Иваново, Шереметевский проспект,21
2
·100%.
1. Концентрация растворов
Раствором называется гомогенная (однородная) система, состоящая из нескольких компонентов. В практической деятельности чаще всего приходится иметь дело с жидкими растворами. Поэтому далее именно жидкие растворы и будут рассматриваться.
Простейший раствор состоит из двух компонентов: растворителя и растворенного вещества. Растворителем считается жидкий компонент.
Чаще всего растворителем бывает вода.
Важнейшей характеристикой любого раствора является его концентрация. Концентрация раствора показывает, в каком соотношении находятся растворенное вещество и растворитель. Это соотношение может быть показано разными способами.
1.1. Способы выражения концентрации растворов
Массовая доля или процентная концентрация (ω)
Этот вид концентрации показывает соотношение масс растворенного вещества и раствора:
ω = m(вещества) . m( раствора)
Так как масса растворенного вещества всегда меньше массы раствора, это соотношение всегда меньше единицы. Поэтому, как правило, его выражают в процентах:
ω = m(вещества) m( раствора)
В этом случае массовую долю растворенного вещества можно назвать процентной концентрацией раствора и использовать обозначение С%:
С% = m(вещества) ·100%. m( раствора)
Можно сказать, что процентная концентрация показывает,
сколько граммов растворенного вещества содержится в 100 граммах раствора.
То есть, если имеется, например, 5%-ный раствор хлорида натрия, то это значит, что в 100 граммах раствора содержится 5 граммов хлорида натрия и соответственно 95 граммов воды.
3
На практике при определении количества жидкого растворителя или раствора измеряют их объем (V). Для определения массы жидкости в этом случае используют ее плотность (ρ), то есть
m(раствора) = V(раствора) · ρ(раствора).
Как правило, плотность растворов измеряется в г/мл или, что одно и то же, в г/см3. Поэтому при использовании этой зависимости объем раствора должен измеряться в миллилитрах.
Молярная концентрация или молярность (СМ)
Этот способ выражения концентрации растворов используется в тех случаях, когда речь идет о каких-либо химических закономерностях, например, о зависимости от концентрации скорости химической реакции, состояния равновесия, электродного потенциала и др.
Молярная концентрация показывает, сколько молей растворенного вещества содержится в одном литре раствора.
То есть, если имеется двухмолярный (2М) раствор серной кислоты, то в одном литре этого раствора содержится два моля серной кислоты.
По определению
С = n(вещества) , М V ( раствора)
где n – число молей растворенного вещества; V- объем раствора, л.
Если принять во внимание, что
n = Mm ,
то можно записать:
|
CM = |
m(вещества) |
, |
|
|
M (вещества) V ( раствора) |
|||
где М – молярная масса вещества, г/моль.
Вэтой формуле объем раствора обязательно должен измеряться
влитрах.
4
Молярная концентрация эквивалента или нормальная концентрация (Сн)
Этот способ выражения концентрации растворов применяется в тех случаях, когда растворенное вещество участвует в какой-либо реакции, и для выполнения расчетов удобно применить закон эквивалентов.
Нормальная концентрация (нормальность) показывает, сколько эквивалентов вещества содержится в одном литре раствора.
Так, если имеем 0,1н раствор гидроксида натрия, то можно сказать, что в одном литре этого раствора содержится 0,1 эквивалент
NaOH.
По определению:
|
СН = |
nЭ |
(вещества) |
, |
|
|
V ( раствора) |
||||
где nэ – число эквивалентов растворенного вещества; V- объем раствора, л,
|
или |
m(вещества) |
||
|
CН = |
, |
||
|
MЭ (вещества) V ( раствора) |
|||
где МЭ – молярная масса эквивалента вещества.
В этой формуле объем раствора также должен измеряться в литрах.
Если в задаче речь идет о реакции, в которой реагирующие вещества находятся в растворах, часто бывает удобно использовать закон эквивалентов для растворов:
СН(1) . V(1) = CH(2) . V(2),
где СН и V – нормальность и объем двух взаимодействующих растворов.
Моляльная концентрация или моляльность (Сm)
Этот способ выражения концентрации растворов встречается довольно редко. Обычно необходимость его использования возникает в тех случаях, когда обсуждается влияние концентрации на изменение температуры замерзания или кипения раствора по сравнению с чистым растворителем.
5
Моляльная концентрация показывает, сколько молей растворенного вещества приходится на 1000 граммов растворителя.
Моляльность может быть рассчитана по формуле:
|
Cm = |
m(вещества) 1000 |
, |
|
|
M (вещества) m( растворителя) |
|||
где m(вещества) – масса растворенного вещества, г; m(растворителя) – масса растворителя, г;
M(вещества) – молярная масса растворенного вещества, г/моль.
1.2. Примеры решения задач по теме «Концентрация растворов»
Задачи по этой теме можно решать или путем логического рассуждения, составляя пропорции на основе определений различных видов концентраций, или используя формулы, приведенные выше. В примерах будут показаны оба способа решения задач.
Пример 1. В 200 мл воды растворено 50 граммов хлорида калия. Вычислите массовую долю вещества в растворе.
|
Дано: |
Решение: |
||||||||
|
V(h3O) = 200 мл |
Плотность воды ρ = 1г/мл, значит, масса воды |
||||||||
|
m(KCl) = 50 г |
m(h3O) = ρ |
. |
V = 1 |
. |
200 = 200 г. |
||||
|
ω = ? |
Общая масса раствора складывается из массы |
||||||||
|
воды и массы растворенного вещества: |
|||||||||
|
m(р-ра) = m(h3O) + m(в-ва) = 200 + 50 = 250 г. |
|||||||||
|
Теперь можно |
рассчитать |
массовую |
долю хлорида калия |
||||||
|
в растворе: |
|||||||||
|
m(KCl ) |
50 |
100% = 20%. |
|||||||
|
ω = |
·100% = |
||||||||
|
( раствора) |
250 |
||||||||
|
m |
Ответ: ω = 20%.
6
Пример 2.
|
Дано: |
Решение: |
||
|
m(р-ра) = 1кг |
Из формулы |
||
|
ω = 10% |
|||
|
m(Nh4 ) |
|||
|
V(Nh4) = ? |
ω = |
·100% |
|
|
m( раствора) |
|||
|
V(h3O) = ? |
|||
можно найти массу растворенного аммиака.
m(раствора) = 1кг = 1000 г,
|
m(Nh4) = |
m( раствора) |
= |
10 1000 |
= 100 г. |
|
100% |
100 |
Аммиак в обычных условиях находится в газообразном состоянии. Для определения объема газообразного вещества можно воспользоваться следствием из закона Авогадро, согласно которому один моль любого газа при нормальных условиях занимает объем
22,4 литра.
M(Nh4) = 17 г/моль.
1 моль Nh4 имеет массу 17 граммов и занимает объем 22,4 литра,
|
100 |
граммов ———————— |
Х литров |
||
|
Х = |
100 22,4 |
= 132 литра. |
V(Nh4) = 132 литра. |
|
|
17 |
Зная массу раствора и массу растворенного вещества, можно найти массу воды:
m(h3O) = m(раствора) − m(Nh4) = 1000 – 100 = 900 г.
Для того чтобы найти объем воды, надо использовать ее плотность ρ(h3O) = 1 г/мл:
|
V(h3O) = |
m(H 2O) |
= |
900 |
= 900 мл. |
|
(H 2O) |
1 |
|||
|
Ответ: V(Nh4) = 132 литра; |
V(h3O) = 900 мл. |
7
Пример 3. Вычислите молярность раствора, содержащего 25,4 г FeCl2 в 500 мл раствора.
|
Дано: |
Решение: |
||||
|
m(FeCl2) = 25,4 г |
Используем формулу для расчета молярной |
||||
|
концентрации |
|||||
|
V(р-ра) = 500 мл |
|||||
|
m(FeCl2 ) |
|||||
|
СМ = ? |
CM = |
. |
|||
|
M (FeCl2 ) V |
( раствора) |
||||
Молярная масса FeCl2 равна 127 г/моль.
V(р-ра) = 500 мл = 0,5 л.
25,4
CM = 1270,5 = 0,4М.
Ответ: СМ = 0,4М.
Пример 4. Вычислите нормальность 50%-ного раствора серной кислоты, плотность которого 1,5 г/мл.
|
Дано: |
Решение: |
||||
|
ω(h3SO4) = 50% |
Для расчета нормальной концентрации по |
||||
|
ρ(р-ра) = 1,5 г/мл |
формуле |
||||
|
СН = ? |
CН = |
m(h3SO4 ) |
|||
|
M э |
(h3SO4 ) V ( раствора) |
||||
надо знать массу h3SO4, молярную массу ее эквивалента и объем раствора.
1.Определим объем раствора.
Очевидно, что 50%-ному раствору серной кислоты соответствует какая-то вполне определенная нормальная концентрация, которая не зависит от количества раствора. Поэтому для выполнения расчета можно взять любое количество этого раствора. Для удобства вычислений возьмем 1 литр раствора:
V(р-ра) = 1 л = 1000 мл.
2. Определим массу h3SO4. Масса взятого раствора
m(раствора) = V(раствора) · ρ(раствора) = 1000 . 1,5 = 1500 г.
8
Из формулы для расчета массовой доли можно найти массу растворенного вещества:
|
m(h3SO4 ) |
m( р ра) |
= |
1500 50 |
= 750 г. |
|
100 |
||||
|
100% |
||||
3.
Ее можно рассчитать по формуле эквивалента сложного вещества:
|
MЭ (h3SO4 ) |
M |
98 |
49 |
г/моль. |
|
|
n z |
2 1 |
||||
4. Подставим полученные значения в исходную формулу и получим:
750 СН = 491 15,3н .
Ответ: СН = 15,3н.
Пример 5. Определите моляльную концентрацию 10%-ного раствора нитрата натрия.
|
Дано: |
Решение: |
|||||
|
ω(NaNO3) = 10% |
Для расчета моляльной |
концентрации ис- |
||||
|
Сm = ? |
пользуем формулу |
m(NaNO |
||||
|
3 ) 1000 |
||||||
|
Cm |
= |
, |
||||
|
M (NaNO3 ) |
m(h3O) |
|||||
M(NaNO3) = 85 г/моль.
Так же, как в предыдущем примере, для перехода от одного способа выражения концентрации раствора к другому можно взять любое количество этого раствора. В данном случае удобно взять 100 граммов раствора.
Так как ω(NaNO3) = 10%, то по определению процентной концентрации можно сказать, что в 100 граммах раствора содержится 10 граммов NaNO3 и 90 граммов воды, то есть
m(NaNO3) = 10 г, m(h3O) = 90 г.
|
Подставим эти значения в исходную формулу. |
|||
|
Cm = |
m(NaNO3 ) 1000 |
10 1000 |
0,13моль / кг . |
|
M (NaNO3 ) m(h3O) |
85 90 |
||
Ответ: Cm = 0,13 моль/кг.
9
Пример 6. Моляльная концентрация раствора карбоната калия 0,2 моль/кг.
|
Дано: |
Решение: |
|||
|
Сm(K2CO3) = 0,2 моль/кг |
Для расчета массовой доли соли ис- |
|||
|
ω(K2CO3) = ? |
пользуем формулу |
|||
|
ω = |
m(K2CO3 ) |
·100%. |
||
|
m( раствора) |
По определению моляльной концентрации можно сказать, что в данном растворе в 1000 граммах воды растворено 0,2 моля K2CO3.
М(K2CO3) = 138 г/моль.
1моль K2CO3 имеет массу 138 граммов,
0,2 моля K2CO3 ———— Х граммов
|
X |
0,2 138 |
27,6 |
г. |
Значит, m(K2CO3) = 27,6 г. |
|
|
1 |
|||||
Масса раствора складывается из массы воды и массы растворенного вещества:
m(р-ра) = m(h3O) + m(K2CO3) = 1000 + 27,6 = 1027,6 г.
Подставим полученные значения в исходную формулу:
|
ω = |
m(K2CO3 ) |
·100% = |
27,6 |
100 = 2,69%. |
||
|
m( раствора) |
1027,6 |
|||||
Ответ: ω = 2,69%.
10
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
16.
06.2021471.62 Кб0Operacni_navod_Cerklazni_system_RUS_final_2016.02.11.pdf
- #
16.06.20217.94 Mб0Posobie_Dezhuranta-2014_Rekomendatsii_Dlya_Prak.pdf
- #
16.06.20211.36 Mб0АНАЛИЗ ОСНОВНЫХ ЭЛЕМЕНТОВ ФИКСАЦИИ АППАРАТА.pdf
- #
16.06.2021575.31 Кб0Анафилактический шок.pdf
- #
16.06.2021726.49 Кб3Желтухи.pdf
- #
16.06.2021614.58 Кб3Концентрация растворов.pdf
- #
16.06.2021504.93 Кб2Ликвор-q.pdf
- #
16.06.20211.26 Mб30Оценочные и прогностические шкалы в МКС.pdf
- #
16.06.20212.54 Mб9СОВЕРШЕНСТВОВАНИЕ МЕДИЦИНСКОЙ СОРТИРОВКИ РАНЕНЫХ НА ПЕРЕДОВЫХ ЭТАПАХ МЕДИЦИНСКОЙ ЭВАКУАЦИИ.pdf
- #
16.06.
20216.16 Mб43Судебно-медицинская травматология.pdf
- #
16.06.20212.02 Mб12Членовредительство.pdf
Как найти массу раствора вещества формула. Вычисление массы растворенного вещества или массы растворителя, которые следует взять для получения раствора определенной концентрации. Расчеты концентрации растворенных веществ в растворах
Задача.
Вычислить
массу соли и воды, необходимые для
приготовления 40 г раствора NаСl
с массовой долей 5%.
1.
Запишите условие задачи с помощью
общепринятых обозначений
m р-ра
= 40г
1. Рассчитайте
массу растворенного вещества по формуле:
m в-ва =
ω ∙
m р-ра /100%
m
(NаСl)
= 5% · 40г/100% = 2г
2. Найдите массу
воды по разности между массой раствора
и массой растворенного вещества:
m р-ля
= m р-ра
– m в-ва
m
(Н 2 О)
= 40г – 2г = 38 г.
3.
Запишите
ответ.
Ответ: для
приготовления раствора необходимо
взять 2г соли и 38г воды.
Алгоритм нахождения массовой доли растворенного вещества при разбавлении (упаривании) раствора
Задача
m р-ра1 =80г
m(Н 2 О)
= 30г
1. В результате
разбавления (упаривания) раствора масса
раствора увеличилась (уменьшилась), а
вещества в нём осталось столько же.
Рассчитайте массу
растворённого вещества, преобразуя
формулу:
ω = m в-ва
/m р-ра
∙ 100%
m в-ва
= ω 1 ·
m р-ра1
/100%
m
в-ва
= 15% · 80г = 12г
2. При разбавлении
раствора общая масса его увеличивается
(при упаривании — уменьшается).
Найдите массу
вновь полученного раствора:
m
р-ра2
= m
р-ра1 +
m(H 2 O)
m р-ра2
= 80г + 30г=110г
3. Рассчитайте
массовую долю растворённого вещества
в новом растворе:
ω 2
= m в-ва /
m р-ра2
∙ 100%
ω 2
= 12г/ 110г· 100% = 10,9%
4. Запишите ответ
Ответ:
массовая доля растворенного вещества
в растворе при разбавлении равна 10,9%
Алгоритм решения задач по «правилу креста»
Для получения
раствора с заданной массовой долей (%)
растворенного вещества путем смешивания
двух растворов с известной массовой
долей растворенного вещества пользуются
диагональной схемой («правило креста»).
Сущность этого
метода состоит в том, что по диагонали
из большей величины массовой доли
растворенного вещества вычитают меньшую.
Разности (с-в) и
(а-с) показывают, в каких соотношениях
нужно взять растворы а и в, чтобы получить
раствор с.
Если
для разбавления в качестве исходного
раствора используют чистый растворитель,
например, Н 2 0,
то концентрация его принимается за 0 и
записывается с левой стороны диагональной
схемы.
Задача
Для
обработки рук хирурга, ран, послеоперационного
поля используется йодная настойка с
массовой долей 5%. В каком массовом
соотношении нужно смешать растворы с
массовыми долями йода 2,5% и 30%, чтобы
получить 330 г йодной настойки с массовой
долей йода 5%?
1. Запишите условие
задачи с помощью общепринятых обозначений.
1. Составьте
«диагональную схему». Для этого
запишите массовые доли исходных растворов
друг под другом, по левую сторону креста,
а в центре заданную массовую долю
раствора.
2.
Вычитают из бóльшей массовой доли
меньшую (30–5=25; 5–2,5=2,5) и находят результаты.
Записывают найденные
результаты с правой стороны диагональной
схемы: при возможности сокращают
полученные числа. В данном случае 25 в
десять раз больше, чем 2,5, то есть вместо
25 записывают 10, вместо 2,5 пишут 1.
Числа
(в данном случае 25 и 2,5 или 10 и 1)называют
массовыми числами. Массовые числа
показывают, в каком соотношении необходимо
взять исходные растворы, чтобы получить
раствор с массовой долей йода 5%.
3. Определите массу
30% и 2,5% раствора по формуле:
m
р-ра
= число частей · m 3 /
сумму массовых частей
m 1 (30%)
= 1· 330г /1+10 = 30г
m 2 (2,5%)
= 10 · 330г/ 1+10 = 300г
4. Запишите ответ.
Ответ:
для приготовления 330 г раствора с массовой
долей йода 5% необходимо смешать 300 г
раствора с массовой долей 2,5% и 30 г с
массовой долей 30%.
Задача 3.1.
Определите массу воды в 250 г 10%-ного раствора хлорида натрия.
Решение.
Из w = m в-ва / m р-ра
находим массу хлорида натрия:
m в-ва = w m р-ра = 0,1 250 г = 25 г NaCl
Поскольку m р-ра = m в-ва + m р-ля
, то получаем:
m(Н 2 0) = m р-ра — m в-ва = 250 г — 25 г = 225 г Н 2 0
.
Задача 3.2.
Определите массу хлороводорода в 400 мл раствора соляной кислоты с массовой долей 0,262 и плотностью 1,13 г/мл.
Решение.
Поскольку w = m в-ва / (V ρ)
, то получаем:
m в-ва = w V ρ = 0,262 400 мл 1,13 г/мл = 118 г
Задача 3.3.
К 200 г 14%-ного раствора соли добавили 80 г воды. Определите массовую долю соли в полученном растворе.
Решение.
Находим массу соли в исходном растворе:
m соли = w m р-ра = 0,14 200 г = 28 г.
Эта же масса соли осталась и в новом растворе. Находим массу нового раствора:
m р-ра = 200 г + 80 г = 280 г.
Находим массовую долю соли в полученном растворе:
w = m соли / m р-ра = 28 г / 280 г = 0,100.
Задача 3.4.
Какой объем 78%-ного раствора серной кислоты с плотностью 1,70 г/мл надо взять для приготовления 500 мл 12%-ного раствора серной кислоты с плотностью 1,08 г/мл?
Решение.
Для первого раствора имеем:
w 1 = 0,78
и ρ 1 = 1,70 г/мл
.
Для второго раствора имеем:
V 2 = 500 мл, w 2 = 0,12
и ρ 2 = 1,08 г/мл
.
Поскольку второй раствор готовим из первого добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
имеем:
m 2 = w 2 V 2 ρ 2 = 0,12 500 мл 1,08 г/мл = 64,8 г.
m 2 = 64,8 г
. Находим
объем первого раствора. Из w 1 = m 1 / (V 1 ρ 1)
имеем:
V 1 = m 1 / (w 1 ρ 1) = 64,8 г / (0,78 1,70 г/мл) = 48,9 мл.
Задача 3.5.
Какой объем 4,65%-ного раствора гидроксида натрия с плотностью 1,05 г/мл можно приготовить из 50 мл 30%-ного раствора гидроксида натрия с плотностью 1,33 г/мл?
Решение.
Для первого раствора имеем:
w 1 = 0,0465
и ρ 1 = 1,05 г/мл
.
Для второго раствора имеем:
V 2 = 50 мл
, w 2 = 0,30
и ρ 2 = 1,33 г/мл
.
Поскольку первый раствор готовим из второго добавлением воды, то массы вещества в обоих растворах одинаковы.
имеем:
m 2 = w 2 V 2 ρ 2 = 0,30 50 мл 1,33 г/мл = 19,95 г.
Масса вещества в первом растворе также равна m 2 = 19,95 г
.
Находим объем первого раствора. Из w 1 = m 1 / (V 1 ρ 1)
имеем:
V 1 = m 1 / (w 1 ρ 1) = 19,95 г / (0,0465 1,05 г/мл) = 409 мл
.
Коэффициент растворимости (растворимость) — максимальная масса вещества, растворимая в 100 г воды при данной температуре. Насыщенный раствор — это раствор вещества, который находится в равновесии с имеющимся осадком этого вещества.
Задача 3.6.
Коэффициент растворимости хлората калия при 25 °С равен 8,6 г. Определите массовую долю этой соли в насыщенном растворе при 25 °С.
Решение.
В 100 г воды растворилось 8,6 г соли.
Масса раствора равна:
m р-ра = m воды + m соли = 100 г + 8,6 г = 108,6 г
,
а массовая доля соли в растворе равна:
w = m соли / m р-ра = 8,6 г / 108,6 г = 0,0792
.
Задача 3.7.
Массовая доля соли в насыщенном при 20 °С растворе хлорида калия равна 0,256. Определите растворимость этой соли в 100 г воды.
Решение.
Пусть растворимость соли равна х
г в 100 г воды.
Тогда масса раствора равна:
m р-ра = m воды + m соли = (х + 100) г
,
а массовая доля равна:
w = m соли / m р-ра = х / (100 + х) = 0,256
.
Отсюда
х = 25,6 + 0,256х; 0,744х = 25,6; х = 34,4 г
на 100 г воды.
Молярная концентрация с
— отношение количества растворенного вещества v (моль)
к объему раствора V (в литрах)
, с = v(моль) / V(л)
, с = m в-ва / (М V(л))
.
Молярная концентрация показывает число моль вещества в 1 л раствора: если раствор децимолярный (с = 0,1 М = 0,1 моль/л
) значит, что в 1 л раствора содержится 0,1 моль вещества.
Задача 3.8.
Определите массу КОН, необходимую для приготовления 4 л 2 М раствора.
Решение.
Для растворов с молярной концентрацией имеем:
с = m / (М V)
,
где с
— молярная концентрация,
m
— масса вещества,
М
— молярная масса вещества,
V
— объем раствора в литрах.
Отсюда
m = с М V(л) = 2 моль/л 56 г/моль 4 л = 448 г КОН
.
Задача 3.9.
Сколько мл 98%-ного раствора Н 2 SO 4 (ρ = 1,84 г/мл) необходимо взять для приготовления 1500 мл 0,25 М раствора?
Решение. Задача на разбавление раствора. Для концентрированного раствора имеем:
w 1 = m 1 / (V 1 (мл) ρ 1)
.
Необходимо найти объем этого раствора V 1 (мл) = m 1 / (w 1 ρ 1)
.
Поскольку разбавленный раствор готовится из концентрированного смешиванием последнего с водой, то масса вещества в этих двух растворах будет одинакова.
Для разбавленного раствора имеем:
с 2 = m 2 / (М V 2 (л))
и m 2 = с 2 М V 2 (л)
.
Найденное значение массы подставляем в выражение для объема концентрированного раствора и проводим необходимые вычисления:
V 1 (мл) = m / (w 1 ρ 1) = (с 2 М V 2) / (w 1 ρ 1) = (0,25 моль/л 98 г/моль 1,5 л) / (0,98 1,84 г/мл) = 20,4 мл
.
Решение задач на разбавление растворов особой
сложности не представляет, однако требует
внимательности и некоторого напряжения.
менее можно упростить решение этих задач,
используя закон разбавления, которым пользуются
в аналитической химии при титровании растворов.
Во всех задачниках по химии показаны решения
задач, представленных как образец решения, и во
всех решениях используется закон разбавления,
принцип которого состоит в том, что количество
растворенного вещества и масса m
в исходном и разбавленном
растворах остаются неизменными. Когда мы решаем
задачу, то это условие держим в уме, а расчет
записываем по частям и постепенно, шаг за шагом,
приближаемся к конечному результату.
Рассмотрим проблему решения задач на
разбавление, исходя из следующих соображений.
Количество растворенного вещества :
= c
V
,
где c
– молярная концентрация
растворенного вещества в моль/л, V
– объем
раствора в л.
Масса растворенного вещества m
(р.в.):
m(р. в.) = m
(р-ра) ,
где m
(р-ра) – масса раствора в г, – массовая доля
растворенного вещества.
Обозначим в исходном (или неразбавленном)
растворе величины c
, V
, m
(р-ра), через с
1 , V
1 ,
m
1 (р-ра), 1 ,
а в разбавленном растворе – через с
2 , V
2 ,
m
2 (р-ра), 2 .
Составим уравнения разбавления растворов. Левые
части уравнений отведем для исходных
(неразбавленных) растворов, а правые части – для
разбавленных растворов.
Неизменность количества растворенного вещества
при разбавлении будет иметь вид:
Сохранение массы m
(р. в.):
Количество растворенного вещества связано с его массой m
(р. в.) cоотношением:
= m
(р.
в.)/M
(р. в.),
где M
(р. в.) – молярная масса растворенного
вещества в г/моль.
Уравнения разбавления (1) и (2) связаны между собой
следующим образом:
с 1 V
1 = m
2 (р-ра) 2 /M
(р. в.),
m 1 (р-ра) 1 = с
2 V
2 M
(р.
в.).
Если в задаче известен объем растворенного
газа V
(газа), то его количество вещества связано с объемом
газа (н.
= V
(газа)/22,4.
Уравнения разбавления примут соответственно
вид:
V(газа)/22,4 = с
2 V
2 ,
V(газа)/22,4 = m
2 (р-ра) 2 /M
(газа).
Если в задаче известны масса вещества или
количество вещества, взятого для приготовления
раствора, то в левой части уравнения разбавления
ставится m
(р. в.) или , в зависимости от условия задачи.
Если по условию задачи требуется объединить
растворы разной концентрации одного и того же
вещества, то в левой части уравнения массы
растворенных веществ суммируются.
Довольно часто в задачах используется плотность
раствора (г/мл). Но
поскольку молярная концентрация с
измеряется в моль/л, то и плотность следует
выражать в г/л, а объем V
– в л.
Приведем примеры решения «образцовых» задач.
Задача 1.
Какой
объем 1М раствора серной кислоты надо взять,
чтобы получить 0,5 л 0,1М
H 2 SO 4 ?
Дано:
с 1 = 1 моль/л,
V
2 = 0,5 л,
с
2 = 0,1 моль/л.
Найти:
Решение
V 1 с
1 = V
2 с
2 ,
V 1 1 = 0,5 0,1; V
1 = 0,05 л,
или 50 мл.
Ответ.
V
1 = 50 мл.
Задача 2
(,
№ 4.23). Определите массу раствора с массовой
долей
(СuSО 4)
10% и массу воды, которые потребуются для
приготовления раствора массой 500 г с массовой
долей
(СuSО 4) 2%.
Дано:
1 = 0,1,
m
2 (р-ра) = 500 г,
2 = 0,02.
Найти:
m
1 (р-ра) = ?
m
(H 2 O) = ?
Решение
m 1 (р-ра) 1 = m
2 (р-ра) 2 ,
m 1 (р-ра) 0,1 = 500 0,02.
Отсюда m
1 (р-ра) = 100 г.
Найдем массу добавляемой воды:
m(H 2 O) = m
2 (р-ра) – m
1 (р-ра),
m(H 2 O) = 500 – 100 = 400 г.
Ответ.
m
1 (р-ра) = 100 г, m
(H 2 O)
= 400 г.
Задача 3
(,
№ 4.37). Какой объем раствора с массовой долей
серной кислоты 9,3%
( = 1,05 г/мл)
потребуется для приготовления 0,35М
раствора
H 2 SO 4
объемом 40 мл?
Дано:
1 = 0,093,
1 = 1050 г/л,
с
2 = 0,35 моль/л,
V
2 = 0,04 л,
М
(H 2 SO 4) = 98 г/моль.
Найти:
Решение
m 1 (р-ра) 1 = V
2 с
2 М
(H 2 SO 4),
V 1 1 1
= V
2 с
2 М
(H 2 SO 4).
Подставляем значения известных величин:
V 1 1050 0,093 = 0,04 0,35 98.
Отсюда V
1 = 0,01405 л, или 14,05 мл.
Ответ.
V
1 = 14,05 мл.
Задача 4
. Какой
объем хлороводорода (н.у.) и воды потребуется,
чтобы приготовить 1 л раствора ( = 1,05 г/см 3), в котором
содержание хлороводорода в массовых долях равно
0,1
(или 10%)?
Дано:
V(р-ра) = 1 л,
(р-ра) = 1050 г/л,
= 0,1,
М
(HCl) = 36,5 г/моль.
Найти:
V
(HCl) = ?
m
(H 2 O) = ?
Решение
V(HCl)/22,4 = m
(р-ра) /М
(HCl),
V(HCl)/22,4 = V
(р-ра) (р-ра) /М
(HCl),
V(HCl)/22,4 = 1 1050 0,1/36,5.
Отсюда V
(HCl) = 64,44 л.
Найдем массу добавляемой воды:
m(H 2 O) = m
(р-ра) – m
(HСl),
m(H 2 O) = V
(р-ра) (р-ра) – V
(HCl)/22,4 М
(HCl),
m(H 2 O) = 1 1050 – 64,44/22,4 36,5 = 945 г.
Ответ.
64,44 л HCl и 945 г воды.
Задача 5
(,
№ 4.34). Определите молярную концентрацию
раствора с массовой долей гидроксида натрия 0,2 и
плотностью 1,22 г/мл.
Дано:
0,2,
= 1220 г/л,
М
(NaOH) = 40 г/моль.
Найти:
Решение
m(р-ра) = с
V
М
(NaOH),
m(р-ра) = с
m
(р-ра) М
(NaOH)/.
Разделим обе части уравнения на m
(р-ра) и
подставим численные значения величин.
0,2 = c
40/1220.
Отсюда c
= 6,1 моль/л.
Ответ.
c
= 6,1 моль/л.
Задача 6
(,
№ 4.30). Определите молярную концентрацию
раствора, полученного при растворении сульфата
натрия массой 42,6 г в воде массой 300 г, если
плотность полученного раствора равна 1,12 г/мл.
Дано:
m(Na 2 SO 4) = 42,6 г,
m
(H 2 O) = 300 г,
= 1120 г/л,
M
(Na 2 SO 4) = 142 г/моль.
Найти:
Решение
m(Na 2 SO 4) = с
V
М
(Na 2 SO 4).
500 (1 – 4,5/(4,5 + 100)) = m
1 (р-ра) (1 –
4,1/(4,1 + 100)).
Отсюда m
1 (р-ра) = 104,1/104,5 500 = 498,09 г,
m(NaF) = 500 – 498,09 = 1,91 г.
Ответ.
m
(NaF) = 1,91 г.
ЛИТЕРАТУРА
1. Хомченко Г.П., Хомченко И.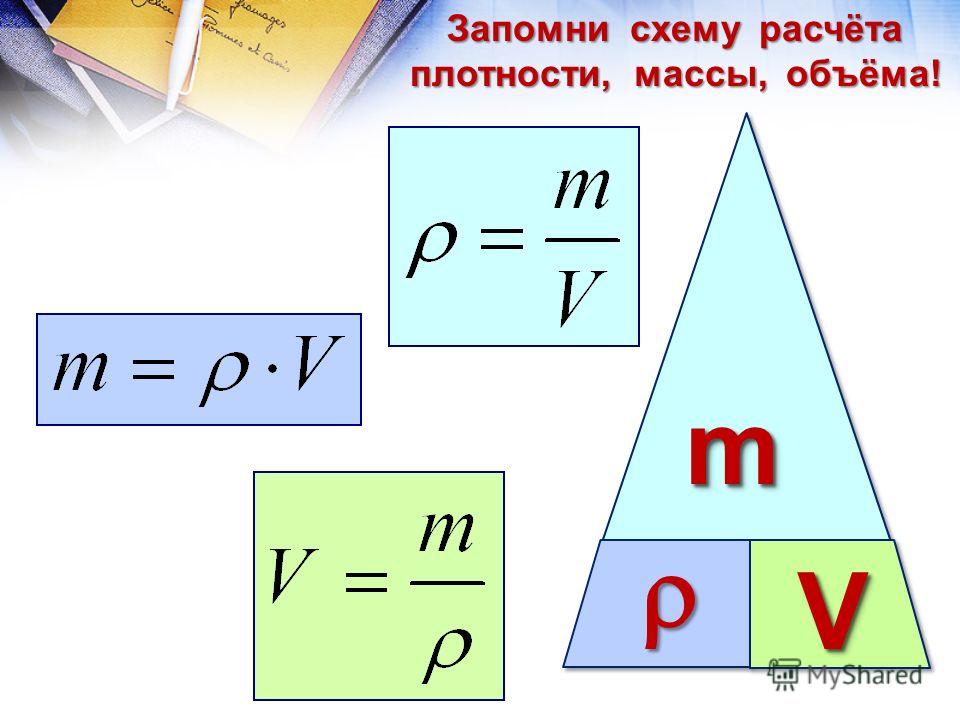
Задачи по химии
для поступающих в вузы. М.: Новая волна, 2002.
2. Фельдман Ф.Г., Рудзитис Г.Е.
Химия-9. М.:
Просвещение, 1990, с. 166.
Задача 3.
5 г поваренной соли (NаС1) растворили в некотором количестве воды. В результате получили 4%-ный раствор NаС1 в воде. Определить массу использованной воды.
Дано:
масса поваренной соли: mNaСl) = 5 г;
массовая доля NаС1 в полученном растворе: NаС1) = 4%.
Найти:
массу использованной воды.
Решение:
Эту задачу можно решить двумя способами: с использованием формулы и пропорции.
I способ:
Подставляем данные из условия в первую формулу и находим массу раствора.
II способ:
Схематично алгоритм решения можно представить следующим образом:
Массовая доля воды в растворе равна: 100% — 4% = 96%.
Так как в растворе содержится 5 г соли, которые составляют 4%, можно составить пропорцию:
5 г составляют 4%
х г составляют 96%
Ответ:
mводы = 120г.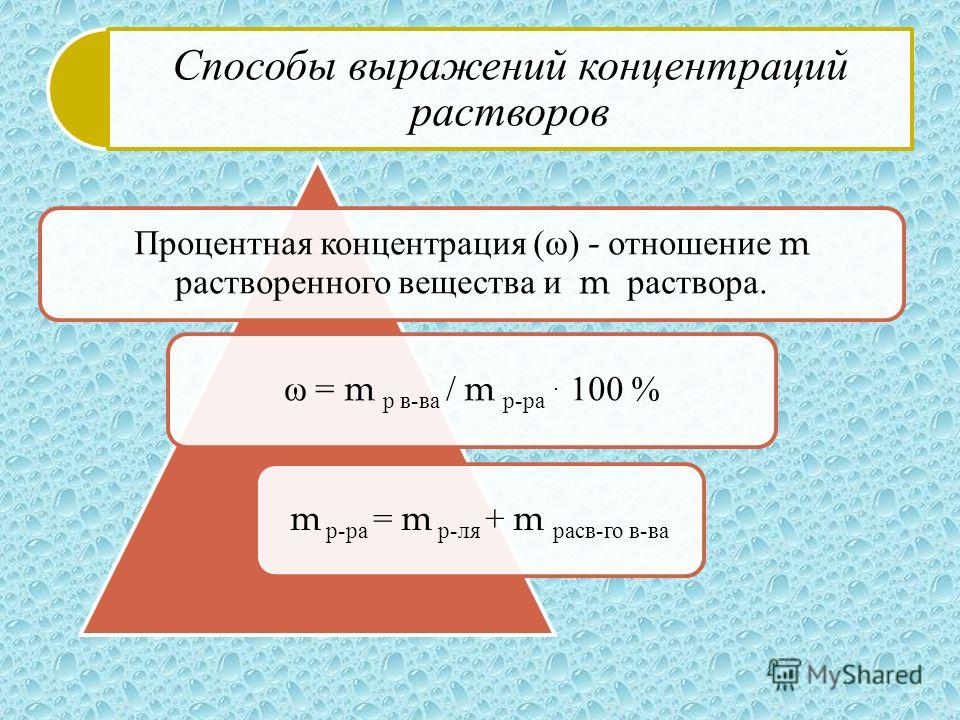
Задача 4.
Некоторое количество чистой серной кислоты растворили в 70 г воды. В результате получили 10%-ный раствор Н 2 SO 4 . Определить массу использованной серной кислоты.
Дано:
масса воды: m(Н 2 О) = 70 г;
массовая доля Н 2 SО 4 в полученном растворе: Н 2 SО 4) = 10%.
Найти:
массу использованной серной кислоты.
Решение:
Здесь также возможно использование и соотношения, и пропорции.
I способ:
Подставим последнее выражение в соотношение для массовой доли:
Подставляем данные из условия в полученную формулу:
Получили одно уравнение с одним неизвестным Решая его, находим массу использованной серной кислоты:
II способ:
Схематично алгоритм решения можно представить следующим образом:
Применим предложенный алгоритм.
m(Н 2 О) = 100% – (Н 2 SО 4) = 100% – 10% = 90%
Составляем пропорцию:
70 г составляют 90%
х г составляют 10%
Ответ:
m(H 2 SO 4) = 7,8 г.
Задача 5.
Некоторое количество сахара растворили в воде. В результате получили 2 л 30%-ного раствора (р = 1,127 г/мл). Определить массу растворенного сахара и объем использованной воды.
Дано:
объем раствора: V р-ра = 2 л;
массовая доля сахара в растворе: (сахара) = 30%;
плотность раствора: р
р-ра =1,127 г/мл
Найти:
массу растворенного сахара; объем использованной воды.
Решение:
Схематично алгоритм решения можно представить следующим образом.
Вычисление массы раствора определенной концентрации по массе растворенного вещества или растворителя.
Вычисление массы растворенного вещества или растворителя по массе раствора и его концентрации.
Вычисление массовой доли (в процентах) растворенного вещества.
Примеры типовых задач по расчету массовой доли (в процентах) растворенного вещества.
Процентная концентрация.
Массовая доля (в процентах) или процентная концентрация (ω)
– показывает число грамм растворенного вещества, содержащееся в 100 граммах раствора.
Процентная концентрация или массовая доля есть отношение массы растворенного вещества к массе раствора.
ω = mраств. в-ва
·100%
(1),
m р-ра
где ω – процентная концентрация (%),
m раств. в-ва – масса растворенного вещества (г),
m р-ра – масса раствора (г).
Массовая доля измеряется в долях единицы и используется в промежуточных расчетах. Если массовую долю умножить на 100 % получится процентная концентрация, которая используется, когда выдается конечный результат.
Масса раствора складывается из массы растворенного вещества и массы растворителя:
m р-ра = m р-ля + m раств. в-ва (2),
где m р-ра – масса раствора (г),
m р-ля – масса растворителя (г),
m раств. в-ва – масса растворенного вещества (г).
Например, если массовая доля растворенного вещества – серной кислоты в воде равна 0,05, то процентная концентрация составляет 5%. Это означает, что в растворе серной кислоты массой 100 г содержится серная кислота массой 5 г, а масса растворителя составляет 95г.
ПРИМЕР 1
. Вычислить процентное содержание кристаллогидрата и безводной соли, если в 450 г воды растворили 50 г CuSO 4 ·5H 2 O.
РЕШЕНИЕ
:
1)Общая масса раствора составляет 450 + 50 = 500 г.
2)Процентное содержание кристаллогидрата находим по формуле (1):
Х = 50 100 / 500 = 10 %
3)Рассчитаем массу безводной соли CuSO 4 , содержащуюся в 50 г кристаллогидрата:
4)Рассчитаем молярную массу CuSO 4 ·5H 2 O и безводной CuSO 4
M CuSO4 · 5h3O = M Cu + M s +4M o + 5M h3O = 64 + 32 + 4·16 + 5·18 = 250 г/моль
М CuSO4 = M Cu + M s + 4M o = 64 + 32 + 4·16 = 160 г/моль
5)В 250 г CuSO 4 ·5H 2 O содержится 160 г CuSO 4
А в 50 г CuSO 4 ·5Н 2 О — Х г СuSO 4
Х = 50·160 / 250 = 32 г.
6)Процентное содержание безводной соли сульфата меди составит:
ω = 32·100 / 500 = 6,4 %
ОТВЕТ
:
ω СuSO4 · 5h3O = 10 %, ω CuSO4 = 6,4 %.
ПРИМЕР 2
.
Сколько грамм соли и воды содержится в 800 г 12 %-ного раствора NaNO 3 ?
РЕШЕНИЕ:
1)Найдем массу растворенного вещества в 800 г 12 %-ного раствора NaNO 3:
800·12 /100 = 96 г
2)Масса растворителя составит: 800 –96 = 704 г.
ОТВЕТ:
Масса HNO 3 = 96 г, масса H 2 O = 704 г.
ПРИМЕР 3
.
Сколько грамм 3 %-ного раствора MgSO 4 можно приготовить из 100 г MgSO 4 7H 2 O?
РЕШЕНИЕ
:
1)Рассчитаем молярную массу MgSO 4 ·7H 2 O иMgSO 4
M MgSO4 · 7h3O = 24 + 32 + 4·16 + 7·18 = 246 г/моль
M MgSO4 = 24 + 32 + 4·16 = 120 г/моль
2)В 246 г MgSO 4 ·7H 2 O содержится 120 г MgSO 4
В 100 г MgSO 4 ·7H 2 O содержится Х г MgSO 4
Х = 100·120 / 246 = 48,78 г
3)По условию задачи масса безводной соли составляет 3 %. Отсюда:
3 % массы раствора составляют 48,78 г
100 % массы раствора составляют Х г
Х = 100·48,78 / 3 = 1626 г
ОТВЕТ
:
масса приготовленного раствора будет составлять 1626 грамм.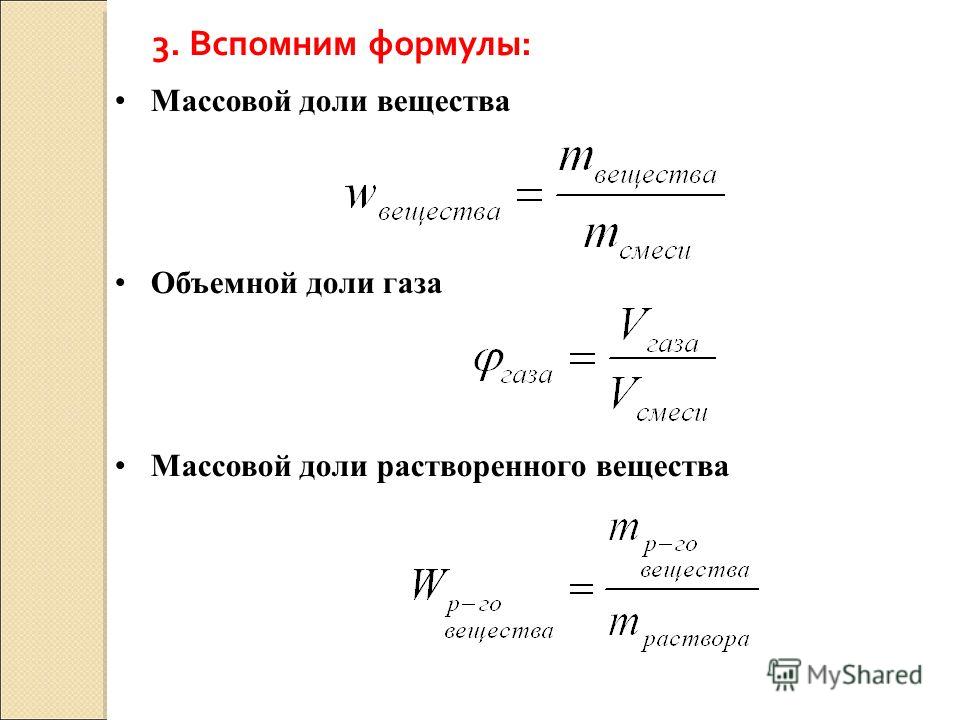
ПРИМЕР 4.
Сколько грамм НС1 следует растворить в 250 г воды для получения 10 %-ного раствора НС1?
РЕШЕНИЕ:
250 г воды составляют 100 – 10 =90 % массы раствора, тогда масса НС1 составляет 250·10 / 90 = 27,7 г НС1.
ОТВЕТ
: Масса HCl составляет 27,7 г.
Приготовление титрованных растворов. Расчеты при приготовлении растворов молярной и нормальной концентрации
Определите, что вам известно и что нет.
В химии разведение означает обычно получение небольшого количества раствора известной концентрации, с последующим его разбавлением нейтральной жидкостью (например водой) и получением, таким образом, менее концентрированного раствора большего объема. Эта операция очень часто применяется в химических лабораториях, поэтому в них реагенты хранятся для удобства в концентрированном виде и разбавляются при необходимости. На практике, как правило, вам известна начальная концентрация, а также концентрация и объем раствора, который вы хотите получить; при этом неизвестен объем концентрированного раствора, который необходимо разбавить.
- В другой ситуации, например при решении школьной задачи по химии, в качестве неизвестной может выступать другая величина: к примеру, вам даны начальный объем и концентрация, и требуется найти конечную концентрацию итогового раствора при его известном объеме. В любом случае полезно выписать известные и неизвестные величины, прежде чем приступать к задаче.
- Рассмотрим пример. Пускай нам необходимо развести раствор концентрацией 5 M, чтобы получить раствор концентрацией 1 мM
. В данном случае нам известна концентрация начального раствора, а также объем и концентрация раствора, который необходимо получить; не
известен объем исходного раствора, который надо развести водой.- Помните: в химии М служит мерой концентрации, называемой также молярностью
, которая соответствует количеству молей вещества на 1 литр раствора.
- Помните: в химии М служит мерой концентрации, называемой также молярностью
Подставьте известные значения в формулу C 1 V 1 = C 2 V 2 .
В этой формуле C 1 — концентрация начального раствора, V 1 — его объем, C 2 — концентрация конечного раствора, и V 2 — его объем.
- Иногда полезно поставить вопросительный знак перед величиной, которую вы собираетесь найти.
- Вернемся к нашему примеру. Подставим в равенство известные нам значения:
- C 1 V 1 = C 2 V 2
- (5 M)V 1 = (1 мM)(1 л). Концентрации имеют разные единицы измерения. Давайте чуть подробнее остановимся на этом.
Учитывайте любое различие в единицах измерения.
Поскольку разбавление приводит к уменьшению концентрации, и нередко значительному, иногда концентрации измерены в разных единицах. Если упустить это, вы можете ошибиться с результатом на несколько порядков. Перед решением уравнения приведите все значения концентрации и объема к одинаковым единицам измерения.
- В нашем случае используются две единицы концентрации, M и мM. Переведем все в М:
- 1 мM × 1 M/1.000 мM
- = 0,001 M
.
Решим уравнение.
Когда вы привели все величины к одинаковым единицам измерения, можете решать уравнение. Для его решения почти всегда достаточно знания простых алгебраических операций.
- Для нашего примера: (5 M)V 1 = (1 мM)(1 л). Приведя все к одинаковым единицам, решим уравнение относительно V 1 .
- (5 M)V 1 = (0,001 M)(1 л)
- V 1 = (0,001 M)(1 л)/(5 M).
- V 1 = 0,0002 л, или 0.2 мл.
Подумайте о применении полученного результата на практике.
Допустим, вы вычислили искомую величину, но все еще затрудняетесь приготовить реальный раствор. Такая ситуация вполне понятна — язык математики и чистой науки иногда далек от реального мира. Если вам уже известны все четыре величины, входящие в уравнение C 1 V 1 = C 2 V 2 , поступите следующим образом:
- Измерьте объем V 1 раствора концентрацией C 1 . Затем долейте разводящую жидкость (воду и т.п.), чтобы объем раствора стал равен V 2 . Этот новый раствор и будет обладать необходимой концентрацией (C 2).
- В нашем примере мы сначала отмеряем 0,2 мл исходного раствора концентрацией 5 M. Затем разводим его водой до объема 1 л: 1 л — 0,0002 л = 0,9998 л, т.е. добавляем к нему 999,8 мл воды. Получившийся раствор будет иметь необходимую нам концентрацию 1 мM.
Для приготовления растворов молярной и нормальной концентрации навеску вещества отвешивают на аналитических весах, а растворы готовятся в мерной колбе. При приготовлении растворов кислот нужный объем концентрированного раствора кислоты отмеряют бюреткой со стеклянным краном.
Навеска растворяемого вещества подсчитывается с точностью до четвертого десятичного знака, а молекулярные массы берутся с точностью, с которой они приведены в справочных таблицах. Объем концентрированной.кислоты подсчитывается с точностью до второго десятичного знака.
Пример 1. Сколько граммов хлорида бария необходимо для приготовления 2 л 0,2 М раствора?
Решение.
Молекулярная масса хлорида бария равна 208,27. Следовательно.
Пример 2. Сколько граммов безводной соды Na 2 C0 3 потребуется для приготовления 500 мл 0,1 н. раствора?
Решение.
Молекулярная масса соды равна 106,004; эквивалент-пая масса 5 N a 2 C0 3 =М: 2 = 53,002; 0,1 экв. = 5,3002 г.
1000 мл 0,1 н. раствора содержат 5,3002 г Na 2 C0 3
500 »» » » » х
» Na 2 C0 3
5,3002-500
х=——
Гооо—- = 2-6501 г Na 2 C0 3 .
Пример 3. Сколько концентрированной серной кислоты (96%: d=l,84) требуется для приготовления 2 л 0,05 н. раствора серной кислоты?
Решение.
Молекулярная масса серной кислоты равна 98,08. Эквивалентная масса серной кислоты 3h 2 so 4 =М: 2=98,08: 2 = 49,04 г. Масса 0,05 экв. = 49,04-0,05 = 2,452 г.
Найдем, сколько H 2 S0 4 должно содержаться в 2 л 0,05 н. раствора:
1 л-2,452 г H 2 S0 4
2 »- х
» H 2 S0 4
х
= 2,452-2 = 4,904 г H 2 S0 4 .
ЧтобА определить, сколько для этого надо взять 96,% раствора H 2 S0 4 , составим пропорцию:
в 100 г конц. H 2 S0 4 -96 г H 2 S0 4
У
» » H 2 S0 4 -4,904 г H 2 S0 4
4,904-100
У
=——— §6—— = 5,11 г H 2 S0 4 .
Пересчитываем это количество на объем: ,. Р
5,11
К = 7 = ТЖ = 2 ‘ 77 мл —
Таким образом, для приготовления 2 л 0,05 н. раствора надо взять 2,77 мл концентрированной серной кислоты.
Пример 4. Вычислить титр раствора NaOH, если известно что его точная концентрация равна 0,0520 н.
Решение.
Напомним, что титром называется содержание в 1 мл раствора вещества в граммах. Эквивалентная масса NaOH=40 01 г Найдем, сколько граммов NaOH содержится в 1 л данного раствора:
40,01-0,0520 = 2,0805 г.
1итр раствора: -щ=- =0,00208 г/мл. Можно воспользоваться также формулой:
9
N
где Т
— титр, г/мл; Э
— эквивалентная масса; N —
нормальность раствора.
Тогда титр данного раствора:
ф
40,01 0,0520
«NaOH =——— jooo—— 0,00208 г/мл.
„ «Р ие Р 5 — Вычислить нормальную концентрацию раствора HN0 3 , если известно, что титр данного раствора равен 0,0065 Для расчета воспользуемся формулой:
Т ■
1000 63,05
5hno 3 = j- = 63,05.
Нормальная концентрация раствора азотной кислоты равна:
— V = 63,05 = 0,1030 н.
Пример 6. Какова нормальная концентрация раствора, если известно, что в 200 мл этого раствора содержится 2,6501 г Na 2 C0 3
Решение.
Как было вычислено в примере 2, Зма 2 со(=53,002.
Найдем, сколько эквивалентов составляет 2,6501 г Na 2 C0 3: Г
2,6501: 53,002 = 0,05 экв. /
Для того чтобы вычислить нормальную концентрацию раствора, составим пропорцию:
1000 » » х »
1000-0,05
х =
—————— =0,25 экв.
В 1 л данного раствора будет содержаться 0,25 эквивалентов, т. е. раствор будет 0,25 н.
Для такого расчета можно воспользоваться формулой:
Р-
1000
где Р
— количество вещества в граммах; Э
— эквивалентная масса вещества; V
— объем раствора в миллилитрах.
Зыа 2 со 3 =53,002, тогда нормальная концентрация данного раствора
2,6501-10С0
N = 53,002-200
Солевой раствор может понадобится для самых разных целей, например, он входит в состав некоторых средств народной медицины. Так как приготовить 1-процентный раствор, если дома нет специальных мензурок для измерения количества продукта? В целом даже и без них можно сделать 1-процентный раствор соли. Как приготовить его, подробно рассказано далее. Прежде чем приступать к приготовлению такого раствора, следует внимательно изучить рецепт и точно определиться с необходимыми ингредиентами. Все дело в том, что определение «соль» может относиться к разным веществам. Иногда это оказывается обычная пищевая соль, иногда каменная или и вовсе хлорид натрия. Как правило, в подробном рецепте всегда удается отыскать пояснение того, какое именно вещество рекомендуется использовать. В народных рецептах нередко указывается также сульфат магния, которые имеет второе название «английская соль».
Если вещество требуется, например, для полоскания горла или снятия боли с зуба, то чаще всего в таком случае рекомендуется применять именно солевой раствор хлорида натрия. Чтобы полученное средство обладало целебными свойствами и не нанесло вред организму человека, следует подбирать для него исключительно качественные ингредиенты. Например, каменная соль содержит много лишних примесей, поэтому вместо нее лучше использовать обычную мелкую (для полоскания можно и йодированную). Что касается воды, то в домашних условиях следует применять фильтрованную или хотя бы кипяченую. В некоторых рецептах рекомендуется использовать дождевую воду или снег. Но, учитывая современное экологическое состояние, делать этого не стоит. Особенно — жителям крупных мегаполисов. Лучше просто тщательно очистить воду из-под крана.
Если специального фильтра дома не оказалось, то можно использовать для очистки воды известный «дедовский» метод. Он подразумевает замораживание воды из-под крана в морозилке.
Теперь стоит определиться с единицами измерения жидкости и твердого вещества. Для соли удобнее всего использовать чайную ложку. Как известно, в ней помещается 7 грамм продукта, если ложечка с горкой, то 10. Последний вариант удобнее применять для высчитывания процентного соотношения. Воду отмерить легко обычным граненым стаканом, если в доме нет специальных мензурок. В нем содержится 250 миллилитров воды. Масса 250 миллилитров чистой пресной воды равна 250 граммам. Удобнее всего использовать полстакана жидкости или 100 граммов. Далее самый сложный этап приготовления солевого раствора. Стоит еще раз внимательно изучить рецепт и определиться с пропорциями.
Вполне возможно допустить некоторую погрешность и, например, в один литр воды добавить одну чайную ложку соли с горкой, чтобы получить 1-процентный солевой раствор. В настоящее время он нередко применяется, например, при лечении простудных заболеваний и особенно боли в горле. В готовый раствор можно добавить также соду или несколько капель йода. Получившаяся смесь для полоскания станет отличным действенным и эффективным средством против боли в горле. Неприятные ощущения уйдут всего после нескольких процедур. Кстати, такой раствор не запрещен для использования самым маленьким членам семьи. Главное, не переусердствовать с дополнительными ингредиентами (особенно с йодом), в противном случае можно повредить слизистую оболочку полости рта и лишь усугубить состояние больного горла.
Также солевой раствор может применяться для облегчения тянущей ноющей зубной боли. Правда, эффективнее использовать более насыщенный, например, 10-процентный. Такая смесь действительно на непродолжительное время способна снять болезненные неприятные ощущения в полости рта. Но она не является лекарственным средством, поэтому откладывать посещение стоматолога после облегчения ни в коем случае нельзя.
Приблизительные растворы.
При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного -55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000-462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5″—требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора
. Пусть с — количество раствора, m%-концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации.
Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы.
При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы.
Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы.
Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего -0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
Растворы щелочей. Едкие щелочи и их растворы активно поглощают влагу и углекислоту из воздуха, поэтому приготовление из них растворов точного титра затруднено.
Когда боек будет правильно уложен в воронке, ампуле с фиксаналом дают свободно падать, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого пробивают боковое углубление ампулы и дают содержимому вытечь. Затем, не меняя положения ампулы, ее тщательно промывают хорошо прокипяченной дистиллированной водой, остуженной до температуры 35- 40°С и взятой в таком количестве, чтобы по охлаждении раствора до 20°С надо было бы добавить до метки лишь несколько капель. Титрованный раствор щелочи следует хранить в таких условиях, которые исключают возможность его соприкосновения с воздухом.
Если же фиксанала нет, титрованные растворы приготовляют из препаратов едкого натра (или едкого кали). Молекулярная масса NaOH равна 40,01.
Чтобы приготовить 1 л 1 и. раствора NaOH, нужно взять 40 г химически чистого едкого натра, а для приготовления 1 л0,1н. раствора — в десять раз меньше, т. е. 4 г.
Для удобства расчета требуемого количества исходных веществ на приготовление 1 л титрованных растворов щелочей разной нормальности рекомендуем пользоваться данными, приведенными в таблице 31.
Таблица 31
|
Исходные химические вещества, г |
Молекулярная масса |
Грамм-эквивалент |
Нормальность раствора |
Вещества для установки титров |
||||||
|
Янтарная плп щавелевая кислота |
||||||||||
|
То же |
Чтобы приготовить 1 л 0,1 н.
После отстаивания раствор осторожно сливают (без осадка) в литровую мерную колбу и доводят дистиллированной свежепрокипяченной водой до метки.
Приготовленный раствор хорошо перемешивают и помещают в бутыль, защищенную от попадания углекислоты. После этого устанавливают титр, т. е. точную концентрацию раствора.
Титр можно устанавливать по щавелевой или янтарной кислоте. Щавелевая кислота (С г Н 2 0 4 -2Н 2 0) двухосновная, и, следовательно, ее грамм эквивалент будет равен половине молекулярной. Если молекулярная масса щавелевой кислоты равна 126,05 г, то ее грамм-эквивалент будет 126,05: 2=63,025 г.
Имеющуюся щавелевую кислоту следует один-два раза перекристаллизовать и только после этого применять для установки титра.
Перекристаллизацию проводят следующим образом: берут произвольное количество вещества, предназначенное для перекристаллизации, растворяют нагреванием, стараясь получить возможно большую концентрацию раствора или насыщенный раствор.
В зависимости от характера кристаллизации вещества насыщенный в горячем состоянии раствор охлаждают. Для быстрого охлаждения раствора при перекристаллизации кристаллизатор помещают в холодную воду, снег или лед. При медленном охлаждении раствор оставляют стоять при температуре окружающего воздуха.
Если выпали очень мелкие кристаллы, их снова растворяют, нагревая; сосуд, в котором осуществлялось растворение, сразу же обертывают в несколько слоев полотенцем, накрывают часовым стеклом и оставляют стоять в полном покое в течение 12-15 ч.
Затем кристаллы отделяют от маточного раствора, фильтруя под вакуумом (воронка Бюхнера), тщательно отжимают, промывают и подсушивают.
Приготавливая 0,1 н. раствор NaOH, необходимо иметь раствор щавелевой кислоты такой же нормальности, для этого на 1 л раствора ее нужно взять 63,025: 10=6,3025 г.
Из приготовленного раствора берут пипеткой 20 мл, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пусть на титрование пошло 22,05 мл щелочи. Как же определить ее титр и нормальность?
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0,6303 г. Следовательно, нормальность ее будет равна не точно 0,1
Чтобы вычислить нормальность щелочи, воспользуемся соотношением VN=ViNt,
т.
Чтобы вычислить титр или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр щелочи будет
Но этот титр не соответствует 0,1 н. раствору NaOH. Для этого прибегают к коэффициенту к,
т. е. отношению практического титра к теоретическому. В данном случае он будет равен
При использовании для установки титра янтарной кислоты раствор ее приготовляют в том же порядке, что и щавелевой, исходя из следующего расчета: молекулярная масса янтарной кислоты (С 4 Н 6 0 4) равна 118,05 г, но так как она двухосновная, то ее грамм-эквивалент 59,02 г.
Чтобы приготовить 1 л децинормального раствора янтарной кислоты, ее нужно взять в количестве 59,02: 10 = =5,902, а для 100 мл раствора -0,59 г.
Установка титра 0,1 н.
Вычисляем титр NaOH, т. е. содержание NaOH в 1 мл раствора. Оно равно: 0,1238: 28=0,00442. Поправка к титру NaOH равна отношению титра практического к теоретическому
Проверка нормальности раствора щелочи по титрованному раствору кислоты. В три конические колбочки отмеряют бюреткой по 20-25 мл титрованного раствора кислоты (НС1 или H 2 S0 4) и титруют раствором NaOH до изменения окраски метилоранжа.
Допустим, что на титрование трех проб по 20 мл 0,1015 н. раствора НС1 затрачено в среднем 19,50 мл раствора NaOH. Нормальность щелочи будет
Растворы кислот. В большинстве случаев в лаборатории приходится иметь дело с серной, соляной и азотной кислотами. Они находятся в виде концентрированных растворов, процентное содержание которых узнаем по плотности.
При аналитических работах используем химически чистые кислоты. Чтобы приготовить раствор той или иной кислоты, количество концентрированных кислот обычно берем по объему, вычисленному по плотности.
Например, нужно приготовить 0,1 н. раствор H 2 S0 4 . Это значит, что в 1 л раствора должно содержаться
Сколько же по объему нужно взять H 2 S0 4 с плотностью 1,84, чтобы, разбавив ее до 1 л, получить 0,1 н. раствор?
Кислота с плотностью 1,84 содержит 95,6% H 2 S0 4 . Следовательно, на 1 л раствора ее нужно взять в граммах:
Выражая массу в объемных единицах, получим
Отмерив из бюретки точно 2,8 мл кислоты, разбавляем ее до 1 л в мерной колбе, затем, титруя щелочью, проверяем нормальность.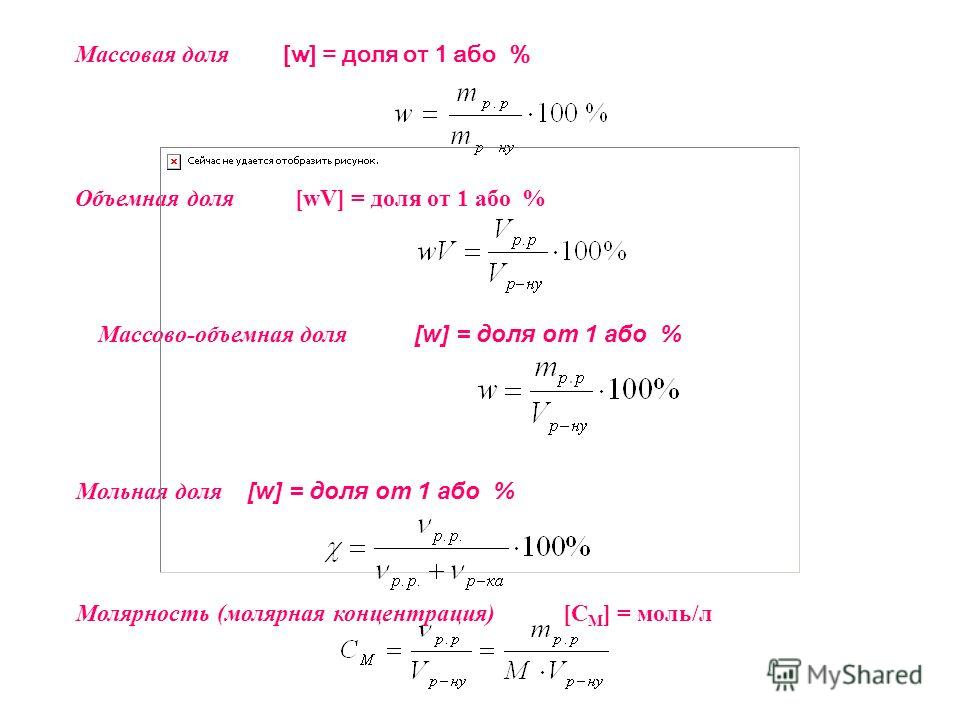
Например, при титровании установлено, что 1 мл 0,1 н. раствора H 2 S0 4 содержит не 0,0049 г H 2 S0 4 , а 0,0051 г. Для вычисления количества воды, которое нужно добавить к 1 л кислоты, составляем пропорцию:
Следовательно, в этот раствор нужно добавить 41 мл воды. Но учитывая, что от исходного раствора было взято на титрование 20 мл, что составляет 0,02, то воды нужно брать меньше, т. е. 41-(41-0,02) =41-0,8 =40,2 мл. Это количество воды и добавляем из бюретки в колбу с раствором.
Приведенная выше работа при выполнении довольно кропотлива, поэтому можно готовить приблизительно точные растворы, вводя поправочный коэффициент, который применяют в работе при каждом титровании. При этом израсходованное число миллилитров раствора умножаем на поправочный коэффициент.
Поправочный коэффициент вычисляем по формуле
где V
— объем испытуемого раствора, взятый для титрования;
k t
— поправочный коэффициент раствора щелочи известной нормальности, по которому устанавливают титр вновь приготовленного раствора кислоты;
У х — объем раствора щелочи известной нормальности, пошедший на титрование испытуемой кислоты.
Таблица 32
|
Исходные химические вещества, мл |
Молекулярная масса |
Нормальность раствора |
|||||||
|
{ |
|||||||||
|
H 2 S0 4 (плотность 1,84) |
|||||||||
|
НС1 (плотность 1,19) |
Для облегчения процесса приготовления титрованных растворов кислот предлагаем таблицу количества исходных веществ для приготовления 1 л растворов разной нормальности (табл. 32).
Необходимо иметь в виду, что при растворении кислот следует прибавлять кислоту к воде, а не наоборот.
7.15: Концентрации: массовые/объемные проценты — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 222385
Цели обучения
- Рассчитайте процент массы/объема раствора.
Как указывалось ранее, химики определили несколько типов концентраций, в каждом из которых используется отдельная химически приемлемая единица или комбинация единиц для обозначения количества растворенного вещества, растворенного в заданном количестве растворителя. В следующих абзацах будет представлено и применено уравнение , которое используется для расчета массовых/объемных процентов, что является последним типом процентной концентрации , которая будет обсуждаться в этой главе.
Уравнение процента массы/объема
массовых/объемных процента раствора определяется как отношение массы растворенного вещества, присутствующего в растворе, к объему раствора в целом. Поскольку этот тип концентрации выражается в процентах, указанную пропорцию должно быть умножено на 100, как показано ниже.
(text{Процент массы/объема}) = ( dfrac{ rm{m_{раствор} ; (rm{g})}}{rm{V_{раствор} ; ( rm{мл})}} ) × ({100})
Как обсуждалось в предыдущих двух разделах этой главы, массовые проценты и объемные проценты можно рассчитать с помощью альтернативного уравнения, в котором массы или объемы растворенного вещества и растворителя, содержащихся в растворе, добавляют соответственно для получения массы или объема, соответственно, этого раствора в целом.

Расчет процента массы/объема
Для включения в приведенное выше уравнение масса растворенного вещества должна быть выражена в граммах, объем раствора должен быть указан в миллилитрах, а химическая формула каждого компонент должен быть записан как вторичная единица в связанной с ним числовой величине. Следовательно, если какое-либо из этих измерений сообщается с использованием альтернативной единицы, его значение необходимо преобразовать в соответствующую единицу, прежде чем включать его в уравнение массовых/объемных процентов.
Во время процессов умножения и деления, которые используются для решения этого уравнения, не происходит сокращения единиц, поскольку единицы, присутствующие в числителе и знаменателе, «г» и «мл» соответственно, не совпадают друг с другом.

Наконец, поскольку массовые/объемные проценты не определяются как точные величины, их значения следует сообщать с использованием правильного количества значащих цифр. Однако «100» — это точное число, поэтому оно не влияет на значимость окончательной сообщаемой концентрации.
Упражнение (PageIndex{1})
Рассчитайте массовый/объемный процент раствора объемом 762,5 миллилитра, приготовленного путем растворения 289,15 граммов азида кальция, Ca(N 3 ) 2 , в воде.
- Ответить
- Чтобы рассчитать массовый/объемный процент раствора, каждое вещество, на которое ссылаются в задаче, должно быть сначала классифицировано как растворенное вещество или растворитель. Поскольку в данном утверждении присутствует индикаторное слово «в», химическое вещество, которое упоминается после , растворитель 9, 0 9045, вода, H в этом растворе, а оставшееся вещество, азид кальция, Ca(N 3 ) 2 , растворенное вещество «по умолчанию».
Прежде чем можно будет применить это уравнение, необходимо подтвердить достоверность единиц, связанных с заданными числовыми значениями. Как указано выше, масса растворенного вещества должна быть выражена в граммах, а объем раствора должен быть указан в миллилитрах. Таким образом, данные количества выражены в соответствующих единицах и могут быть непосредственно включены в уравнение массовых/объемных процентов, как показано ниже. Единицы массы и объема исключаются при упрощении этого уравнения, , хотя «г» и «мл» не сокращаются, математически , чтобы избежать получения единицы плотности в результате деления заданных величин. Чтобы отличить массовый/объемный процент, который рассчитывается путем упрощения отношения массы к объему , от других концентраций, основанных на процентах, единицей, в которой сообщается результирующая концентрация, является «% m/v Ca( N 3 ) 2 ». Химическая формула растворенного вещества записывается как вторичная единица расчетного количества, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.
(text{Процент массы/объема}) = ( dfrac{289,15 ; rm{g} ; rm{Ca(N_3)_2}}{762,5 ; rm{мл} ; rm{решение}}) × ({100})
(text{Процент массы/объема}) = ({37,92131… % rm{m/v} ; rm{Ca(N_3)_2}} ≈ {37,92 % rm{m/v} ;rm{Ca(N_3)_2}})
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
-
- Теги
-
-
На этой странице нет тегов.
Концентраторы | Безграничная химия |
Молярность
Молярность определяется как количество молей растворенного вещества на объем всего раствора.
Цели обучения
Расчет концентрации раствора с использованием молярности.
Ключевые выводы
Ключевые моменты
- Молярность (М) указывает количество молей растворенного вещества на литр раствора (моль/литр) и является одной из наиболее распространенных единиц, используемых для измерения концентрации раствора.
- Молярность можно использовать для расчета объема растворителя или количества растворенного вещества.
- Связь между двумя растворами с одинаковым количеством молей растворенного вещества может быть представлена формулой c 1 V 1 = c 2 V 2 , где c — концентрация, а V — объем.
Ключевые термины
- разбавление : Процесс, при котором раствор делается менее концентрированным путем добавления большего количества растворителя.
- Единица СИ : Современная форма метрической системы, широко используемой в науке (сокращенно SI от французского: Système International d’Unités).
- молярность : Концентрация вещества в растворе, выраженная в количестве молей растворенного вещества на литр раствора.
- концентрация : Относительное количество растворенного вещества в растворе.
В химии концентрацию раствора часто измеряют в молярности (М), которая представляет собой количество молей растворенного вещества на литр раствора. Эта молярная концентрация (c i ) рассчитывается путем деления количества молей растворенного вещества (n i ) на общий объем (V) из:
ci=niVtext{c}_text{i}=frac{text{n}_text{i}}{text{V} }ci=Vni
Единицей СИ для молярной концентрации является моль/м 3 . Однако моль/л является более распространенной единицей молярности. Раствор, который содержит 1 моль растворенного вещества на 1 литр раствора (1 моль/л), называется «однимолярным» или 1 М. Единица моль/л может быть преобразована в моль/м 3 с помощью следующего уравнения:
1 моль/л = 1 моль/дм 3 = 1 моль дм −3 = 1 M = 1000 моль/м 3
Расчет молярности
Чтобы рассчитать молярность раствора, количество молей растворенного вещества необходимо разделить на общее количество литров полученного раствора.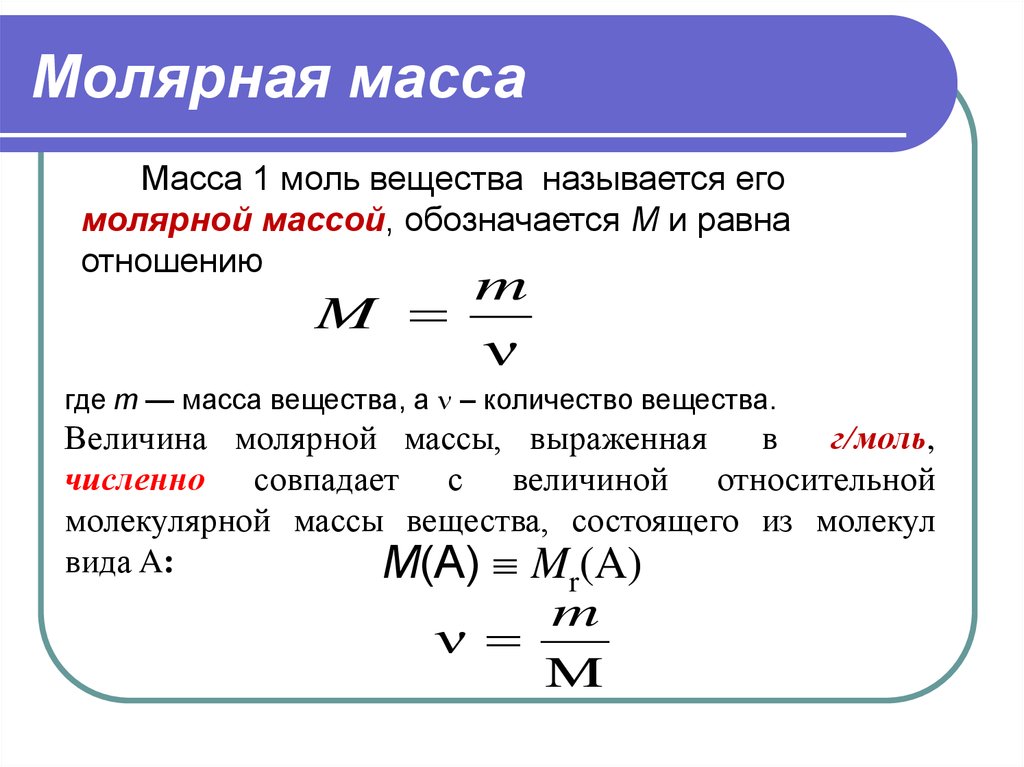
Расчет молярности по молям и объему
Если в воде (растворителе) растворить 10,0 г NaCl (растворенное вещество) и получить 2,0 л раствора, какова молярность этого раствора?
Сначала мы должны преобразовать массу NaCl в граммах в моли. Мы делаем это путем деления на молекулярную массу NaCl (58,4 г/моль).
10,0 грамм NaCl×1 моль58,4 г/моль=0,17 моль NaCl10,0 text{ грамм NaCl} times frac{text{1 моль}}{58,4 text {г/моль}} = 0,17 text { моль NaCl} 10,0 грамм NaCl×58,4 г/моль1 моль=0,17 моль NaCl
Затем мы делим количество молей на общий объем раствора, чтобы получить концентрацию.
ci=niVtext{c}_text{i}=frac{text{n}_text{i}}{text{V}}ci=Vni
ci=0,17 моль NaCl2 л растворtext{c}_text{i}=frac{0,17 text{ моль NaCl}}{2 text{ л раствор}}ci=2 л раствор 0,17 моль NaCl
ci=0,1 Mtext{c}_text{i} = 0,1 text{ M}ci=0,1 M
Раствор NaCl представляет собой 0,1M раствор.
Расчет молей с учетом молярности
Чтобы рассчитать количество молей в растворе с учетом молярности, мы умножаем молярность на общий объем раствора в литрах.
Сколько молей хлорида калия (KCl) содержится в 4,0 л 0,65 М раствора?
ci=niVtext{c}_{text{i}}=frac{text{n}_{text{i}}}{text{V}}ci=Vni
0,65 M=ni4,0 L0,65 text{M} = frac{text{n}_text{i}}{4,0 text{L}}0,65 M=4,0 Lni
ni= (0,65 М)(4,0 л)=2,6 моль KCltext{n}_text{i} = (0,65 text{ M})(4,0 text{ L}) = 2,6 text{ моль KCl}ni =(0,65 М)(4,0 л)=2,6 моль KCl
2,6 моль KCl содержится в 0,65 М растворе, который занимает 4,0 л.
Расчет объема с учетом молярности и молей
Мы также можем рассчитать объем, необходимый для удовлетворения определенной массы в граммах, учитывая молярность раствора. Это полезно для определенных растворенных веществ, которые не могут быть легко взвешены с помощью весов.
Сколько миллилитров 3,0 М раствора Bh4-ТГФ необходимо для получения 4,0 г Bh4?
Сначала мы должны перевести граммы BH 3 в моли, разделив массу на молекулярную массу.
4,0 г Bh413,84 г/моль Bh4=0,29 моль Bh4frac{4,0 text{ г }text{BH}_3 }{13,84 text{г/моль}text{BH}_3} = 0,29text{ моль }text{BH}_313,84 г/моль Bh44,0 г Bh4=0,29 моль Bh4
Зная, что нам нужно получить 0,29 моль BH 3, , мы можем использовать это и заданной молярности (3,0 М) для расчета объема, необходимого для достижения 4,0 г.
ci=niVtext{c}_{text{i}}=frac{text{n}_{text{i}}}{text{V}}ci=Vni
3,0 M=0,29 моль Bh4V3.0 text{ M} = frac{0,29 text{моль BH}_3} {text{V}}3,0 M=V0,29 моль Bh4
V=0,1L text{V} = 0,1 text{L}V=0,1 л
Теперь, когда мы знаем, что существует 4,0 г BH 3 присутствует в 0,1 л, мы знаем, что нам нужно 100 мл раствора для получения 4,0 г BH 3 .
Разбавление
Разбавление — это процесс уменьшения концентрации растворенного вещества в растворе, обычно путем добавления большего количества растворителя. Эта зависимость представлена уравнением c 1 V 1 = c 2 V 2 , где c 1 и c 2 — начальная и конечная концентрации, а V 1
Пример 1
У ученого есть 5,0 М раствор соляной кислоты (HCl), и для его нового эксперимента требуется 150,0 мл 2,0 М HCl. Сколько воды и сколько 5,0 М HCl должен использовать ученый, чтобы получить 150,0 мл 2,0 М HCl?
c 1 V 1 = c 2 V 2
c 1 и V 1 – концентрация и объем исходного раствора HCl 5. c 2 и V 2 представляют собой концентрацию и объем желаемого раствора или 150,0 мл 2,0 М раствора HCl.
(5,0 М HCl)(V1)=(2,0 М HCl)(150,0 мл)(5,0 text{М HCl})(text{V}_1) = (2,0 text{М HCl})(150,0 text{мл})(5,0 М HCl)(V1)=(2,0 М HCl)(150,0 мл)
V 1 = 60,0 мл 5,0 М HCl
Если для приготовления используется 60,0 мл 5,0 М HCl нужного раствора, можно рассчитать количество воды, необходимое для правильного разбавления раствора до нужной молярности и объема:
150,0 мл — 60,0 мл = 90,0 мл
Чтобы ученый получил 150,0 мл 2,0 М HCl, ему потребуется 60,0 мл 5,0 М HCl и 90,0 мл воды.
Пример 2
К 25 мл исходного раствора 5,0 М HBr добавляли воду до тех пор, пока общий объем раствора не составлял 2,5 л. Какова молярность нового раствора?
Нам дано следующее: c 1 = 5,0 M, V 1 = 0,025 л, V 2 = 2,50 л. разбавленный раствор.
(5,0 М)(0,025 л) = c 2 (2,50 л)
c2=(5,0 М)(0,025 л)2,50 л=0,05 Мtext{c}_2 = frac{(5,0 text {M})(0,025 text{L}) }{2,50 text{L}} =0,05 text{M}c2=2,50L(5,0M)(0,025L)=0,05M
Обратите внимание, что все единицы измерения объема были преобразованы в литры.
Моляльность
Моляльность – это свойство раствора, которое указывает количество молей растворенного вещества на килограмм растворителя.
Цели обучения
Рассчитайте моляльность раствора и объясните, как это свойство является коллигативным
Ключевые выводы
Ключевые моменты
- Моляльность — это свойство раствора, которое определяется как количество молей растворенного вещества на килограмм растворителя.
- Единицей моляльности в системе СИ является моль/кг. Раствор с моляльностью 3 моль/кг часто описывают как «3 моляль» или «3 моляль». Однако, следуя системе единиц СИ, теперь предпочтительнее использовать моль/кг или родственную единицу СИ.
- Поскольку объем раствора зависит от температуры и давления окружающей среды, масса может иметь большее значение для измерения растворов.
В этих случаях подходящей мерой является моляльность (не молярность).
Ключевые термины
- моляльность : Концентрация вещества в растворе, выраженная как количество молей растворенного вещества на килограмм растворителя.
- коллигативное свойство : Свойство растворов, которое зависит от отношения числа частиц растворенного вещества к числу молекул растворителя в растворе, а не от типа присутствующих химических соединений.
- интенсивное свойство : Свойство материи, не зависящее от количества материи.
Измерения массы (моляльности) в зависимости от объема (молярности)
Моляльность — это интенсивное свойство растворов, которое рассчитывается как количество молей растворенного вещества, деленное на килограммы растворителя. В отличие от молярности, которая зависит от объема раствора, моляльность зависит только от массы растворителя.
Определение моляльности
Моляльность b (или m) раствора определяется как количество растворенного вещества в молях, n растворенного вещества , деленное на массу растворителя в кг, m растворителя :
bMsolute=nsolutemsolvent text{bM}_{text{solute}}=frac{text{n}_{text{solute}}}{text{m}_{text{растворитель}}}bMsolute=msolvent nsolute
Моляльность основана на массе, поэтому ее можно легко преобразовать в отношение масс, обозначаемое w:
bMsolute=nsolutemsolvent=wsolutewsolventtext{bM}_{text{solute}}=frac{ text{n}_{text{растворенное}}}{text{m}_{text{растворитель}}} = frac{text{w}_{text{растворенное}}}{text {w}_{text{растворитель}}}bMsolute=msolventnsolute=wsolventwsolute
По сравнению с молярной концентрацией или массовой концентрацией приготовление раствора заданной молярности проще, поскольку для этого требуется только хороший масштаб; и растворитель, и растворенное вещество взвешиваются, а не измеряются по объему.
Раствор соленой воды : Поваренная соль легко растворяется в воде с образованием раствора. Если известны массы соли и воды, можно определить моляльность.
шт.
Единицей моляльности в СИ является моль/кг или моль растворенного вещества на кг растворителя. Раствор с молярностью 1 моль/кг часто называют «1 моляль» или «1 моль». Однако, следуя системе единиц СИ, Национальный институт стандартов и технологий, который является авторитетом США в области измерений, считает термин «моляль» и символ единицы измерения «м» устаревшими и предлагает использовать моль / кг. или другая родственная единица СИ вместо этого.
Расчет моляльности
Легко вычислить моляльность, если мы знаем массу растворенного вещества и растворителя в растворе.
Расчет моляльности по заданной массе
Если мы взвесим 5,36 г KCl и растворим это твердое вещество в 56 мл воды, какова будет моляльность раствора? Помните, что моляльность равна моль растворенного вещества/кг на растворитель. KCl — это наше растворенное вещество, а вода — наш растворитель. Сначала нам нужно рассчитать количество молей, присутствующих в 5,36 г KCl:
моль KCl=5,36 г × (1 моль74,5 г)=0,0719 моль KCltext{моль KCl} = 5,36 text{г} times (frac{1 text{ моль}}{74,5 text{г}}) = 0,0719 text{ моль KCl} моль KCl=5,36 г × (74,5 г1 моль)=0,0719 моль KCl
Нам также необходимо преобразовать 56,0 мл воды в эквивалентную массу в граммах, используя известную плотность воды (1,0 г/мл):
56,0 мл × (1,0 г/л) = 56,0 г56,0 text{мл} times (frac{1,0 text{g}}{text{мл}}) = 56,0 text{g}56,0 мл×(мл1,0г)=56,0 г
56,0 г воды эквивалентно 0,056 кг воды.
моляльность=(молькг растворителя)=(0,0719 моль KCl0,056 кг воды)=1,3 мtext{ моляльность} = (frac {text{моль}}{text{кг растворителя}}) = (frac {0,0719text{моль KCl}}{0,056text{кг воды}})= 1,3\text{м } моляльность = (кг моль растворителя) = (0,056 кг воды 0,0719моль KCl)=1,3 м
Моляльность нашего раствора KCl и воды составляет 1,3 м. Поскольку раствор очень разбавлен, моляльность почти идентична молярности раствора, которая составляет 1,3 М.
Расчет массы с учетом моляльности
Мы также можем использовать моляльность, чтобы найти количество вещества в растворе. Например, сколько уксусной кислоты в мл необходимо для приготовления 3,0 м раствора, содержащего 25,0 г KCN?
Во-первых, мы должны преобразовать образец KCN из граммов в моли:
моль KCN = 25,0 г × (1 моль 65,1 г) = 0,38 мольtext{ моль KCN} = 25,0 text{г} times (frac {1 text{ моль}}{65,1 text{г} }) = 0,38 text{ моль} моль KCN=25,0 г × (65,1 г1 моль)=0,38 моль
Затем можно использовать моли KCN, чтобы найти кг уксусной кислоты.
0,38 моль KCl×(кг уксусной кислоты3,0 моль KCl)=0,12 кг уксусной кислоты0,38 text{ моль KCl} times ( frac {text{кг уксусной кислоты}}{3,0 text{моль KCl}}) = 0,12text{кг уксусной кислоты}0,38 моль KCl×(3,0 моль KCl кг уксусной кислоты)=0,12 кг уксусной кислоты
Получив массу уксусной кислоты в кг, переведем из кг в граммы: 0,12 кг равно 120 г. Затем мы используем плотность уксусной кислоты (1,05 г/мл при 20 90 203 o 90 204 C) для преобразования в требуемый объем в мл. Чтобы получить это, мы должны умножить на величину, обратную плотности:
120,0 г уксусной кислоты × (мл1,05 г) = 114,0 мл уксусной кислоты120,0 text{ г уксусной кислоты} times (frac {text{мл} }{1,05 text{г}}) = 114,0 text{мл уксусной кислоты}120,0 г уксусной кислоты×(1,05 гмл)=114,0 мл уксусной кислоты
Таким образом, нам потребуется 114 мл уксусной кислоты для приготовления 3,0 м раствора, содержащего 25,0 г KCN.
Молярность и моляльность : В этом уроке вы узнаете, чем отличаются молярность и моляльность.
Молярная доля и молярный процент
Молярная доля – это количество молекул данного компонента в смеси, деленное на общее количество молей в смеси.
Цели обучения
Рассчитайте мольную долю и мольный процент для данной концентрации смеси
Ключевые выводы
Ключевые моменты
- Мольная доля описывает количество молекул (или молей) одного компонента, деленное на общее количество молекул (или молей) в смеси.
- Молярная доля используется, когда два реакционноспособных компонента смешиваются вместе, поскольку соотношение двух компонентов известно, если известна мольная доля каждого из них.
- Умножение мольной доли на 100 дает мольные проценты, которые описывают то же самое, что и мольная доля, только в другой форме.
Молярные доли могут быть получены из различных концентраций, включая моляльность, молярность и композиции в процентах по массе.
Ключевые термины
- моль : Основная единица СИ для количества вещества; количество вещества, которое содержит столько элементарных частиц, сколько атомов содержится в 0,012 кг углерода-12.
- молярная доля : Отношение количества молей одного компонента в смеси к общему количеству молей.
Мольная доля
В химии молярная доля x i определяется как количество молей компонента, n i , деленное на общее количество молей всех компонентов смеси, n tot :
xi=nintottext{x}_{text{i}}=frac{ text{n}_{text{i}}}{text{n}_{text{tot}}}xi=ntotni
Молярные доли безразмерны, а сумма всех молярных доля в данной смеси всегда равна 1.
Свойства молярной доли
Мольная доля очень часто используется при построении фазовых диаграмм.
- Не зависит от температуры, в отличие от молярной концентрации, и не требует знания плотностей фаз(ы).
- Смесь с известными молярными долями может быть приготовлена путем взвешивания соответствующих масс компонентов.
- Мера симметрична; в молярных долях х=0,1 и х=0,9 роли «растворителя» и «растворенного вещества» обратимы.
- В смеси идеальных газов мольная доля может быть выражена как отношение парциального давления к общему давлению смеси.
Молярная доля в растворе хлорида натрия : Молярная доля увеличивается пропорционально массовой доле в растворе хлорида натрия.
Мольные проценты
Умножение мольной доли на 100 дает мольный процент, также называемый количеством/количественным процентом (сокращенно n/n%). Для общей химии все мольные проценты смеси в сумме составляют 100 мольных процентов. Мы можем легко преобразовать мольные проценты обратно в мольные доли, разделив на 100.
Расчеты с молярной долей и молярным процентом
Молярная доля в смесях
Смесь газов образовалась путем соединения 6,3 молей O 2 и 5,6 молей N 2 . Какова молярная доля азота в смеси?
Сначала мы должны найти общее количество родинок с n всего = n N2 + n O2 .
ntotal=6,3 моль+5,6 моль=11,9 мольtext{n}_{text{всего}}=6,3 text{моли}+5,6 \ text{моли} = 11,9 text{moles}ntotal=6,3 моля+5,6 моля=11,9 моля
.
Затем мы должны разделить количество молей N 2 на общее количество молей:
x (молярная доля) = (моли N2 моли N2+ моли O2) = (5,6 моль11,9 моль) = 0,47x (text {мольная доля}) = (frac {text{моли} text{N}_2}{text{моли} text{N}_2 + text{моли} O_2})= (frac {5,6 text { моль}}{11,9 text{ моль}})= 0,47x(молярная доля)=(моль N2+ моль O2 моль N2)=(11,9 моль5,6 моль)=0,47
Молярная доля азота в смеси равна 0,47.
Мольная доля в растворах
Молярная доля также может применяться в случае растворов. Например, 0,100 моль NaCl растворяют в 100,0 мл воды. Какова молярная доля NaCl?
Нам дано количество молей NaCl, но объем воды. Сначала мы конвертируем этот объем в массу, используя плотность воды (1,00 г/мл), а затем переводим эту массу в моли воды:
100 мл h3O×(1,0 г1мл)=100,0 г h3O×(1 моль18,0 г) = 5,55 моль ч3O100 text{мл} H_2O times (frac {1,0text{г}}{1text{мл}})= 100,0 text{г} text{ H}_2text{O} times (frac {1 text{ моль}}{18,0 г}) = 5,55 text{ моль } text{H}_2text{O}100 мл ч3O× (1мл1,0г)=100,0г·ч3О×(18,0г1 моль) = 5,55 моль·ч3О
С помощью этой информации мы можем найти общее количество имеющихся родинок: 5,55 + 0,100 = 5,65 молей. Если разделить моли NaCl на общее количество молей, то найдем мольную долю этого компонента:
x=(0,100моль5,65моль)=0,0176text{x} = (frac {0,100 text{моль }}{5,65 text {моль}}) = 0,0176x=(5,65моль0,100моль)=0,0176
Мы находим, что молярная доля NaCl равна 0,0176.
Мольная доля многокомпонентных смесей
Мольные доли также можно найти для смесей, которые образованы из нескольких компонентов. С ними обращаются так же, как и раньше; опять же, общая мольная доля смеси должна быть равна 1,9.0028
Например, раствор образуется при смешивании 10,0 г пентана (C 5 H 12 ), 10,0 г гексана (C 6 H 14 ) и 10,0 г бензола (C 6
4 Н 6 ). Какова молярная доля гексана в этой смеси?
Сначала мы должны найти количество молей, присутствующих в 10,0 г каждого компонента, учитывая их химические формулы и молекулярные массы. Количество молей для каждого находится путем деления его массы на соответствующий молекулярный вес. Находим, что имеется 0,138 моль пентана, 0,116 моль гексана и 0,128 моль бензола.
Мы можем найти общее количество молей, взяв сумму всех молей: 0,138+0,116+0,128 = 0,382 общих молей. Если мы разделим количество молей гексана на общее количество молей, мы вычислим мольную долю:
x=(0,116 моль0,382 моль)=0,303text{x} = (frac {0,116 text{моль}}{0,382 text{моль}}) = 0,303x=(0,382 моль0,116 моль)=0,303
Мольная доля гексана равна 0,303.
Молярная доля от моляльности
Молярная доля также может быть рассчитана по моляльности. Если у нас есть 1,62 м раствора столового сахара (C 6 H 12 O 6 ) в воде, какова молярная доля столового сахара?
Поскольку нам дана моляльность, мы можем преобразовать ее в эквивалентную молярную долю, которая уже является массовым отношением; помните, что моляльность = моли растворенного вещества/кг растворителя. Учитывая определение моляльности, мы знаем, что у нас есть раствор с 1,62 моль сахара и 1,00 кг (1000 г) воды. Поскольку мы знаем количество молей сахара, нам нужно найти количество молей воды, используя ее молекулярную массу:
1000 г h3O×(1 моль18,0 г)=55,5 молей h3O1000 text{g} text{H}_2text{O} times (frac {1 text{mol}}{ 18,0 text{г}}) = 55,5 text{ моль }text{H}_2text{O}1000 г·ч3O×(18,0 г1 моль)=55,5 моль·ч3O
Общее число молей представляет собой сумму молей воды и сахара, или всего 57,1 молей раствора.
x=(1,62 моль сахара57,1 моль раствор)=0,0284text{x} = (frac {1,62 text{ моль сахара}}{57,1 text{ моль раствор}}) = 0,0284 x = (57,1 моль раствора 1,62 моль сахара) = 0,0284
При мольной доле 0,0284 мы видим, что имеем 2,84% раствор сахара в воде.
Молярная доля от массы в процентах
Молярная доля также может быть рассчитана из массовых процентов. Какова молярная доля коричной кислоты, которая имеет массовый процент мочевины 50,00% в коричной кислоте? Молекулярная масса мочевины составляет 60,16 г/моль, а молекулярная масса коричной кислоты – 148,16 г/моль.
Во-первых, мы принимаем общую массу 100,0 г, хотя можно принять любую массу. Это означает, что мы имеем 50,0 г мочевины и 50,0 г коричной кислоты. Затем мы можем рассчитать присутствующие моли, разделив каждый на его молекулярную массу. У нас есть 0,833 моля мочевины и 0,388 моля коричной кислоты, так что всего у нас 1,22 моля.
Чтобы найти молярную долю, мы делим количество молей коричной кислоты на общее количество молей:
x=(0,388 моль коричной кислоты1,22 моль раствора)=0,318text{x} = (frac {0,388 text{ моль коричной кислоты}}{1,22 text{ моль раствора}})= 0,318x=(1,22 моль раствора.388 моль коричной кислоты)=0,318
Молярная доля коричной кислоты равна 0,318.
Лицензии и авторство
Контент под лицензией CC, совместно используемый ранее
- Курирование и пересмотр. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензионный контент CC, конкретное указание авторства
Концентрация в процентах по массе/объему Учебное пособие по химии
Ключевые понятия
⚛ Концентрация в процентах по массе/объему – это измерение концентрации раствора.
· Массовая/объемная процентная концентрация также известна как массовая/объемная процентная концентрация.
⚛ массовая/объемная концентрация в процентах обычно обозначается аббревиатурой w/v (%) или w/v% или (w/v)% или %(w/v) или %w/v
· Массовая/объемная концентрация в процентах обычно обозначается аббревиатурой m/v (%) или m/v% или (m/v)% или %(m/v) или %m/v
⚛ вес.
⚛ Для расчета концентрации вес/объем % (массовая/объемная концентрация):
| мас./об. (%) = % (масс./об.) = 908:30 | масса растворенного вещества (г) объем раствора (мл) |
× 100 |
⚛ Общепринятыми единицами измерения (1) для % массы/объема являются г/100 мл (граммы растворенного вещества на 100 мл раствора)
· пример: 5% (масса/объем) = 5 г/100 мл
· пример: 12%(масс./об.) = 12 г/100 мл
⚛ Измените уравнение для концентрации w/v% (m/v%), чтобы найти:
(i) масса растворенного вещества
масса (растворенное вещество) = [объем (раствор) × (вес/объем)%]/100
(ii) объем раствора
объем (раствор) = [масса (растворенное вещество)/(вес/объем)%] × 100
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Расчет концентрации в процентах по массе/объему
Концентрация в процентах по массе/объему (w/v%) или концентрация в процентах по массе/объему (m/v%) является мерой концентрации раствора.
мас./об.% или масс./об.% рассчитывают путем деления массы растворенного вещества в граммах на объем раствора в миллилитрах с последующим умножением на 100, как показано ниже.
| мас./об. (%) = | масса растворенного вещества (г) объем раствора (мл) |
× 100 |
Процентная концентрация говорит нам, сколько частей растворенного вещества присутствует на 100 частей раствора.
В терминах веса на объем (масса на объем) это означает, что процентная концентрация говорит нам о частях растворенного вещества по массе на 100 частей по объему раствора.
В единицах СИ концентрация w/v% (m/v%) должна быть указана в кг/100 л, но эти единицы слишком велики, чтобы быть полезными для химиков в лаборатории, граммы и миллилитры являются более удобными единицами измерения для нас. .
Напомним, что 1 кг = 1 000 г
Напомним, что 1 л = 1 000 мл
т.о. кг/100 л = 1000 г/100 000 мл = г/100 мл
, поэтому единицы измерения концентрации в весовом/объемном % чаще всего указываются как г/100 мл
Таким образом, единицами концентрации w/v% (m/v%) являются граммы растворенного вещества на 100 мл раствора (г/100 мл).
Это означает, что концентрация в процентах масса/объем (концентрация в процентах масса/объем) может быть указана разными, но эквивалентными способами. Некоторые примеры приведены в таблице ниже:
| мас./об.% (масс./об.%) |
= | г/100 мл |
|---|---|---|
| 0,5 % (вес/объем) | = | 0,5 г/100 мл |
| 1,0 %(масс./об.) 908:30 | = | 1,0 г/100 мл |
| 5,25 % (вес/объем) | = | 5,25 г/100 мл |
| 12,78 %(масс./об.) | = | 12,78 г/100 мл |
| 22,75 % (вес/объем) | = | 22,75 г/100 мл |
Чтобы приготовить раствор с определенной концентрацией, вы взвесите твердое вещество, а затем растворите его в достаточном количестве растворителя, чтобы получился известный объем раствора.
Следовательно, вы будете знать значение двух величин:
- масса растворенного вещества
- объем раствора
, который можно использовать для расчета процентной концентрации веса/объема (концентрация в процентах масса/объем).
Для расчета процентной концентрации масса/объем (массовая/объемная концентрация в процентах):
- Шаг 1: Напишите уравнение: либо масса/объем % = масса/объем × 100, либо масса/объем % = масса/объем × 100
- Шаг 2: Определите растворенное вещество и растворитель (по названию или химической формуле)
- Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
- Шаг 4: Проверить соответствие единиц измерения и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
- Шаг 5: Подставьте эти значения в уравнение и решите.
- Шаг 6: Напишите ответ
Примеры обработки: масс./об.% (масс./об.%) Расчеты
Вопрос 1. Какова массовая/объемная концентрация 250 мл водного раствора хлорида натрия, содержащего 5 г NaCl?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
вес/объем (%) = (масса растворенного вещества ÷ объем раствора) × 100
Шаг 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид натрия = NaCl
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (NaCl) = 5 г
объем раствора = 250 мл
Шаг 4: Проверить единицы измерения на соответствие и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса растворенного вещества (NaCl) = 5 г (преобразование единиц не требуется)
объем раствора = 250 мл (пересчет единиц измерения не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = (5 г ÷ 250 мл) × 100 = 2 г/100 мл
(Примечание: допустима только 1 значащая цифра)
Шаг 6: Напишите ответ
вес./об. % = 2 г/100 мл = 2 % (вес./об.) = 2 % (масс./об.)
Вопрос 2. 10,00 г BaCl 2 растворяют в 90,00 г воды.
Плотность раствора 1,090 г/мл (1,090 г/мл -1 ).
Рассчитайте массовую/объемную процентную концентрацию раствора.
Решение:
Шаг 1: Напишите уравнение: либо m/v% = m/v × 100, либо w/v% = w/v × 100
масса/объем (%) = (масса растворенного вещества ÷ объем раствора) × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид бария = BaCl 2
растворитель = вода = H 2 O (l) (это водный раствор)
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества = масса (BaCl 2 ) = 10,00 г
масса растворителя = масса (H 2 O) = 90,00 г
плотность раствора = 1,090 г/мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса растворенного вещества = масса (BaCl 2 ) = 10,00 г (преобразование единиц не требуется)
объем раствора неизвестен и должен быть рассчитан с использованием плотности раствора и масс растворенного вещества и растворителя:
плотность = масса(раствор) ÷ объем(раствор)
масса(раствор) = масса(раствор) + масса(растворитель)
масса(раствор) = 10,00 г BaCl 2 + 90,00 г воды = 100,0 г
объем(раствор) = масса(раствор) ÷ плотность(раствор)
объем (раствор) = 100,0 г ÷ 1,090 г /мл = 91,74 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
m/v (%) = (масса растворенного вещества ÷ объем раствора) × 100
м/об (%) = (10,00 г ÷ 91,74 мл) × 100
м/об (%) = 10,90 г/100 мл
(Примечание: оправданы только 4 значащие цифры)
Шаг 6: Напишите ответ
масс./об. % = 10,90 г/100 мл = 10,90 % (масс./об.) = 10,90 % (масс./об.)
↪ Наверх
Преобразование других единиц измерения в вес./об. % или масс./об. %
Наиболее распространенными единицами измерения % масс./об. (масс./об.%) являются г/100 мл (граммы растворенного вещества на 100 мл раствора).
Если масса растворенного вещества не указана в граммах, вам необходимо перевести единицы измерения в граммы.
Если объем раствора не указан в миллилитрах, вам необходимо перевести единицы измерения в миллилитры.
Рабочие примеры: w/v% (m/v%) Расчеты, требующие преобразования единиц измерения
Вопрос 1. 2,00 л водного раствора хлорида калия содержат 45,0 г KCl.
Какова процентная концентрация массы/объема этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид калия = KCl
9Растворитель 0027 – вода, H 2 O, так как это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса KCl = 45,0 г
объем раствора = 2,00 л
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса KCl = 45,0 г (масса в г, преобразование единиц измерения не требуется)
объем раствора = 2,00 л (необходимо перевести в мл)
В (раствор) = 2,00 л × 10 3 мл/ л = 2000 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = [45,0 г ÷ 2000 мл] × 100 = 2,25 г/100 мл
(Примечание: оправданы только 3 значащие цифры)
Шаг 6: Напишите ответ
% масс./об. = 2,25 г/100 мл = 2,25 % (масс./об.) = 2,25 % (масс./об.)
Вопрос 2. 15 мл водного раствора сахарозы содержат 750 мг сахарозы.
Какова массовая/объемная концентрация этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо m/v% = m/v × 100, либо w/v% = w/v × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = сахароза
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (сахароза) = 750 мг
объем раствора = 15 мл
Шаг 4: Проверить соответствие единиц измерения и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
Масса растворенного вещества
(сахароза) = 750 мг (необходимо перевести в граммы)
масса растворенного вещества = 750 мг ÷ 1000 мг /г = 0,750 г
объем раствора = 15 мл (преобразование не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = (0,750 г ÷ 15 мл) × 100 = 5,0 г/100 мл
(Примечание: оправданы только 2 значащие цифры)
Шаг 6: Напишите ответ
масс./об. % = 5,0 г/100 мл = 5,0 % (масс./об.) = 5,0 % (масс./об.)
Вопрос 3. 186,4 л водного раствора гидроксида натрия содержит 1,15 кг NaOH.
Какова процентная концентрация массы/объема этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = гидроксид натрия = NaOH
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (NaOH) = 1,15 кг
объем раствора = 186,4 л
Шаг 4: Проверьте единицы измерения на соответствие и при необходимости переведите (масса в граммах, объем в миллилитрах) (2)
масса растворенного вещества (NaOH) = 1,15 кг (перевести единицы в г)
масса растворенного вещества (NaOH) = 1,15 кг = 1,15 кг × 1000 г/ кг = 1 150 г
объем раствора = 186,4 л (перевести единицы в мл)
объем раствора = 186,4 л = 186,4 л × 1000 мл/ л = 186 400 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
мас./об. (%) = (1 150 г ÷ 186 400 мл) × 100
мас./об. (%) = 0,617 г/100 мл
(Примечание: оправданы только 3 значащие цифры)
Шаг 6: Напишите ответ
% масс./об. = 0,617 г/100 мл = 0,617 % (масс./об.) = 0,617 % (масс./об.)
↪ Наверх
Расчет объема и массы реагента
В предыдущих разделах мы рассчитали концентрацию растворов в процентах по весу и объему, используя известные массу растворенного вещества и объем раствора.
Когда мы начинаем использовать этот раствор в лаборатории, мы, скорее всего, будем использовать пипетку или бюретку для подачи объема раствора.
Если мы знаем объем используемого раствора, мы можем рассчитать массу присутствующего растворенного вещества.
| масса растворенного вещества (г) = | объем раствора (мл) × масса/объем (%) 100 |
Если мы знаем массу растворенного вещества, которое хотим использовать, мы можем рассчитать объем раствора, который нам потребуется.
| объем раствора (мл) = 908:30 | масса растворенного вещества (г) масса/объем (%) |
× 100 |
Вопрос 1. Учащийся должен добавить в реакционный сосуд 1,22 г хлорида натрия.
Студенту предоставляется 11,78 г/100 мл водного раствора хлорида натрия (11,78 % масс./об.).
Какой объем этого раствора нужно добавить в реакционный сосуд?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Преобразуйте уравнение, чтобы найти объем раствора:
мас./об.% = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
Умножить обе части уравнения на объем
мас./об.% × объем (мл) = (масса растворенного вещества (г) ÷ объем раствора (мл) ) × объем (мл) × 100
мас./об.% × объем (мл) = масса растворенного вещества (г) × 100
Разделите обе части уравнения на мас.
[ мас./об.% × объем (мл)]/ мас./об.% = (масса растворенного вещества (г) × 100)/вес./об.%
| объем раствора (мл) = | масса растворенного вещества (г) масса/объем (%) |
× 100 |
Этап 2: Определите растворенное вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид натрия = NaCl
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
необходимая масса растворенного вещества = масса (NaCl) = 1,22 г
концентрация NaCl (водн.) при условии = масса/объем (%) = 11,78 г/100 мл
Требуется
объемов раствора = ? мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
необходимая масса растворенного вещества = масса (NaCl) = 1,22 г (преобразование единиц не требуется)
концентрация NaCl (водн.
Требуется
объемов раствора = ? мл
Шаг 5: Подставьте эти значения в уравнение и решите.
| объем раствора (мл) | = | масса растворенного вещества (г) масса/объем (%) |
× 100 |
| = | 1,22 г 11,78 г/100 мл |
× 100 | |
| = | 10,36 мл | ||
| = | 10,4 мл |
(Примечание: оправданы только 3 значащие цифры)
Шаг 6: Напишите ответ
объем раствора = 10,4 мл
Вопрос 2. Какова масса йодида калия в граммах в 14,86 мл 32,44 г/100 мл водного раствора йодида калия (32,44 % вес/объем)?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Измените уравнение, чтобы найти массу растворенного вещества:
вес/объем (%) = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
Разделите обе части уравнения на 100
вес/объем (%) ÷ 100 = масса растворенного вещества (г) ÷ объем раствора (мл)
Умножить обе части уравнения на объем раствора (мл)
масса растворенного вещества (г) = (вес/объем (%) ÷ 100) × объем раствора (мл)
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = йодид калия = KCl
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества = масса (KI) = ? г
объем (KI (водн.) ) = 14,86 мл
концентрация раствора = мас./об.% (KI (водн.) ) = 32,44 г/100 мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
объем (KI (водн.) ) = 14,86 мл (преобразование единиц не требуется)
мас./об.% (KI (водн.) ) = 32,44 г/100 мл (преобразование единиц не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
масса растворенного вещества (г) = (масс./об.% ÷ 100) × объем раствора (мл)
масса (KI) = (32,44 ÷ 100) × 14,86 = 4,821 г
(Примечание: оправданы 4 значащие цифры)
Шаг 6: Напишите ответ
масса растворенного вещества (KI) = 4,821 г
↪ Наверх
Пример вопроса: расчеты масс.

Определите массу в граммах нитрата калия (KNO 3 ) в 22,65 мл 2,15% (масс./об.) водного раствора нитрата калия.
м (КНО 3 (водн.) ) = г
↪ Наверх
Сноски:
(1) Общепринятыми единицами измерения % масс./об. (масс./об.%) являются г/100 мл, но возможны и другие единицы, например, кг/100 л, мг/100 мкл.
Мы ограничим последующее обсуждение г/100 мл, но вы можете применить ту же логику и уравнения, используя другие подходящие единицы измерения.
Обратите внимание, что растворимость чаще всего указывается в виде весового отношения процентной концентрации.
(2) Вам не нужно преобразовывать эти единицы, потому что и масса, и объем даны в единицах СИ, то есть
мас./об.% = (1,15 кг/186,4 л) × 100 = 0,617 кг/100 л = 617 г/100 000 мл = 0,617 г/100 мл
, но, вероятно, лучше попрактиковаться в преобразовании единиц измерения, по крайней мере, до тех пор, пока вы полностью не поймете, что означает концентрация w/v%.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Отношение количества
или массы вещества, содержащегося в
системе, к объему или массе этой системы
называется концентрацией.
Рассмотрим несколько
способов выражения концентрации.
Процентная
концентрация
(массовая доля растворенного вещества)
(ω) показывает, сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора. Массовая
доля – безразмерная величина, ее выражают
в долях единицы или процентах:
,
где ω – массовая
доля (%) растворенного вещества; m1
– масса растворенного вещества, г; m
– масса раствора, г.
Масса раствора
равна произведению объема раствора V
(мл) на его плотность r
(г/см3):
,
тогда
.
Молярная
концентрация (молярность)
раствора – показывает, сколько молей
растворенного вещества содержится в
1л раствора.
Молярную концентрацию
(моль на литр) выражают формулой
,
где m1
– масса растворенного вещества, г; М –
молярная масса растворенного вещества,
г/моль; V
– объем раствора, л.
Количество вещества
в молях определяется по формуле:
n
= m1
/М, тогда
Нормальная
концентрация (нормальность раствора)
показывает, сколько грамм-эквивалентов
растворенного вещества содержится в 1
л раствора (моль на литр):
,
где m1
– масса растворенного вещества, г; V
– объем раствора, л.
Э – эквивалентная
масса растворенного вещества (г/моль),
которую рассчитывают по формуле:
Э=(г/моль),
где М – мольная
масса вещества, n
– количество катионов (анионов), В
– валентность. Валентность – это
способность атомов элемента присоединять
определенное число атомов другого
элемента. Эквивалент кислоты можно
определить по формуле: Э = М (кислоты)
/ основность (число атомов водорода).
Например: Э
Н2SO4==49г/моль;
эквивалент основания по формуле: Э = М
(основания) / кислотность (число ОН–
групп), так Э
Fe(OH)3==35,6г/моль;
эквивалент соли по формуле: Э = М(соли)
/ число атомов металла * валентность
металла,
Э Al2(SO4)3==114г/моль.
Моляльность
раствора Сm
показывает
количество растворенного вещества,
находящееся в 1 кг растворителя:
,
где m2
– масса растворителя, кг; n
– количество растворенного вещества,
моль.
Пример
1.
Вычислить молярность и нормальность
40 %-го раствора фосфорной кислоты,
плотность которого 1,25 г/см3.
Объем раствора 1л.
Решение.
Для расчета молярности и нормальности
раствора найдем массу фосфорной кислоты
в 1 л (1000 мл) 40 %-го раствора:
w
= m1
· 100/V
∙ r;
.Молярная
масса Н3РO4
равна 98 г/моль, следовательно,
=
500/98 = 5,1 моль/л.
Молярная
масса эквивалента Н3РO4
равна 98/3 = 32,7 г/моль.
Тогда
СН
= 500/32,7 =
1,53 моль/л.
Пример
2.
Вычислить
массовую долю КОН в 2н. растворе, плотность
которого 1,08 г/см3.
Решение.
Поскольку
нормальность рассчитывается на 1 л
раствора, найдем массу растворенного
вещества в 1 л:
СН=
m1/Э∙V;
ЭKOH
= 56 г/моль;
mКОН=2∙56∙1=112
г.
Теперь
вычислим массовую доли КОН в растворе,
содержащем 112
г
гидроксида калия:
w=
m1∙100/V∙r=112∙100/1000∙1,08=10,4
%.
Пример 3.
На нейтрализацию 50 см3
раствора кислоты израсходовано 25 см3
0,5 н. раствора щелочи. Чему равна молярная
концентрация эквивалентов кислоты?
Решение.
Так как вещества взаимодействуют между
собой в эквивалентных соотношениях, то
растворы равной молярной концентрации
эквивалентов реагируют в равных объемах.
При разных молярных концентрациях
эквивалентов объемы растворов реагирующих
веществ обратно пропорциональны их
нормальностям, т.е.
V1:
V2
= С2
: С1
или V1∙
С1
= V2
∙
С2
50С1
= 25 • 0,5; откуда С1
= 25 • 0,5 / 50 = 0,25н.
Задание:
решить следующие задачи, принимая объем
раствора равным
1 л:
|
Вариант |
Вещество |
Концентрация |
Плотность |
Вычислить |
|
121 |
Na2CO3 |
0,30 |
1,030 |
Процентную |
|
122 |
HNO3 |
9,0 |
1,275 |
Процентную |
|
123 |
NH4Cl |
10 |
1,028 |
Молярную |
|
124 |
Al2(SO4)3 |
0,55 |
1,176 |
Процентную |
|
125 |
HNO3 |
2 |
– |
Нормальную |
|
126 |
HCl |
15,0 |
1,073 |
Нормальную |
|
127 |
H2SO4 |
13,0 |
1,680 |
Процентную |
|
128 |
H3PO4 |
44,0 |
1,285 |
Нормальную |
|
129 |
HClO4 |
9,0 |
1,150 |
Процентную |
|
130 |
H2SO4 |
2 |
– |
Нормальную |
|
131 |
CH3COOH |
34,0 |
1,043 |
Молярную |
|
132 |
BaCl2 |
2,30 |
1,203 |
Процентную |
|
133 |
K2CO3 |
4 |
– |
Нормальную |
|
134 |
CuSO4 |
14,0 |
1,155 |
Нормальную |
|
135 |
FeCl3 |
1,90 |
– |
Нормальную |
|
136 |
K2CO3 |
6,0 |
1,567 |
Процентную |
|
137 |
NaCl |
3 |
– |
Молярную |
|
138 |
NaCl |
20 |
1,148 |
Молярную |
|
139 |
HClO4 |
4,0 |
1,230 |
Процентную |
|
140 |
K2CO3 |
3 |
– |
Нормальную |
Задание: решить
следующие задачи
|
№ задачи |
|
|
141 |
На |
|
142 |
Смешали |
|
143 |
Определить |
|
144 |
Смешали |
|
145 |
Для |
|
146 |
Смешали |
|
147 |
На |
|
148 |
Смешали |
|
149 |
На |
|
150 |
Вычислить |
|
151 |
Определить |
|
152 |
Вычислить |
|
153 |
Определить |
|
154 |
Определить |
|
155 |
Вычислить |
|
156 |
Вычислить |
|
157 |
Определить |
|
158 |
Смешали |
|
159 |
Определить |
|
160 |
Вычислить |
Соседние файлы в папке му по химии
- #
- #
- #
- #
- #
- #
- #





























 06.2021471.62 Кб0Operacni_navod_Cerklazni_system_RUS_final_2016.02.11.pdf
06.2021471.62 Кб0Operacni_navod_Cerklazni_system_RUS_final_2016.02.11.pdf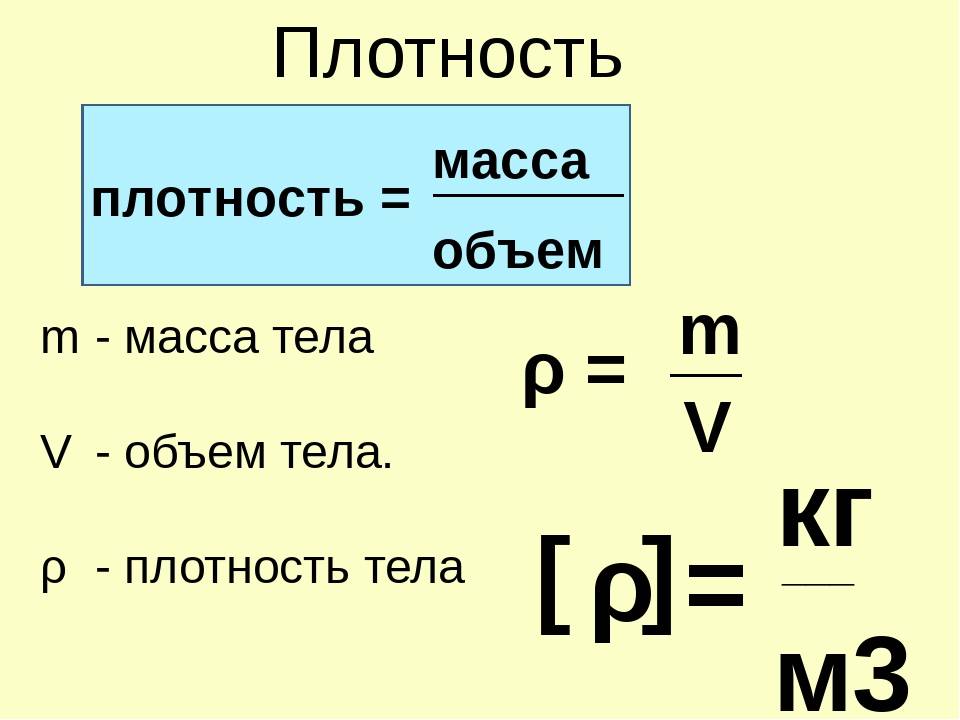 20216.16 Mб43Судебно-медицинская травматология.pdf
20216.16 Mб43Судебно-медицинская травматология.pdf








 В этих случаях подходящей мерой является моляльность (не молярность).
В этих случаях подходящей мерой является моляльность (не молярность).  Молярные доли могут быть получены из различных концентраций, включая моляльность, молярность и композиции в процентах по массе.
Молярные доли могут быть получены из различных концентраций, включая моляльность, молярность и композиции в процентах по массе. 

