Зная концентрацию комплексного иона, например  , и определив концентрацию свободных ионов металла
, и определив концентрацию свободных ионов металла  и «вымытых» из комплекса координированных групп
и «вымытых» из комплекса координированных групп  . можно найти числовую величину константы динамического равновесия, отвечающего вторичной электролитической диссоциации комплекса. Такого рода константы называют константами нестойкости, обратные им величины называют константами устойчивости. Применив закон действия масс к равновесной системе:
. можно найти числовую величину константы динамического равновесия, отвечающего вторичной электролитической диссоциации комплекса. Такого рода константы называют константами нестойкости, обратные им величины называют константами устойчивости. Применив закон действия масс к равновесной системе:

получим

где  —константа нестойкости.
—константа нестойкости.
С учетом активностей это уравнение можно представить следующим образом:

Чем меньше величина констант нестойкости, тем устойчивей комплекс.
Зная величину константы нестойкости данного комплексного иона, можно вычислить концентрацию комплексообразователя и лиганда.
Числовые значения констант нестойкости некоторых комплексных ионов приводятся в справочниках.
Пример 1. Вычислить концентрацию комплексообразователя и лиганда в 1 М растворах  и сравнить полученные результаты.
и сравнить полученные результаты.
Решение: а) Для 
Если обозначим  через
через  , то согласно уравнению:
, то согласно уравнению:

можем написать:

Подставим в выражение константы нестойкости значения концентраций комцлексо-образователя  и лиганда
и лиганда  :
:

В силу того, что  в растворе слабого электролита очень мала по сравнению с концентрацией комплексного иона, можно значение
в растворе слабого электролита очень мала по сравнению с концентрацией комплексного иона, можно значение  приравнять к 1. Тогда получим:
приравнять к 1. Тогда получим:

откуда

б) Для 

откуда

Сопоставляя результаты, полученные для  , можно отметить, что концентрация комплексообразователей в обоих растворах приблизительно одинакова:
, можно отметить, что концентрация комплексообразователей в обоих растворах приблизительно одинакова:

Концентрация лиганда в растворе медно-аммиачного комплекса превышает таковую в серебряно-аммиачном комплексе приблизительно в 100 раз.
Ниже приводятся величины констант нестойкости роданидных комплексов железа, имеющих большое значение в аналитической химии. Для первой ступени

Для второй ступени

Для третьей ступени

На основании констант нестойкости можно сделать заключение, что прочность различных комплексов не одинакова. Электролитическая диссоциация  протекает по уравнению:
протекает по уравнению:

Применив закон действия масс к этим равновесным системам, получим:

Это показывает, что более устойчивым является  , константа нестойкости которого во много раз меньше константы нестойкости
, константа нестойкости которого во много раз меньше константы нестойкости  .
.
Различной прочностью комплексных соединений объясняются многие известные факты поведения комплексных соединений при качественном анализе. Например, действуя хлоридом калия на  , нельзя выделить ион серебра в виде
, нельзя выделить ион серебра в виде  , в то время как действуя иодидом калия, можно выделить
, в то время как действуя иодидом калия, можно выделить  из
из  , но не из
, но не из  .
.
Действуя сероводородом, выделяют осадок  из обоих растворов, содержащих эти комплексы.
из обоих растворов, содержащих эти комплексы.
Такое действие рассматриваемых реагентов  находится в прямой зависимости от растворимости образующихся соединений и констант нестойкости комплексных ионов. Например:
находится в прямой зависимости от растворимости образующихся соединений и констант нестойкости комплексных ионов. Например:

Благодаря этому возможно осуществлять взаимные переходы одних соединений в другие по схеме:

Указанные взаимные переходы идут в сторону образования наименее растворимого соединения и наиболее стойкого комплекса.
На основании приведенной выше схемы можно сделать вывод о том, что  является более стойким комплексным соединением, чем
является более стойким комплексным соединением, чем  .
.
Из уравнений констант нестойкости комплексов можно сделать следующие практические выводы:
1. Электролитическая диссоциация комплексного иона уменьшается при добавлении избытка комплексующего агента, связывающего данный ион в комплексное соединение.
Так, электролитическая диссоциация  затрудняется при увеличении концентрации аммйака в растворе.
затрудняется при увеличении концентрации аммйака в растворе.
2. Усиления электролитической диссоциации комплекса можно достигнуть при уменьшении концентрации реагента, связывающего ион в комплексное соединение.
В рассматриваемом случае при уменьшении в растворе концентрации аммиака облегчается электролитическая диссоциация аммиачного комплекса.
Аммиачный комплекс  может быть получен путем при-ливания избытка аммиака к какой-либо растворимой в воде соли серебра или к некоторым нерастворимым в воде соединениям серебра
может быть получен путем при-ливания избытка аммиака к какой-либо растворимой в воде соли серебра или к некоторым нерастворимым в воде соединениям серебра  .
.
Чем больше растворимость подвергающихся комплексообразованию соединений серебра, тем легче пройдет комплексообразование. В случае малорастворимых солей, например  , аммиачные комплексы не образуются. Наоборот, как мы видели выше, комплекс
, аммиачные комплексы не образуются. Наоборот, как мы видели выше, комплекс  разрушается при действии KI.
разрушается при действии KI.
Это объясняется тем, что растворимость  больше растворимости
больше растворимости  . Но
. Но  , взаимодействуя с KCN, образует растворимое комплексное соединение
, взаимодействуя с KCN, образует растворимое комплексное соединение  . Это происходит потому, что константа нестойкости комплекса
. Это происходит потому, что константа нестойкости комплекса  , равная
, равная  меньше константы нестойкости комплекса
меньше константы нестойкости комплекса  , равной
, равной  .
.
В
растворах комплексных соединений
существует система динамических
равновесий, т. е. комплексные соединения
подвержены в значительной степени
электролитической диссоциации. Ионы
или молекулы, находящиеся во внешней
сфере, связаны в комплексном соединении
гораздо слабее, чем ионы или молекулы,
находящиеся во внутренней сфере. Такая
различная прочность связи обусловливает
характер диссоциации комплексных
соединений. Диссоциация комплексных
соединений протекает по стадиям. На
первой стадии комплексное соединение
диссоциирует как сильный электролит,
т. е. практически полностью. Далее,
комплексный ион диссоциирует как слабый
электролит по ступеням, т. е. лиганды
отделяются от комплексообразователя
постепенно. Например, диссоциация
комплексной соли [Ag(NH3)2]Cl
протекает по следующим стадиям: Первая
стадия: [Ag(NH3)2]Cl
→[Ag(NH3)2]+ +
Cl–
Вторая
стадия:1.
Ag(NH3)2]+ →AgNH3+ +
NH3
![]()
2.
AgNH3+
→Ag+ +
NH3
![]()
Диссоциация
комплекса идет лишь в незначительной
степени и может быть охарактеризована
величиной общей константы ионизации
данного комплекса, которая определяется
как произведение констант диссоц![]() иации
иации
по отдельным ступеням. Так, в данном
примере
Чем
больше величина этой константы, тем
сильнее комплекс диссоциирует, тем
менее он устойчив. Эта константа
называется константой
нестойкости.
Обратная величина константы нестойкости
называется константой
устойчивости :
![]()
Константы
нестойкости для различных комплексных
ионов различны и могут служить мерой
устойчивости комплекса.
28.
Дисперсная система —
это образования из двух или более
фаз, которые совершенно или практически
не смешиваются и не реагируют друг с
другом химически. Первое из веществ
(дисперсная
фаза)
мелко распределено во втором (дисперсионная
среда).
Если фаз несколько, их можно отделить
друг от друга физическим способом.
Обычно дисперсные системы —
это коллоидные растворы, золи. К
дисперсным системам относят также
случай твёрдой дисперсной среды, в
которой находится дисперсная фаза.
По
агрегатному состоянию: Г/Г, Ж/Ж, Т/Т, Г/Ж,
Г/Т, Ж/Т, Ж/Г, Т/Ж, Т/Г. Дисперсные системы
делятся на: грубодисперсные, эмульсии
и суспензии.
29.
Гетерогенными
считаются
системы, состоящие из нескольких
гомогенных частей, отделенных друг от
друга поверхностями раздела. Каждая
из таких однородных частей, входящих
в состав гетерогенной системы, называется
ее «фазой», а самая гетерогенная
система—многофазной.
По агрегатному состоянию: Г/Г, Ж/Ж, Т/Т,
Г/Ж, Г/Т, Ж/Т, Ж/Г, Т/Ж, Т/Г. Дисперсные
системы делятся на: грубодисперсные,
эмульсии и суспензии. Коллоидные
растворы
представляют собой гетерогенные
дисперсные системы с величиной частиц
дисперсной фазы от 0,001 до 0,1 мкм, которые
состоят из агрегатов атомов и молекул
(мицелл). Мицеллы, как правило, нельзя
визуально обнаружить с помощью
обыкновенного иммерсионного микроскопа,
но они видны через световой микроскоп
в виде светящихся точек, находящихся
в беспрерывном движении. Поперечник
частиц в золях составляет больше 1/2
световой волны, поэтому свет не может
свободно проходить через них и
подвергается большему или меньшему
рассеиванию. В отличие от истинных
растворов золи обладают очень малым
осмотическим давлением, что является
следствием большой относительной массы
частиц. Коллоидные растворы легко
проходят через стандартные фильтры,
но не проникают через фильтры с очень
мелкими порами. Устойчивость этих
растворов обусловлена степенью
дисперсности частиц, имеющих электрические
заряды, а также сольватацией (гидратацией)
коллоидных частиц.
30.Поверхностное
натяжение s есть
величина, измеряемая энергией Гиббса,
приходящейся на единицу площади
поверхностного слоя. Оно численно равно
работе, которую необходимо совершить
против сил межмолекулярного взаимодействия
для образования единицы поверхности
раздела фаз при постоянной температуре
![]() Концентрирование
Концентрирование
вещества на поверхности раздела фаз
называется адсорбцией.
Жидкость или твёрдое тело, на поверхности
которого происходит адсорбция
называется адсорбентом,
а вещество, образующее поверхностный
слой (адсорбирующийся газ или растворённое
вещество) – адсорбатом.
Адсорбция
по Гиббсу –
это избыток адсорбата в адсорбционном
слое, выражается в моль/см2.
Связь
между адсорбцией по Гиббсу и поверхностным
натяжением описывается уравнением
Гиббса:
![]() для
для
растворённых веществ
![]() для
для
адсорбции газов или паров где С –
объёмная концентрация растворённого
вещества в моль/л, Р –
парциальное давление адсорбирующегося
газа в атм., К –
универсальная газовая постоянная
равная 8,31107 эргмоль-1град-1, Т –
абсолютная температура в К, ![]() –
–
поверхностная активность.
Зависимость
адсорбции ^ Г от
равновесной концентрации С или
давления Р при
постоянной температуре называется изотермой
адсорбции.
Все
вещества по их воздействию на поверхностное
натяжение воды можно разделить на три
группы (рис.4):
1.Поверхностно-активные
вещества
(ПАВ) – понижают
поверхностное натяжение растворителя
(sр.р<s0),
g>0 (по отношению к воде – органические
соединения дифильного строения –
органические кислоты, спирты, амины,
эфиры и т.д).
2.Поверхностно-инактивные
вещества (ПИВ) –
незначительно повышают поверхностное
натяжение растворителя (sр.р >s0),
g<0 (неорганические кислоты, основания,
соли, глицерин, a-аминокислоты
и др).
3. ^ Поверхностно-неактивные
вещества (ПНВ) –
практически не изменяют поверхностного
натяжения растворителя (sр.р =s0),
g=0 (по отношению к воде веществами
являются сахароза и ряд других).</s
Адсорбция—
увеличение концентрации
растворенного вещества у поверхности
раздела двух фаз (твердая
фаза-жидкость,
конденсированная фаза – газ) вследствие
нескомпенсированности сил межмолекулярного
взаимодействия на разделе фаз. Адсорбция
является частным случаем сорбции,
процесс, обратный адсорбции – десорбция.
32.ОВР
– химическая реакция, протекающая с
изменением степеней окисления элементов.
ОВР состоит из двух полуреакций:
окисления и восстановления.
Окисление
– процесс отдачи электронов атомов
или ионом.
восстановление
– процесс присоединения электронов
атомов или ионом.
Окислитель
– атом или ион, принимающий электроны.
сильные
окислители: F2,
O2,
O3,
H2O2,
Cl2
и
т.д.
Восстановитель
– атом или ион, отдающий электроны.
Сильные восстановители: щелочные и
щелочноземельные металлы и т.д.
степень
окисления
– условный заряд атома в молекуле,
вычисленный в предложении, что все
связи имеют ионный характер. Это
означает, что более электроотрицательный
атом, смещая к себе одну электронную
пару, приобретает заряд -1. Неполярная
связь между одинаковыми атомами не
дает вклада в степень окисления.
Определение
направления реакций.
Её можно определить по второму закону
термодинамики. Если энергия Гиббса
окислительно-восстановительной реакции
ниже нуля (ΔG<0),
то реакция может протекать в прямом
направлении. Ели указанная энергия
выше нуля (ΔG>0),
то прямая реакция в данных условиях
невозможна, а возможна лишь обратная
реакция. Энергию Гиббса можно рассчитать,
зная энергии Гиббса реакций образования
продуктов и исходных веществ, которые
для стандартных состояний приводятся
в справочниках.
33.типы
ОВР. Признаки
ОВР: образование простых веществ,
изменение состава ионов реагирующих
веществ, число исходных веществ не
равно числу продуктов. Все ОВР
можно разделить на три
типа: межмолекулярные, внутримолекулярные
и
диспропорционирования.
В межмолекулярных
(межатомных) реакциях
окислительные функции выполняют одни
вещества, а восстановительные – другие.
Например, в реакции H2S
+ Cl2 =
S + 2HCl электроны от восстановителя –
молекулы сероводорода – переходят к
окислителю – молекуле Cl2.
В
реакциях
внутримолекулярного окисления-восстановления
одна часть молекулы – окислитель,
другая – восстановитель. Простейшими
примерами могут служить реакции
термического
разложения вещества.
Реакции диспропорционирования (самоокисления-самовосстановления)
протекают с одновременным уменьшением
и увеличением степени окисления атомов
одного и того же элемента. Они характерны
для соединений или простых веществ,
состоящих из промежуточных степеней
окисления данного элемента:
|
|
34.
Гальванический элемент Даниэля – Якоби
состоит из медной пластины, погружённой
в раствор CuSO4,
и цинковой пластины, погружённой в
раствор ZnSO4.
Для предотвращения прямого взаимодействия
окислителя и восстановителя электроды
отделены друг от друга пористой
перегородкой. На поверхности цинковой
пластины возникает двойной электрический
слой и устанавливается равновесие Zn
↔ Zn2+
+ 2e¯.
В результате протекания этого процесса
возникает электродный потенциал цинка.
На поверхности медной пластины также
возникает двойной электрический слой
и устанавливается равновесие Cu
↔ Cu2+
+ 2e¯
поэтому возникает электродный потенциал
меди. Потенциал цинкового электрода
имеет более отрицательное значение,
чем потенциал медного электрода, поэтому
при замыкании внешней цепи, т.е. при
соединении цинка с медью металлическим
проводником электроны будут переходить
от цинка к меди. В результате перехода
электронов от цинка к меди равновесие
на цинковом электроде сместится вправо,
поэтому в раствор перейдёт дополнительное
количество ионов цинка. В то же время
равновесие на медном электроде сместится
влево и произойдёт разряд ионов меди.
При работе гальванического элемента
Даниэля – Якоби протекают след. процессы:
1. реакция окисления цинка Zn
– 2e
→ Zn2+.
Процессы окисления в химии получили
название анодных процессов, а электроды,
на которых идут процессы окисления,
называют анодами;
2. реакция восстановления ионов меди
Cu2+
+ 2e
→ Cu.
Процессы восстановления в электрохимии
получили название катодных процессов,
а электроды, на которых идут процессы
восстановления, называют катодами;
3. движение электронов во внешней цепи;
4. движение ионов в растворе: анионов
(SO42-)
к аноду, катионов (Cu2+,
Zn2+)
к катоду. Движение ионов в растворе
замыкает электрическую цепь гальванического
элемента. Суммируя электродные реакции,
получаем
Zn
+ Cu2+
= Cu
+ Zn2+.
Вследствие этой хим. реакции в
гальваническом элементе возникает
движение электронов во внешней цепи и
ионов внутри элемента, т.е. электрический
ток, поэтому суммарная хим. реакция,
протекающая в гальваническом элементе,
называется токообразующей.
В электрохимии стандартный
электродный потенциал,
является мерой индивидуального
потенциала обратимого электрода (в
равновесии) в стандартном
состоянии,
которое осуществляется в растворах
при эффективной концентрации в 1 моль/кг
и в газах при давлении в 1 атмосферу или
100 кПа (килопаскалей).
35.
Электрохимический ряд напряжений
металлов. ЭДС
гальванического элемента.
E
= φк
– φа;
W
= nFE;
![]()
37.Электролизом
называют процессы, происходящие на
электродах под действием электрического
тока, подаваемого от внешнего источника.
При электролизе происходит превращение
электрической энергии в химическую.
Ячейка для электролиза, называемая
электролизёром, состоит из 2-х электродов
и электролита. Электрод, на котором
идёт реакция восстановления (катод), у
электролизёра подключён к отрицательному
полюсу внешнего источника тока. Электрод,
на котором протекает реакция окисления
(анод), подключён к положительному
полюсу источника тока. Электролиз
связан с наложением определённого
электрического поля, под действием
которого в электролите могут возникать
некоторые характерные процессы.
Электрокинетические процессы происходят
в тех случаях, когда одна фаза
диспергированна в другой; к их числу
относится электрофорез – движение
взвешенных твёрдых частиц внутри
жидкости. При наложении электрического
поля наблюдается явление электроосмоса
– движение жидкости относительно
твердого тела. Электролиз
расплавов. При
электролизе расплава электролита на
электроде, подключенном к минусу
источника тока (катоде), через который
в систему поставляются электроны,
восстанавливаются катионы электролита
в атомы. На другом электроде, присоединенном
к плюсу источника тока (аноде), с помощью
которого из системы отводятся электроны,
окисляются анионы электролита. Например,
при электролизе хлорида натрия ионы
натрия восстанавливаются в атомы по
уравнениюNa+ + е
?Na0,
а
на аноде происходит окисление ионов
хлора в молекулы:
2Cl– -2e
?Cl2.Электролиз
является процессом, в ходе которого
происходит превращение электрической
энергии в химическую.
Электролиз
растворов электролитов
Главное отличие этого типа электролиза
от электролиза расплавов состоит в
том, что в водных растворах электролитов
(при электролизе в качестве электролитов
значительно чаще используют соли, чем
кислоты или основания) кроме катионов
и анионов электролита (соли) всегда
присутствуют молекулы воды, а также
ионы Н+ и
ОН–,
образующиеся в результате ее диссоциации,
а в случае гидролиза соли — то и в
результате гидролиза. Поэтому наряду
с ионами растворенной соли в электродных
реакциях могут принимать участие
молекулы воды, ионы Н+ или
ОН–.
Продукты, выделяющиеся на электродах,
зависят от природы ионов соли, находящегося
в растворе, а также вида материала, из
которого изготовлены электроды. На
катоде могут протекать три вида
процессов:1. Восстановление
ионов металла: Меn+ + ne ? Me
2. Восстановление молекул воды в
нейтральных или щелочных растворах:2Н2О
+ 2е ? Н2 +
2ОН– ЕН2О/Н2 =
–0,828 В. 3. Восстановление ионов
водорода в кислотных растворах: 2Н+ +
2е ? Н2,
ЕН+/Н2 =
0,000 В.
На
аноде также могут протекать три вида
процессов:
1. Окисление
атомов металла: Ме – ne ? Men+
2. Окисление
молекул воды в кислотных и нейтральных
растворах:
2Н2О
– 4е ? О2 +
4Н+ ЕО2/Н20 =
+1,229 В.
3. Окисление
гидроксид-ионов в щелочных растворах:
4ОН– –
4е ? О2 +
2Н2О,
ЕН+/Н2 =
+0,04 В.
38.
Законы электролиза: Первый
закон Фарадея: масса
конкретного вещества mтеор,
выделившегося на электроде, прямо
пропорциональна количеству электричества,
прошедшего через электролизер: mтеор ?
?Q.
Введение
в полученное соотношение коэффициента
пропорциональности К превращает его
в уравнение: mтеор =
к Q.
Коэффициент
К называют электрохимическим эквивалентом.
При Q =
1Кл, к= mтеор,
т.е. электрохимический эквивалент –
это масса вещества, выделившегося на
электроде при прохождении через
электролизер 1 кулона электричества.
Т.к. Q
=It, то mтеор=
k It,
где I –
сила тока, прошедшего через электролизер,
А; t –
время проведения электролиза, с. Второй
закон:
если через электролизеры проходят
одинаковые количества электричества,
то массы веществ, выделившихся на
электродах, относятся между собой как
их эквивалентные массы, или при Q=const
m1/m2=Э1/Э2.
Электролиз
в гидрометаллургии является
одной из стадий переработки
металлсодержащего сырья, обеспечивающей
получение товарных металлов.
Электролиз
может осуществляться с растворимыми
анодами – процесс электрорафинирования
или с нерастворимыми – процесс
электроэкстракции.
Главной
задачей при электрорафинировании
металлов является обеспечения необходимой
чистоты катодного металла при приемлемых
энергетических расходах.
В
цветной металлургии электролиз
используется для извлечения
металлов из
руд и их очистки.
Электролизом расплавленных сред
получают алюминий, магний, титан,
цирконий, уран, бериллий и др.
Для рафинирования
(очистки) металла
электролизом из него отливают пластины
и помещают их в качестве анодов в
электролизер. При пропускании тока
металл, подлежащий очистке, подвергается
анодному растворению, т. е. переходит
в раствор в виде катионов. Затем эти
катионы металла разряжаются на катоде,
благодаря чему образуется компактный
осадок уже чистого металла. Примеси,
находящиеся в аноде, либо остаются
нерастворимыми, либо переходят в
электролит и удаляются.
39.Коррозия
– разрушение металлов и сплавов под
действием окружающей среды. Сущность
коррозии: самопроизвольный процесс.
I
Химическая коррозия – самопроизвольное
разрушение металлов при взаимодействии
с сухими газами и без конденсации влаги
на поверхности металла или жидкими
неэлектролитами. Химическая коррозия:
2Fe(тв)+Cl2(г)=FeCl3(ТВ);
в жидких неэлектролитах (нефть и
нефтепродукты, органические растворители)
II
Электрохимическая коррозия –
самопроизвольное разрушение металлов
при их соприкосновении с растворами
электролитов, в результате в системе
возникает электрический ток.
Протекает:
1) в растворах электролитах, в водных
растворах кислот, солей, щелочей, морской
воде;
2) в атмосфере любого влажного
газ, в том числе в атмосфере планеты
Земля;
3) в почве.
Основные
процессы, протекающие при электрохимической
коррозии металлов, их отличия от
процессов, процессов протекающих в
гальваническом элементе. Зависимость
протекания процессов коррозии от pH
среды.
Анодное
окисление металла:
Fe°
– 2e
= Fe²+
Катодное
восстановление окислителя (зависит от
pH
среды):
pH<7
– 2H+2e=H2°
pH=7
– O2+2H2O+4e=4OH¯
Вторичные
химические реакции:
Me+nOH¯=Me(OH)n
–pH=7
Me+An¯=Me(An)n
–pH<7
Кроме
первичных и вторичных процессов,
происходит движение электронов в
металле и ионов в электролите.
Возникновение тока объясняет образование
на поверхности металла микроскопических
гальванических элементов.
Отличие
процессов протекающих при электрохимической
коррозии, от процессов гальванического
элемента является отсутствие внешней
цепи.
Электрохимическая
коррозия может протекать на поверхности
одного и того же металла, если: 1) в
металле есть примеси; 2) во влажном
воздухе при комнатной температуре; 3)
в случае неравномерной аэрации
поверхности металла.
40.
Жёсткость
воды.
Жесткость
воды –это сумарное содержание солей
Са и Mg
Жесткость
воды подразделяется на 2
вида.
1)Карбонатная(временная) →
Обусловленная наличием в воде
гидрокарбонатов Са и Mg
Са(НСО3)
и Mg(НСО3)2
2)
Не карбонатная(постоянная) → Обусловленная
наличием в воде хлоридов и сульфитов
Са и Mg
СаCl2
СаSO4
и Mg
Cl2
MgSO4
Ж-жесткость
воды
Ж=m/
Эm*V
Ж=(м.экв/Л)-милиэквиволент/литр
m
-масса в-ва обусловливающие жесткость
или затрачимого на устранение
жесткости(м2)
Эm
-эквивалентная масса этого в-ва
V
-объём в (л)
Жобщ=
Жпост+
Жврем
Ж<2-мягкая
вода
Методы
умягчения воды
1.Устроение
карбонатной(временной) жесткости
А)
Кипячение
Са(НСО3)2
→ СаСО3↓+
СО2↑+H2O
Б)Хим
методы-добавление соды
Са(НСО3)2+
Nа2СО3→
СаСО3↓+2NaHCO3
-добавление
извести
Са(НСО3)2+Ca(OH)2→2
Са+СО3↓+2
H2O
2.Устранение
не постоянной жесткости
А)
добавление соды
СаCl2+
Nа2СО3→
СаСО3↓+2NaCl
Б)
Катионирование
Катионированием
называется процесс обмена катионов
между веществами (электролитами),
растворенными в воде, и твердым
нерастворимым веществом, погруженным
в эту воду и называется катионитом.
Катион, который катионит отдает в
раствор взамен поглощаемых катионов,
называется обменным. Свойства применяемых
в технике катионитов таковы, что в их
состав могут быть введены разные
обменные катионы. Однако для практики
водообработки важными являются только
три обменных катиона – натрий, водород
и аммоний. В зависимости от того, каким
из этих катионов ‹заряжен› катионит,
различают три процесса: натрий-катионирование
(Na-катионирование),
водород-катионирование (Н-катионирование)
и аммоний-катионирование (-катионирование).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
При получении растворов комплексных соединений, происходит их диссоциация на ионы внутренней и внешней сферы. После отщепления внешней сферы (первичная диссоциация), обратимой диссоциации подвергается внутренняя сфера (вторичная диссоциация):
[MLn] ↔ M + nL
Заряды для упрощения опущены, а ионы представлены в негидрированном виде.
Диссоциация комплекса протекает ступенчато, т.е. лиганды удаляются из внутренней сферы последовательно один за другим.
Константа устойчивости и константа нестойкости комплекса
При смешивании двух растворов, содержащих ионы металла и лиганд, произойдет ступенчатое комплексообразование, т.е. последовательное присоединение лиганда к металлу:
| M + L↔[ML] | K1 = [ML]/([M]·[L]) |
| ML + L↔[ML2] | K2 = [ML2]/([ML]·[L]) |
| ……………… | ……………….. |
| MLn-1 + L↔[MLn] | Kn = [MLn]/([MLn-1]·[L]) |
Присоединение лиганда к металлу будет происходить до тех пор, пока количество лигандов не станет равным координационному числу комплексообразователя. Устанавливается динамическое равновесие, при котором происходит как образование комплекса, так и его распад.
Каждой ступени также соответствует свое состояние равновесия, которое характеризуется соответствующей константой равновесия. Константы K1, K2…Kn называют ступенчатыми константами устойчивости (образования) комплексов.
Процесс комплексообразования можно выразить и через так называемые суммарные (кумулятивные) константы устойчивости – βi(обр):
| M + L↔[ML] | β1 = K1 = [ML]/([M]·[L]) |
| M + 2L↔[ML2] | β2 = K1· K2 = [ML2]/([M]·[L]2) |
| ……………… | ……………….. |
| M + nL↔[MLn] | βn = K1· K2·…· Kn = [MLn]/([M]·[L]n) |
Константа βn – общая константа образования комплекса.
Константы устойчивости характеризуют прочность комплекса в растворе, которая увеличивается с ростом их значения.
Процесс диссоциации также можно охарактеризовать с помощью констант, называемых константами нестойкости комплексов:
| [MLn] ↔ MLn-1 + L | Kн1 = 1/Kn = ([MLn-1]·[L])/[MLn] |
| [MLn-1] ↔ MLn-2 + L | Kн2 = 1/Kn-1 = ([MLn-2 ]·[L])/[MLn-1] |
| ……………… | ……………….. |
| [ML] ↔ M + L | Kнn = 1/K1 = ([M]·[L])/[ML] |
Константы Kн1, Kн2… Kнn называют ступенчатыми константами нестойкости (неустойчивости) комплексов. Понятно, что ступенчатые константы нестойкости это обратные величины соответствующих ступенчатых констант устойчивости.
Процесс диссоциации комплекса, также как и процесс комплексообразования, можно охарактеризовать с помощью суммарных равновесий. В этом случае они называются суммарными (кумулятивными) константами нестойкости:
| [MLn] ↔ MLn-1 + L | βн1 = Kн1= ([MLn-1]·[L])/[MLn] |
| [MLn] ↔ MLn-2 + 2L | βнn2 = Kн1· Kн2 = ([MLn-2]·[L]2)/[MLn] |
| ……………… | ……………….. |
| [MLn] ↔ M + nL | βнn = Kн1· Kн2·…· Kнn = ([M]·[L]n)/[MLn] |
Суммарная константа βнn для комплекса MLn называется общей константой нестойкости (неустойчивости) комплекса. Общая константа нестойкости является обратной величиной общей константы устойчивости:
βнn = 1/βn
Как и константа устойчивости, константа нестойкости является количественным показателем устойчивости комплексного соединения в растворе. Прочность комплекса тем больше, чем меньше значение константы нестойкости.
Факторы, влияющие на устойчивость комплекса:
- Внешние факторы: температура, природа растворителя, ионная сила и состав раствора.
- Фундаментальные факторы:
- Природа комплексообразователя, например, устойчивость комплекса [Cu(NH3)2]+ выше, чем устойчивость комплекса [Ag(NH3)2]+, т.е. β2([Cu(NH3)2]+) = 7,2 ·1010 > β2([Ag(NH3)2]+ ) = 1,7· 107. По результатам многих исследований составлен ряд комплексообразователей, в котором устойчивость комплексных соединений, содержащих эти металлы, растет в ряду:
Mn(II) – Fe(II) – Co(II) – Ni(II) – Cu(II).
Природа лиганда и координационное число здесь никакого влияния не оказывают. Данный ряд называют “естественный порядок устойчивости”.
- Природа лигандов, например, устойчивость комплекса [Ag(CN)2]+ выше, чем устойчивость комплекса [Ag(NH3)2]+, т.е. > β2([Ag(NH3)2]+) = 7,1·1019 > β2([Ag(NH3)2]+ ) = 1,7·107.
- Cтерические факторы: хелатный эффект – за счет образования хелатных циклов, полидентантные лиганды образуют более устойчивые комплексы, нежели их монодентантные аналоги.
Стерический эффект — пространственное окружение донорных атомов лиганда, также влияет на устойчивость комплекса.
- Структура лиганда.
Наверное, каждый, кто знаком со школьной химией и интересовался ею хоть немного, знает о существовании комплексных соединений. Это очень интересные соединения с широкими областями применения. Если же вы не слышали о таком понятии, то ниже мы вам всё объясним. Но начнём с истории открытия этого достаточно необычного и интересного вида химических соединений.

История
Комплексные соли были известны ещё до открытия теории и механизмов, позволяющих им существовать. Их назвали по имени химика, который открыл то или иное соединение, и систематических названий для них не было. И, следовательно, нельзя было по формуле вещества понять, какими свойствами оно обладает.
Так продолжалось до 1893 года, пока щвейцарский химик Альфред Вернер не предложил свою теорию, за которую спустя 20 лет и получил Нобелевскую премию по химии. Интересно то, что свои исследования он проводил только с помощью интерпретации различных химических реакций, в которые вступали те или иные комплексные соединения. Сделаны исследования были ещё до открытия электрона Томпсоном в 1896 году, а после этого события, спустя десятки лет, теория была дополнена, в намного более модернизированном и усложнённом виде дошла до наших дней и активно используется в науке для описания явлений, происходящих во время химических превращений с участием комплексов.
Итак, перед тем как перейти к описанию того, что такое константа нестойкости, разберёмся в теории, о которой мы говорили выше.
Теория комплексных соединений
Вернер в своей первоначальной версии координационной теории сформулировал ряд постулатов, которые легли в её основу:
- В любом координационном (комплексном) соединении должен присутствовать центральный ион. Это, как правило, атом d-элемента, реже – некоторые атомы p-элементов, а из s-элементов способен выступать в этом качестве только Li.
- Центральный ион вместе со связанными с ним лигандами (заряженные или нейтральные частицы, например вода или анион хлора) образует внутреннюю сферу комлесного соединения. Она ведёт себя в растворе как один большой ион.
- Внешняя сфера состоит из ионов, противоположных по знаку заряду внутренней сферы. То есть, например, для отрицательно заряженной сферы [CrCl6]3- ионом внешней сферы могут быть ионы металлов: Fe3+, Ni3+ и т. д.
А теперь, если с теорией всё понятно, мы можем перейти к химическим свойствам комплексных соединений и их различиям с обычными солями.

Химические свойства
В растворе комплексные соединения распадаются на ионы, а точнее на внутреннюю и внешнюю сферы. Можно сказать, что они ведут себя как сильные электролиты.
К тому же внутрення сфера тоже может распадаться на ионы, но для того, чтобы это произошло, требуется затратить довольно много энергии.
Внешняя сфера в комплексных соединениях может заменяться другими ионами. Например, если во внешней сфере был ион хлора, а в растворе также присутствует ион, который вместе с внутренней сферой будет давать нерастворимое соединение, или же в растворе есть катион, дающий нерастворимое соединение с хлором, будет происходить реакция замещения внешней сферы.
А теперь, прежде чем перейти к определению того, что такое константа нестойкости, поговорим о явлении, которое напрямую связано с этим понятием.
Электролитическая диссоциация
Вам это слово, наверное, знакомо ещё со школы. Но всё равно дадим определение этому понятию. Диссоциация – это распад молекул растворённого вещества на ионы в среде растворителя. Это происходит благодаря образованию достаточно прочных связей молекул растворителя с ионами растворённого вещества. Например, вода обладает двумя противоположно заряженными концами, и одни молекулы притягиваются отрицательным концом к катионам, а другие – положительным концом к анионам. Так образуются гидраты – ионы, окружённые молекулами воды. Собственно, в этом и состоит суть электролитической диссоциации.
Теперь, собственно, вернемся к основной теме нашей статьи. Что такое константа нестойкости комплексных соединений? Всё достаточно просто, и в следующем разделе мы разберём это понятие подробно и в деталях.
Константа нестойкости комплексных соединений
Этот показатель на самом деле является прямой противоположностью константе устойчиовсти комплексов. Поэтому с неё и начнём.
Если вы слышали про константу равновесия реакции, то легко поймёте нижеизложенный материал. Но а если нет, сейчас мы кратко расскажем об этом показателе. Константа равновесия определяется как отношение концентрации продуктов реакции, возведённых в степени их стехиометрических коэффициентов, к исходным веществам, в которых точно так же учитываются коэффициенты в уравнении реакции. Она показывает, в какую сторону преимущественно пойдёт реакция при той или иной концентрации исходных веществ и продуктов.
Но с чего мы вдруг начали говорить про константу равновесия? На самом деле константа нестойкости и константа устойчивости являются, по сути, константами равновесия соответственно реакций разрушения и образования внутренней сферы комплекса. Связь между ними определяется очень просто: Кн=1/Куст.
Чтобы лучше понять материал, приведём пример. Возьмём комплексный анион [Ag(NO2)2]– и запишем уравнение реакции его распада:
[Ag(NO2)2]– => Ag+ + 2NO2–.
Константа нестойкости комплексного иона этого соединения равна 1,3*10-3. Значит, он достаточно устойчив, но всё же не до такой степени, чтобы считаться очень стабильным. Чем больше устойчивость комплексного иона в среде растворителя, тем меньше константа нестойкости. Формула её может быть выражена через концентрации исходных и реагирующих веществ: Кн=[Ag+]*[2NO2–]2/[[Ag(NO2)2]–].
Теперь, когда мы разобрались с основным понятием, стоит привести немного данных о различных соединениях. В левом столбце написаны названия химических веществ, а в правом – константа нестойкости комплексных соединений.
Таблица
| Вещество | Константа нестойкости |
| [Ag(NO2)2]– | 1.3*10-3 |
| [Ag(NH3)2]+ | 6.8×10-8 |
| [Ag(CN)2]– | 1×10-21 |
| [CuCl4]2- | 2*10-4 |
Более подробные данные по всем известным соединениям приведены в специальных таблицах в справочниках. В любом случае константа нестойкости комплексных соединений, таблица которой для нескольких соединений приведена выше, вряд ли серьёзно поможет вам без использования справочника.

Заключение
После того как мы выяснили, как рассчитать константу нестойкости, остаётся лишь один вопрос – о том, зачем это всё нужно.
Основное назначение этой величины – определение устойчивости комплексного иона. А значит, мы можем предсказать стабильность в растворе того или иного соединения. Это очень помогает во всех сферах, так или иначе связанных с применением комплексных веществ. Приятного изучения химии!
Константы нестойкости комплексных соединений (справочная таблица)
Автор Владислав Панарин На чтение 1 мин Просмотров 19.3к. Опубликовано 31.03.2021 Обновлено 18.07.2022
Константы нестойкости комплексных соединений. Большая справочная таблица с удобным поиском.
Информация
Кнест — константа нестойкости (диссоциации) комплексного соединения.
Вам также может понравиться
Таблица электроотрицательности химических элементов
015.8к.
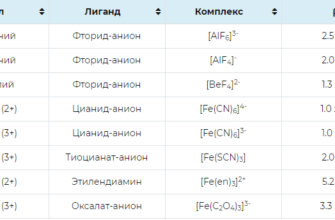
Константы устойчивости комплексных соединений.
127.8к.

Электрохимический ряд напряжений (активности) металлов —
016.8к.
Полезные формулы для расчёта pH растворов электролитов
019.1к.

Таблица растворимости — это наглядная таблица со списком
018.4к.
Длиннопериодная периодическая таблица (система) химических
010.8к.

Короткопериодная периодическая таблица (система) химических
012.2к.
Стандартные окислительно-восстановительные потенциалы
073к.
