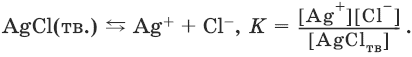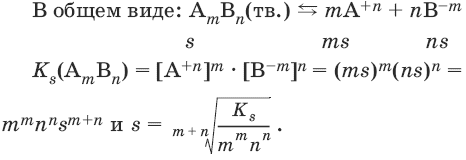Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
В насыщенных водных растворах малорастворимых соединений устанавливается равновесие:
PbCl2(кристалл.) ↔Pb2+(насыщ.р-р) + 2 Cl–(насыщ.р-р)
которое описывается константой равновесия, называемой произведением растворимости (ПР). Величина ПР равна:
ПР = [Pb2+] [Cl–]2
Понятие ПР используется только при описании гетерогенных равновесий в насыщенных растворах малорастворимых сильных электролитов и их твердых фаз. Растворимость вещества равна его концентрации в насыщенном растворе. Насыщенный раствор находится в равновесии с кристаллической фазой.
ПР связано с изменением энергии Гиббса процесса уравнением:
ΔGоT = – RT lnПР (1)
которое используется для расчетов ПР по термодинамическим данным.
Чем меньше величина ПР, тем в меньшей степени осуществляется переход вещества в раствор. Так, PbCl2 более растворим, чем PbI2 (при 25оС ПР(PbCl2) = 1,6·10–5, ПР(PbI2) = 8,2× 10–9), поэтому количественно осаждать ионы Pb2+ лучше в виде йодида, а не хлорида свинца.
Из определенной опытным путем растворимости соединения можно рассчитать ПР и, наоборот, зная ПР соединения, можно рассчитать его растворимость в воде.
Рассмотрим растворение малорастворимого электролита КnАm. В насыщенном растворе этого электролита имеет место равновесие:
КnАm (к) + aq ↔ n Кm+(насыщ.р-р) + m An-(насыщ.р-р)
Произведение растворимости КnАm запишется в виде:
ПР = [Кm+]n [An-]m (2)
Если обозначить растворимость электролита буквой Р, то концентрации катионов и анионов в насыщенном растворе составят:
[Кm+] = nP; [An-] = mP
В результате для величины ПР получаем
ПР = [nP]n [mP]m = nn mm Pn+m (3)
Растворимость симметричных электролитов (содержащих равнозарядные ионы, например, AgCl, BaSO4, AlPO4) рассчитывается как корень квадратный из ПР.
Добавление в раствор малорастворимого электролита, например, AgCl, веществ, содержащих одноименные ионы, в частности, BaCl2 или AgNO3, приводит к уменьшению растворимости этого электролита.
Примеры решения задач
Задача 1. Рассчитайте произведение растворимости карбоната бария, если известно, что при 298 К в 100 мл его насыщенного раствора содержится 1,38× 10-3 г BaCO3.
Решение. М(BaCO3) = 197 г/моль. Растворимость Р карбоната бария равна:
Р(BaCO3) = 7·10–5 моль/л.
В насыщенном растворе карбоната бария:
ВаСО3(к) + aq ↔ Ba2+(насыщ.р-р) + СO32–(насыщ.р-р)
концентрации ионов бария и карбонат-ионов равны. Следовательно,
[Ba2+] = [СO32-] = 7× 10–5 моль/л
Таким образом, растворимость Р карбоната бария равна 7·10–5 моль/л. Величина ПР составит:
ПР = [Ba2+][СO32–] = Р× Р = (7× 10–5)2 = 4,9× 10–9.
Задача 2. Вычислите растворимость PbCl2 в воде (моль/л и г/л), если произведение растворимости при 298 К для этой соли равно 1,6·10–5.
Решение.
PbCl2(к) + aq ↔ Pb2+(насыщ.р-р) + 2 Cl—(насыщ.р-р)
Пусть Р (моль/л) — растворимость PbCl2. Тогда концентрации ионов соли в растворе составят:
[Pb2+] = Р; [Cl–] = 2[Pb2+] = 2P.
ПР(PbCl2) = [Pb2+][ Cl—]2 = Р(2Р)2 = 1,6× 10-5.
Р(PbCl2) = 278× 1,6× 10–2 = 4,413 г/л, где 278 — М(PbCl2) (г/моль)
В этой задаче следует обратить внимание на то, что в квадрат возводится удвоенное значение растворимости: (2Р)2, т.е. растворимость умножается на стехиометрический коэффициент, и полученная величина возводится в степень, равную стехиометрическому коэффициенту.
Задача 3. Вычислите растворимость (моль/л) PbCl2 в 0,1 М растворе KCl, если ПР (PbCl2) = 1,6× 10–5 при 298 К.
Решение. Суммарная концентрация хлорид-ионов составляет
[Cl–] = (2Р + 0,1) моль/л
Хлорид-ионы образуются при диссоциации PbCl2. В его насыщенном растворе:
PbCl2(к) + aq ↔ Pb2+(насыщ.р-р) + 2 Cl—(насыщ.р-р)
а также за счет диссоциации неассоциированного электролита KCl в его 0,1М растворе:
KCl → K+ + Cl—
Запишем выражение для ПР(PbCl2): ПР = Р (2Р + 0,1)2. Слагаемым 2Р по сравнению со вторым слагаемым 0,1 можно пренебречь. Следовательно, ПР = Р(0,1)2. Растворимость PbCl2, равная концентрации ионов Pb2+, составляет Р = 1,6·10–3 моль/л.
В воде растворимость PbCl2 равна 1,6× 10–2 моль/л (см. предыдущую задачу), в растворе KCl растворимость PbCl2 уменьшилась и составила 1,6× 10–3 моль/л.
Задача 4. Смешали 100 мл 0,01 н раствора CuCl2 и 300 мл 0,1 н раствора Na2S. Выпадет ли осадок cульфида меди, если ПР(CuS) = 6,3× 10–36? Примите, что соли в растворе диссоциированы полностью и объем полученного раствора равен 400 мл.
Решение. Осадок выпадет, если [Сu2+][S2–] > ПР(СuS), т.е. если произведение концентраций ионов Сu2+ и S2– в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
Молярные концентрации растворов равны:
См (СuCl2) = 1/2× 0,01 = 0,005M
См (Na2S) = 1/2× 0,1 = 0,05M
До смешения растворов: [Сu2+] = 0,005 M, [S2–] = 0,05М.
После смешения растворов концентрации ионов изменятся и станут равными:
[Сu2+] = 0,005× 0,1:0,4 = 0,00125M
[S2–] = 0,05× 0,3:0,4 = 0,0375М
Следовательно, произведение концентраций ионов равно:
[Сu2+][S2–] = 0,00125× 0,0375 = 4,7× 10–5(моль/л)2
Поскольку [Сu2+][S2–] = 4,7·10–5 >> 6,3·10–36, то осадок выпадет.
Задача 5. При 298 К произведение растворимости BaSO4 равно 1× 10–10. Определите, в каком объеме воды растворяется 1 г сульфата бария.
Решение.
BaSO4(к) + aq ↔ Ba2+(насыщ.р-р) + SO42– (насыщ.р-р)
Примем растворимость BaSO4 за Р моль/л.
Растворимость BaSO4 равна концентрации ионов Ba2+ и SO42– в растворе: [Ba2+] = [SO42–].
ПР(BaSO4) = [Ba2+]·[SO42–] = Р·Р = 1× 10-10
Р = √ПР = 1× 10-5 моль/л или 233× 10–5 = 2,33× 10–3 г/л,
где 233 — М(BaSO4) (г/моль).
Следовательно, 1 г BaSO4 растворяются в 1/2,33× 10–3 = 429,2 л воды.
Задачи для самостоятельного решения
1. При некоторой температуре растворимость карбоната серебра равна 10-4 моль/л. Рассчитайте ПР этой соли.
2. При некоторой температуре в 20 л воды растворяется 4×10-3 моль фторида кальция. Рассчитайте ПР этой соли.
3. При некоторой температуре в 10 л воды растворяется 1,112 г хлорида свинца. Рассчитайте ПР этой соли.
4. При некоторой температуре рН насыщенного раствора гидроксида кальция составляет 13. Рассчитайте величину ПР этого основания.
5. ПР сульфата серебра при комнатной температуре составляет 5,02× 10-5. Рассчитайте растворимость этой сли в воде. Какой объем воды понадобится для растворения 1 г этой соли?
6. Вычислить растворимость Ag2SO4 в воде (моль/л и г/л), если произведение растворимости при 298 К для этой соли равно 1,2× 10–5.
7. Вычислить растворимость (моль/л) Ni(OH)2 в 0,15 М растворе Ni(NO3)2, если ПР(Ni(OH)2) = 1,2× 10–16 при 298 К.
8. Смешали 150 мл 0,1 н раствора FeCl2 и 350 мл 0,01 М раствора NaOH. Выпадет ли осадок Fe(OH)2, если ПР(Fe(OH)2) = 1,6× 10–15. Принять, что объем полученного раствора равен 500 мл (осаждение гидроксида проводят в инертной атмосфере).
|
Произведение концентраций ионов равно: |
9. При 298 К произведение растворимости Ag2CrO4 равно 4,7× 10–12. Определить, сколько г Ag2CrO4 можно растворить в 100 л воды при этой температуре.
10. При 298 К растворимость PbS в 0,015 М водном растворе K2S равна 4,1× 10–26 моль/л. Определить Go298 процесса растворения PbS.
В
системе, состоящей из раствора и осадка,
идут два процесса – растворение осадка
и осаждение. Равенство скоростей этих
двух процессов является условием
равновесия.
Насыщенный
раствор – это раствор, который находится
в равновесии с осадком.
Применим
закон действия масс к равновесию между
осадком и раствором.
AgCl(тв.)
Ag+
+ Cl–
Поскольку
[AgClтв]
= const, имеем:
К[AgClтв]
= KSAgCl
=[Ag+][Cl–]
В общем виде имеем:
AmBn(тв.)
mA+n
+ nB-m
и KS(AmBn)
= [A+n]m[B-m]n.
Константа
растворимости
KS
(или
произведение растворимости ПР) –
произведение концентраций ионов в
насыщенном растворе малорастворимого
электролита – есть величина постоянная
и зависит лишь от температуры.
Примеры
величин KS
для ряда солей:
KS(AgCl)
= 1,610-10
KS(Ag2CrO4)
= 1,110-12
KS(Ag2S)
= 610-50.
Растворимость
малорастворимого
вещества s может быть выражена в молях
на литр. В зависимости от величины s
вещества могут быть разделены на
малорастворимые – s < 10-4
моль/л, среднерастворимые – 10-4
моль/л
s
10-2
моль/л
и хорошо растворимые s >10-2
моль/л.
Растворимость
соединений связана с их константой
растворимости. Для AgCl имеем:
AgCl(тв.)Ag+
+ Cl–
s
s s
Растворимость
s – молярная концентрация AgCl в растворе:
s
= [AgClр–р]
= m/(MV)
[AgClр–р]
= s = [Ag+]
= [Cl–].
Отсюда
KS
AgCl
= [Ag+][Cl–]
= s2
и
s=.
В
общем виде для AmBn
имеем: AmBn(тв.)mA+n
+ nB-m
s
ms ns
KS(AmBn)
= [A+n]m[B-m]n
=
(ms)m(ns)n
= mmnnsm+n.
Пример.
Найти растворимость AgCl (KS=1,610-10)
и Ag2CrO4
(KS=
1,210-12).
Решение.
AgCl
Ag+
+ Cl–
,
KS
= s2,
s ==
1,3410-5
моль/л.
Ag2CrO4
2Ag+
+ CrO42-
s
2s s
KS
= (2s)2s
= 4s3,
s =
= 6,510-5
моль/л.
Хотя
обычно растворимость тем меньше, чем
меньше KS,
в данном случае для соединений разных
типов s(AgCl) < s(Ag2CrO4),
хотя KS(AgCl)
> KS(Ag2CrO4).
Условие осаждения и растворения осадка
Для
равновесия между осадком и раствором
– насыщенного раствора – имеем в случае
AgCl:
AgClAg+
+ Cl–
[Ag+][Cl–]
= KS.
Условие
осаждения записывается в виде: [Ag+][Cl–]
> KS
В
ходе осаждения концентрации ионов
уменьшаются до установления равновесия.
Условие
растворения осадка или существования
насыщенного раствора записывается в
виде: [Ag+][Cl–]
< KS.
В
ходе растворения осадка концентрация
ионов увеличивается до установления
равновесия.
Эффект общего иона
Добавление
общего иона уменьшает растворимость
малорастворимых соединений.
Пример.
Найдем растворимость AgCl в 0,1 М растворе
NaCl.
Решение.
AgCl
Ag+
+ Cl–
s
s s+0,10,1
KS
AgCl
= [Ag+][Cl–]
= s
0,1 = 1,610-10,
s = 1,610-9
моль/л.
Растворимость
AgCl в воде (см. выше) равна 1,3410-5
моль/л, растворимость AgCl в 0,1М NaCl – 1,610-9
моль/л, т.е. в 104
раз меньше.
Солевой эффект
Увеличение
ионной силы раствора увеличивает
растворимость малорастворимых соединений.
Поскольку
концентрации ионов, образующихся при
диссоциации малорастворимых соединений,
а также ионная сила получаемых растворов
малы, то оказывается возможным использовать
в выражениях KS
концентрации ионов, а не их активности.
В тех случаях, когда в растворе присутствуют
сильные электролиты, обусловливающие
большую ионную силу раствора, необходимо
в выражении для KS
подставлять активность ионов.
Определим
растворимость AgCl в 0,1 М NaCl с учетом ионной
силы раствора
AgCl
Ag+
+ Cl–
s
s s+0,10,1
Для
0,1М NaCl
= 0,1 и fAg+
= fCl–
= 0,78.
KS
= aAg+aCl–
= fAg+[Ag+]fCl-[Cl–]
= 0,78s0,780,1
= 1,610-10,
s
= 1,610-9/(0,78)2
= 2,610-9
M, т. е. в 1,64 раза больше, чем без учета
ионной силы раствора. Солевой эффект
значительно меньше эффекта одноименного
иона.
Пример.
Растворимость Mg(OH)2
равна 0,012 г/л. Найти KS.
Решение.
М(Mg(OH)2)
= 58 г/моль, s = 0,12г/л / 58г/моль =
=
2,0710-4М.
Mg(OH)2
Mg2+
+ 2OH–
KS
= [Mg2+][OH–]2
= s(2s)2
= 4s3
= 4(2,0710-4)3
= 3,610-11.
Пример.
Выпадает ли осадок PbCl2
при смешивании равных объемов растворов
0,1M Pb(NO3)2
и 0,1M NaCl, если KS(PbCl2)
=
=
1,610-5.
Решение.
После смешивания растворов концентрации
ионов уменьшатся в два раза, т.е. имеем:
[Pb2+]
= [Na+]
= [Cl–]
= 0,05M, а [NO3–]
= 0,1 M. Находим ионную силу раствора:
=
1/2(0,0522
+ 0,112
+ 0,0512
+ 0,0512)
= 0,2.
Находим
коэффициенты активности: fPb2+
= 0,24 и fCl–
= 0,70.
Имея
для PbCl2Pb+2
+ 2Cl–
KS
PbCl2
= aPb2+aCl–2,
вычисляем величину aPb2+aCl–2
для нашего раствора:
aPb2+aCl–2
= fPb2+[Pb2+](fCl-[Cl–])2
= 0,240,050,7020,052
= 1,4710-5
, что меньше, чем ПРPbCl2
(1,610-5),
поэтому осадка не образуется.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В системе, состоящей из раствора и осадка, идут два процесса – растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия.
Насыщенный раствор – раствор, который находится в равновесии с осадком.
Закон действия масс в применении к равновесию между осадком и раствором дает:
Поскольку [AgClтв] = const,
К • [AgClтв] = Ks(AgCl) = [Ag+] • [Cl?].
В общем виде имеем:
АmBn(тв.) ? mA+n + nB-m
Ks(AmBn) = [А+n]m • [В-m]n.
Константа растворимости Ks
(или произведение растворимости ПР) – произведение концентраций ионов в насыщенном растворе малорастворимого электролита – есть величина постоянная и зависит лишь от температуры.
Растворимость малорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые – s < 10-4 моль/л, среднерастворимые – 10-4 моль/л ? s ? 10-2 моль/л и хорошо растворимые s >10-2 моль/л.
Растворимость соединений связана с их произведением растворимости.
Условие осаждения и растворения осадка
В случае AgCl: AgCl ? Ag+ + Cl?
Ks
= [Ag+] • [CI?]:
а) условие равновесия между осадком и раствором: [Ag+] • [Cl?] = Ks.
б) условие осаждения: [Ag+] • [Cl?] > Ks; в ходе осаждения концентрации ионов уменьшаются до установления равновесия;
в) условие растворения осадка или существования насыщенного раствора: [Ag+] • [Cl?] < Ks; в ходе растворения осадка концентрация ионов увеличивается до установления равновесия.