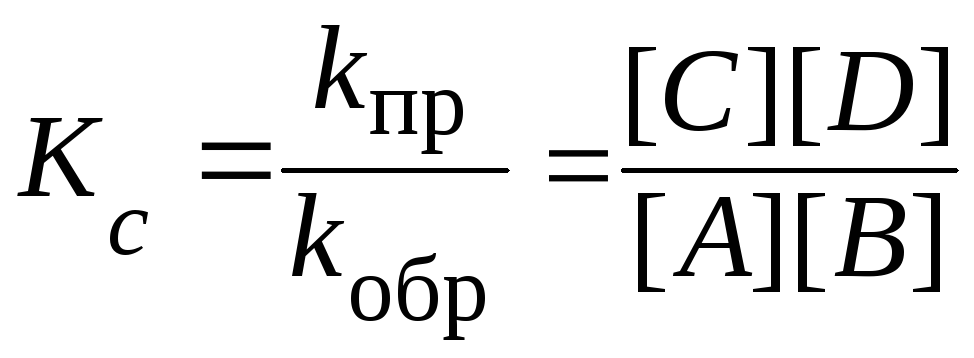Лекция по теме«Химическое равновесие»
Учебные
вопросы
-
Состояние равновесия
-
Константа
равновесия -
Расчет
равновесных концентраций -
Смещение
химического равновесия. Принцип Ле
Шателье
-
Состояние равновесия
Реакции,
протекающие при одних и тех же условиях
одновременно в противоположных
направлениях, называются обратимыми.
Рассмотрим
обратимую реакцию, которая протекает
в закрытой системе
A
+ B
C
+ D
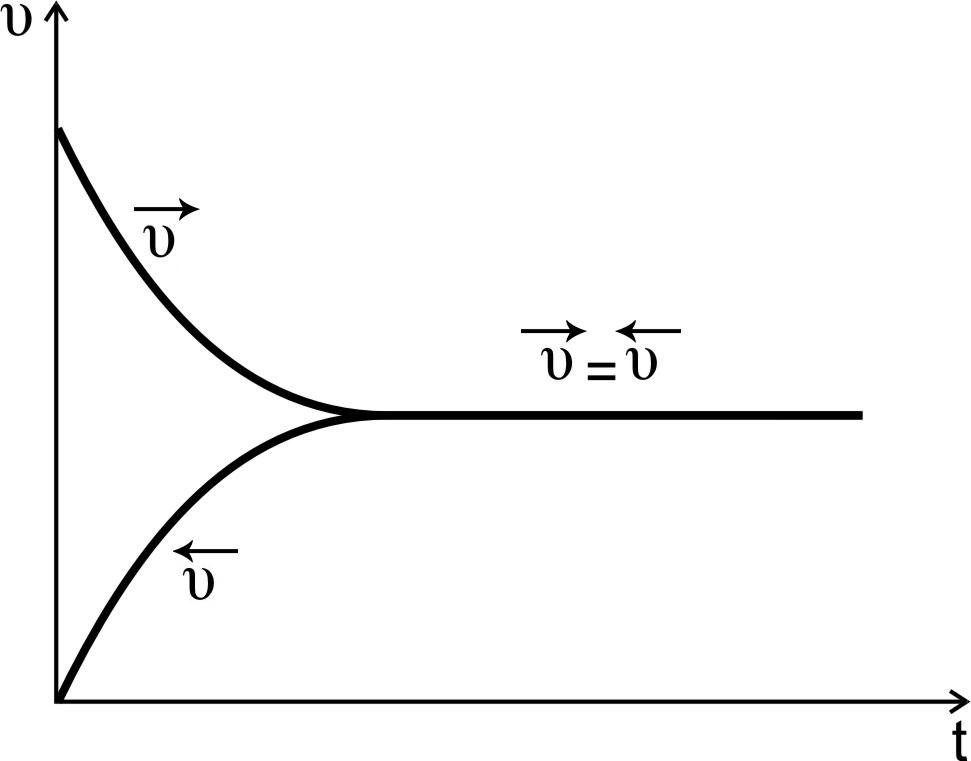
Скорость
прямой реакции описывается уравнением:
пр
= k
пр
[A]
[B],
где
пр
–
скорость прямой реакции;
k
пр
–
константа скорости прямой реакции.
С
течением времени концентрации реагентов
А
и В
уменьшаются, скорость реакции падает
(рис.1, кривая
пр).
Реакция
между А
и В
приводит к образованию веществ C
и D,
молекулы которых при столкновениях
могут вновь дать вещества А
и В.
Скорость
обратной реакции описывается уравнением:
обр
= k
обр
[С] [D],
где
обр
–
скорость обратной реакции;
k
обр
–
константа скорости обратной реакции.
По
мере того как концентрации веществ C
и D
возрастают, скорость обратной реакции
растет (рис.1, кривая
обр).
Рис.1. Изменение скоростей
прямой и обратной реакций во времени
Через
некоторое время скорости
прямой и обратной реакций становятся
равными:
пр
=
обр
Такое
состояние системы называется состоянием
равновесия.
В
состоянии равновесия концентрации всех
его участников перестают меняться во
времени.
Такие
концентрации называются
равновесными.
Химическое
равновесие
– это
динамическое равновесие. Неизменность
концентраций веществ, присутствующих
в закрытой системе, есть следствие
непрерывно идущих химических процессов.
Скорости прямой и обратной реакции не
равны нулю, а нулю равна наблюдаемая
скорость процесса.
Равенство
скоростей прямой и обратной реакций –
это кинетическое условие химического
равновесия.
2. Константа равновесия
При
равенстве скоростей прямой и обратной
реакции
пр
=
обр
справедливо
равенство
k
пр[A]
[B]
= k
обр
[С]
[D],
где
[A],
[B],
[С],
[D]
– равновесные концентрации веществ.
Поскольку
константы скоростей не зависят от
концентраций, равенство можно записать
иначе:
Отношение
констант скоростей прямой и обратной
реакций ( kпр/kобр)
называют константой химического
равновесия:
|
|
Истинное
химическое равновесие может устанавливаться
только в том случае, если равновесны
все элементарные стадии механизма
реакции. Сколь бы сложны ни были механизмы
прямой и обратной реакций, но в состоянии
равновесия они должны обеспечить
стехиометрический переход исходных
веществ в продукты реакции и обратно.
Это значит, что алгебраическая сумма
всех стадий процесса равна стехиометрическому
уравнению реакции, т.е. стехиометрические
коэффициенты представляют собой сумму
молекулярностей всех стадий механизма.
Для
сложной реакции
aA
+ bB
cC
+ dD
|
Кс |
Для
одной и той же температуры отношение
произведения равновесных концентраций
продуктов реакции в степенях, равных
стехиометрическим коэффициентам, к
произведению равновесных концентраций
исходных веществ в степенях, равных
стехиометрическим коэффициентам,
представляет постоянную величину.
Это
вторая формулировка закона действующих
масс.
В
выражение константы равновесия
гетерогенной реакции входят только
концентрации веществ, находящихся в
жидкой или газообразной фазе, так как
концентрации твердых веществ остаются,
как правило, постоянными.
Например,
выражение для константы равновесия
следующей реакции
СО2
(г)
+ С(тв)
2СО(г)
записывается
так:
Кс
=

Уравнение
константы равновесия показывает, что
в условиях равновесия концентрации
всех веществ, участвующих в реакции,
связаны между собой. Численное значение
константы равновесия определяет, каким
должно быть соотношение концентраций
всех реагирующих веществ при равновесии.
Изменение
концентрации любого из этих веществ
влечет за собой изменения концентраций
всех остальных веществ. В итоге
устанавливаются новые концентрации,
но соотношение между ними вновь отвечает
константе равновесия.
Величина
константы равновесия зависит от
природы
реагирующих веществ и температуры.
Константа
равновесия, выраженная через молярные
концентрации реагирующих веществ (Кс)
и константа равновесия, выраженная
через равновесные парциальные давления
(Кр)
(см. «Основы химической термодинамики»),
связаны между собой соотношениями:
Кр
= Кс
RT
,
Kc
=
Кр
/ (RT)
,
где
– изменение числа газообразных молей в
реакции.
Стандартное
изменение энергии Гиббса равно
GТ
= – RT
ln
Kp,
а
также
GТ
=
H
– T
S.
После
приравнивания правых частей уравнений:
–
RT
ln
Kp
=
H
– T
S
или
ln
K
р
= –
H
/ (RT)
+
S/R
.
Уравнение
не только устанавливает вид зависимости
константы от температуры, но и показывает,
что константа определяется природой
реагирующих веществ.
Константа
равновесия не зависит от концентраций
(как и константа скорости реакции),
механизма реакции, энергии активации,
от присутствия катализаторов.
Смена механизма, например, при введении
катализатора, не влияет на численное
значение константы равновесия, но,
конечно, меняет скорость достижения
равновесного состояния.
Соседние файлы в папке Кинетика_лекции
- #
- #
- #
- #
Обратимые и необратимые химические реакции. Понятие о химическом равновесии. Решение задач
На уроке будет рассмотрена тема «Обратимые и необратимые химические реакции. Химическое равновесие», будут рассматриваться факторы, влияющие на смещение химического равновесия. Вы познакомитесь с принципом Ле Шателье. Вводится понятие обратимых и необратимых реакций.
I. Понятие прямой и обратной реакции
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
А+В→АВ, прямая реакция
Но многие химические реакции могут идти в обратную сторону.
АВ 
Для краткости такую реакцию записывают, используя две стрелки, одну – вперед, другую – назад.
А+В
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н2 + I2
Скорость химической реакции увеличивается с увеличением концентрации исходных веществ и соответственно уменьшается с уменьшением концентрации исходных веществ. Получается, что, по мере прохождения реакций, скорость прямой реакции будет уменьшаться, т. к. исходные вещества будут расходоваться. А скорость обратной реакции будет возрастать, потому что концентрация вещества АВ исходного для обратной реакции будет постепенно увеличиваться. До каких пор скорость прямой реакции будет уменьшаться, а обратной увеличиваться? Это будет до того момента, когда скорости прямой и обратной реакции станут равными. Наступит химическое равновесие. Рис. 1.
Рис. 1
Химическое равновесие– это состояние реакционной системы, в котором скорости прямой и обратной реакции равны.
II. Константа равновесия
Равновесная концентрация веществ
Равновесная концентрация веществ – это концентрации веществ в реакционной смеси, находящихся в состоянии химического равновесия. Равновесная концентрация обозначается химической формулой вещества, заключенной в квадратные скобки.
Например, следующая запись
Рис. 2
Химическое равновесие (Рис. 2) отличается от привычного для нас понятия «равновесие». Химическое равновесие – динамическое. В системе, находящейся в состоянии химического равновесия, происходят и прямая, и обратная реакции, но их скорости равны, и поэтому концентрации участвующих веществ не меняются. Химическое равновесие характеризуется константой равновесия, равной отношению констант скоростей прямой и обратной реакций.
Константы скорости прямой и обратной реакции – это скорости данной реакции при концентрациях исходных для каждой из них веществ в равных единицах. Также константа равновесия равна отношению равновесных концентраций продуктов прямой реакции в степенях стехиометрических коэффициентов к произведению равновесных концентраций реагентов.
Если 

III. Обратимые и необратимые химические реакции
Если константа равновесия значительно больше 1, такую реакцию называют необратимой.
Необратимыми называются химические реакции, которые происходят только в одном направлении до полного расходования одного из реагентов.
Например, это реакция:
4Р+5О2 =2Р2О5 (2)
Обратимыми называются химические реакции, которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях.
IV. Факторы, влияющие на смещение равновесия
Если изменить внешние условия, то состояние химического равновесия нарушится. Смещение равновесия в зависимости от изменения внешних условий в общем виде определяется
Принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении.
Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. Какие факторы можно изменять, чтобы сместить равновесие? Это
· Температура
· Давление
· Концентрации веществ
Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций не оказывают влияние на смещение химического равновесия.
Рассмотрим влияние факторов на смещение химического равновесия более детально.
1. Влияние температуры
Реакция синтеза аммиака относится к экзотермическим реакциям. При прохождении прямой реакции теплота выделяется, а при прохождении обратной – поглощается.
Правило: Если увеличить температуру, то, согласно правилу Ле Шателье, равновесие сместится в таком направлении, чтобы уменьшить это воздействие.
В данном случае влево, так как теплота поглощается. Реакция синтеза аммиака проводится при температуре около 500
Если реакция эндотермическая, то повышение температуры приведет к смещению равновесия вправо.
2. Изменение концентрации веществ
Правило:При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ – в сторону реакции его образования.
Например, при увеличении концентрации азота в реакции синтеза аммиака, равновесие сместится вправо, т. е. в сторону расходования азота. Если же в этой реакции удалять из реакционной смеси аммиак, то равновесие сместится в сторону его образования. Сделать это можно, например, при растворении аммиака в воде.
3. Изменение давления
Правило:Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. При увеличении давления химическое равновесие смещается в сторону уменьшения объемов веществ.
Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака.
Если число моль газа одинаково и слева и справа, например, в реакции получения оксида азота (II),
N2 +O2
то изменение давления не будет оказывать влияние на положение химического равновесия в таких реакциях. Изучение химического равновесия имеет большое значение, как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Окончательный выбор условий требует учета влияния их и на скорость процесса.
Видео “Химическое равновесие в растворах”
V. Примеры решения задач
Задача №1. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) = 2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2]= a, [О2] = b, [SO3] = с.Согласно закону действия масс скорости v прямой и обратной реакции до изменения объема:
vпр = Ка2b
vобр = К1с2
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b; [SO3] = 3с. При новых концентрациях скорости v’ прямой и обратной реакции:
v’пр = К(3а)2(3b) = 27Ка2b
v’обр = К1(3с)2 = 9К1с2
Отсюда:
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Задача №2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции νТ2 при температуре 70оС больше скорости реакции νТ1при температуре 30оС в 16 раз.
Задача № 3. Константа равновесия гомогенной системы: СО(г) + Н2О(г) = СО2(г) + Н2(г)
при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх =3 моль/л, [Н2О]исх = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
vпр = К1 [СО][Н2О]
vобр = К2[СО2][Н2]
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ:
[СО2]р = [Н2]р = х моль/л;
[СО]р = (3 – х) моль/л;
[Н2О]р = (2 – х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
Таким образом, искомые равновесные концентрации:
[СО2]р = 1,2 моль/л;
[Н2]р= 1,2 моль/л;
[СО]р = 3 – 1,2 = 1,8 моль/л;
[Н2О]р = 2 – 1,2 = 0,8 моль/л.
Задача № 4. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г) ↔ 2CO2(г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определить константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение:
1). Так как в условии задачи даны равновесные концентрации, то константа равновесия равна 2:
2). Если исходная смесь не содержала СО2, то на момент химического равновесия в системе образовалось 0,16 моль СО2.
По УХР: 2CO(г) + O2(г) ↔ 2CO2(г)
На образование 0,16 моль СО2 затрачено:
υпрореагировавшее(СО)=υ(CO2)=0,16 моль
υпрореагировавшее(О2)=1/2υ(CO2)=0,08 моль
Следовательно,
υисходное = υпрореагировавшее + υравновесное
υисходное (СО)=0,16 +0,2 = 0,36 моль
υисходное (O2)=0,08 +0,32 = 0,4 моль
|
Вещество |
CO |
O2 |
CO2 |
|
Сисходная |
0,36 |
0,4 |
0 |
|
Спрореагировавшая |
0,16 |
0,08 |
0,16 |
|
Сравновесная |
0,2 |
0,32 |
0,16 |
Задача № 5. Определить равновесную концентрацию HI в системе H2(г) + I2(г) ↔ 2HI(г), если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени образовалось x моль/л HI
|
Вещество |
H2 |
I2 |
HI |
|
сисходн., моль/л |
1 |
2 |
0 |
|
спрореагир., моль/л |
х/2 |
х/2 |
x |
|
cравн., моль/л |
1-x/2 |
2-x/2 |
x |
Тогда,
Решая это уравнение, получаем, что равновесная концентрация HI равна 1,33 моль/л.
Задача №6. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: PCl5(г) = РСl3(г) + Сl(г); ΔН = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесно, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (ΔН > 0) то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентрации РСl3 или Сl2.
VI. Решите задачи
Задача №1. Исходные концентрации СO и O2 в обратимой реакции 2CO(г) + O2(г)↔ 2CO2(г) равны соответственно 6 и 4 моль/л. Вычислите константу равновесия, если концентрацияCO2 в момент равновесия равна 2 моль/л.
Задача №2. Реакция протекает по уравнению 2SO2(г) + O2(г) = 2SO3(г) + Q
Укажите, куда сместится равновесие, если
а) увеличить давление
б) повысить температуру
в) увеличить концентрацию кислорода
г) введение катализатора?
ЦОРы
Видео:“Химическое равновесие в растворах”
Химическое равновесие – состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно
предлагают похожий вариант, однако говорят о “равенстве концентраций исходных веществ и продуктов” – это грубая ошибка. Химическое равновесие –
равенство скоростей.
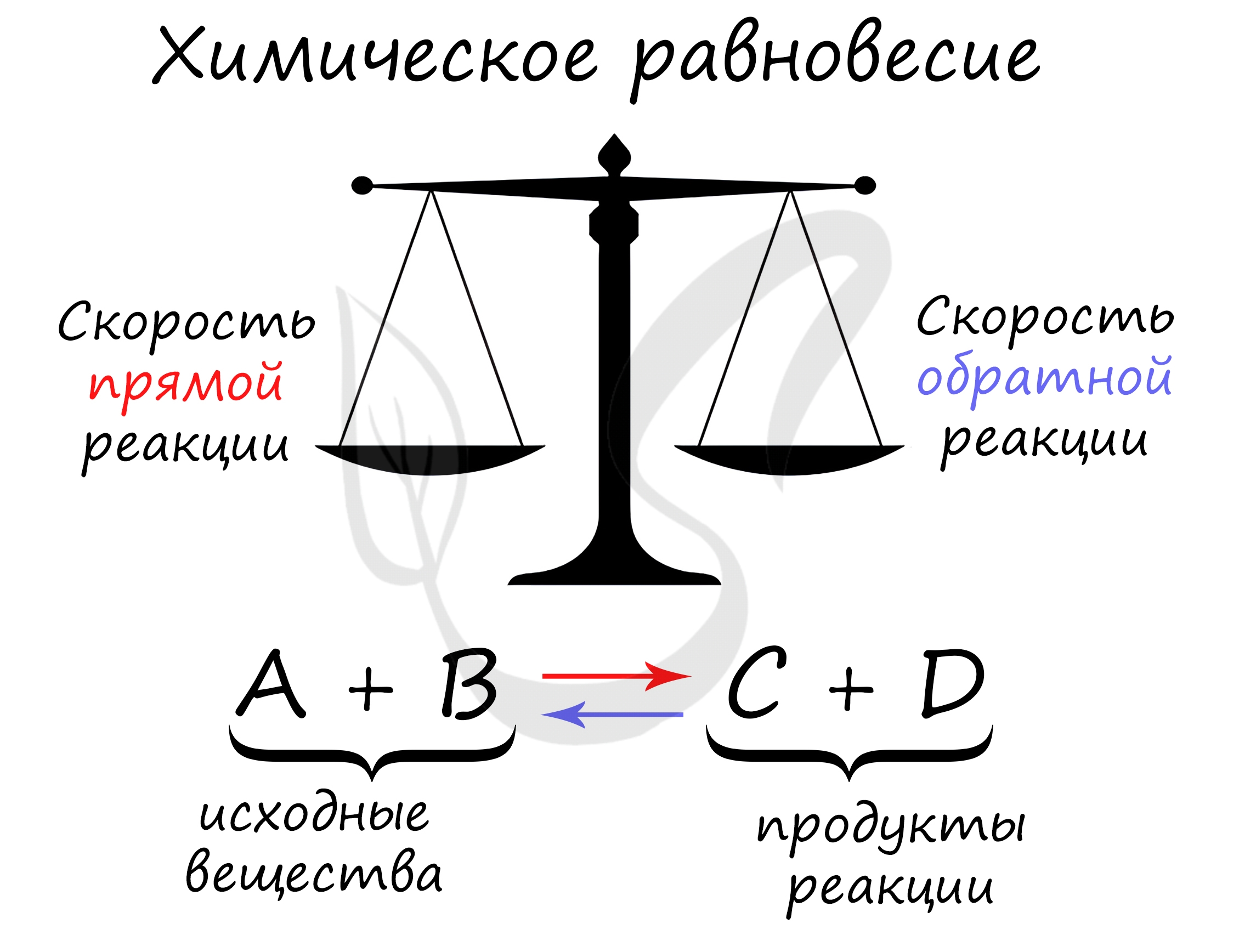
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать
внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных
задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно
справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие:
равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону.
Если добавляете вещество из левой части (продуктов реакции) – смещается в сторону исходных веществ. Посмотрите на пример ниже.

Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить “пустое”
место, которые мы создали. Наглядно демонстрирую на примере:
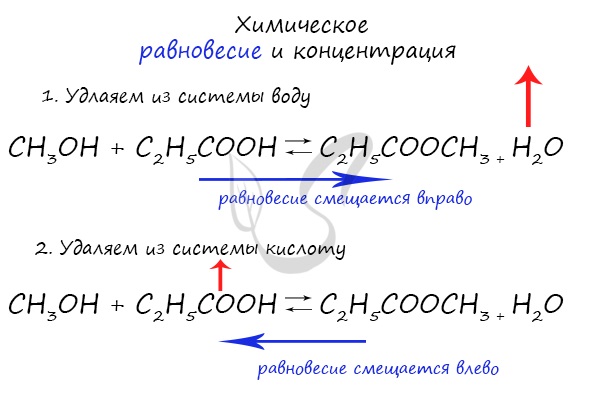
Можно подвести итог полученным знаниям таким образом: “Куда добавляем – оттуда смещается, откуда берем – туда смещается”. Воспользуйтесь
этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа.
Твердые вещества и жидкости считать не нужно. Например:
CO2(г) + С(тв) ⇄ 2CO(г) – Q
В приведенном уравнении количество молекул газа в левой части – 1, в правой – 2.
Запомните правило: “При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления – в сторону больших газов”.
Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
H2(г) + I2(г) ⇄ 2HI(г) – Q
Слева – 2 газа, и справа – 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или
эндотермическая.
Следуйте следующему правилу: “При увеличении температуры равновесие смещается в сторону эндотермической реакции, при
уменьшении – в сторону экзотермической реакции”. У любой обратимой реакции есть экзо- и эндотермические части:
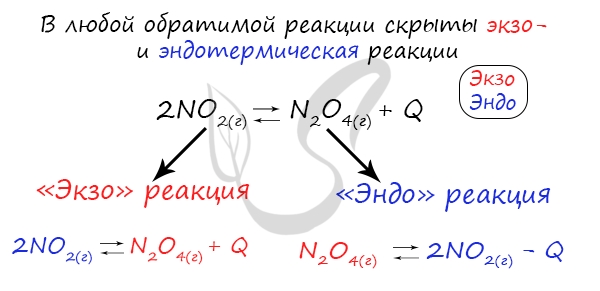
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
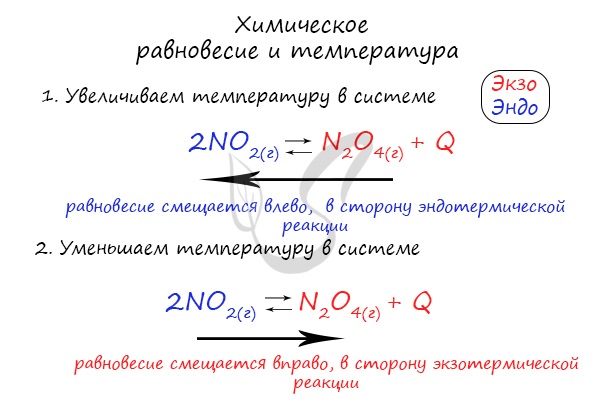
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа
равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации
веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10-1.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химическая кинетика
| Напечатано:: | Гость |
| Дата: | среда, 24 мая 2023, 02:20 |
Описание
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
Оглавление
- 1. Скорость химической реакции
- 1.1. Кинетическое уравнение химической реакции. Порядок реакции
- 1.2. Реакции нулевого порядка
- 1.3. Реакции первого порядка
- 1.4. Реакции второго порядка
- 1.5. Методы определения порядка реакции
1. Скорость химической реакции
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
(II.1)
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
(II.2)
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
(II.3)
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
2Н2 + О2 → 2Н2О
концентрации водорода, кислорода и воды изменяются в различной степени:
ΔС(Н2) = ΔС(Н2О) = 2 ΔС(О2).
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + … → еЕ + …
можно записать
(II.4)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
1.1. Кинетическое уравнение химической реакции. Порядок реакции
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + … → еЕ + …
можно записать
(II.4)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
1.2. Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
(II.5)
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
1.3. Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А → В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
(II.6)
(II.7)
После интегрирования выражения (II.7) получаем:
(II.8)
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
(II.9)
Рис. 2.3 Зависимость логарифма концентрации от времени для реакций первого порядка.
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
(II.10)
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
(II.11)
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
(II.12)
Отсюда
(II.13)
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
1.4. Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
(II.14)
либо
(II.15)
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
(II.16)
После разделения переменных и интегрирования получаем:
(II.17)
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
(II.18)
Таким образом, для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
(II.19)
(II.20)
Рис. 2.4 Зависимость обратной концентрации от времени для реакций второго порядка.
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
(II.21)
В этом случае для константы скорости получаем выражение
(II.22)
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции. Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
СН3СООС2Н5 + Н2О → СН3СООН + С2Н5ОН
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
(II.23)
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
1) Избыток воды:
(II.24)
(II.25)
2) Избыток этилацетата:
(II.26)
(II.27)
В этих случаях мы имеем дело с так назывемой реакцией псевдопервого порядка. Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
1.5. Методы определения порядка реакции
Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных частных порядков эти зависимости имеют следующий вид:
|
Порядок реакции |
Зависимость концентрации от времени |
|
1 |
|
|
2 |
|
|
3 |
|
Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться прямой линией. Если, например, график, построенный по опытным данным, оказался прямолинейным к координатах lnC = f(t), то частный порядок реакции по данному веществу равен единице.
Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
|
Порядок реакции |
Выражение для константы скорости |
|
1 |
|
|
2 |
|
|
3 |
|
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.
|
Порядок реакции |
Выражение для периода полупревращения |
|
1 |
|
|
2 |
|
|
3 |
|
По характеру зависимости t1/2 от Co нетрудно сделать вывод о порядке реакции по данному веществу. Данный метод, в отличие от описанных выше, применим и для определения дробных порядков.