Зависимость скорости реакции от температуры
Скорость большинства
химических реакций с повышением
температуры возрастает. Это зависимость
приближённо описывается эмпирическим
правилом Вант-Гоффа: при повышении на
каждые 10 градусов скорость химической
реакции увеличивается в 2-4 раза.
Математически
правило Вант-Гоффа можно выразить
следующей математической зависимостью:
![]() ,
,
(96)
где v1
–cкорость реакции
при температуреt1; v2– скорость реакции при температуреt2; γ– температурный коэффициент скорости,
равный 2-4 для разных реакций.
Более точно
зависимость константы скорости от
температуры описывается уравнением
Аррениуса:
k =
P·Z·e![]() , (97)
, (97)
где k
– константа скорости реакции;Z– частота столкновений (число столкновений
в единице объёма за единицу времени),
измеряется в единицах константы скорости;R– газовая постоянная,
кДж/моль∙К; Т – абсолютная температура,
К; Еа– энергия активации, кДж/моль.
Под энергией
активации понимают минимальный избыток
энергии (по сравнению с величиной средней
энергии молекул), которым должны обладать
молекулы для того, чтобы реакция между
ними стала возможной. Такие молекулы
называются активными.
Множитель e![]() называют экспоненциальным; он характеризует
называют экспоненциальным; он характеризует
долю активных столкновений молекул от
их общего числа. Из уравнения Аррениуса
вытекает, что доля активных столкновений,
а, значит, и константа скорости тем
больше, чем меньше энергия активации и
чем выше температура. С увеличением
температуры повышается кинетическая
энергия молекул, а, следовательно, и
доля активных молекул.
В уравнение
Аррениуса введён также поправочный
множитель Р (стерический фактор),
учитывающий ориентацию сложных молекул
в пространстве в момент столкновения
по отношению друг к другу. Чем сложнее
участвующие в реакции молекулы, тем
меньше Р, а значит, и скорость реакции.
Уравнение Аррениуса
можно представить также в виде:
![]() ,
,
(98)
где k1,
k2–
константы скорости соответственно при
температурах Т1и Т2.
Уравнение (98)
используют для вычисления константы
скорости реакции при заданной температуре,
если известна величина её для другой
(близкой) температуры и величина Еа.
Интервал температур Т1и Т2необходимо брать близким, так как в
широком диапазоне Еазаметно
изменяется. Можно также по двум константам
скоростей, измеренным при двух близких
температурах, вычислить энергию активации
данной реакции.
Пример 14. Реакция
между веществами А и В выражается
уравнением
2А + В → С
Начальная
концентрация вещества А равна 3,2 моль/л,
а вещества В – 1,6 моль/л. Константа
скорости реакции 0,75. какова скорость
реакции в начальный момент и по истечении
некоторого времени, когда концентрация
вещества А уменьшилась на 0,5 моль/л?
Решение.
Используем уравнение (86) для
вычисления скорости реакции в начальный
момент
v0
= k ·(с![]() )2
)2
·с![]() =
=
0,75·(3,2)2·1,6 = 12,29.
По истечении
некоторого времени, когда концентрация
вещества А уменьшится на 0,5 моль/л,
концентрация вещества В (в соответствии
с уравнением химической реакции) должна
уменьшится на 0,25 моль, т.е.
сВ= 1,6 – 0,25
= 1,35 моль/л.
Следовательно,
скорость реакции станет равной
v1
= k ·(с![]() )2
)2
·с![]() или
или
v1
=0,75· (2,7)2 · 1,35 = 7,38.
Пример 15. Реакция
разложения пероксида водорода в водном
растворе протекает как реакция первого
порядка. Период полураспада при данном
условии равен 15,86 мин. Определить, какое
время потребуется для разложения (при
заданных условиях) 99% пероксида водорода.
Решение. По
периоду полураспада, используя выражение
(91), вычислим константу скорости разложения
перикиси водорода:
k
=![]() .
.
Зная константу,
определяем время, за которое разложится
99% перекиси водорода:
k
=![]() ;
;![]() ;
;
![]()
Пример 16.
Вычислить по правилу Вант-Гоффа,
при какой температуре реакция закончится
за 25 мин, если при 20ºС на это требуется
2ч. Температурный коэффициент скорости
реакции равен 3.
Решение. Между
константами скоростей и временем
завершения реакции существует обратно
пропорциональная зависимость
 ,
,
где τ1 и τ2– время завершения реакции при
температурахt1 иt2.
Тогда уравнение
(96) можно записать
![]() ,
,
откуда
t2
– t1
=
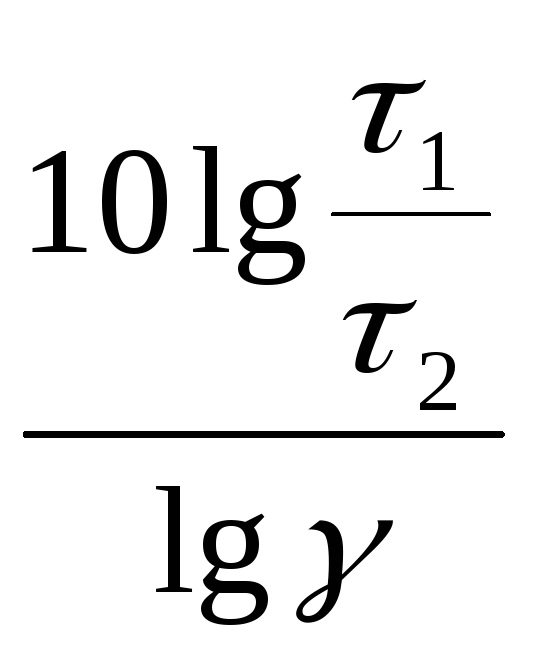 ,
,
а t2
=
 +t1
+t1
=
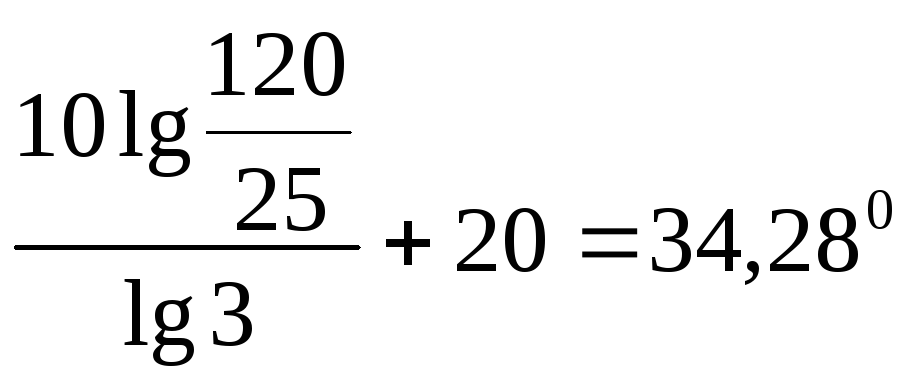 .
.
Пример 17. Для
одной из реакций опытным путём были
определены две константы скорости при
443ºС – 0,0067, а при 508ºС – 0,1059. Определить
энергию активации данной реакции.
Решение.
Используя формулу (98), откуда получаем
Еа= ,
,
или
Еа= ,
,
Т1= 443 + 273 =
716 К; Т2= 508 + 273 = 781 К;R= 8,314 Дж/(моль·К);
Еа= Дж/моль
Дж/моль
= 197,5 кДж/моль.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Уравнение Аррениуса используется для расчета скорости реакции. Это важная часть химической кинетики. Это помогает понять влияние температуры на скорость реакции. Это уравнение было предложено в 1889 году Сванте Аррениусом.
Где k = константа скорости
A = коэффициент частоты
Ea = энергия активации
R = газовая постоянная
T = температура Кельвина
В основе уравнения Аррениуса лежит теория столкновений. Согласно этой теории, реакция — это столкновение двух молекул (одного или двух разных веществ) с образованием промежуточного соединения. Образованный таким образом промежуточный продукт нестабилен и существует в течение короткого периода времени. Промежуточные разрывы дают две молекулы продукта. Энергия, используемая для образования промежуточного продукта, известна как энергия активации.
Теперь, если мы возьмем логарифм с обеих сторон уравнения Аррениуса, реакция изменится на
Ln — натуральный логарифм, значения могут быть взяты из логарифмической таблицы.
Для графического представления
Если сравнить это уравнение с уравнением прямой, получим
y = ln k
х = 1 / Т
m = -Ea / R
c = ln A
Это дает прямолинейный график, но с отрицательным наклоном.
График кв / с (1 / Т)
Влияние температуры
Из графика мы заключаем, что температура и скорость реакции пропорциональны. С повышением температуры скорость реакции также увеличивается. Кинетическая энергия увеличивается с температурой. Итак, когда мы увеличиваем температуру, количество молекул с кинетической энергией больше, чем энергия активации, увеличивается. Это увеличивает скорость общей реакции за счет уменьшения энергии активации.
При изменении температуры на 10 К скорость увеличивается почти вдвое.
Возьмем уравнения Аррениуса для моментов времени T1 и T2, где скорости реакции равны K1 и K2 соответственно.
ln k1 = -Ea / RT1 + ln A —— (1)
ln k2 = -Ea / RT2 + ln A —— (2)
вычитание (1) из (2)
ln k2 — ln k1 = Ea / RT1 — Ea / RT2
ln k2 / k1 = (Ea / R)1 / т1 — 1 / т21/Т1—1/Т2
преобразование ln в журнал;
журнал k2 / k1 = (Ea /2.303R)( Т2 — Т1 ) / Т1 т2(Т2—Т1)/Т1Т2
Уравнение Аррениуса также подразумевает, что некаталитическая реакция больше зависит от температуры по сравнению с каталитической реакцией.
Некоторые реальные примеры из жизни:
-
Молоко скисает быстрее, если хранить его при комнатной температуре, а не в холодильнике;
-
Сливочное масло летом прогоркает быстрее, чем зимой;
-
Яйца варятся вкрутую намного быстрее на уровне моря, чем в горах.
-
Хладнокровные животные, такие как насекомые и рептилии, более вялые в холодные дни.
Эффект катализатора
Катализатор также помогает увеличить скорость реакции. Катализатор достигает этого за счет снижения энергии активации, необходимой для протекания реакции.
Вопрос
Ниже приведен пример задачи, которая поможет вам лучше понять и решить вопросы, основанные на уравнении Аррениуса.
1. Найдите энергию активации реакции (в кДж / моль), если константа скорости при 650 К составляет 3,4 М-1 с-1 и 35,0 при 750 К.
Отвечать:
k2 / k1 = (Ea /2.303R)( Т2 — Т1 ) / Т1 т2(Т2—Т1)/Т1Т2
35,0 / 3,4 = (Ea / 2,303 * 8,314)( 750 — 650 ) / 750 * 650(750—650)/750*650
10.294 = (Ea /19.147)( 100 ) / 487500(100)/487500
1.0125 = (Ea /19.147)( 100 ) / 487500(100)/487500
Ea = 1,0125 * 19,147 * 4875
Ea = 94508,395 Дж / моль
Ea = 9,4508 * 104 Дж / моль
Ea = 9,4503 кДж / моль
Важность уравнения Аррениуса
Уравнение Аррениуса важно по следующим причинам:
-
Это позволяет учесть факторы, влияющие на скорость реакции, которую нельзя определить с помощью закона скорости.
-
С помощью этого уравнения можно найти влияние энергетического барьера, температуры, частоты, наличия катализатора, ориентации столкновений.
Таким образом, это причины, по которым понимание и изучение уравнения Аррениуса так важно.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 мая 2021 года; проверки требует 1 правка.
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости 

Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 


Здесь предэкспоненциальный множитель (фактор частоты) 

В рамках теории активных соударений 
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений 
В рамках теории активированного комплекса получаются другие зависимости 
частотный фактор 

Уравнение Аррениуса в дифференциальной форме:
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Низкотемпературный предел скорости химических реакций[править | править код]
Из уравнения Аррениуса следует, что при стремлении температуры к абсолютному нулю химическая активность любых веществ исчезает. В действительности, при крайне низких температурах становятся существенными квантовомеханические эффекты туннелирования. В результате при низких температурах уравнение Аррениуса уже не выполняется. Существует низкотемпературный предел скорости химических реакций: при приближении температуры к абсолютному нулю экспоненциальная зависимость скорости реакций от температуры исчезает, скорость химических реакций перестает зависеть от температуры и достигает конечного ненулевого значения.[1]
См. также[править | править код]
- Уравнение Димрота-Рейнхардта
- Уравнение Лейдлера — Эйринга
Примечания[править | править код]
- ↑ В. И. Гольданский, «Явление квантового низкотемпературного предела скорости химических реакций», Усп. хим., 44:12 (1975), 2121—2149; Russian Chem. Reviews, 44:12 (1975), 1019—1035
Литература[править | править код]
- Штиллер В. Уравнение Аррениуса и неравновесная кинетика. — М.: Мир, 2000. — 176 с.
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.

здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
![]()
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
![]()
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.

Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.

Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
513
Создан на
11 января, 2022 От Admin

Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции водорода с хлором.
1) понижение температуры
2) повышение давления в системе
3) добавление хлороводорода
4) увеличение концентрации хлора
5) уменьшение концентрации водорода
Запишите в поле ответа номера выбранных внешних воздействий.
2 / 10
Из предложенного перечня выберите два вещества, между которыми реакция протекает с наибольшей скоростью в одинаковых условиях.
1) Fe (проволока)
2) Ca(OH)2 (р-р)
3) HCl (р-р)
4) Fe (порошок)
5) Cu (порошок)
3 / 10
Из предложенного перечня выберите два вещества, между которыми реакция протекает с наибольшей скоростью в одинаковых условиях.
1) AgNO3 (р-р)
2) FeO
3) HCl (р-р)
4) BaCO3
5) Mg(OH)2
4 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению
скорости реакции между азотом и кальцием.
1) понижение температуры
2) использование ингибитора
3) повышение давления в системе
4) уменьшение концентрации азота
5) повышение температуры
5 / 10
Из предложенного перечня выберите схемы всех реакций, скорость которых увеличится при повышении концентрации кислорода.
1) O2(г) + S(тв.) = SO2(г)
2) CO(г) + O2(г) → CO2(г)
3) CuO(тв.) → Cu2О(тв.) + O2(г)
4) O2(г) + N2(г) → NO(г)
5) O2(г) → O3(г)
6 / 10
Из предложенного списка химических реакций выберите те, скорость которых увеличивается при использовании катализатора.
1) C + O2 = CO2
2) CO + 2H2 = CH3OH
3) Zn + 2HCl = ZnCl2 + H2
4) 2Na + S = Na2S
5) N2 + 3H2 = 2NH3
7 / 10
Из предложенного перечня выберите две схемы химических реакций, для которых увеличение концентрации кислоты приведёт к увеличению скорости их протекания.
1) H2О(ж) + Cl2(г) → HCl(р-p) + HClO(р-р)
2) Zn(тв.) + HCl(р-р) → ZnCl2(р-р) + H2(г)
3) P2O5(тв.) + H2О(ж) → H3PO4(p-p)
4) SO2(г) + H2O(ж) → H2SО3(p-p)
5) CuO(тв.) + H2SO4(p-p) → CuSO4(p-p) + H2О(ж)
Запишите в поле ответа номера выбранных схем реакций.
8 / 10
Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости реакции хлора с водородом.
1) понижение давления
2) понижение температуры
3) увеличение концентрации Сl2
4) увеличение концентрации Н2
5) введение в систему хлороводорода
Запишите номера выбранных ответов.
9 / 10
Из предложенного перечня выберите все реакции, для которых увеличение давления приводит к увеличению скорости реакции.
1) СаСО3 + 2НВr(р-р) → СаВr2 + СO2 + Н2О
2) СH2=СН2 + Н2 → СН3—СН3
3) H2 + Cl2 → 2HCl
4) 2СН4 → С2Н2 + 3Н2
5) KН + Н2О(ж) → КОН + Н2
Запишите номера выбранных ответов.
10 / 10
Из предложенного перечня выберите все реакции; для которых увеличение давления не приводит к увеличению скорости реакции.
1) Cl2 + H2 = 2HCl
2) 4P(белый) + 5O2 = 2P2O5
3) Fe(порошок) + S(порошок) = FeS
4) Zn + 2HCl(р-р) = ZnCl2 + H2
5) C + 2H2 = CH4
Запишите номера выбранных ответов.
Ваша оценка
The average score is 39%
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. Правило Вант-Гоффа
С повышением температуры скорость реакции увеличивается. Зависимость скорости реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается в 2-4 раза.
Математическое выражение правила Вант-Гоффа:
![]() (16),
(16),
а при условии, что концентрации всех реагирующих веществ равны 1 моль/л:
![]() (17),
(17),
где ![]() ,
, ![]() и
и ![]() ,
, ![]() – соответственно скорости и константы скоростей реакции при температурах
– соответственно скорости и константы скоростей реакции при температурах ![]() и
и ![]() .
.
Температура может быть выражена как в °С, так и в К, так как изменение температуры не зависит от единиц измерения (![]() ).
).
![]() – температурный коэффициент скорости реакции, который показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов:
– температурный коэффициент скорости реакции, который показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов:
![]() (18)
(18)
Поскольку при концентрациях реагирующих веществ 1 моль/л скорость химической реакции численно равна константе скорости ![]() , то
, то
![]() (19)
(19)
Учитывая тот факт, что скорость реакции обратно пропорциональна времени ее протекания из уравнения (18), при ![]() получаем
получаем
![]() (20)
(20)
Используя уравнения (16 – 20), можно рассчитать:
– константу скорости (или скорость) реакции при заданной температуре, если известны значения этих величин при двух других температурах;
– на сколько градусов надо повысить (или понизить) температуру реакции, чтобы скорость ее увеличилась (или уменьшилась) в N раз;
– при какой температуре следует проводить реакцию, чтобы она закончилась за определенное время, если известны температурный коэффициент реакции и скорость ее при любой температуре;
– температурный коэффициент реакции и т. д.



