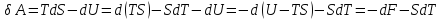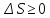В
результате кругового процесса система
возвращается в исходное состояние,
следовательно, полное изменение
внутренней энергии равно нулю. Поэтому,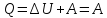
количеству полученной извне теплоты.
Если в ходе кругового процесса система
не только получает количество теплоты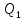
но и теряет (отдает) количество теплоты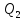
то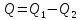
Термический
коэффициент полезного действия для
кругового процесса – это величина,
равная отношению работы, совершенной
системой, к количеству теплоты, полученному
в этом цикле системой:
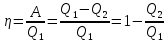
(40.1)
§ 41. Энтропия
«Энтропия»
в переводе с греческого означает поворот,
превращение. Это понятие введено в
термодинамику немецким ученым Р.
Клаузиусом как мера необратимого
рассеяния энергии.
Количество
теплоты
которое должно быть доставлено системе
или отнято у неё при переходе от одного
состояния в другое, не определяется
однозначно начальным и конечным
состояниями, но существенно зависит от
способа осуществления этого перехода
.
Однако,
приведенное количество теплоты –
отношение теплоты
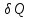
Т
системы при бесконечно малых изменениях
состояния системы – есть функция
состояния системы.
В любом
обратимом круговом процессе
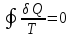
Следовательно, подынтегральное выражение
есть полный дифференциал некоторой
функции, которая определяется только
начальным и конечным состояниями системы
и не зависит от пути, каким система
пришла в это состояние.
Энтропией
Sназывается
функция состояния системы, дифференциалом
которой является
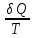
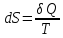
(41.1)
Таким
образом, первое начало термодинамики
можно записать в виде
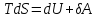
откуда
Функция
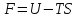
называется энергией Гельмгольца или
свободной энергией.
Изменение
энтропии.
В
замкнутой системе для обратимых процессов
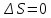
для необратимых процессов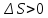
Энтропия
замкнутой системы может либо возрастать
(в случае необратимых процессов) либо
оставаться постоянной (в случае обратимых
процессов):
– неравенство
Клаузиуса.
Поскольку
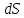
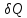
изменения энтропии можно судить о
направлении процесса теплообмена.
При
нагревании тела
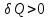
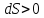
при охлаждении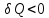
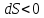
Принцип
возрастания энтропии:Все
процессы в замкнутой системе ведут к
увеличению её энтропии. В замкнутой
системе идут в направлении от менее
вероятных состояний к более вероятным,
до тех пор, пока вероятность состояния
не станет максимальной. В состоянии
равновесия – наиболее вероятного
состояния системы- число микросостояний
максимально, при этом максимальна и
энтропия.
§ 42. Второе начало термодинамики
Выражая
всеобщий закон сохранения и превращения
энергии, первое начало термодинамики
не позволяет определить направление
протекания процесса. В самом деле,
процесс самопроизвольной передачи
энергии в форме теплоты от холодного
тела к горячему, ни в какой мере не
противоречит первому закону термодинамики.
Однако при опускании раскаленного куска
железа в холодную воду никогда не
наблюдается явление дальнейшего
нагревания железа за счет соответствующего
охлаждения воды. Далее, первое начало
не исключает возможности такого процесса,
единственным результатом которого было
бы превращение теплоты, полученной от
нагревателя в эквивалентную ей работу.
Так, например, основываясь на первом
начале можно было бы попытаться построить
периодически действующий двигатель,
совершающий работу за счет одного
источника тепла (например, за счет
внутренней энергии океана). Такой
двигатель называется вечным двигателем
второго рода. Обобщение огромного
экспериментального материала привело
к выводу о невозможности построения
вечного двигателя второго рода. Этот
вывод получил название второго начала
термодинамики.
Существует
ряд различных по форме, одинаковых по
существу формулировок второго начала:
-
Невозможен
процесс, единственным результатом
которого является превращение всей
теплоты, полученной от нагревателя, в
эквивалентную ей работу. -
Формулировка
Клаузиуса: теплота сама собой не может
переходить от менее нагретого тела к
более нагретому.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
КПД кругового процесса
В результате кругового процесса система возвращается в исходное состояние, следовательно, полное изменение внутренней энергии равно нулю. Поэтому ΔQ=ΔU+A=A, то есть работа, совершаемая за цикл, равна количеству полученной извне теплоты. Если в ходе кругового процесса система не только получает количество теплоты Q1, но и теряет (отдает) количество теплоты Q2, то Q=Q1-Q2.
Термический коэффициент полезного действия для кругового процесса – это величина, равная отношению работы, совершенной системой, к количеству теплоты, полученному в этом цикле системой:
η=A/Q1=(Q1-Q2)/Q1=1-(Q2/Q1) (65)
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Реальные процессы необратимы, в них всегда происходит диссипация (потеря) энергии (из-за трения, теплопроводности и т.д.). Обратимые процессы – это физическая модель (идеализация реальных процессов).
кпд, круговой процесс, внутренняя энергия, Физика, работа, коэффициент полезного действия, термодинамика, обратимые процессы
Добавлять комментарии могут только зарегистрированные пользователи.
Регистрация Вход
Речь в статье пойдет о КПД различных циклов, проводимых с газом. При этом давайте помнить, что внутренняя энергия изменяется тогда, когда изменяется температура, а в адиабатном процессе передачи тепла не происходит, то есть для совершения работы в таком процессе газ “изыскивает внутренние резервы”. Кроме того, работа численно равна площади под кривой процесса, а работа за цикл – площади внутри цикла.
Задача 1.
На рисунке представлена диаграмма цикла с одноатомным идеальным газом. Участки и
– адиабаты. Вычислите КПД
данной тепловой машины и максимально возможный КПД
.
К задаче 1
КПД тепловой машины можно вычислить как
Машина получает тепло только на участке AB, и, так как работы здесь не совершается, то можно вычислить количество теплоты, полученное газом, как увеличение его внутренней энергии:
Работа численно равна площади, ограниченной циклом. Поэтому
Участк и
по условию – адиабаты, то есть передачи тепла газу на этих участках не происходит, следовательно, работа будет совершена за счет «внутренних резервов» – то есть внутренней энергии. Нужно, следовательно, найти, как она изменилась.
Задачу можно решить двумя способами. Во-первых, просто определить температуры в точках и
,
и
, это легко сделать из данных графика с помощью уравнения Менделеева-Клапейрона, и затем посчитать
. Но, так как
, а
,то изменение внутренней энергии будет равно
Определим максимальный КПД. Посчитаем его как КПД цикла Карно. Максимальная температура газа будет достигнута в точке , а минимальная – в точке
:
Ответ: ,
.
Задача 2.
Над идеальным одноатомным газом проводят цикл, включающий изобару, изохору, изотерму, при этом работа газа за цикл равна кДж. В процессе изотермического сжатия (3-1) внешние силы совершают над газом положительную работу
кДж. Найдите КПД данной тепловой машины.
К задаче 2
Работа газа в процессе 1-2– площадь под линией процесса 1-2. Работа внешних сил – площадь под циклом (под линией 3-1). Поэтому полная работа за цикл – это разность работы газа и работы внешних сил, площадь, ограниченная линиями цикла. Она будет равна 5 кДж.
Работа газа в процессе 1-2, таким образом, равна 8 кДж. А поскольку процесс изобарный, то кДж. Тогда КПД
Ответ: .
Задача 3.
КПД тепловой машины, работающей по циклу, включающему изотермический (1-2) и адиабатный (3-1) процессы, равен , причем работа, совершенная 2 моль одноатомного идеального газа в изотермическом процессе
кДж. Найдите разность
максимальной и минимальной температур газа в цикле.
К задаче 3
Полная площадь под кривой процесса 1-2 равна кДж. При этом, так как КПД машины 25%, то площадь внутри цикла равна
, а под кривой 3-1 –
. В процессе 1-2 изменения внутренней энергии не было, так как температура не менялась, а в процессе 3-1 газу не передавали тепло, следовательно, работа совершена за счет внутренней энергии. Т.е.
Ответ: 500 K.