Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Сегодня – особенный день. “И что же в нем такого необычного?” – спросите вы. Отвечаю. Я, наконец-то, добралась до моего самого любимого царства-королевства, до моих конфет и пирожных, малинок и клубничек! Окислительно-восстановительные реакции! Вы даже не представляете, насколько это интересно!
Мои ученики в процессе подготовки к экзамену по химии, проходят несколько стадий вызревания. Первое серьезное испытание на прочность – газы! Это из серии “гестапо отдыхает”. Решив огромное количество газовых задач, по сравнению с которыми 28-е задачи ЕГЭ – детский лепет, народ полностью структурирует свой мозг и настраивает мышление на профессиональное восприятие химии по-взрослому.
Вторая ступень химической зрелости и мудрости – окислительно-восстановительные реакции. Они приучают к усидчивости и внимательности. Набравшись опыта в написании ОВР, ребята начинают чувствовать себя ломоносовыми, клапейронами и менделеевыми в одном флаконе. За спиной вырастают крылья и… понеслось! Дальнейшее изучение химии проходит на едином дыхании, профессиональный рост – в геометрической прогрессии. На этой стадии мои ученики уже могут заткнуть за пояс каждого второго школьного преподавателя химии!
Понимая всю серьезность материала статьи, я отключила мобильную связь с внешним миром – с Карлсоном, Алисой (которая из страны Чудес), Сири, Фрекен Бок (тем более, что она работает химичкой в школе, где учится Малыш) и всеми остальными озорниками и хулиганами. Оставила только астральную связь для служебного пользования. Возможно, музы на чаек залетят или еще кто-нибудь забредет. А мы с вами займемся самым интересным делом – будем раскладывать по полочкам все накопленные мною знания по теории и практике окислительно-восстановительных реакций. Долго будем этим заниматься. Пока не надоест. Итак, поехали!
Окислительно-восстановительные реакции (ОВР) – химические реакции, в результате которых происходит изменение степеней окисления элементов.
ОВР протекают с участием двух участников – окислителя и восстановителя, и состоят из двух противоположных процессов:
1) Окисление – процесс отдачи электронов (восстановитель отдает электроны окислителю, восстановитель окисляется – окислитель восстанавливается).
2) Восстановление – процесс присоединения электронов (окислитель присоединяет электроны от восстановителя, окислитель восстанавливается – восстановитель окисляется).
Кто же вы, господа окислители и восстановители? Как вас узнать среди огромного количества химических веществ? Сегодня разберем самые общие характеристики участников ОВР (окислителей и восстановителей) на отдельных примерах. После изучения технологии написания ОВР (в следующей статье), поработаем с целыми семействами окислителей и восстановителей, с неорганическими и органическими веществами, проводя реакции в разных средах. А пока – читаем внимательно!
Окислитель – атом в составе молекулы или иона, который присоединяет электроны от восстановителя. Происходит процесс восстановления окислителя (его степень окисления снижается).
Окислительная активность – способность атома отбирать электроны у других атомов.
Окислительно-восстановительный потенциал (редокс-потенциал) – показатель окислительной активности, мера способности атомов химического элемента присоединять электроны (восстанавливаться). Стандартные потенциалы окислительно-восстановительных пар помещены в таблицу.
Чем выше стандартный потенциал окислительно-восстановительной пары, тем выше окислительная активность атомов элемента, тем он – более сильный окислитель
Окислительную активность определяют два фактора:
1) Электроотрицательность. Чем выше электроотрицательность химического элемента, тем выше окислительная активность простого вещества. В Периодической Системе Элементов электроотрицательность растет в сторону правого верхнего угла (слева направо и снизу вверх). Самый сильный окислитель – фтор, на втором месте – кислород.
2) Степень окисления. Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (она равна номеру группы). Почему? Да, потому что у такого атома на внешнем уровне вообще нет валентных электронов. Ни одного. Все валентные электроны он где-то потерял (отдал кому-то) и остался гол, как сокол (в чем мать родила). Больше отдавать нечего, поэтому можно только присоединять.
У вас часто возникает вопрос – почему при дефиците электронов формируется положительная степень окисления или положительный заряд иона (т.е. почему у окислителя валентные электроны в дефиците или отсутствуют, а его заряд +n)? Да, потому что электроны заряжены отрицательно, а протоны (в ядре) – положительно. В электронейтральном атоме протоны и электроны уравновешены (сколько протонов, столько электронов). Если электроны убрать, то проявятся положительные заряды протонов, которые никуда не деваются в химических реакциях (их можно сдвинуть с насиженного места только ядерными реакциями). Теперь понятно? Если все еще “ежик в тумане”, читайте эту и следующие статьи. Я буду рассматривать все тяжело понимаемые моменты с разных сторон. В конце концов, все станет на свои места и туман рассеется.
Давайте, придумаем образ окислителя. Кто вы, мистер-окислитель? Это – захватчик, завоеватель, грабитель, который скачет на коне и, угрожая, копьем и ружьем, отбирает электроны у восстановителей (часто, отбирает все, что есть). Окислитель не только безжалостный разбойник, но еще и жадина – очень проблематично вернуть назад электроны, которые забрал окислитель. Как только окислитель ограбит восстановителя (заберет у него электроны) он тут же падает вниз по градационной шкале степеней окисления (“падает в глазах окружающих”).
Пример сильного окислителя – перманганат-ион. Его часто используют в различных ОВР. Обратите внимание, в зависимости от среды реакции, перманганат-ион образует различные продукты.
Ребята, не слушайте училок-химичек, которые заставляют запоминать продукты ВСЕХ окислительно-восстановительных реакций. Если вы забыли образующиеся вещества и просите помочь, они орут, обзывая вас неучами и и бездельниками. При этом, сами срочно хватают спасательный учебник по химии и пафосно зачитывают вам и всему классу продукты конкретной реакции. Вы задайте этим глупым училкам вопрос – помнят ли они дни рождения всех своих родственников? Что касается меня, то после 16-ти часов работы (такое тоже бывает), я часто забываю номер своего телефона. Но… ЛЮБУЮ ОВР напишу за пару минут (как говорят, темной ночью под кроватью)! Потому, что знаю особые секреты окислительно-восстановительных реакций, которые, между прочим, собираюсь раскрыть моим ученикам и всем моим читателям.
Постепенно, статья за статьей, мы будем изучать технологию написания окислительно-восстановительных реакций, знакомиться с целыми семействами окислителей и восстановителей, их особенностями, характером поведения в разных средах, предполагаемыми продукты. Лукавить не буду, кое-что нам, все-таки, придется запомнить. Совсем немного. Чуть-чуть. Примерно 15 точек, включающих продукты ОВР и основные рекомендации. И вы напишите ЛЮБУЮ окислительно-восстановительную реакцию! В ЛЮБОЙ среде!
Первое задание: запомните три продукта восстановления перманганат-иона (выделено красным цветом) в зависимости от среды протекания окислительно-восстановительной реакции (кислая, нейтральная или щелочная).
Восстановитель – атом в составе молекулы или иона, который отдает электроны окислителю. Происходит процесс окисления восстановителя (его степень окисления повышается).
Восстановительная активность – способность атома отдавать электроны другим атомам.
Восстановительную активность определяют два фактора:
1) Радиус атома. Чем больше радиус атома химического элемента, тем выше восстановительная активность простого вещества. В Периодической Системе Элементов радиус атома увеличивается в сторону левого нижнего угла (справа налево и сверху вниз).
2) Степень окисления. Чем ниже степень окисления атома в составе молекулы или иона, тем ярче проявляется восстановительная активность.
Только свойства восстановителя проявляют атомы с минимально возможной степенью окисления. Для неметаллов она равна “восемь минус номер группы”. Для металлов – ноль. Как только восстановитель отдаст электроны окислителю, он поднимется вверх по градационной шкале степеней окисления (“растет в глазах окружающих”).
Посмотрите, как ведет себя сера в роли восстановителя в разных веществах (с разными степенями окисления).
Настало время придумать образ восстановителя. Кто вы, мистер-восстановитель? У меня восстановитель ассоциируется с добрым дедушкой-альтруистом, который одаривает электронами каждого желающего окислителя.
Как же вас различить, господа окислители и восстановители в группе веществ, предложенных для реакций?!
Окислитель можно отыскать по высокой (иногда, максимально высокой) степени окисления, кроме того, мы изучим многие семейные портреты окислителей. Продукты окислителей мы ЗАПОМНИМ (их около 10, не более), кроме того, проведем анализ процесса восстановления окислителя по градационной шкале степеней окисления.
Восстановитель отыщем по низкой (иногда, максимально низкой) степени окисления. Продукт восстановителя будем устанавливать путем анализа с использованием градационных шкал степеней окисления. Хотя… сделаю вам подарок. Читайте мнемоническое стихотворение. Пригодится.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7 (903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
Репетитор по химии и биологии кбн В.Богунова
1. Окислители и восстановители
2. Классификация окислительно–восстановительных реакций
3. Основные правила составления ОВР
4. Общие закономерности протекания ОВР
5. Основные схемы ОВР
5.1. Схема восстановления перманганатов
5.2. Схема восстановления хроматов/бихроматов
5.3. Разложение нитратов
5.4. Окислительные свойства азотной кислоты
5.5. Взаимодействие металлов с серной кислотой
5.6. Пероксид водорода
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.

Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.

Типичные окислители и восстановители приведены в таблице.

В лабораторной практике наиболее часто используются следующие окислители:
-
перманганат калия (KMnO4);
-
дихромат калия (K2Cr2O7);
-
азотная кислота (HNO3);
-
концентрированная серная кислота (H2SO4);
-
пероксид водорода (H2O2);
-
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
-
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых элемент-окислитель и элемент-восстановитель входят в состав одного вещества:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O

Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S-2 -2e = S0
Mn+7 + 1e = Mn+6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:

Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.

Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.

Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2+. Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны. В нейтральном растворе марганец восстанавливается до степени окисления +4, с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6. Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.

Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P-3, As-3= P+5, As+5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].

Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N+5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N+4); оксид азота (II) NO (N+2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H+, которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например:
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S+4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 + 5H2S+6O4(конц) → 4Na2+SO4 + H2S—2 + 4H2O
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S+4O2 + H2O2-1 → H2S+6O4-2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
2KMn+7O4 + 5H2O2-1 + 3H2SO4 → 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O
Окислительно-восстановительные реакции. Окислитель и восстановитель

Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
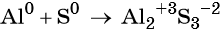
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:

Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
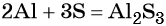
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
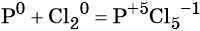
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
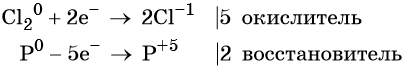
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
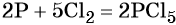
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
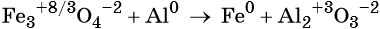
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
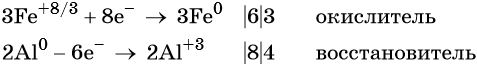
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
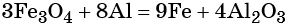
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
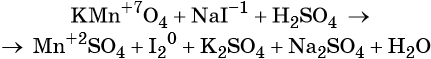
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
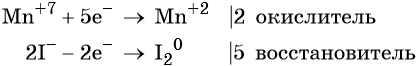
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
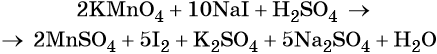
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
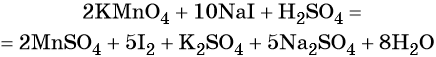
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
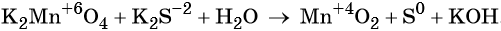
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
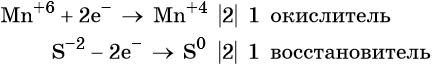
Основные коэффициенты в уравнении реакции равны единице:
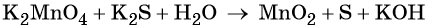
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
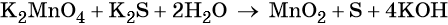
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
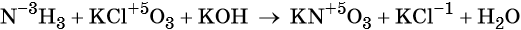
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:

Проставляем найденные основные коэффициенты в уравнение реакции:
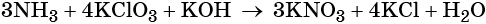
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
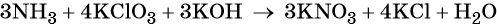
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
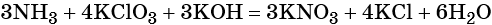
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
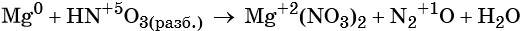
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
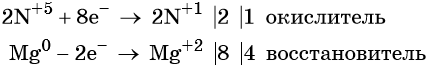
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
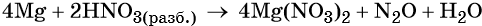
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
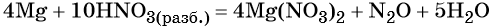
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
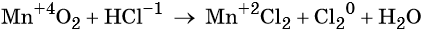
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
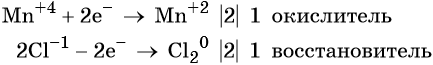
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
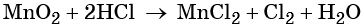
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
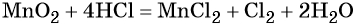
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
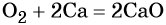
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
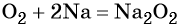
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
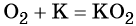
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
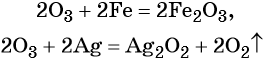
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
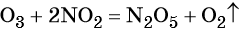
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
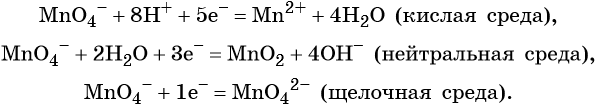
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
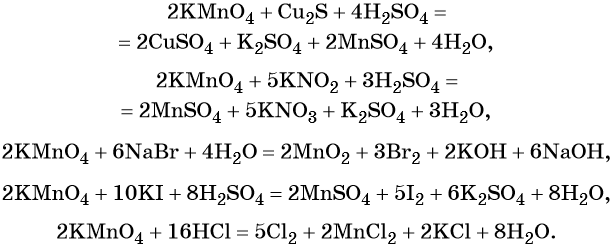
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
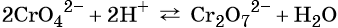
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
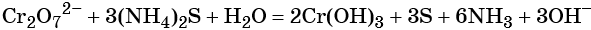
В кислой среде образуются ионы Cr3+:
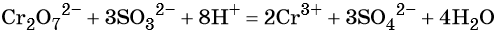
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
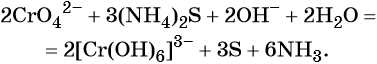
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
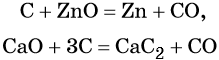
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:

Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
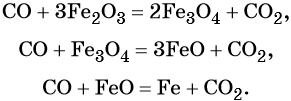
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
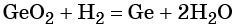
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы


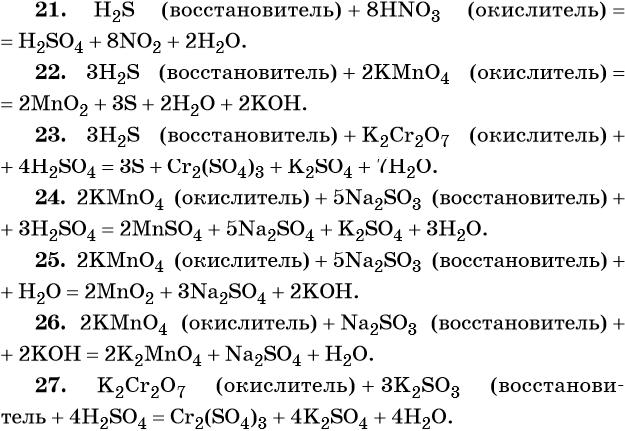



Как узнать где в химической реакции окислитель а где восстановитель?
Профи
(918),
закрыт
10 лет назад
Дополнен 13 лет назад
Если известна только левая часть уравнения (то есть исходные продукты реакции)?! 1
ули .
Профи
(576)
13 лет назад
если после реакции (после знака равно) вещество приобретает положительный заряд значит он восстановитель
а если приобретает отрицательный заряд значит окислитель
вот например
H2 + O2 = H2O
до реакции и у водорода и у кислорода заряд нулевой
после реакции
водород приобретает заряд +1 а кислород -2 значит водород восстановитель
а кислород окислитель!!
Источник: =)) если что непонятно пиши)
BeardMax
Просветленный
(26657)
13 лет назад
Для этого надо знать, что такое степень окисления.
Научиться определять степень окисления у любого атома в химическом соединении.
Далее смотреть, у каких атомов СО увеличивается в реакции, а у какого уменьшается. Первые – восстановители, вторые – окислители.
В общем химию не надо было прогуливать.
ООО
Ученик
(70)
13 лет назад
Восстановитель – это вещество, отдающее электроны. Н-р, Са (2+) – 2е = Са (0)
Окислитель – вещ-во, принимающее электроны.
Маришка
Знаток
(271)
13 лет назад
Чтобы это узнать, нужно смотреть, что является реагентами, а что добавлено в виде среды. Например, если в исходных веществах есть Mn (+4) и вода, то Mn поменяет степень окисления на (+6), если не ошибаюсь. Кроме того, можно посмотреть, в какой степени окисления находятся элементы (вдруг где-то она минимальная или наоборот максимальная).

Привет)
Сегодня я хочу разобрать одну из самых интересных тем в неорганической химии, которая навевает на некоторых страх и непонимание, -это окислительно-восстановительные реакции.
Процесс окисления и восстановления заключается в том, что любое сложное вещество образуется тогда, когда один элемент отдает электроны, а другой забирает.
Рассмотрим этот процесс на известной всем реакции образования гремучего газа – Н2О (это та же реакция, что и образование воды, но, в отличие от последней, она осуществима при обычных условиях).

Итак, вначале мы пишем химическую реакцию (смотри пункт А), и расставляем степени окисления всех элементов.
Для удобства можно подчеркнуть те элементы, которые изменили свои степени окисления. В этой реакции это произошло с водородом и кислородом.
Разбираем детально этот процесс: у водорода до стрелки стоит степень окисления 0, почему?
Любое простое вещество, которое не входит в состав сложного вещества, всегда пишется со знаком 0, потому что это атом, а атом электронейтрален, соответственно, заряд должен быть равен 0.
Это же самое мы пишем у кислорода, так как до стрелки он представлен в виде свободного атома.
Теперь смотрим молекулу гремучего газа, Н2О: у водорода степень окисления равна +1, так как он отдал один электрон, а кислород имеет степень окисления -2, так как он принял два электрона, но это не логично.
Если элемент отдал электрон, то у него по сути должен быть знак -, а если принял, то +.
- Однако, стоит запомнить, что если у элемента в процессе ОВР степень окисления увеличилась, значит он отдал электроны, и теперь называется восстановителем.
- А если элемент принял электроны, то его степень окисления уменьшилась, и он теперь окислитель. В данной реакции восстановитель это водород, а окислитель-это кислород.
Теперь наступает самый сложный момент, как показать переход электронов. Смотрим пункт Б: рассматриваем первый процесс с водородом.
Слева пишем водород который стоит до стрелки, справа- после стрелки, между ними- количество электронов.
В первую очередь необходимо посмотреть как меняется степень окисления водорода: сначала Н2 имеет степень окисления 0, а после стрелки +1, и было бы естественно написать что водород отдал один электрон, но в итоге получается -2, почему? Когда элемент отдает электроны, он теряет их, и соответственно, ставим-2, а не +2; теперь рассматриваем другой аспект- почему -2, а не -1.
- Водород, как и любой элемент необходимо уравнивать в соответствии с химической реакцией, это в основном касается тех случаев, когда в реакции присутствуют газы, которые пишутся с индексом 2 (например, О2, Н2, N2).
- Мы видим, что у водорода до стрелки 2 атома, после стрелки тоже 2, но мы не имеем права писать второй водород также с индексом, так как он уже не свободное вещество, и представляет собой ион, поэтому ставим эту двойку в качестве коэффициента.
Если вышеперечисленный процесс понятен, переходим к аналогичному с кислородом:
- Также как в случае с водородом, уравниваем кислород, чтобы до и после стрелки их было одинаковое количество, теперь у тебя может возникнуть вопрос, почему в пункте Б в процессе с кислородом перешло не 2, а 4 электрона, опять-таки объясняется удвоением количества электронов в связи исходя из реакции.
Почему +4? В процессе присоединения электронов элемент, в нашем случае кислород забирает два электрона, умноженное на два, то есть 4, у него становится больше, поэтому ставим «+».
Теперь пришло время немного расслабиться, потому что осталось совсем чуть-чуть).
В пункте Д, напротив процесса водорода за чертой стоит цифра 4, а напротив кислорода-2, может возникнуть непонимание, зачем это нужно и откуда взялись эти цифры. Цифры, стоящие за чертой, это количество электронов, отданные водородом и принятые кислородом, в сумме.
Важный аспект в том, что эти цифры нужно переместить крест-накрест, и поставить за черту,- они и выполняют роль коэффициентов при уравнивании. Если эти цифры имеют общее кратное, необходимо их сократить, и начать уравнивать- перед водородом нужно поставить 2, перед кислородом 1, но как ты знаешь, коэффициент 1 мы не ставим; смотри пункт Г.
В последнюю очередь нужно записать, какой элемент является окислителем, а какой восстановителем (это нужно для решения задач), пункт В.
Ну вот и все, реакция уравнена, мучения закончились).
Подведем итог, чтобы быстро и правильно решать реакции ОВР, нужно:
– верно указать степени окисления всех элементов в реакции;
– запомнить, что если у элемента увеличилась степень окисления, что он восстановитель, и над стрелкой ставим “-е”, а если степень окисления уменьшилась, то этот элемент-окислитель, и над стрелкой при указании перехода ставим “+е”;
– внимательно расставлять коэффициенты, кислород уравнивать в самую последнюю очередь.
На этой прекрасной ноте я заканчиваю урок.
Внизу представлены задания по этой теме для самостоятельного решения.
При возникновении вопросов, пиши)




