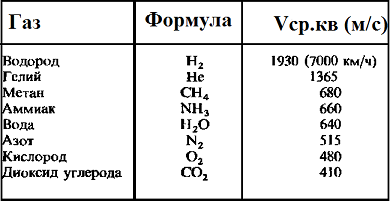
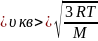Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
Таблица значений средней квадратичной скорости молекул некоторых газов
Для того чтоб понять, откуда же у нас получается эта формула, мы выведем среднюю квадратичную скорость молекул. Вывод формулы начинается с основного уравнения молекулярно кинетический теории (МКТ):
Где у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:
Если посмотреть, то PV это две третьих средней кинетической энергии всех молекул (а у нас взят 1 моль молекул):
Тогда, если приравнять правые части, у нас получается, что для 1 моля газа средняя кинетическая энергия будет равняться:
Но средняя кинетическая энергия, так же находится, как :
А вот теперь, если мы приравняем правые части и выразим из них скорость и возьмем квадрат,Число Авогадро на массу молекулы , получается Молярная масса то у нас и получится формула для средней квадратичной скорости молекулы газа:
А если расписать универсальную газовую постоянную, как , и за одно молярную массу
, то у нас получится?
В Формуле мы использовали :
— Средняя квадратичная скорость молекул
— Постоянная Больцмана
— Температура
— Масса одной молекулы
— Универсальная газовая постоянная
— Молярная масса
— Количество вещества
— Средняя кинетическая энергия молекул
— Число Авогадро
Определение средней квадратичной скорости молекул газа
Содержание:
- Средняя квадратичная скорость молекул газа — что это за параметр
- От каких величин зависит в идеальном газе
-
Формула средней квадратичной скорости молекул
- Как посчитать в зависимости от природы газа и температуры?
Средняя квадратичная скорость молекул газа — что это за параметр
Молекулы любого газа пребывают в постоянном движении. Его можно охарактеризовать с точки зрения средней их скорости или средней квадратичной скорости. Первое понятие имеет специальный термин — скорость теплового движения. Второе — средняя квадратичная скорость — величина, для которой существует специальная формула.
Для того, чтобы полностью разобраться в понятии средней квадратичной скорости молекул газа, вводится условный участник процесса — идеальный газ.
Определение
Идеальный газ — это математическая модель, потенциальную энергию которой принимают за ноль, а кинетическую характеризуют в полном объеме. Идеальный газ подходит в качестве модели окружающих нас газов, например, обычного воздуха.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Определение
Средняя квадратичная скорость — физическая величина, отличная от средней арифметической скорости молекул, определяемая по формуле: корень квадратный из средней арифметической квадратов скоростей различных молекул.
Кинетическая энергия определяется скоростью движения молекул, поэтому зависит от температуры. Скорости молекул одного газа не одинаковы. Часть молекул движутся очень быстро, часть — с незначительной скоростью. Однако для большинства существует некое среднее значение. Если изобразить это на графике в виде параболы, такие молекулы со средней скоростью будут составлять ее верхнюю часть.
В единице объема газа содержится огромное число молекул. Поэтому, например, его давление на стенки сосуда — величина постоянная. В ином случае, если бы в единицу времени о стенку ударялось различное количество молекул, давление бы «скакало».
Из изложенного можно сделать вывод: скорость — свойство отдельной молекулы газа, а давление — характеристика их совокупности.
От каких величин зависит в идеальном газе
Для идеального газа средняя квадратичная скорость прямо пропорциональна его температуре и обратно пропорциональна молярной массе газа.
В математическом выражении данная зависимость выражается через корень квадратный:
(V=surd(3RT/mu)
)
где R — универсальная постоянная величина, Т — температура газа, μ — молярная масса.
Из формулы видно, что искомая величина (средняя квадратичная скорость) зависит от природных свойств газа и его температуры.
Формула средней квадратичной скорости молекул
Математическое выражение формулы выглядит следующим образом:
(V_{ср;кв}=surd(V_{12}+V_{22}+V_{n2})/N)
В формуле присутствуют следующие условные обозначения: V1, V2, Vn — скорости молекул, а N — их количество.
Формула может иметь и другой вид:
(V_{ср;кв}=surd1/Nastsum V_2)
или
(V_{ср;кв}=int V_2F(V)dV)
Как посчитать в зависимости от природы газа и температуры?
Проведенное интегрирование формулы, цель которого определить зависимость искомой единицы от природных свойств иттемпературы газа, приводит расчеты к формуле:
(V_{ср;кв}=surd(3kT/mo))
или
(V_{ср;кв}=surd(3RT/mu))
При поступательном движении молекул газа Vср кв — составляющая уравнения для молекулярно-кинетической теории.
Если n=N/V, где N — число частиц, а V — объем, то концентрация частиц n получает следующее формульное выражение:
(p=1/3ast nmo(V_{ср;кв})^2)
Насколько полезной была для вас статья?
Рейтинг: 2.33 (Голосов: 3)
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Текст с ошибкой:
Расскажите, что не так
Поиск по содержимому
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Движение
молекул газа подчиняется законам
статистической физики. В каждый
момент времени скорости отдельных
молекул могут значительно отличаться
друг от друга, но их средние значения
одинаковы и при расчетах используются
не мгновенные скорости отдельных
молекул, а некоторые средние значения.
Различают среднюю арифметическую <u>
и среднюю квадратичную <Uкв>
скорость хаотического движения молекул.
Пусть
имеется N молекул, скорости которых
соответственно u1,
u2,…., un.
Средняя
арифметическая скорость хаотического
движения молекул по модулю равна

Средняя
квадратичная скорость хаотического
движения молекул
где<υ^2>-средний
квадрат скорости движ. молекул.Его не
следует с квадратом средней скорости<
υ ^2>≠(< υ >)^2.Как показывают
расчеты
;
;R-универ.газ
постоянная.R=8.31Дж/моль*К;
R=KNa
;
9) Основное уравнение мкт идеального газа
Это
уравнение связывает между собой
параметры состояния идеального газа
и характеристики движения его молекул.
Для вывода основного уравнения МКТ
рассмотрим одноатомный идеальный газ,
находящийся в термодинамическом
равновесии.
Представим
себе сосуд в виде куба с длиной ребра
/ (рис.6.4), в котором беспорядочно движутся
Л’ молекул массой то
каждая.
Стенки сосуда подвергаются непрерывной
бомбардировке молекулами. Удары молекул
обуславливают давление газа на стенки.
В виду беспорядочности движения молекул,
результат их удара о стенки таков, как
если бы 1/3 всех молекул двигалась
прямолинейно между правой и левой
стенками (вдоль оси х),
1/3 молекул
— между передней и задней стенками
(вдоль оси у)
и 1/3 молекул
— между верхней и нижней стенками
(вдоль оси г).
Отдельная молекула, летящая перпендикулярно
к одной из стенок, например, к правой
со скоростью у
в результате
упругого удара отскочит назад и ее
импульс изменится на Ар
= р – ро или
в проекциях: Ар
= тoи
– (-mou
)= 2mou
продолжительность
удара. Р=1/3nm0<v^2>;vкен=m0<v^2>/2;
Р=2/3nWкен=nKT;-Уравнение
МКТ. n-
конц.молекул, К-кофициэнт, постоянная
Вольцмана.К=1.38*10^-23Дж/К. Wкен=3/2KT.
10) Температура и тепловое равновесие системы
Если
два тела разной температуры привести
в соприкосновение, то, как показывает
опыт, между ними будет происходить
теплообмен -— передача энергии от более
нагретого тела к менее нагретому, и
тела придут в состояние теплового
равновесия, температуры у них будут
одинаковые.
Тепловым
равновесием
называют такое состояние системы, при
котором все макроскопические параметры
(P,V,T)
остаются неизменными.
Любая
термодинамическая система может
находиться в различных состояниях
теплового равновесия. В каждом из этих
состояний давление и объем могут быть
различны (но постоянны), а температура
имеет строго определенное значение, и
она одинакова во всех частях системы.
Следовательно,
температура
характеризует состояние теплового
равновесия термодинамической системы.
Если привести
в соприкосновение два газа с различными
значениями средней кинетической
энергии молекул, то молекулы, движущиеся
с большими скоростями, сталкиваясь с
молекулами другого газа, будут их
ускорять, сами при этом замедляясь.
Происходит передача энергии, пока
не наступит момент, когда средние
кинетические энергии молекул обоих
газов выравняются. Это и есть состояние
теплового равновесия, при котором
переход внутренней энергии от одного
газа к другому прекращается, хотя
столкновения беспорядочно движущихся
молекул обоих газов будет продолжаться.
Температура
характеризует тепловое равновесие:
P=2/3n<WK>=2/3n/V*<WK>:
2/3*<WK>=PV/N:
PV/N=KT:
<WK>=3/2*KT
Абсалютная
Т есть мера <Wкен>поступательного
движ. молекул.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить скорость молекул газа? Помогите ответить!
Дима Федоренко
Ученик
(87),
закрыт
10 лет назад
Leonid
Высший разум
(388685)
11 лет назад
Строго – по распределению Максвелла.
Если нужна среднеквадратическая скорость – то по формуле Больцмана E = 3/2 kT. Это кинетическая энергия, приходящаяся в среднем на одну молекулу. По энергии и массе молекулы не штука найти скорость, соответствующую вот такой энергии.