А́том водоро́да — физико-химическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра, как правило, входит протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон образует электронную оболочку; наибольшая вероятность обнаружения электрона в единичном объёме наблюдается для центра атома. Интегрирование по сферическому слою показывает, что наибольшая вероятность обнаружения электрона в единичном слое соответствует среднему радиусу, равному боровскому радиусу 
Атом водорода имеет особое значение в квантовой механике и релятивистской квантовой механике, поскольку для него задача двух тел имеет точное или приближённое аналитическое решение. Эти решения применимы для разных изотопов водорода (с соответствующими поправками).
В квантовой механике атом водорода описывается двухчастичной матрицей плотности или двухчастичной волновой функцией. Также упрощённо рассматривается как электрон в электростатическом поле бесконечно тяжёлого атомного ядра, не участвующего в движении (или просто в кулоновском электростатическом потенциале вида 1/r). В этом случае атом водорода описывается редуцированной одночастичной матрицей плотности или волновой функцией.
В 1913 году Нильс Бор предложил модель атома водорода, имеющую множество предположений и упрощений, и вывел из неё спектр излучения водорода. Предположения модели не были полностью правильны, но тем не менее приводили к верным значениям энергетических уровней атома.
Результаты расчётов Бора были подтверждены в 1925—1926 годах строгим квантовомеханическим анализом, основанном на уравнении Шрёдингера. Решение уравнения Шрёдингера для электрона в электростатическом поле атомного ядра выводится в аналитической форме. Оно описывает не только уровни энергии электрона и спектр излучения, но и форму атомных орбиталей.
Решение уравнения Шрёдингера[править | править код]
Решение уравнения Шрёдингера для водородного атома использует тот факт, что кулоновский потенциал является изотропным, то есть не зависит от направления в пространстве, другими словами, обладает сферической симметрией. Хотя конечные волновые функции (орбитали) не обязательно сферически симметричны, их зависимость от угловой координаты следует полностью из изотропии основного потенциала: собственные значения оператора Гамильтона можно выбрать в виде собственных состояний оператора углового момента. Это соответствует тому факту, что угловой момент сохраняется при орбитальном движении электрона вокруг ядра. Отсюда следует, что собственные состояния гамильтониана задаются двумя квантовыми числами углового момента l и m (целые числа). Квантовое число углового момента l может принимать значения 0, 1, 2… и определяет величину углового момента. Магнитное квантовое число может принимать m = −l, …, +l; оно определяет проекцию углового момента на (произвольно выбранную) ось z.
В дополнение к математическим выражениям для волновых функций полного углового момента и проекции углового момента нужно найти выражение для радиальной зависимости волновой функции. В потенциале 1/r радиальные волновые функции записываются с использованием полиномов Лагерра. Это приводит к третьему квантовому числу, которое называется основным квантовым числом n и может принимать значения 1, 2, 3… Основное квантовое число в атоме водорода связано с полной энергией атома. Заметим, что максимальное значение квантового числа углового момента ограничено основным квантовым числом: оно может изменяться только до n − 1, то есть l = 0, 1, …, n−1.
Из-за сохранения углового момента состояния с одинаковыми l, но различными m в отсутствие магнитного поля имеют одну и ту же энергию (это выполняется для всех задач с аксиальной симметрией). Кроме того, для водородного атома состояния с одинаковыми n, но разными l также вырождены (то есть имеют одинаковую энергию). Однако это свойство — особенность лишь атома водорода (и водородоподобных атомов), оно не выполняется для более сложных атомов, которые имеют (эффективный) потенциал, отличающийся от кулоновского (из-за присутствия внутренних электронов, экранирующих потенциал ядра).
Если мы примем во внимание спин электрона, то появится последнее, четвёртое квантовое число, определяющее состояния атома водорода — проекция углового момента собственного вращения электрона на ось Z. Эта проекция может принимать два значения. Любое собственное состояние электрона в водородном атоме полностью описывается четырьмя квантовыми числами. Согласно обычным правилам квантовой механики, фактическое состояние электрона может быть любой суперпозицией этих состояний. Это объясняет также, почему выбор оси Z для квантования направления вектора углового момента является несущественным: орбиталь для данных l и 

Рассмотрим сейчас решение уравнения Шрёдингера для атома водорода. Так как потенциальная функция электрона в атоме водорода имеет вид 
Здесь ψ — волновая функция электрона в системе отсчёта протона, m — масса электрона, 

Так как потенциальная функция зависит от r, а не от координат по отдельности, удобно будет записать лапласиан в сферической системе координат 
Уравнение Шрёдингера в сферических координатах:
В этом уравнении 




После подстановки значений частных производных в уравнение Шрёдингера получим:
Умножим уравнение на 
Второе слагаемое тут зависит только от φ. Перенесём его в правую часть равенства.
Равенство возможно, когда обе части равны какой-то постоянной величине. Обозначим её 
Решением этого уравнения являются функции:
Угол φ может изменяться от 0 до 2π. Функция 


Далее, интегрируя квадрат модуля функции 

Далее рассмотрим левую часть уравнения (1). Она, конечно, равна 
Разделим уравнение на 
После аналогичного вышеуказанному перенесению второго слагаемого в правую часть и обозначения величины, которой равны эти части, через 
Решение этих двух последних уравнений приводит к значениям l и n соответственно. Три квантовых числа в совокупности полностью описывают состояния электрона в атоме водорода.
Модуль полной энергии электрона в стационарном состоянии в атоме водорода обратно пропорционален 

Число l называется азимутальным квантовым числом и определяет орбитальный момент количества движения электрона и форму электронного облака; может иметь значения от 0 до n − 1 (n здесь относится к энергетическом уровню, на котором находится рассматриваемый электрон).
Магнитное квантовое число 

Математическое описание атома водорода[править | править код]
Энергетический спектр[править | править код]
Энергетические уровни атома водорода, включая подуровни тонкой структуры, записываются в виде:
- где
— постоянная тонкой структуры,
— собственное значение оператора полного момента импульса.
Энергию 

(в системе СИ),
- где h — постоянная Планка,
электрическая постоянная. Величина E0 (энергия связи атома водорода в основном состоянии) равна 13,62323824 эВ = 2,182700518⋅10−18 Дж. Эти значения несколько отличаются от действительного значения E0, поскольку в расчёте не учтена конечная масса ядра и эффекты квантовой электродинамики.
Волновые функции[править | править код]
В сферических координатах волновые функции имеют вид:
- где:
— Боровский радиус,
— обобщённые полиномы Лагерра степени
от функции
— нормированные на единицу сферические функции.
Угловой момент[править | править код]
Собственные значения для оператора углового момента:
Нахождение энергии электрона из модели Бора[править | править код]
Вычислим уровни энергии атома водорода без учёта тонкой структуры, используя простую модель атома Бора. Для этой цели можно сделать грубое допущение электрона, двигающегося по круговой орбите на фиксированном расстоянии. Приравнивая кулоновскую силу притяжения 

Здесь 



Отсюда кинетическая энергия электрона:
- где
расстояние от электрона до ядра.
Потенциальная его энергия:
Полная энергия, соответственно, равна:
Для нахождения радиуса rn стационарной орбиты с номером n рассмотрим систему уравнений, в которой второе уравнение есть математическое выражение первого постулата Бора 
Отсюда получаем выражение для радиуса стационарной орбиты с номером n:
Радиус первой орбиты оказывается равным 
Подставляя это значение в выражение для энергии, получим:
Отсюда мы можем найти волновое число (по определению это обратная длина волны или число длин волн, укладывающихся на 1 см) фотона, излучаемого атомом водорода за один переход из возбуждённого состояния с главным квантовым числом 

- где
постоянная Ридберга в системе СГС (она равна 109 737,31568539 см−1)[1].
Визуализация орбиталей атома водорода[править | править код]
Плотность вероятности для электрона при различных квантовых числах (l)
Изображение справа показывает первые несколько орбиталей атома водорода (собственные функции гамильтониана). Они представляют собой поперечные сечения плотности вероятности, величина которой отражена цветом (чёрный цвет соответствует минимальной плотности вероятности а белый — максимальной). Квантовое число углового момента l обозначено в каждой колонке, используя обычные спектроскопические обозначения (s означает l = 0; p: l = 1; d: l = 2). Главное квантовое число n (= 1, 2, 3…) отмечено справа от каждого ряда. Для всех картин магнитное квантовое число m равно 0, и сечение взято в плоскости — XZ, Z — вертикальная ось. Плотность вероятности в трёхмерном пространстве получается при вращении картинки вокруг оси Z.
Основное состояние, то есть состояние самой низкой энергии, в котором обычно находится электрон, является первым, состоянием 1s (n = 1, l = 0). Изображение с большим количеством орбиталей доступно до более высоких чисел n и l. Отметим наличие чёрных линий, которые появляются на каждой картинке, за исключением первой. Они — узловые линии (которые являются фактически узловыми поверхностями в трёх измерениях). Их общее количество всегда равно n − 1, которое является суммой числа радиальных узлов (равного n − l − 1) и числа угловых узлов (равного l).
Строение и свойства атома водорода[править | править код]
Образование атома водорода и его спектр излучения[править | править код]
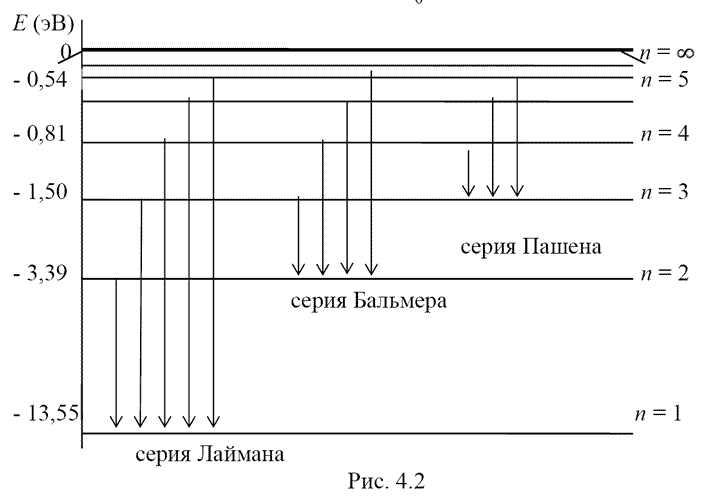
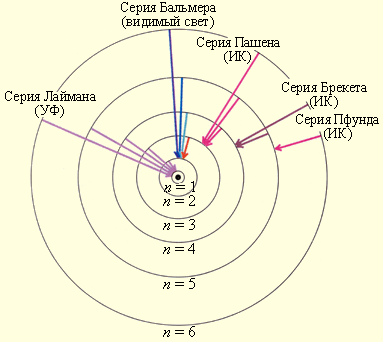
Схема энергетических уровней атома водорода и спектральные серии
При попадании в электрическое поле положительно заряженного протона и отрицательно заряженного электрона происходит захват последнего протоном — образуется атом водорода. Образовавшийся атом водорода находится в возбуждённом состоянии. Время жизни атома водорода в возбуждённом состоянии — доли или единицы наносекунд (10−8—10−10сек)[2], однако очень высоковозбуждённые атомы, находящиеся в состоянии с большими главными квантовыми числами при отсутствии столкновений с другими частицами, в очень разрежённых газах могут существовать до нескольких секунд. Снятие возбуждения атома происходит за счёт излучения фотонов с фиксированной энергией, проявляющихся в характерном спектре излучения водорода. Поскольку объём газообразного атомарного водорода содержит множество атомов в различных состояниях возбуждения, спектр состоит из большого числа линий.
Схема образования спектра атомарного водорода и спектральные серии представлена на рисунке[3].
Линии спектра серии Лаймана обусловлены переходом электронов на нижний уровень с квантовым числом n = 1 с уровней с квантовыми числами n = 2, 3, 4, 5, 6… Линии Лаймана лежат в ультрафиолетовой области спектра. Линии спектра серии Бальмера обусловлены переходом электронов на уровень с квантовым числом n = 2 с уровней с квантовыми числами n = 3, 4, 5, 6… и лежат в видимой области спектра.
Линии спектра серий Пашена, Брэкета и Пфунда обусловлены переходом электронов на уровни с квантовыми числами n, равными 3, 4 и 5 (соответственно), и расположены в инфракрасной области спектра[4].
В нормальном (основном) состоянии (главное квантовое число n = 1) атом водорода в изолированном виде может существовать неограниченное время. Согласно квантовохимическим расчётам, радиус места наибольшей вероятности нахождения электрона в атоме водорода в нормальном состоянии (главное квантовое число n = 1) равен 0,529 Å. Этот радиус является одной из основных атомных констант, он получил название боровский радиус (см. выше). При возбуждении атома водорода электрон проходит на более высокий квантовый уровень (главное квантовое число n = 2, 3, 4 и т. д.), при этом радиус места наибольшей вероятности нахождения электрона в атоме возрастает пропорционально квадрату главного квантового числа:
- rn = a0 · n2.
Возбуждение и ионизация атома водорода[править | править код]
Возбуждение атома водорода происходит при нагревании, электроразряде, поглощении света и т. д., причём в любом случае атом водорода поглощает определённые порции — кванты энергии, соответствующие разности энергетических уровней электронов. Обратный переход электрона сопровождается выделением точно такой же порции энергии. Квантовые переходы электрона соответствуют скачкообразному изменению концентрического шарового слоя вокруг ядра атома водорода, в котором преимущественно находится электрон (шаровым слой является только при нулевом значении азимутального квантового числа l).
Согласно квантовомеханическим расчётам, наиболее вероятное расстояние электрона от ядра в атоме водорода равно боровскому радиусу ~ 0,53 Å при n = 1; 2,12 Å — при n = 2; 4,77 Å — при n = 3 и так далее. Значения этих радиусов относятся как квадраты натуральных чисел (главного квантового числа) 12 : 22 : 32…. В очень разреженных средах (например, в межзвёздной среде) наблюдаются атомы водорода с главными квантовыми числами до 1000 (ридберговские атомы), чьи радиусы достигают сотых долей миллиметра.
Если электрону в основном состоянии придать дополнительную энергию, превышающую энергию связи E0 ≈ 13,6 эВ, происходит ионизация атома водорода — распад атома на протон и электрон.
Радиальное распределение вероятности нахождения электрона в атоме.
Строение атома водорода в основном состоянии[править | править код]
Радиальная зависимость dp(r)/dr плотности вероятности нахождения электрона в атоме водорода, находящемся в основном состоянии, представлена на рисунке. Эта зависимость даёт вероятность того, что электрон будет обнаружен в тонком шаровом слое радиуса r толщиной dr с центром в ядре. Площадь этого слоя равна S = 4πr2, его объём dV = 4πr2dr. Общая вероятность нахождения электрона в слое равна (4πr2dr) ψ2, поскольку в основном состоянии волновая функция электрона сферически симметрична (то есть постоянна в рассматриваемом шаровом слое). Рисунок выражает зависимость dp(r)/dr = 4πr2ψ2. Кривая радиального распределения плотности вероятности dp(r)/dr нахождения электрона в атоме водорода имеет максимум при a0. Этот наиболее вероятный радиус совпадает с боровским радиусом. Размытое облако плотности вероятности, полученное при квантовомеханическом рассмотрении, значительно отличается от результатов теории Бора и согласуется с принципом неопределённости Гейзенберга. Это размытое сферически симметричное распределение плотности вероятности нахождения электрона, называемое электронной оболочкой, экранирует ядро и делает физическую систему протон-электрон электронейтральной и сферически симметричной — у атома водорода в основном состоянии отсутствуют электрический и магнитный дипольные моменты (как и моменты более высоких порядков), если пренебречь спинами электрона и ядра. Максимум объёмной плотности вероятности ψ2 достигается не при r = a0, как для радиальной зависимости, а при r = 0.
Атом водорода в электрическом поле[править | править код]
По теории деформационной поляризации, нейтральный атом водорода, попадая во внешнее электрическое поле, подвергается деформации — центр электронной оболочки атома водорода смещается относительно ядра на некоторое расстояние L, что приводит к появлению в атоме водорода наведённого электрического дипольного момента μ[5]. Величина наведённого дипольного момента прямо пропорциональна напряжённости внешнего электрического поля E:
- μ = αeE = Lq
Коэффициент пропорциональности αe носит название электронной поляризуемости. Электронная поляризуемость атома водорода составляет 0,66 Å3.[6]
Чем выше напряжённость приложенного электрического поля, тем больше смещение центра электронной оболочки от центра атома водорода и, собственно, длина наведённого диполя:
- L = αe E/q,
- где q — величина заряда ядра атома водорода.
При высоких значениях напряжённости приложенного электрического поля атом водорода подвергается ионизации полем с образованием свободных протона и электрона.
Взаимодействие атома водорода с протоном[править | править код]
Деформационная поляризация атома водорода в электрическом поле протона
Протон, обладая положительным элементарным электрическим зарядом q = 1,602•10 −19 Кл, как и всякий точечный электрический заряд создаёт вокруг себя электрическое поле с напряжённостью E.
E = q/R2,
Где R — расстояние точки поля до протона.
Нейтральный атом водорода, попадая в электрическое поле протона, подвергается деформационной поляризации (см. рисунок). Длина наведённого электрического диполя атома водорода обратно пропорциональна квадрату расстояния между атомом водорода и протоном L = αe E/q = αe/R2 = 0,66/R2
Отрицательный полюс наведённого электрического диполя атома водорода ориентируется в сторону протона. В результате чего начинает проявляться электростатическое притяжение между атомом водорода и протоном. Сближение частиц (атома водорода и протона) возможно до тех пор, пока центр плотности вероятности нахождения электрона станет равноудалённым от обоих протонов. В этом предельном случае d=R=2L. Центр области вероятного нахождения электрона совпадает с центром симметрии образовавшейся системы H2+ — молекулярного иона водорода, при этом
d=R=2L=³√2αe = ³√2•0,66 = 1,097 Å.
Найденная величина d = 1,097 Å близка к экспериментальной величине межъядерного расстояния в молекулярном ионе водорода H2+ — 1,06 Å.[7]
Взаимодействуя с протоном, атом водорода образует молекулярный ион водорода
H2+,H + H + -> H2+ + Q,
Характеризующийся простейшей одноэлектронной ковалентной химической связью.
Взаимодействие атома водорода с электроном[править | править код]
Деформационная поляризация атома водорода под действием приближающегося электрона и модель гидрид-иона H–
Электрон, обладая элементарным электрическим зарядом, как и протон, создаёт вокруг себя электрическое поле, но (в отличие от электрического поля протона) с отрицательным знаком. Нейтральный атом водорода, попадая в электрическое поле электрона, подвергается деформационной поляризации. Центр электронной оболочки атома водорода смещается относительно ядра на некоторое расстояние L в противоположную сторону к приближающемуся электрону. Приближающийся электрон как бы вытесняет из атома водорода находящийся в нём электрон, подготавливая место для второго электрона. Величина смещения центра электронной оболочки атома водорода L обратно пропорциональна квадрату расстояния атома водорода к приближающемуся электрону R:
L = αe/R2 = 0.66/R2 (рис)
Сближение атома водорода и электрона возможно до тех пор, пока центры областей плотностей вероятности нахождения обоих электронов не станут равноудалёнными от ядра объединённой системы — отрицательно заряженного иона водорода. Такое состояние системы имеет место при
re = L = R = 3√0,66 = 0,871 Å,
где re — орбитальный радиус двухэлектронной оболочки гидрид-иона H–.
Таким образом, атом водорода проявляет своеобразную амфотерность: он может взаимодействовать как с положительно заряженной частицей (протоном), образуя молекулярный ион водорода H2+, так и с отрицательно заряженной частицей (электроном), образуя гидрид-ион H–.
Рекомбинация атомов водорода[править | править код]
Рекомбинация атомов водорода обсуловлена силами межатомного взаимодействия. Происхождение сил, вызывающих притяжение электрически нейтральных атомов друг к другу, было объяснено в 1930 году Ф.Лондоном. Межатомное притяжение возникает вследствие флуктуации электрических зарядов в двух атомах, находящихся близко друг от друга. Поскольку электроны в атомах движутся, то каждый атом обладает мгновенным электрическим дипольным моментом, отличным от нуля. Мгновенный диполь на одном атоме наводит противоположно направленный диполь в соседнем атоме. Наступает синхронизация колебаний двух атомов — двух осцилляторов, частоты которых совпадают. Результатом этого процесса является образование молекулы водорода.
Наличие мгновенного электрического дипольного момента у атома водорода выражается в характерной особенности атома водорода, проявляющейся в крайней реакционной способности атомарного водорода и склонности его к рекомбинации. Время существования атомарного водорода составляет около 1 с при давлении в 0,2 мм рт. ст. Рекомбинация атомов водорода имеет место, если образующаяся молекула водорода быстро освобождается от избытка энергии, выделяющейся при взаимодействии атомов водорода путём тройного столкновения. Соединение атомов водорода в молекулу протекает значительно быстрее на поверхности различных металлов, чем в самом газе. При этом металл воспринимает ту энергию, которая выделяется при образовании молекул водорода, и нагревается до очень высоких температур. Тепловой эффект реакции образования молекулярного водорода из атомов водорода составляет 103 ккал/моль.
На принципе рекомбинации атомов водорода разработана атомно-водородная сварка. Между двумя вольфрамовыми стержнями создаётся электрическая дуга, через которую по облегающим стержни трубкам пропускается ток водорода. При этом часть молекул водорода распадается на атомы, которые затем вновь соединяются на металлической поверхности, помещаемой на небольшом расстоянии от дуги. Металл может быть таким путём нагрет до температуры выше 3500° C[8].
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения водорода в атомарное состояние (α) в зависимости от абсолютной температуры (T) представлены в таблице[9]:
| T, к | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10-6 | 2,47 · 10-2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10-4 | 7,83 · 10-2 | 0,621 | 0,954 | 0,992 | 0,999 |
См. также[править | править код]
- Водород
- Водородоподобный атом
- Квантовая механика
- Квантовая химия
- Квантовая теория поля
- Квантовое состояние
- Принцип неопределённости
- Волновая функция
- Электронное облако
- Ридберговский атом
Примечания[править | править код]
- ↑ Сивухин Д. В. § 13. Спектр водорода // Общий курс физики. — М.: Наука, 1986. — Т. V. Атомная и ядерная физика. Часть 1: Атомная физика. — С. 68. — 416 с. — ISBN 5-02-014053-8.
- ↑ Ахметов Н. С. Неорганическая химия. Учебное пособие для вузов с ил. — 2-е изд., перераб. и доп. — М.: «Высшая школа», 1975. — 672 с.
- ↑ Некрасов Б. В. Курс общей химии. — 14-е изд. — М.: ГНТИ химической литературы, 1962. — С. 113. — 976 с.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия. — пер. с англ. под ред. д. х. н., проф. К. В. Топчиевой. — М.: «Мир», 1978. — С. 369—370. — 645 с.
- ↑ Потапов А. А. Деформационная поляризация: Поиск оптимальных моделей. — Новосибирск: «Наука», 2004. — 511 с. — ISBN 5-02-032065-X.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: Издательство химической литературы, 1962. — Т. 1. — С. 385. — 1071 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: Издательство химической литературы, 1962. — Т. 1. — С. 388. — 1071 с.
- ↑ Некрасов Б. В. Курс общей химии. — 14-е изд. — М.: ГНТИ химической литературы, 1962. — С. 110. — 976 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: “Химия”, 1964. — Т. 3. — С. 24. — 1008 с. — 65 000 экз.
Литература[править | править код]
- Luca Nanni. The Hydrogen Atom: a Review on the Birth of Modern Quantum Mechanics (англ.). — arXiv:1501.05894.
Ссылки[править | править код]
- Griffiths (англ.) (рус., David J. Introduction to Quantum Mechanics (англ.). — Upper Saddle River, NJ: Prentice Hall, 1995.
- Bransden, B.H.; C.J. Joachain. Physics of Atoms and Molecules (англ.). — London: Longman, 1983.
- Физика атома водорода на Scienceworld
- Графическое представление орбиталей
- Апплет, изображающий орбитали атома водорода
Уравнение
Шредингера, примененное
к атому водорода, позволяет получить
результаты боровской теории атома
водорода без привлечения постулатов
Бора и условия квантования.
Согласно
квантовой механике, не
существует определенных круговых орбит
электронов, как в
теории Бора. В силу волновой природы электрон
«размазан» в пространстве, подобно
«облаку» отрицательного заряда.
Применим
уравнение Шредингера к электрону,
находящемуся в атоме водорода.
Решение
задачи об энергетических уровнях
электрона для водорода, а также
водородоподобных систем сводится к
задаче о движении электрона в кулоновском
поле ядра. Потенциальная энергия
взаимодействия электрона с ядром,
обладающим зарядом Ze (для
атома водорода Z =
1), определяется выражением 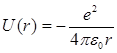
и
зависит только от r –
расстояния между электроном и протоном,
поэтому задачу с таким видом потенциальной
энергии обычно решают в сферической
системе координат. В общем случае
волновая функция является функцией от
всех координат и уравнение Шредингера
будет иметь вид:
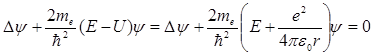
(21.21)
Квантовые
числа –
целые или дробные числа, определяющие
возможные значения физических величин,
характеризующих квантовую систему
(молекулу, атом, атомное ядро, элементарную
частицу). Квантовые числа отражают
дискретность (квантованность) физических
величин, характеризующих микросистему.
Основные квантовые числа
11.
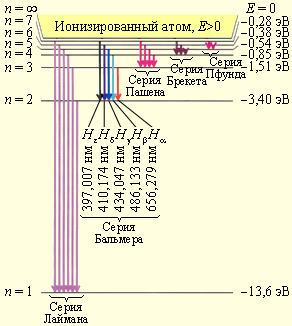
Диаграмма состояний электрона в атоме
водорода.
Диаграмма
энергетических уровней атома водорода.
Показаны переходы, соответствующие
различным спектральным сериям. Для
первых пяти линий серии Бальмера в
видимой части спектра указаны длины
волн
12.
Спин элементарных частиц и атомных
ядер. Фермионы и бозоны. Принцип Паули.
Спин
—
собственный момент импульса элементарных
частиц, имеющий квантовую природу и не
связанный с перемещением частицы как
целого. Спином называют также собственный
момент импульса атомного ядра или атома;
в этом случае спин определяется как
векторная сумма (вычисленная по правилам
сложения моментов в квантовой механике)
спинов элементарных частиц, образующих
систему, и орбитальных моментов этих
частиц, обусловленных их движением
внутри системы.
Спин
измеряется в единицах ħ] (приведённой постоянной
Планка,
или постоянной
Дирака)
и равен ħJ, где J —
характерное для каждого сорта частиц
целое (в том числе нулевое)
или полуцелое положительное
число — так называемое спиновое
квантовое число,
которое обычно называют просто спином
(одно из квантовых
чисел).
13. Строение многоэлектронного атома. Периодическая система элементов Менделеева.
Электронная
конфигурация элемента. Запись
распределения электронов в атоме по
оболочкам, подоболочкам и орбиталям
получила название электронной кофигурации
элемента. Обычно электронная конфигурация
приводится для основного состояния
атома
При
записи электронной конфигурации
указывают цифрами главное квантовое
число (n), буквами – подоболочки (s,p,d или
f), а степень буквенных обозначений
подуровней обозначает число электронов
в данной подоболочке.
Например,
электронная конфигурация водорода –
1s1,
лития – 1s22s1,
бора – 1s22s22p1,
магния – 1s22s22p63s2,
титана – 1s22s22p63s23p63d24s2.
При
составлении электронных конфигураций
многоэлектронных атомов учитывают:
принцип минимальной энергии, принцип
Паули, правила Гунда и Клечковского.
Принцип
минимальной энергии. Согласно
этому принципу электроны в основном
состоянии заполняют орбитали в порядке
повышения уровня энергии орбиталей.
Первыми заполняются орбитали с
минимальными уровнями энергии.
|
Рис. |
В Правило Исключение |
Принцип
запрета Паули. В
1925 г. П. Паули постулировал принцип
запрета, согласно которому в атоме не
может быть двух электронов, обладающих
одинаковым набором квантовых
чисел n, l, ml и ms.
Отсюда следует, что на каждой атомной
орбитали может быть не более двух
электронов, причем они должны иметь
противоположные (антипараллельные)
спины, т.е. допускается заполнение ↑↓
и не допускается заполнение ↓↓ и ↑↑.
Правило
Гунда. В
соответствии с этим правилом заполнение
орбиталей одной подоболочки в основном
состоянии атома начинается одиночными
электронами с одинаковыми спинами.
После того как одиночные электроны
займут все орбитали в данной подоболочке,
заполняются орбитали вторыми электронами
с противоположными спинами. Например,
у атома азота орбитали в основном
состоянии заполняют р-подоболочку
2р3 по
одному электрону
Возбужденное
состояние атома. Электронная
пара, образующая связь, может образоваться
за счет неспаренных электронов, имеющихся
в невозбужденных атомах.
Однако
число ковалентных связей может быть
больше числа неспаренных электронов.
Например, в невозбужденном состоянии
(которое называется также основным
состоянием) атом углерода имеет два
неспаренных электрона, однако для него
характерны соединения, в которых он
образует четыре ковалентные связи. Это
оказывается возможным в результате
возбуждения атома. При этом один из
s-электронов переходит на p-подуровень:
Увеличение
числа создаваемых ковалентных связей
сопровождается выделением большего
количества энергии, чем затрачивается
на возбуждение атома. Поскольку
валентность атома зависит от числа
неспаренных электронов, возбуждение
приводит к повышению валентности. У
атомов азота, кислорода, фтора количество
неспаренных электронов не увеличивается,
т.к. в пределах второго уровня нет
свободных орбиталей, а перемещение
электронов на третий квантовый уровень
требует значительно большей энергии,
чем та, которая выделилась бы при
образовании дополнительных связей.
Таким образом, при
возбуждении атома переходы электронов
на свободные орбитали возможны только
в пределах одного энергетического
уровня.
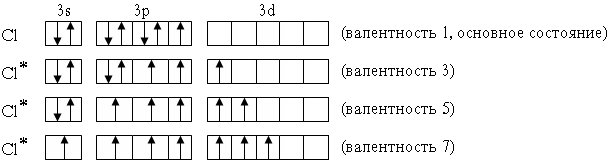
Элементы
3-го периода – фосфор, сера, хлор – могут
проявлять валентность, равную номеру
группы. Это достигается возбуждением
атомов с переходом 3s- и 3p-электронов на
вакантные орбитали 3d-подуровня:
P*
1s22s22p63s13p33d1
(валентность
5)
S*
1s22s22p63s13p33d2
(валентность
6)
Cl*
1s22s22p63s13p33d3
(валентность 7)
В
приведенных выше электронных формулах
возбужденных атомов подчеркнуты
подуровни, содержащие только неспаренные
электроны. На примере атома хлора легко
показать, что валентность может быть
переменной:
Периодическая
система химических элементов (таблица
Менделеева)
— классификация химических элементов,
устанавливающая зависимость различных
свойств элементов от заряда атомного
ядра. Система является графическим
выражением периодического закона,
установленного русским химиком Д. И.
Менделеевым в 1869 году. Её первоначальный
вариант был разработан Д. И. Менделеевым
в 1869—1871 годах и устанавливал зависимость
свойств элементов от их атомного веса
(по-современному, от атомной массы).(см.
лекцию 13.6)
Квантово-мхеаническая теория атомов
Рассмотрим теперь квантово-механическую теорию атомов, гораздо более полную, чем старая теория Бора. Она сохраняет некоторые аспекты старой теории. Например, электроны могут находиться в атоме только в дискретных состояниях с определенной энергией; при переходе электрона из одного состояния в другое испускается (или поглощается) фотон. Но квантовая механика – не просто обобщение теории Бора. Она представляет собой гораздо более глубокую теорию и рисует совершенно иную картину строения атома. Согласно квантовой механике, не существует определенных круговых орбит электронов, как в теории Бора. В силу волновой природы электрон «размазан» в пространстве, подобно «облаку» отрицательного заряда.
(7.1.1) где Ψ(r) – волновая функция положения, зависящая от расстояния r до центра.
Постоянная r1 совпадает с радиусом первой боровской орбиты. Следовательно, электронное облако в основном состоянии водорода сферически-симметрично, как показано на рис. 7.1.
Рис. 7.1
Электронное облако грубо характеризует размеры атома, но поскольку облако может не иметь четко выраженных границ, атомы также не имеют ни точной границы, ни определенного размера.
Как мы увидим в дальнейшем, не все электронные облака сферически-симметричны. Обратите внимание на то, что, хотя функция Ψ(r) при больших радиусах r, как следует из приведенного выше выражения, сильно убывает, она не обращается в нуль на конечных расстояниях. Поэтому квантовая механика утверждает, что основная часть атома не представляет собой пустое пространство. Т.к.
только при
, мы заключаем, что и во Вселенной не существует в подлинном смыслепустого пространства.
Электронное облако можно интерпретировать как с корпускулярной, так и с волновой точки зрения. Напомним, что под частицей мы понимаем нечто локализованное в пространстве: в любой момент времени частица занимает вполне определенное положение в пространстве. Следовательно, размытое в пространстве облако является результатом волновой природы электронов. Электронное облако можно также интерпретировать как распределение вероятностей для данной частицы. Мы не можем предсказать траектории, по которой будет двигаться электрон. После измерения его положения точно предсказать, где будет находиться электрон в последующие моменты времени, невозможно. Мы можем лишь вычислить вероятность обнаружения электрона в различных точках. Ясно, что подобная ситуация в корне отличается от классической ньютоновской физики. Как отмечал впоследствии Бор, бессмысленно даже спрашивать, как при испускании атомом светового фотона, электрон переходит из одного состояния в другое.
Атом водорода. Решение задачи об энергетических уровнях электрона для водорода (а также водородных систем: атома гелия He+, лития Li2+ и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z = 1):
,
(7.1.2) где r – расстояние между электроном и ядром. Графически функция U(r) изображается на рис. 7.2 жирной кривой. U(r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает.
Рис. 7.2
Состояние электрона в атоме водорода описывается волновой функцией Ψ, удовлетворяющей стационарному уравнению Шредингера, учитывающему значения (7.1.2):
,
(7.1.3) где m – масса электрона, E – полная энергия электрона в атоме.
Рассмотрим энергию электрона. В теории дифференциальных уравнений доказывается, что уравнения типа (7.1.3) имеют решение, удовлетворяющее однозначности, конечности и непрерывности волновой функции Ψ только при собственных значениях энергии
,
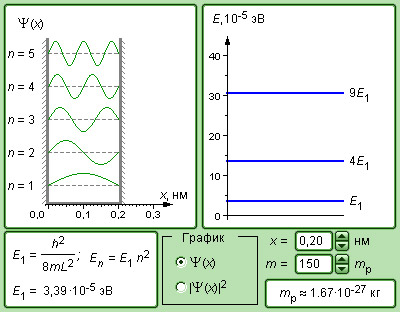
(7.1.4) где n = 1, 2, 3,…. Т.е. имеет дискретный набор отрицательных значений энергии.
Таким образом, как и в случае потенциальной ямы с бесконечно высокими стенками, решение уравнения Шредингера для атома водорода приводит к появлениюдискретных энергетических уровней. Возможные значения E1, E2, E3,… показаны на рис. 7.2 в виде горизонтальных полос. Самый низкий уровень E1, отвечающий минимальной возможной энергии, – основной (n=1), все остальные
(n = 2, 3, 4,…) – возбужденные. При
движение электрона является связанным – он находится внутри гиперболической потенциальной ямы. Из рис. 7.2 следует, что по мере роста главного квантового числа n энергетические уровни располагаются теснее и при

.
При E > 0 движение электрона становится свободным, т.е. область E > 0 соответствует ионизированному атому.
Итак, если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой механике дискретные значения энергии, являясь следствием самой теории, вытекают непосредственно из решения уравнения Шредингера.
Квантовые числа.
В квантовой механике доказывается, что уравнению Шредингера удовлетворяют собственные функции , определяемые набором трёх квантовых чисел:главного n, орбитального l и магнитного m.
Главное квантовое числоn характеризует расстояние электрона от ядра – радиус орбиты.
Согласно (7.1.4) n определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения, начиная с единицы.
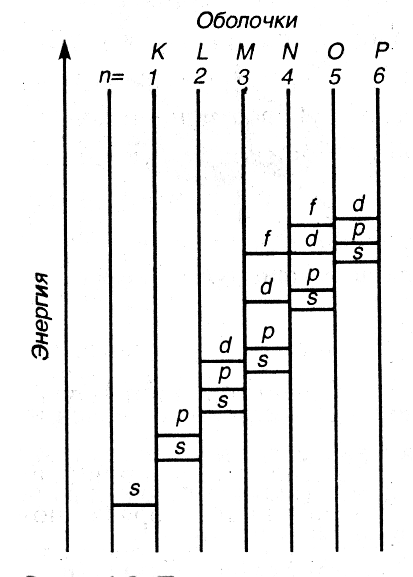
В атомной физике состояния электрона, соответствующие главному квантовому числу n, (n = 1, 2, 3, 4,…) принято обозначать буквами K, L, M, N,….
Орбитальное квантовое число l = 0, 1, 2, … n–1 характеризует эллиптичность орбиты электрона (рис. 7.3) и определяет момент импульса электрона .
Рис. 7.3
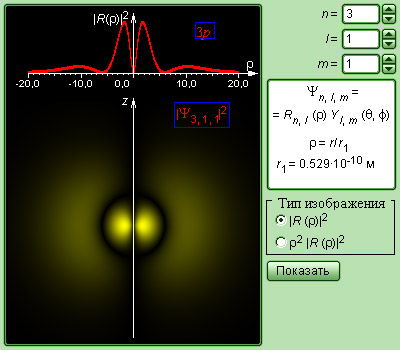
Квадрат модуля функции характеризует вероятность найти электрон в заданной точке. Область пространства, в которой высока вероятность обнаружить электрон (не менее 0,95), называют орбиталью. Основные типы орбиталей обозначают буквами s, p, d, f , … (от слов sharp, principal, diffuse, fundamental).
Два типа орбиталей s (она одна), p (их три), по которым «размазан» электронный заряд, показаны на рис. 7.4.
Рис. 7.4
Орбитали часто называют подоболочками оболочек, поскольку они характеризуют формы разных орбит, на которых можно обнаружить электроны,находящиеся в одной оболочке (при заданном квантовом числе n).
Решая последовательно задачу об электроне в прямоугольной потенциальной яме, мы доказали, что энергия и положение электрона квантуются, т.е. принимают дискретные значения.
Решая уравнения Шредингера для атома, можно получить выражения для энергии, момента импульса и других динамических переменных электрона без привлечения каких-либо постулатов.
Рассмотрим (без вывода) движение электрона в потенциальном поле .
Обратимся вновь к стационарному уравнению Шредингера:
| (7.2.1) |
Так как электрическое поле – центрально-симметрично, то для решения этого уравнения воспользуемся сферической системой с координатами (r, θ, φ), которые связаны с декартовыми координатами, как это следует из рис. 7.5, соотношениями:
;
;
.
Рис. 7.5
Подставим в (7.2.1) выражение оператора Лапласа в сферических координатах и получим уравнение Шредингера в следующем виде:
| (7.2.2) |
Уравнение (7.2.2) имеет решение при всех значениях полной энергии E > 0, что соответствует свободному электрону. При Е < 0 электрон находится в потенциальном поле ядра:
| (7.2.3) |
Таким образом, энергия принимает дискретные значения, т.е. квантуется (n = 1, 2, 3…).
Вывод такой же, как и в теории Бора, но в квантовой механике этот вывод получается как естественное следствие из уравнения Шредингера.
В квантовой механике широко используется понятие – оператор. Под оператором понимают правило, посредством которого одной функции φ сопоставляется другая функция f, т е. , где
– символ обозначения оператора.
Используя оператор энергии, стационарное уравнение Шредингера можно записать в виде:
| (7.2.4) |
Это традиционный вид записи уравнения Шредингера,здесь – оператор энергии – гальмитониан.
Воздействуя на волновую функцию Ψ, полученную при решении уравнения (7.2.2) оператором момента импульса (движение электрона вокруг ядра осуществляется по криволинейной траектории), можно получить выражение для момента импульса.
Для момента импульса в квантовой механике вводятся четыре оператора: оператор квадрата момента импульса и три оператора проекций момента импульса на оси координат
.
Оказалось, что одновременно определенные значения могут иметь лишь квадрат момента импульса и одна из проекций на координатные оси. Две другие проекции оказываются при этом совершенно неопределенными. Это означает, что «вектор» момента импульса не имеет определенного направления, и следовательно не может быть изображен, как в классической механике с помощью направленного отрезка, прямой.
Решение уравнения является очень трудным. Поэтому ограничимся только конечным результатом.
Собственное значение орбитального момента импульса L:
| (7.2.5) |
гдеl – орбитальное квантовое число(l = 0, 1, 2, …, n – 1).
Если обратиться к привычной нам модели атома, то n характеризует среднее расстояние электрона от ядра (радиус орбиты), l–эллиптичность орбиты.
Из выражения для L видно, что орбитальный момент импульса электрона в атоме тоже квантуется.
Основным состоянием электрона в атоме водорода является s-состояние. Если вычислить наиболее вероятное расстояние от ядра для электрона в s–состоянии, получим: – это первый боровский радиус (в СИ
).
Для других значений n получим выражения, соответствующие боровским орбитам.
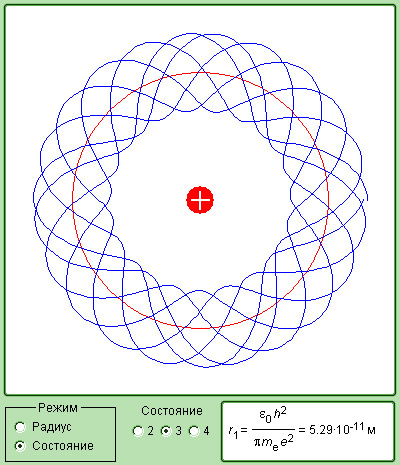
Боровские орбиты электрона представляют собой геометрическое место точек, в которых с наибольшей вероятностью может быть обнаружен электрон.
По теории Бора, вероятность нахождения электрона при любых других значениях r, кроме r = , равна нулю (рис. 7.6).
Рис. 7.6
Согласно квантовой механике эта вероятность достигает максимального значения лишь при r = . Допускается нахождение электрона и на других расстояниях от ядра, но с меньшей вероятностью.
Из представлений классической физики следует, что орбитальный момент импульса электрона и пропорциональный ему магнитный момент
ориентированы перпендикулярно плоскости орбиты электрона и противоположно направлены (рис. 7.7).
Рис. 7.7
Между и
существует связь:
| (7.3.1) |
где – орбитальное гиромагнитное отношение.
В квантовой механике, естественно, не может быть указана ориентация и
относительно плоскости электронной орбиты (орбиты, в буквальном смысле этого слова, нет).
В квантовой механике проекция ( ) вектора
на направление внешнего магнитного поля z может принимать лишь целочисленные значения, кратные ħ:
| (7.3.2) |
Здесь m = 0, ±1, ±2,…±l – магнитное квантовое число,l – орбитальное квантовое число, определяющее модуль вектора , ħ – естественная единица измерения механического момента импульса микрочастиц.
На рис. 7.8 показаны возможные ориентации вектора в состояниях s, p, d.
Рис. 7.8
Таким образом, пространственное квантование приводит к «расщеплению» энергетических уровней на ряд подуровней
Спин электрона
В 1922 году О. Штерн и В. Герлах поставили опыты, целью которых было измерение магнитных моментов Pm атомов различных химических элементов.
Схема опыта изображена на рис. 7.9. В колбе с вакуумом, 10–5 мм рт. ст., нагревался серебряный шарик К, до температуры испарения.
Рис. 7.9 Рис. 7.10
Атомы серебра летели с тепловой скоростью около 100 м/с через щелевые диафрагмы В и, проходя резко неоднородное магнитное поле, попадали на фотопластинкуА.
Были получены неожиданные результаты: на фотопластинке получились две резкие полосы – соответствующим лишь двум возможным ориентациям магнитного момента (рис. 7.10).
Этим доказывался квантовый характер магнитных моментов электронов. Измерения показали, что проекция магнитного момента электрона равна магнетону Бора:
.
Напомнинм, что
.
Единицей измерения магнитных моментов электронов и атомов является магнетон Бора (ħ – единица измерения механического момента импульса).
Кроме того, в этих опытах было обнаружено новое явление. Валентный электрон в основном состоянии атома серебра имеет орбитальное квантовое число l = 0 (s–состояние). Но при l = 0 (проекция момента импульса на направление внешнего поля равна нулю). Возник вопрос, пространственное квантование какого момента импульса обнаружилось в этих опытах и проекция какого магнитного момента равна магнетону Бора.
Предположили существование собственного механического момента импульса у электрона (спина) и, соответственно, собственного магнитного момента электрона Pms.
Из общих выводов квантовой механики следует, что спин должен быть квантован: , где s – спиновое квантовое число.
Из опытов следует, что таких ориентаций всего две: , а значит s = 1/2, т.е. спиновое квантовое число имеет только одно значение.
Для атомов первой группы, валентный электрон которых находится в s–состоянии (l = 0), момент импульса атома равен спину валентного электрона. Поэтому обнаруженное для таких атомов пространственное квантование момента импульса в магнитном поле является доказательством наличия у спина лишь двух ориентацийво внешнем поле. (Опыты с электронами в p–состоянии подтвердили этот вывод, хотя картина получилась более сложной) (желтая линия натрия – дуплет из-за наличия спина).
Численное значение спина электрона:
.
Проекция спинового механического момента импульса на направление внешнего магнитного поля может принимать два значения:
| (7.4.1) |
Так как мы всегда имеем дело с проекциями, то говоря, что спин имеет две ориентации, имеем в виду две проекции.
Самым простым из всех атомов является атом водорода, и он выступил в свое время в качестве своеобразного тест-объекта для теории Бора. К моменту появления теории атом водорода был тщательно исследован в ходе экспериментов: имелось знание о том, что он содержит единственный электрон. Ядром атома является протон.
Протон – это частица с положительным зарядом, модуль которого равен модулю заряда электрона, а масса больше массы электрона в 1836 раз.
Серия Бальмера и формула Ридберга
Начало XIX века ознаменовалось открытием линейчатого спектра.
Линейчатый спектр – это дискретные спектральные линии в видимой области излучения атома водорода.
В последующем закономерности, в соответствии с которыми ведут себя длины волн (или частоты) линейчатого спектра, подробно в количественном отношении исследовал И. Бальмер (в 1885 г.)
Серия Бальмера – совокупность спектральных линий атома водорода в видимой части спектра.
Позднее подобные серии спектральных линий обнаружились в ультрафиолетовой и инфракрасной частях спектра. В 1890 г. И. Ридберг составил запись эмпирической формулы для частот спектральных линий (формула Ридберга):
νnm=R1m2-1n2.
Для серии Бальмера m = 2, n = 3, 4, 5, …. Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4, … .
Неизменяемая R в формуле для частот спектральных линий носит название постоянной Ридберга и равна: R=3,29·1015 Гц.
До того, как Бор сформулировал постулаты, вопросы, каким же образом возникают линейчатые спектры и каков смысл целых чисел, входящих в формулы спектральных линий водорода (и некоторых других атомов), оставались без ответа.
Правило квантования
Постулаты Бора задали направление для развития новой науки – квантовой физики атома. Однако в них не было «рецепта», как определить параметры стационарных состояний (орбит) и соответствующих им значений энергии En.
Бором было сформулировано правило квантования, которое приводило к соотносимым с опытом значениям энергий стационарных состояний атома водорода. Ученый выдвинул гипотезу, что момент импульса электрона, совершающего вращение вокруг ядра, может принимать лишь дискретные значения, кратные постоянной Планка.
Для круговых орбит правило квантования Бора имеет запись:
meνrn=nh2π (n=1, 2, 3,…).
В данном выражении me является массой электрона, υ – его скоростью, rn обозначает радиус стационарной круговой орбиты.
Правило квантования Бора дает возможность путем вычисления определить радиусы стационарных орбит электрона в атоме водорода и отыскать значения энергий. Скорость электрона, который совершает вращение по круговой орбите некоторого радиуса r в кулоновском поле ядра, записывается в виде соотношения (в соответствии с 2 законом Ньютона):
ν2=e24πε0mer.
Самой близкой к ядру орбите соответствует значение n=1.
Боровский радиус – это радиус первой орбиты, расположенной ближе всех к ядру электрона атома водорода, определяемый как:
r1=α0=ε0h2πmee2=5,29·10-11 м.
Радиусы последующих орбит получают возрастание пропорционально n2.
Полная механическая энергия E системы из атомного ядра и электрона, вращающегося по стационарной круговой орбите радиусом rn, имеет запись:
En=Ek+Ep=meν22-e24πε0rn.
Заметим, что Ep<0, поскольку имеет место действие сил притяжения между электроном и ядром. Подставим в это выражение записи для υ2 и rn и получаем:
En=-mee48e02h2·1n2.
В квантовой физике атома целое число n=1, 2, 3, … носит название главного квантового числа.
В соответствии со вторым постулатом Бора: когда электрон переходит с одной стационарной орбиты с энергией En на другую стационарную орбиту с энергией Em<En, атом испускает квант света с частотой νnm, равной ΔEnmh:
νnm=∆Enmh=mee48ε02h31m2-1n2.
Это выражение полностью идентично с эмпирической формулой Ридберга для спектральных серий атома водорода, если за постоянную R взять:
R=mee48ε02h3.
Подставим в это выражение числовые значения всех переменных, получим
R=3,29·1015 Гц.
Полученное значение отлично коррелируется с эмпирическим значением R.
На рисунке 6.3.1 проиллюстрировано образование спектральных серий в излучении атома водорода при переходе электрона с высоких стационарных орбит на более низкие.
Рисунок 6.3.1. Стационарные орбиты атома водорода и образование спектральных серий.
Рисунок 6.3.2 демонстрирует диаграмму энергетических уровней атома водорода с указанием переходов для различных спектральных серий.
Рисунок 6.3.2. Диаграмма энергетических уровней атома водорода с указанием переходов для различных спектральных серий. Также имеется указание длин волн для первых пяти линий серии Бальмера.
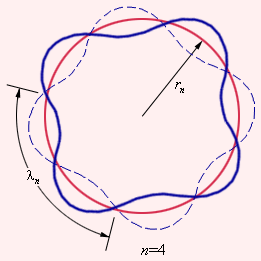
Тот факт, что теория Бора для атома водорода и результаты эксперимента оказались так отлично согласованы между собой, стал весомым аргументом в пользу верности этой теории. Но при этом попытка использовать теорию применительно к более сложным атомам закончилась провалом. Бору не удалось дать физическую интерпретацию правилу квантования – это позже, спустя десятилетие, сделал де Бройль, опираясь на представления о волновых свойствах частиц. Его предположение заключалось в том, что каждая орбита в атоме водорода соответствует волне, получающей распространение по окружности около ядра атома. Стационарная орбита имеет место тогда, когда волна постоянно повторяет себя после каждого оборота вокруг ядра. Иначе говоря, стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты (рис. 6.3.3). Такое явление подобно стационарной картине стоячих волн в струне с закрепленными концами.
Рисунок 6.3.3. Иллюстрация идеи де Бройля возникновения стоячих волн на стационарной орбите для случая n=4.
Согласно дебройлевским идеям, в стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться целое число длин волн λ:
nλn=2πrn
Если подставить сюда формулу длины волны де Бройля λ=hp, где p=meυ – импульс электрона, то:
nhneν=2πrn или meνrn=nh2π.
Итак, правило квантования Бора находится во взаимосвязи с волновыми свойствами электронов.
Вообще можно сказать, что Бор достиг поразительных успехов в попытках объяснить спектральные закономерности. Появилось утверждение, что атомы являются квантовыми системами, а энергетические уровни стационарных состояний атомов дискретны. Практически одномоментно с возникновением боровской теории экспериментально было доказано, что существуют стационарные состояния атома и квантование энергии. Дискретность энергетических состояний атома опытным путем продемонстрировали в 1913 г. Д. Франк и Г. Герц, исследуя столкновение электронов с атомами ртути. Выяснилось, что при энергии электронов менее 4,9 эВ их столкновение с атомами ртути протекает согласно закону абсолютно упругого удара. А, когда энергия электронов равна 4,9 эВ, столкновение с атомами ртути будет иметь черты неупругого удара. Таким образом, выходит, что, столкнувшись с неподвижными атомами ртути, электроны лишаются всей своей кинетической энергии, что, в свою очередь, означает факт поглощения атомами ртути энергии электрона и перевода электронов из основного состояния в первое возбужденное состояние:
E2-E1=4,9 эВ.
В соответствии с концепцией Бора, когда будет происходить обратный самопроизвольный переход атома, ртуть будет испускать кванты с частотой
ν=E2-E1h=1,2·1015 Гц.
Линия спектра с подобной частотой в самом деле нашлась в ультрафиолетовой части спектра излучения атомов ртути.
Утверждения о дискретных состояниях находились в противоречии с классической физикой, в связи с чем также возник закономерный вопрос: не опровергает ли квантовая теория законы классической физической теории.
Квантовая физика отнюдь не стремилась отменить фундаментальные основы, такие как законы сохранения энергии, импульса, электрического разряда и подобное. По сформулированному Бором принципу соответствия квантовая физика вмещает в себя классические представления, и при некоторых условиях можно заметить планомерный переход от квантовых представлений к классическим. Энергетический спектр атома водорода как раз дает нам такой пример (рис. 6.3.2): при больших квантовых числах n≫1 дискретные уровни постепенно становятся ближе, что задает плавный переход в область непрерывного спектра, вытекающего из классической физики.
Постулаты Бора со своей «половинчатостью», «полуклассикой» стали важной ступенью развития квантовых основ, введение которых в физику потребовало серьезной перестройки механики и электродинамики, произошедшей в 20-е – 30-е годы XX века.
Квантовые числа
Видение Бора о том, что существуют определенные орбиты для движения электронов в атоме, оказалось очень условным. В действительности, траектория движения электрона в атоме почти не имеет общего с движением планет или спутников. Физический смысл есть лишь в возможности обнаружить электрон в том или ином месте, и эта вероятность описывается квадратом модуля волновой функции |Ψ|2. Волновая функция Ψ служит решением базового уравнения квантовой механики – уравнения Шредингера. Выяснилось, что состояние электрона в атоме описывается целым набором квантовых чисел.
Основное квантовое число n – квантовое число, задающее квантование энергии атома.
Орбитальное квантовое число l – число, применяемое для квантования момента импульса.
Магнитное квантовое число m – число, применяемое для квантования проекции момента импульса.
Квантовое число m введено в связи с тем, что проекция момента импульса на любое выделенное в пространстве направление (к примеру, направление вектора B→ магнитного поля) также принимает дискретный ряд значений.
Все виды квантовых чисел (n, l, m) находятся во взаимосвязи с правилами квантования. К примеру, орбитальное квантовое число l может принимать значения целого числа от 0 до (n – 1). Магнитное квантовое число m может принимать любые значения целого числа в интервале ±l. Тогда каждому значению главного квантового числа n, описывающему состояние энергии атома, соответствует целый ряд комбинаций квантовых чисел l и m. Одновременно с этим, с каждой такой комбинацией соотносится определенное распределение вероятности |Ψ|2 обнаружения электрона в разных точках пространства («электронное облако»).
s-состояния (1s, 2s, …, ns, …) – это состояния, при которых орбитальное квантовое число l равно нулю.
Описываются s-состояния сферически симметричными распределениями вероятности.
Когда l>0 сферическая симметрия электронного облака нарушается.
p-состояния – это состояния при l=1.
d-состояния – это состояния при l=2 и т.д.
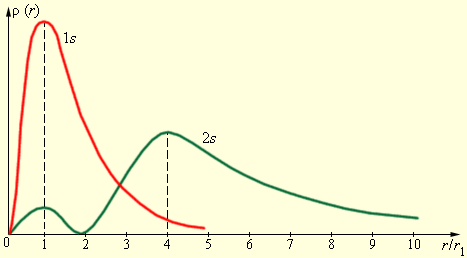
Рис. 6.3.4 иллюстрирует кривые распределения вероятности ρ (r)=4πr2|Ψ|2 обнаружения электрона в атоме водорода на разных расстояниях от ядра в состояниях 1s и 2s.
Рисунок 6.3.4. Распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s и 2s. r1=5,29·10–11 м – радиус первой орбиты Бора.
На рисунке 6.3.4 наглядно продемонстрировано, что электрон в состоянии 1s (основное состояние атома водорода) имеет возможность быть обнаруженным на различных расстояниях от ядра. С самой высокой вероятностью электрон обнаружится на расстоянии, равном радиусу r1 первой боровской орбиты. Вероятность нахождения электрона в состоянии 2s достигает максимума на расстоянии r=4r1 от ядра. И в том, и в том случае атом водорода возможно представить, как сферически симметричное электронное облако, в центре которого расположено ядро.
Рисунок 6.3.5. Модель квантования электронных орбит.
Рисунок 6.3.6. Модель атома водорода.
Рисунок 6.3.7. Модель частицы в потенциальной яме.
Водород в таблице менделеева занимает 1 место, в 1 периоде.
| Символ | H |
| Номер | 1 |
| Атомный вес | 1.0078400 |
| Латинское название | Hydrogenium |
| Русское название | Водород |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема водорода
H: 1s1
Порядок заполнения оболочек атома водорода (H) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Водород имеет 1 электрон,
заполним электронные оболочки в описанном выше порядке:
1 электрон на 1s-подуровне
Степень окисления водорода
Атомы водорода в соединениях имеют степени окисления 1, 0, -1.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы водорода
Валентность H
Атомы водорода в соединениях проявляют валентность I.
Валентность водорода характеризует способность атома H к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа H
Квантовые числа определяются последним электроном в конфигурации,
для атома H эти числа имеют значение N = 1, L = 0, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации H:
Eo = 1312 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где H в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве