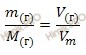Известно, что масса углекислого газа (CO2) 35 грамм. Определите объём углекислого газа (CO2).
Решение задачи
Так как, углекислый газ (CO2) – газообразное вещество, то для нахождения объема углекислого газа (CO2) массой 35 г будем использовать формулу перерасчета, которая устанавливает связь между массой и объемом газа:
Откуда выразим объем произвольной массы газа:
Учитывая, что молярная масса углекислого газа (CO2) равна:
M (CO2) = 12 + 2 ∙ 16 = 44 (г/моль)
Рассчитаем объем углекислого газа (CO2):
Ответ:
объем углекислого газа равен 17,82 литра.
Рассчитать объем углекислого газа.
Рассчитать объем углекислого газа при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем углекислого газа, если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Химическая формула углекислого газа CO₂.
Расчет объема воздуха (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 1 кг углекислого газа
Рассчитать объем газа: азота, водорода, гелия, кислорода, углекислого газа, хлора
Рассчитать объем углекислого газа при нормальных условиях:
Рассчитать объем углекислого газа:
Теория:
Рассчитать объем углекислого газа при нормальных условиях, если известна его масса, можно по формуле:
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(СО₂) = 12 + 2·16 = 44 г/моль,
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем углекислого газа, если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(СО₂) = 12 + 2·16 = 44 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 1 кг углекислого газа:
Рассчитайте объем для 1 кг углекислого газа при нормальных условиях.
V = m · Vm / M = 1 000 грамм · 22,4 л/моль / 44 г/моль = 509,090 литров.
Рассчитайте объем для 1 кг углекислого газа при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 1 000 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 44 г/моль) = 1 909,385 литров или 1,909385 м3.
Рассчитать объем газа: азота, водорода, гелия, кислорода, углекислого газа, хлора
Коэффициент востребованности
1 576
Мария К.
1 декабря 2018 · 38,4 K
Человек науки, полиглот, энтузиаст. Химия, компьютерные технологии, нейропсихология и все… · 1 дек 2018
Найдем для начала количество вещества СО2 в моль.
n = m/Mr = 5 г / 44 г/моль = 0,1136 моль,
n — количество вещества, m — масса, Mr — молярная масса (находится из таблицы Менделеева сложением атомарных масс атомов молекулы).
CO2 это газ, а 1 моль любого газа при нормальных условиях занимает объем 22,4 л (так называемый молярный объем Vm).
Из закона Авогадро, который позволяет определить количество газа на основании его объема: n=V/Vm
Значит V = n*Vm = 0,1136 моль * 22,4 л/моль = 2,55 л
18,2 K
для корректного ответа на вопрос не хватает давления
Комментировать ответ…Комментировать…
Студент, учусь на 5 курсе Самарского Университета. Увлекаюсь спортом (футбол, баскетбол)… · 1 дек 2018
Объем можно найти из закона Авогадро: n = V/Vm. Отсюда V=n*Vm (Vm – молярный объем газа, 1 моль занимает 22,4 литра). А в свою очередь количество вещества находится из формулы n=m/Mr (m-масса, Mr-молярная масса, 44 г/моль для CO2).
В итоге подстановкой получаем: V = m/Mr * Vm = 5/44 * 22.4 = 2.55 л.
Ответ: 2.55 литра.
2,8 K
Комментировать ответ…Комментировать…
Нередко при продаже сварочного полуавтомата менеджеры сталкиваются с вопросом о расходе углекислоты. Основываясь на опыте одного из наших менеджеров, мы ответим на этот вопрос. Для того, чтобы получить данные о расходе, возьмем в расчет следующую ситуацию: клиент варит проволокой 0,8мм, небольшие толщины и в небольшом объеме. Расход углекислого газа определяется по формуле G =qt, где t— основное время сварки. Основное время — это время на непосредственное выполнение сварочной операции. q — удельный расход СО2 в л/мин. Удельный расход СО2 зависит от диаметра проволоки и силы сварочного тока и определяется по таблице.
| Диаметр, мм | 0,8 | 1,0 | 1,2 | 1,6 | 2 | 2 |
| Сила сварочного тока, А | 60—120 | 60—160 | 100—250 | 200—250 | 240—280 | 280—400 |
| Удельный расход СО2, л/мин | 8—9 | 8—9 | 9—12 | 14—15 | 15—18 | 18—20 |
После вычисления объема СО2 в литрах обычно переводят это значение в массу, учитывая, что при испарении 1 кг углекислоты образуется 509 л газа. Необходимо также указать требуемое количество баллонов СО2, зная, что в одном баллоне содержится 25 кг углекислоты.
Определяем время сварки Т 1б, на которое хватит одного баллона при сварке проволокой 0,8 мм: Т 1б = 25 кг (кол-во углекислоты в баллоне)*509 л / 9 л/мин (расход газа при сварке)=12725 л (литров газа получаемого из одного баллона)/ 9 л/мин = 1414 мин сварки ≈ 24 часа сварки.24 часа – это время непосредственной сварки, т.е.
по сути, это то время которое сварщик держит включенной кнопку на горелке (пренебрегаем продувкой после сварки при отпускании кнопки).
Какая масса 1 литра углекислоты?
Баллоны углекислотные 1 литр ГОСТ 949-73
| Объем, л. | 1 | |
|---|---|---|
| Диаметр цилиндрической части, мм. | 89 | |
| Длина корпуса баллона, мм. | 240 | 255 |
| Масса баллона, кг. | 1,2 | 2,3 |
| Толщина стенки баллона, не менее, мм. | 1,9 | 3,6 |
Сколько литров углекислого газа в 40 литровом баллоне?
Параметры — Углекислотный баллон окрашивается в черный цвет. Надпись «Углекислота» или «СО2» — желтая. Кроме надписи на баллон наносятся паспортные данные о нем. В комплект помимо самого баллона входят колпак, кольца резиновые транспортировочные и башмак. Примерная масса этих элементов 7,5 кг.
- Масса баллона указывается без веса дополнительных деталей.
- Вес углекислотного баллона емкостью 40 л из стали 45Д — 58,5 кг.
- Длина 1,37 м.
- С плоским дном выпускают только баллоны небольшой емкости.
- В баллоне на 40 л содержится до 12 м3 углекислоты, массой 20-24 кг.
- При испарении этого количества образуется более 12 000 литров углекислого газа.
Рабочее давление — 150 кг/см2 (5-6Па). При повышении температуры до 31 градуса Цельсия и снижении давления до 75 атмосфер газ переходит в жидкое состояние.
Сколько весит 1 м3 со2?
Физические свойства углекислоты Углекислота (СО2, двуокись углерода, диоксид углерода) – вещество с химическое формулой СО2 и молекулярной массой 44,011 г/моль, которое может существовать в четырёх фазовых состояниях – газообразном, жидком, твёрдом и сверхкритическом.
Газообразное состояние СО2 носит общеупотребительное название «углекислый газ». При атмосферном давлении это бесцветный газ без цвета и запаха, при температуре +20 ?С плотностью 1,839 кг/м? (в 1,52 раза тяжелее воздуха), хорошо растворяется в воде (0,88 объёма в 1 объёме воды), частично взаимодействуя в ней с образованием угольной кислоты.
Входит в состав атмосферы в среднем 0,035% по объёму. При резком охлаждении за счёт расширения (детандирование) СО2 способен десублимироваться – переходить сразу в твёрдое состояние, минуя жидкую фазу. Газообразный диоксид углерода ранее нередко хранили в стационарных газгольдерах.
- В настоящее время такой способ хранения не применяется; углекислый газ в необходимом количестве получают непосредственно на месте – путём испарения жидкой углекислоты в газификаторе.
- Далее газ можно легко перекачать по любому газопроводу под давлением 2-6 атмосфер.
- Жидкое состояние СО2 носит техническое название « жидкая углекислота » или просто «углекислота».
Это бесцветная жидкость без запаха, средней плотностью 771 кг/м3, которая существует только под давлением 3 482519 кПа при температуре 0-56,5 град.С («низкотемпературная углекислота»), либо под давлением 3 4827 383 кПа при температуре 0+31,0 град.С («углекислота высокого давления»).
- Углекислоту высокого давления получают чаще всего путём сжатия углекислого газа до давления конденсации, при одновременном охлаждении водой.
- Низкотемпературную углекислоту, являющейся основной формой диоксида углерода для промышленного потребления, чаще всего получают по циклу высокого давления путём трехступенчатого охлаждения и дросселирования в специальных установках.
При небольшом и среднем потреблении углекислоты (высокого давления),т для её хранения и транспортировки используют разнообразные стальные баллоны (от баллончиков для бытовых сифонов до ёмкостей вместимостью 55 л). Самым распространенным является 40 л баллон с рабочим давление 15 000 кПа, вмещающим 24 кг углекислоты.
За стальными баллонами не требуется дополнительный уход, углекислота сохраняется без потерь в течение длительного времени. Баллоны с углекислотой высокого давления окрашивают в чёрный цвет. При значительном потреблении, для хранения и транспортировки низкотемпературной жидкой углекислоты используют изотермические цистерны самой разнообразной вместимости, оснащённые служебными холодильными установками.
Существуют накопительные (стационарные) вертикальные и горизонтальные цистерны вместимостью от 3 до 250 т, транспортируемые цистерны вместимостью от 3 до 18 т. Цистерны вертикального исполнения требуют строительства фундамента и используются преимущественно в условиях ограниченного пространства для размещения.
- Применение горизонтальных цистерн позволяет снизить затраты на фундаменты, особенно при наличии общей рамы с углекислотной станцией.
- Цистерны состоят из внутреннего сварного сосуда, изготовленного из низкотемпературной стали и имеющего пенополиуретановую или вакуумную теплоизоляцию; наружного кожуха из пластика, оцинкованной или нержавеющей стали; трубопроводов, арматуры и приборов контроля.
Внутренняя и наружная поверхности сварного сосуда подвергаются специальной обработке, благодаря чему снижена до вероятность поверхностной коррозии металла. В дорогих импортных моделях наружный герметичный кожух выполнен из алюминия. Использование цистерн обеспечивает заправку и слив жидкой углекислоты; хранение и транспортировку без потерь продукта; визуальный контроль массы и рабочего давления при заправке, в процессе хранения и выдачи.
- Все типы цистерн оснащены многоуровневой системой безопасности.
- Предохранительные клапаны позволяют производить проверку и ремонт без остановки и опорожнения цистерны.
- При мгновенном снижении давления до атмосферного, происходящем при впрыске в специальную расширительную камеру (дросселировании), жидкий диоксид углерода мгновенно превращается в газ и тончайшую снегообразную массу, которую прессуют и получают диоксид углерода в твёрдом состоянии, который носит общеупотребительное название «сухой лёд».
При атмосферном давлении это белая стекловидная масса плотностью 1 562 кг/м?, с температурой -78,5 ?С, которая на открытом воздухе сублимируется – постепенно испаряется, минуя жидкое состояние. Сухой лёд может быть также получен непосредственно на установках высокого давления, применяемых для получения низкотемпературной углекислоты, из газовых смесей, содержащих СО2 в количестве не менее 75-80%.
Объёмная холодопроизводительность сухого льда почти в 3 раза больше, чем у водяного льда, и составляет 573,6 кДж/кг. Твёрдый диоксид углерода обычно выпускают в брикетах размером 200?100?20-70 мм, в гранулах диаметром 3, 6, 10, 12 и 16 мм, редко в виде тончайшего порошка («сухой снег»). Брикеты, гранулы и снег хранят не более 1-2 суток в стационарных заглублённых хранилищах шахтного типа, разбитых на небольшие отсеки; перевозят в специальных изотермических контейнерах с предохранительным клапаном.
Используются контейнеры разных производителей вместимостью от 40 до 300 кг и более. Потери на сублимацию составляют, в зависимости от температуры окружающего воздуха 4-6% и более в сутки. При давлении свыше 7,39 кПа и температуре более 31,6 град.С диоксид углерода находится в так называемом сверхкритическом состоянии, при котором его плотность как у жидкости, а вязкость и поверхностное натяжение как у газа.
- Эта необычная физическая субстанция (флюид) является отличным неполярным растворителем.
- Сверхкритический CO2 способен полностью или выборочно экстрагировать любые неполярные составляющие с молекулярной массой менее 2 000 дальтон: терпеновые соединения, воски, пигменты, высокомолекулярные насыщенные и ненасыщенные жирные кислоты, алкалоиды, жирорастворимые витамины и фитостерины.
Нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов. Обладая подобными свойствами, сверхкритический диоксид углерода всё шире применяется в процессах экстракции, фракционирования и импрегнации органических и неорганических веществ.
Удельный вес, Удельный вес углекислоты зависит от давления, температуры и агрегатного состояния, в котором она находится. Критическая температура углекислоты +31 град. Удельный вес углекислого газа при 0 град и давлении 760 мм рт.ст. равен 1, 9769 кг/м3. Молекулярный вес углекислого газа 44,0. Относительный вес углекислого газа по сравнению с воздухом составляет 1,529. Жидкая углекислота при температурах выше 0 град. значительно легче воды, и ее можно хранить только под давлением. Удельный вес твердой углекислоты зависит от метода ее получения. Жидкая углекислота при замораживании превращается в сухой лед, представляющий прозрачное, стеклообразное твердое тело. В этом случае твердая углекислота имеет наибольшую плотность (при нормальном давлении в сосуде, охлаждаемом до минус 79 град., плотность равна 1,56). Промышленная твердая углекислота имеет белый цвет, по твердости близка к мелу, ее удельный вес колеблется в зависимости от способа получения в пределах 1,3 — 1,6.
Уравнение состояния. Связь между объемом, температурой и давлением углекислого газа выражается уравнением V= R T/p — A, где V — объем, м3/кг; R — газовая постоянная 848/44 = 19,273; Т — температура, К град.; р давление, кг/м2; А — дополнительный член, характеризующий отклонение от уравнения состояния для идеального газа. Он выражается зависимостью А =( 0, 0825 + (1,225)10-7 р)/(Т/100)10/3.
Тройная точка углекислоты. Тройная точка характеризуется давлением 5,28 ата (кг/см2) и температурой минус 56,6 град. Углекислота может находиться во всех трех состояниях (твердом, жидком и газообразном) только в тройной точке. При давлениях ниже 5,28 ата (кг/см2) (или при температуре ниже минус 56,6 град.) углекислота может находиться только в твердом и газообразном состояниях. В парожидкостной области, т.е. выше тройной точки, справедливы следующие соотношения i’ x + i» у = i, x + у = 1, где, x и у — доля вещества в жидком и парообразном виде; i’ — энтальпия жидкости; i» — энтальпия пара; i — энтальпия смеси. По этим величинам легко определить величины x и у. Соответственно для области ниже тройной точки будут действительны следующие уравнения: i» у + i» z = i, у + z = 1, где, i» — энтальпия твердой углекислоты; z — доля вещества в твердом состоянии. В тройной точке для трех фаз имеются также только два уравнения i’ x + i» у + i»’ z = i, x + у + z = 1. Зная значения i,’ i’,’ i»’ для тройной точки и используя приведенные уравнения можно определить энтальпию смеси для любой точки.
Теплоемкость. Теплоемкость углекислого газа при температуре 20 град. и 1 ата составляет Ср = 0,202 и Сv = 0,156 ккал/кг*град. Показатель адиабаты k =1,30. Теплоемкость жидкой углекислоты в диапазоне температур от -50 до +20 град. характеризуется следующими значениями, ккал/кг*град. : Град.С -50 -40 -30 -20 -10 0 10 20 Ср, 0,47 0,49 0,515 0,514 0,517 0,6 0,64 0,68
Точка плавления. Плавление твердой углекислоты происходит при температурах и давлениях, соответствующих тройной точке (t = -56,6 град. и р = 5,28 ата) или находящихся выше ее. Ниже тройной точки твердая углекислота сублимирует. Температура сублимации является функцией давления: при нормальном давлении она равна -78,5 град., в вакууме она может быть -100 град. и ниже.
Энтальпия. Энтальпию пара углекислоты в широком диапазоне температур и давлений определяют по уравнению Планка и Куприянова. i = 169,34 + (0,1955 + 0,000115t)t — 8,3724 p(1 + 0,007424p)/0,01T(10/3), где I – ккал/кг, р – кг/см2, Т – град.К, t – град.С. Энтальпию жидкой углекислоты в любой точке можно легко определить путем вычитания из энтальпии насыщенного пара величины скрытой теплоты парообразования. Точно так же, вычитая скрытую теплоту сублимации, можно определить энтальпию твердой углекислоты.
Теплопроводность, Теплопроводность углекислого газа при 0 град. составляет 0,012 ккал/м*час*град.С, а при температуре -78 град. она понижается до 0,008 ккал/м*час*град.С. Данные о теплопроводности углекислоты в 10 4 ст. ккал/м*час*град.С при плюсовых температурах приведены в таблице. Давление, кг/см2 10 град.20 град.30 град.40 град. Газообразная углекислота 1 130 136 142 148 20 — 147 152 157 40 — 173 174 175 60 — — 228 213 80 — — — 325 Жидкая углекислота 50 848 — — — 60 870 753 — — 70 888 776 — — 80 906 795 670 Теплопроводность твердой углекислоты может быть вычислена по формуле : 236,5/Т1,216 ст., ккал/м*час*град.С.
Коэффициент теплового расширения. Объемный коэффициент расширения а твердой углекислоты рассчитывают в зависимости от изменения удельного веса и температуры. Линейный коэффициент расширения определяют по выражению b = a/3. В диапазоне температур от -56 до -80 град. коэффициенты имеют следующие значения: а *10*5ст. = 185,5-117,0, b* 10* 5 cт. = 61,8-39,0.
Вязкость. Вязкость углекислоты 10 *6ст. в зависимости от давления и температуры (кг*сек/м2) Давление, ата -15 град.0 град.20 град.40 град, 5 1,38 1,42 1,49 1,60 30 12,04 1,63 1,61 1,72 75 13,13 12,01 8,32 2,30
Диэлектрическая постоянная. Диэлектрическая постоянная жидкой углекислоты при 50 – 125 ати, находится в пределах 1,6016 – 1,6425. Диэлектрическая постоянная углекислого газа при 15 град. и давлении 9,4 — 39 ати 1,009 – 1,060.
Влагосодержание углекислого газа. Содержание водяных паров во влажном углекислом газе определяют с помощью уравнения, Х = 18/44 * p’/p – p’ = 0,41 p’/p – p’ кг/кг, где p’ – парциальное давление водяных паров при 100%-м насыщении; р – общее давление паро-газовой смеси.
Растворимость углекислоты в воде. Растворимость газов измеряется объемами газа, приведенными к нормальным условиям (0 град, С и 760 мм рт. ст.) на объем растворителя. Растворимость углекислоты в воде при умеренных температурах и давлениях до 4 – 5 ати подчиняется закону Генри, который выражается уравнением Р = Н Х, где Р — парциальное давление газа над жидкостью; Х — количество газа в молях; Н – коэффициент Генри.
Жидкая углекислота как растворитель. Растворимость смазочного масла в жидкой углекислоте при температуре -20град. до +25 град. составляет 0,388 г в100 СО2, и увеличивается до 0,718 г в 100 г СО2 при температуре +25 град.С. Растворимость воды в жидкой углекислоте в диапазоне температур от -5,8 до +22,9 град. составляет не более 0,05% по весу.
Техника безопасности По степени воздействия на организм человека газообразный диоксид углерода относится к 4-му классу опасности по ГОСТу 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности». Предельно допустимая концентрация в воздухе рабочей зоны не установлена, при оценке этой концентрации следует ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5%. При применении сухого льда, при использовании сосудов с жидкой низкотемпературной углекислотой должно обеспечиваться соблюдение мер безопасности, предупреждающих обморожение рук и других участков тела работника.
Вся информация ресурса www.tech-group.pro имеет исключительно информативные цели и не является публичной офертой к купле/продаже или иным действиям.
Как перевести из литров в килограммы?
1 литр = 1 килограмм.
Сколько килограмм углекислоты в 20 литровом баллоне?
Баллоны углекислотные 20 литров ГОСТ 949-73
| Объем, л. | 20 | |
|---|---|---|
| Рабочее давление, МПа (кгс/см2) | 9,8 (100) | 19,6 (200) |
| Диаметр цилиндрической части, мм. | 219 | |
| Длина корпуса баллона, мм. | 730 | 770 |
| Масса баллона, кг. | 28,5 | 42,0 |
Сколько кг углекислоты в 5 литровом баллоне?
Определение расхода углекислого газа в аквариуме — Углекислый газ заправляется в баллоны не в литрах, а в килограммах. Мы рекомендуем заправлять баллоны с коэффициентом 0,6, максимальное значение для заправки не более 0,72. Рассмотрим пример, за основу взяв баллон 5 литров.5 л*0,72=3,6 кг заправленного углекислого газа.1 кг Со2 находящегося в баллоне под большим давлением в жидкой фазе при испарении образует около 570 литров (570 дм³) углекислого газа в газовой фазе,3,6 кг * 570 = 2052 литра Со2 в чистом виде.
Сколько кг СО2 в 10 литровом баллоне?
Баллон углекислотный 10 л Для сварщиков, пищевиков и представителей множества других профессий сжиженный CO 2 давно уже является привычным расходным материалом. Единственная сложность — как и любой другой газ, его выгоднее и удобнее хранить под высоким давлением в специальных стальных баллонах, а выводить для пользовательских нужд наружу через специальный понижающий редуктор.
В соответствии с до сих пор актуальным ГОСТ 949-73 для хранения жидкой углекислоты разрешается использовать баллоны объемом 40, 10 и 5 литров, в которые можно закачать соответственно 24, 6 и 3 кг сжиженного углекислого газа. Службам снабжения и сбыта удобнее работать с баллонами максимальной емкости.
Между тем, вес только пустого 40-литрового стального баллона составляет 65 кг, а заправленного — около 90. Без средств малой механизации и крепкого подсобника даже просто погрузку-разгрузку таких «емкостей» в одиночку осилить не удастся. В то же время, номинально весит всего 15 кг, а вместе с углекислотой — 21.
- Насколько удобнее, например, сварщику-предпринимателю отправляться на выезд с таким баллоном, чем ворочать в одиночку 40-литровый.
- Еще одна область деятельности, в которой может выручить компактный, но достаточно вместительный «ведерный» баллон — выездная торговля газированными напитками и пивом.
- Несмотря на размеры, углекислого газа в таком баллоне хватит надолго.
В каждом килограмме двуокись углерода жидкая аккумулирует 500 литров газа. Следовательно, из полностью заправленного 10-литрового баллона можно будет получить 3000 литров CO 2, С газированной водой перебоев не будет! Читать подробнее: Баллон углекислотный 10 л
Какой должен быть расход углекислоты на полуавтомате?
От чего зависит расход — Далее мы дадим несколько рекомендаций, какой должен быть расход газа при, учитывая диаметр присадочной проволоки и силу сварочного тока. Учтите, что это довольно усредненные значения, от них можно отступать.
Итак, если вы используете проволоку диаметром от 0,8 до 1 миллиметра и установили силу тока от 60 до 160 Ампер, то средний расход должен быть около 8 литров в минуту.Если вы используете проволоку диаметром 1,2 миллиметра и установили силу тока от 100 до 250 Ампер, то средний расход должен быть около 9-12 литров в минуту.Если вы используете проволоку диаметром 1,4 миллиметра и установили силу тока от 120 до 320 Ампер, то средний расход должен быть около 12-15 литров в минуту.
Если вы используете проволоку диаметром 1,6 миллиметра и установили силу тока от 240 до 380 Ампер, то средний расход должен быть около 15-18 литров в минуту. Если вы используете проволоку диаметром 2 миллиметра и установили силу тока от 280 до 450 Ампер, то средний расход должен быть около 18-20 литров в минуту.
Это средний расход газа при сварке полуавтоматом. Ведь помимо прямых факторов увеличения расхода (таких как диаметр проволоки и толщина металла), есть еще и косвенные. К примеру, если вы варите на улице или просто не в закрытом боксе, то расход может существенно увеличиться, ведь газ будет быстро улетучиваться.
Особенно расход неприятно удивит вас, если на улице дует ветер. Также важно качество самого газа и то, насколько хорошо он взаимодействует с металлом. Ведь если на производство поставляют некачественный разбавленный газ, вы просто не сможете сохранить показатели расхода в норме.
Сколько углекислоты в 50 литровом баллоне?
4. Углекислота.24, 6 кг.
Сколько весит 40 литровый баллон с углекислотой?
Углекислотный баллон 40л — Цена: от 15000 руб/шт (не является публичной офертой) Наличие: под заказ Баллон углекислотный предназначен для транспортировки и хранения углекислоты. Баллон для углекислоты комплектуется кольцом горловины, вентилем, предохранительным колпаком и опорным башмаком.
- Корпус углекислотных баллонов окрашивается эмалевой краской черного цвета.
- На баллон наносится надпись «УГЛЕКИСЛОТА» желтого цвета.
- Углекислотные баллоны емкостью 40 литров изготавливаются из стали марки –30ХГСА, 45, Д.
- Масса баллонов указана без вентилей, колпаков, колец и башмаков и является справочной величиной и номинальной при изготовлении баллонов с ограничением по массе.
Длины баллонов указаны как справочные и принимаются номинальными при изготовлении баллонов с ограничением по длине. Ориентировочная масса колпака металлического-1,8 кг; из волокнита-0,5 кг; башмака-5,2 кг. Резьба горловины баллонов должна изготавляться в соответствии с ГОСТ 9909-81.
Телеканал CNN сообщил тревожную новость: концентрация углекислого газа (CO2) в атмосфере Земли достигла рекордного значения за всю историю человечества. Теперь в каждом кубометре воздуха содержится почти пол- литра диоксида углерода.
Как проверить количество углекислоты в баллоне?
Измерение специальным прибором — Современные производители предлагают пользователям оборудование, показания которого не зависят от внешних и внутренних факторов. Принцип измерения основан на ультразвуке. Прибор подставляют к баллону и определяют степень наполненности по цветовому индикатору.
Сколько литров в 1 кг?
Величина литра — Один литр равен объёму куба, каждая сторона которого равна 10 см,1 литр воды имеет массу примерно 1 кг (при +4 °C ).1 литр по действующему в настоящее время определению равен в точности 1 кубическому дециметру : 1 л = 1 дм³ = 0,001 м³ (таким образом, 1 кубический метр (м³), официальная единица СИ для объёма, равен в точности 1000 литрам ).
- Это определение было принято в 1964 году на 12-й Генеральной конференции по мерам и весам,
- До этого, в 1901 году решением 3-й Генеральной конференции по мерам и весам литр был определён как объём 1 килограмма чистой воды при нормальном атмосферном давлении (760 мм рт.
- Ст.) и температуре наибольшей плотности воды (+3,98 °C),
Один килограмм, в свою очередь, был определён как масса платино-иридиевого цилиндра, эталона килограмма, хранящего во Франции, масса которого тоже предполагалась изначально равной массе 1 литра воды при вышеприведённых условиях. Однако позже было установлено, что масса цилиндра оказалась на двадцать восемь миллионных частей больше, и, следовательно, объём литра составлял 1,000028 дм³,
Также следует учесть, что взаимоотношение массы и объёма воды (как и любой жидкости) не постоянно и зависит от температуры, давления, влажности и изотопной однородности. Таким образом, в 1964 году отказались от привязки литра к массе воды или какого-либо иного вещества и определили литр равным в точности 1 дм³,
Согласно недавним измерениям стандартного образца чистой дистиллированной воды, выделенного из океанической воды и считающегося репрезентативным в отношении изотопного состава кислорода и водорода для воды из океанического резервуара ( Венский стандарт океанской воды ), плотность воды равна 0,999975±0,000001 кг/л при температуре максимальной плотности (+3,984 °C) под давлением в одну стандартную атмосферу (760 торр, 101 325 Па ).
Что больше 1 литр или 1 кг?
Что больше 1 кг молока или 1 литр молока
Из таблицы плотностей находим, что средняя плотность молока (зависит от жирности молока) равна ro = 1030 килограмм на кубический метр.Вычислим объем, который будет занимать один килограмм молока:V = m / ro = 1 / 1030 = 0,00097 кубических метров или 0,97 кубических дециметров.С учетом того, что 1 кубический дециметр равен 1 литру, получаем, что 1 килограмм молока будет занимать объем, равный 0,97 литров.Так как 0,97 литров меньше чем 1 литр, то 1 литр молока будет больше, чем 1 килограмм.Ответ: 1 литр молока больше, чем 1 килограмм.
Знаешь ответ? Как написать хороший ответ? Будьте внимательны!
Копировать с других сайтов запрещено. Стикеры и подарки за такие ответы не начисляются. Используй свои знания. :)Публикуются только развернутые объяснения. Ответ не может быть меньше 50 символов!
Читать подробнее: Что больше 1 кг молока или 1 литр молока
Сколько будет 5 литров в кг?
Что больше 5литров или 5киллограмм Ответить на этот вопрос однозначно невозможно. Что такое литры и что такое килограммы? Килограмм – мера веса, показывающая массу вещества. Масса обозначается m. Литр – мера объема, показывающая какой объем занимает то или иное вещество (обычно жидкость). Объем обозначается V.
Между собой эти величины связаны формулой m = V * p, где р – плотность вещества.Значит для каждого вещества соотношение 5 кг и 5 л дадут разный результат.К примеру, если плотность дистиллированной воды условно = 1 г/см 3, то 5 кг воды = 5 л.Плотность морской воды = 1,03 г/см 3, тогда 5 кг морской воды = 5,15 л, следовательно 5 кг > 5 л.Плотность спирта = 0,8 г/см 3, 5 кг спирта = 4 л, тогда 5 кг < 5 л.
Знаешь ответ? Как написать хороший ответ? Будьте внимательны!
Копировать с других сайтов запрещено. Стикеры и подарки за такие ответы не начисляются. Используй свои знания. :)Публикуются только развернутые объяснения. Ответ не может быть меньше 50 символов!
Читать подробнее: Что больше 5литров или 5киллограмм
Сколько весит 40 литровый баллон с углекислотой?
Баллон углекислотный СО2 40 л
| Рабочее давление | 14,7 МПа (150 кгс/см2) |
|---|---|
| Емкость | 40 литров |
| Диаметр цилиндрической части | 219 мм |
| Длина корпуса | 1400 мм |
| Вес | 65 кг |
Сколько весит полный баллон с углекислотой?
Масса пустого баллона — 65-75 кг. Все баллоны немного разные. Масса конкретного баллона указана на его горловине. В баллоны с рабочим давлением 125 атм мы закачиваем 19 кг углекислоты.
Сколько весит 10 литровый баллон с углекислотой?
Баллон углекислотный 10 л Для сварщиков, пищевиков и представителей множества других профессий сжиженный CO 2 давно уже является привычным расходным материалом. Единственная сложность — как и любой другой газ, его выгоднее и удобнее хранить под высоким давлением в специальных стальных баллонах, а выводить для пользовательских нужд наружу через специальный понижающий редуктор.
- В соответствии с до сих пор актуальным ГОСТ 949-73 для хранения жидкой углекислоты разрешается использовать баллоны объемом 40, 10 и 5 литров, в которые можно закачать соответственно 24, 6 и 3 кг сжиженного углекислого газа.
- Службам снабжения и сбыта удобнее работать с баллонами максимальной емкости.
Между тем, вес только пустого 40-литрового стального баллона составляет 65 кг, а заправленного — около 90. Без средств малой механизации и крепкого подсобника даже просто погрузку-разгрузку таких «емкостей» в одиночку осилить не удастся. В то же время, номинально весит всего 15 кг, а вместе с углекислотой — 21.
Насколько удобнее, например, сварщику-предпринимателю отправляться на выезд с таким баллоном, чем ворочать в одиночку 40-литровый. Еще одна область деятельности, в которой может выручить компактный, но достаточно вместительный «ведерный» баллон — выездная торговля газированными напитками и пивом. Несмотря на размеры, углекислого газа в таком баллоне хватит надолго.
В каждом килограмме двуокись углерода жидкая аккумулирует 500 литров газа. Следовательно, из полностью заправленного 10-литрового баллона можно будет получить 3000 литров CO 2, С газированной водой перебоев не будет! Читать подробнее: Баллон углекислотный 10 л
Сколько углекислоты в 50 литровом баллоне?
4. Углекислота.24, 6 кг.
Автор:
Laura McKinney
Дата создания:
8 Апрель 2021
Дата обновления:
20 Май 2023
При нормальном атмосферном давлении диоксид углерода не имеет жидкой фазы. Когда температура падает ниже -78,5 ° C или -109,3 ° F, газ превращается непосредственно в твердое вещество в результате осаждения. В другом направлении твердое вещество, также известное как сухой лед, не плавится в жидкость, а сублимируется непосредственно в газ. Жидкий углекислый газ существует только при давлениях, превышающих пятикратное нормальное атмосферное давление. Следовательно, конверсия между газом и жидкостью полностью зависит от давления. Для этого расчета, конвертируйте между газом при одной атмосфере давления около точки замерзания воды и жидкостью при комнатной температуре и давлении 56 атмосфер.
Определите массу газа CO2. При одной атмосфере и 0 градусах Цельсия плотность газа CO2 составляет 1,977 г / л. Умножьте объем в литрах на 1.977, чтобы получить количество граммов CO2. В качестве примера рассмотрим 1000 литров газа CO2. В этих условиях он имел бы массу 1977 грамм или 1,977 килограмма.
Разделите массу на плотность жидкого CO2. Жидкий CO2 при комнатной температуре и 56 атмосфер составляет 0,770 грамм на миллилитр. В примере этот расчет даст результат 2567,5 миллилитра.
Преобразуйте единицы, чтобы их можно было сравнить. Разделите миллилитры на 1000, чтобы получить литры для сравнения с газовой фазой. В приведенном примере получается 2,5675 литров жидкости на 1000 литров газа.