Задача.
Есть две ёмкости 9 и 5 литров. Как точно отмерить 3 литра?
Подобных этой задач не мало. Все решают такие задачи по -разному. Многие подбирают варианты розлива интуитивно, подбирая нужный вариант. А в итоге, это решение следующего уравнения.
9 * х + 5 * у = 3, где х и у некоторые числа , выражающие количество вёдер ёмкостью 9 л и 5 л соответственно.
Даже на первый взгляд видно, что решение уравнения следующее:
9 * 2 – 5 * 3 = 3. 18 – 15 = 3. что означают полученные цифры. (будем считать, что + 2 – это вливаем 3 ведра по 9 литров, а -3 – это выливает 3 ведра по 5 литров.
В итоге получаем следующий алгоритм розлива.
1. В отдельную ёмкость наливаем 9 литров с помощью предложенной ёмкости. Затем из налитых 9 литров выливаем 5 литров. В ёмкости остаётся ровно 4 литра.
9 л – 5 л = 4 л.
2. Повторяем этот процесс: наливаем снова 9 литров и забираем 5 литров, в ёмкости остаётся ровно 8 литров.
4 л + 9 л – 5 л = 8л.
3. Из полученных восьми литров выливаем 5 литров, зачерпнув данной ёмкость. в 5 литров.
8 л – 5 л = 3 л.
Вот так просто и быстро можно решить такую задачу.
Далее = рассмотрите ещё одну задачу.
Задача.
Как отмерить 4 литра воды с помощью двух ведер по 5 и 3 литра?
Совет от автора.
5 * х + 3 * у = 4. Как и в предыдущей задаче х и у количество вёдер соответственно по 5 литров и 3 литра, чтобы получить в результате 4 литра.
Напрашивается результат: 2 ведра по 5 литров и 2 ведра по 3 литра , но со знаком минус. То есть:
2 * 5 л – 2 * 3 л = 4 л.
Единственный ли это алгоритм получения ёмкости 4 литра из вёдер 5 л и 3 л?
Напишите свой вариант решения этой задачи.
Подписывайтесь на наш канал. И делитесь этой статьёй в соцсетях.
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:
 в которых
в которых
Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:

Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1.
Какое количество вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(СО2) = 0,75 моль.
Задача № 2.
Какое число молекул содержится в 2,5 моль кислорода?

Ответ: N(O2) = 1,505 • 1024.
Задача № 3.
Определите объем (н. у.), который займут 0,25 моль водорода.

Задача № 4.
Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?

Задача № 5.
Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
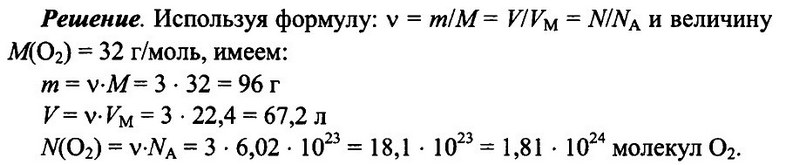
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задача № 6.
Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
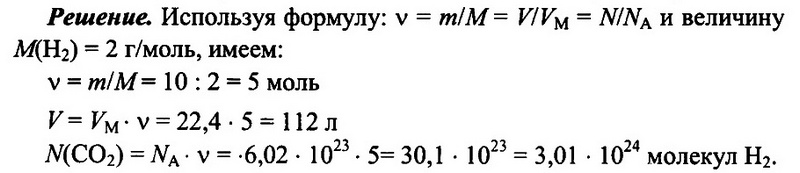
Ответ: 5 моль; 112 л; 3,01 • 1024.
Задача № 7.
Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.

Ответ: 2,5 моль; 177,5 г; 1,5 • 1024.
Задача № 8.
Имеется 2,4 • 1023 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
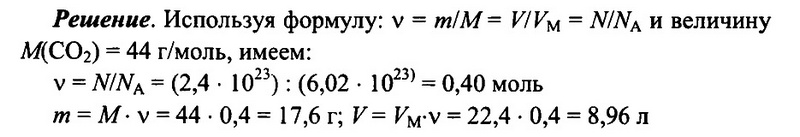
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9.
Какова масса порции оксида азота (IV), содержащей 4,816 • 1023 молекул? Каков ее объем (н. у.)?

Задача № 10.
Масса порции простого вещества, содержащей 1,806 • 1024 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.

Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Сложные задачи на количество …
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
- Перейти дальше: Решение задач с долей вещества в смеси, в соединении
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
11. Сюжетные текстовые задачи
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
Задачи на растворы, смеси и сплавы
(blacktriangleright) Концентрация вещества в растворе (сплаве) – это процент содержания этого вещества в растворе (сплаве): [text{концентрация вещества}=dfrac{text{масса вещества}}{text{масса раствора}}cdot 100%]
(blacktriangleright) Заметим, что в задачах из данной подтемы зачастую удобно составлять уравнения относительно кислоты или активного вещества.
Задание
1
#846
Уровень задания: Равен ЕГЭ
Сергей смешал раствор, содержащий (20%) кислоты и раствор, содержащий (40%) той же кислоты. В итоге у него получился раствор, содержащий (32,5%) кислоты, причём объём полученного раствора (4) литра. Сколько литров раствора, содержащего (20%) кислоты, использовал Сергей при смешивании?
Пусть (x) литров раствора, содержащего (20%) кислоты использовал Сергей при смешивании, тогда
(4 – x) литров раствора, содержащего (40%) кислоты использовал Сергей при смешивании,
(dfrac{20}{100}x) – объём кислоты в растворе, содержащем (20%) кислоты, (dfrac{40}{100}(4 – x)) – объём кислоты в растворе, содержащем (40%) кислоты.
Так как в итоге кислоты оказалось (dfrac{32,5}{100} cdot 4 = 1,3) литра, то:
[dfrac{20}{100}x + dfrac{40}{100}(4 – x) = 1,3,] откуда находим (x = 1,5).
Ответ: 1,5
Задание
2
#844
Уровень задания: Равен ЕГЭ
Один газ в сосуде А содержал (21%) кислорода, второй газ в сосуде В содержал (5%) кислорода. Масса первого газа в сосуде А была больше массы второго газа в сосуде В на 300 г. Перегородку между сосудами убрали так, что газы перемешались и получившийся третий газ теперь содержит (14,6%) кислорода. Найдите массу третьего газа. Ответ дайте в граммах.
Пусть (x) грамм – масса второго газа, тогда
(x + 300) грамм – масса первого газа,
(dfrac{21}{100}(x + 300)) грамм – масса кислорода в первом газе,
(dfrac{5}{100}x) грамм – масса кислорода во втором газе,
тогда масса кислорода в третьем газе составляет (dfrac{14,6}{100}(2x + 300)) грамм.
Так как третий газ возник в результате смешивания первого и второго, то:
[dfrac{21}{100}(x + 300) + dfrac{5}{100}x = dfrac{14,6}{100}(2x + 300),] откуда находим (x = 600). Таким образом, масса третьего газа равна (600 + 600 + 300 = 1500) грамм.
Ответ: 1500
Задание
3
#843
Уровень задания: Равен ЕГЭ
Иван случайно смешал молоко жирностью (2,5%) и молоко жирностью (6%). В итоге у него получилось 5 литров молока жирностью (4,6%). Сколько литров молока жирностью (2,5%) было у Ивана до смешивания?
Пусть (x) литров молока жирностью (2,5%) было у Ивана, тогда
(5 – x) литров молока жирностью (6%) было у Ивана,
(dfrac{2,5}{100}x) – объём жира в молоке жирностью (2,5%), (dfrac{6}{100}(5 – x)) – объём жира в молоке жирностью (6%).
Так как в итоге жира оказалось (dfrac{4,6}{100} cdot 5 = 0,23) литра, то:
(dfrac{2,5}{100}x + dfrac{6}{100}(5 – x) = 0,23), откуда находим (x = 2).
Ответ: 2
Задание
4
#841
Уровень задания: Равен ЕГЭ
В сосуде А содержится 3 литра 17-процентного водного раствора вещества Х. Из сосуда В в сосуд А перелили 7 литров 19-процентного водного раствора вещества Х. Сколько процентов составляет концентрация полученного в сосуде А раствора?
Концентрация в процентах – это отношение объёма вещества к объёму смеси, умноженное на 100(%). До переливания в сосуде А было (3 cdot 0,17 = 0,51) литра вещества Х, в сосуде В было (7 cdot 0,19 = 1,33) литра вещества Х.
После переливания объём вещества Х в сосуде А стал (0,51 + 1,33 = 1,84) литра, а объём всего раствора (3 + 7 = 10) литров. Тогда концентрация в процентах составила [dfrac{1,84}{10} cdot 100% = 18,4%.]
Ответ: 18,4
Задание
5
#2133
Уровень задания: Равен ЕГЭ
Во сколько раз больше должен быть объём (5)-процентного раствора кислоты, чем объём (10)-процентного раствора той же кислоты, чтобы при смешивании получить (7)-процентный раствор?
Пусть объём (5)-процентного раствора кислоты равен (x) литров, а объём (10)-процентного раствора равен (y) литров, тогда требуется найти значение величины (dfrac{x}{y}) при условии [0,05x + 0,1y = 0,07(x + y)
qquadLeftrightarrowqquad
dfrac{x}{y} = dfrac{3}{2} = 1,5,,] таким образом, ответ: (1,5).
Ответ: 1,5
Задание
6
#2134
Уровень задания: Равен ЕГЭ
Во сколько раз больше должен быть объём (20)-процентного раствора кислоты, чем объём (14)-процентного раствора той же кислоты, чтобы при смешивании получить (18)-процентный раствор?
Пусть объём (20)-процентного раствора кислоты равен (x) литров, а объём (14)-процентного раствора равен (y) литров, тогда требуется найти значение величины (dfrac{x}{y}) при условии [0,2x + 0,14y = 0,18(x + y)
qquadLeftrightarrowqquad
dfrac{x}{y} = 2,,] таким образом, ответ: (2).
Ответ: 2
Задание
7
#2629
Уровень задания: Равен ЕГЭ
Смешав (25)-процентный и (95)-процентный растворы кислоты и добавив (20) кг чистой воды, получили (40)-процентный раствор кислоты. Если бы вместо (20) кг воды добавили (20) кг (30)-процентного раствора той же кислоты, то получили бы (50)-процентный раствор кислоты. Сколько килограммов (25)-процентного раствора использовали для получения смеси?
Заметим, что вода – это раствор, не содержащий кислоту, то есть содержащий (0%) кислоты.
Пусть (x) кг – масса раствора с (25)-процентным содержанием кислоты, (y) кг – масса раствора с (95)-процентным содержанием кислоты. Составим схему, описывающую получение (40)-процентного раствора:
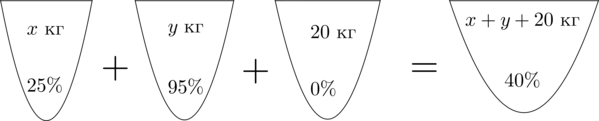
Заметим, что количество кислоты во всех трех растворах равно количеству кислоты в получившемся растворе. Найдем количество кислоты в первом растворе.
Если раствор весит (x) кг, а в нем (25%) кислоты, то в килограммах в нем (dfrac{25}{100}cdot x) кислоты.
Таким же образом можно посчитать количество кислоты в остальных растворах. Получим первое уравнение:
[dfrac{25}{100}cdot x+dfrac{95}{100}cdot y+
dfrac{0}{100}cdot 20=dfrac{40}{100}cdot (x+y+20)]
Аналогично составим схему, описывающую получение (50)-процентного раствора:
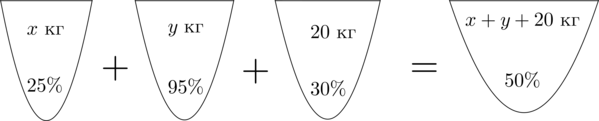
Значит, уравнение, описывающее эту ситуацию, будет выглядеть так:
[dfrac{25}{100}cdot x+dfrac{95}{100}cdot y+
dfrac{30}{100}cdot 20=dfrac{50}{100}cdot (x+y+20)]
Таким образом, решив систему из полученных двух уравнений, найдем (x). Для этого можно умножить оба уравнения на (100), чтобы сделать их проще на вид:
[begin{cases}
25x+95y+0=40(x+y+20)\
25x+95y+30cdot 20=50(x+y+20)
end{cases}]
Вычтем из второго уравнения первое и получим новую систему:
[begin{aligned} &begin{cases}
25x+95y=40(x+y+20)\
30cdot 20=10(x+y+20)
end{cases} quad Rightarrow quad begin{cases}
5x+19y=8(x+y+20)\
y=40-x end{cases} quad Rightarrow \[2ex] Rightarrow quad
&begin{cases}
3x-11(40-x)+160=0\
y=40-x end{cases} quad Rightarrow quad begin{cases}
x=20\y=20end{cases} end{aligned}]
Таким образом, раствора с (25%) кислоты было (20) кг.
Ответ: 20

УСТАЛ? Просто отдохни
Часто в задании по математике просят составить задачу по схеме. Например, в том же Петерсоне таких заданий уйма.
Ниже представлены различные сюжеты задач на литры, которые можно придумать, подставив в условие данные вам значения из схемы.
-
Пример задачи «Литры бензина»
Машина в первый день израсходовала * литров бензина. Во второй день (больше, меньше на столько-то и т.п.). А в третий день столько же, сколько в первый и второй день вместе…
2. Пример задачи «Литры воды»
В одном ведре (бочонке, бочке, банке) столько-то воды, в другом столько-то. В третьем больше чем в первом на столько-то. Сколько всего воды в трех ведрах?…
3. Пример задачи «Литры компота»
Мама сварила *литров компота. Бабушка сварила на * литров больше. Потом пришел папа и выпил * литров компота. Сколько осталось?…
4. Пример задачи «Литры краски»
Ребята красили забор. Красной краски потратили *литров. Зеленой краски — * литров. Желтой краски столько же, сколько красной и зеленой. Сколько всего краски потратили?…
5. Пример задачи «Литры сока»
Петя выпил * литров сока. Мама на * литров больше. А папа столько же, сколько Петя и мама вместе. Сколько всего литров сока выпили?
6. Пример задачи «Пионерский лагерь и литры компота»
Повара в пионерском лагере сварили * литров компота. На завтрак дети выпили * литров. На обед — * литров. Сколько литров компота им осталось на ужин?
7. Пример задачи «Веселые конкурсы и литры воды»
Дети соревновались командами, кто донесет больше воды в ложках (блюдцах, тарелках,…). Первая команда набрала * литров воды. Вторая команда на * литров больше. А третья команда на * литров меньше чем первая. Какая команда победила?
8. Пример задачи «Магазин и литры»
В первый день в магазин завезли * литров масла (сока, воды, газировки). Во второй день *литров. В первый день купили * литров. Во второй день купили * литров масла. Сколько всего литров масла осталось в магазине?
Решебники по математике здесь
Просмотров 3.3к. Опубликовано 28.06.2022
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.
Как найти объем в химии ℹ️
Вы знаете, что один и тот же химикат любого вещества содержит одинаковое количество структурных единиц. Однако у каждого вещества есть своя структурная единица массы. Поэтому масса одной и той же химической массы разных веществ также отличается.
Молекулярная масса — это масса той части вещества, которая приходится на один моль химической массы.
Молекулярная масса вещества X обозначается символом m(x). Она равна отношению массы конкретного вещества M(x) (г или кг) к химической массе N(x) (моль).
В Международной системе единиц молекулярный вес выражается в кг/моль. В химии чаще используется единица измерения Г/моль.
Определите молекулярную массу углерода. Масса углерода в одном моле стехиометрической массы составляет 0,012 кг или 12 г. Поэтому:.
Молекулярная масса любого вещества численно равна его относительной молекулярной массе, выраженной в Г/моль.

На рисунке 47 показан пример веществ (H2O, CACO3и Zn) с одинаковой химической массой — 1 моль. Как видите, массы различных веществ с одним молем химической массы различны.

Молекулярный вес является важной характеристикой всех индивидуальных веществ. Она отражает взаимосвязь между массой вещества и его химическим количеством. Знание одной из этих величин позволяет определить массу другой — химической — величины.
И наоборот, химическое количество по массе:.
А также количество структурных подразделений:.
Связь между свойствами этих трех веществ в их кумулятивном состоянии можно представить с помощью простой диаграммы.

Формула и алгоритм нахождения объёма
Сегодня мы изучаем важный навык в химии — как находить количество различных растворов и других веществ. Эти знания необходимы, потому что они помогут вам решить многие проблемы как в тетради, так и в жизни. Все, что вам нужно знать, — это состоявшийся человек.
Важно понимать, что тип опухоли, которую нужно найти, может варьироваться в зависимости от сущности, которую нужно найти, а точнее, от общего состояния этой сущности. Типы нахождения объемов газа и жидкости противоположны друг другу.
Точный и правильный вид для нахождения объема жидкости: C = n/v.
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Используя другую задачу и другие данные, существует второй тип для нахождения объема жидкости: v = m/p.
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
Если в дополнение к объему вам нужно найти массу, вы можете сделать это, зная тип и количество интересующего вас вещества. Используя тип вещества, найдите его молекулярную массу, сложив атомные массы всех элементов, входящих в его состав.
Например, возьмем M(AUSO2). В наших расчетах мы должны получить 197 + 32 + 16 * 2 = 261 г/моль. После этих вычислений находим массу по типу m = n*m: где
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества обычно указывается в задаче. Если нет, то это может быть опечатка или ошибка в задаче, и вместо того, чтобы пытаться самостоятельно вычислить несуществующую цену, следует обратиться за помощью и объяснениями к преподавателю. В этой статье приведены основные алгоритмы типов и разрешений.
Существует также тип для определения количества газа. Это: v= n*vm:.
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Однако существуют определенные исключения. Исключением является то, что при нормальных условиях, т.е. при определенном давлении и температуре, объем газа постоянен и составляет 22,3 л/моль.
Также возможен третий вариант. Если сама задача содержит уравнения реакций, то решение должно проходить по-другому. Из полученных уравнений вы можете найти количество каждого вещества, равное коэффициенту. Например, Ch4 + 2O2 = CO2+H2O. Из этого уравнения следует, что при взаимодействии 1 моль метана и 2 моль кислорода образуется 1 моль углерода и 1 моль воды. Учитывая, что речь идет о количестве вещества одного компонента, нетрудно найти количества всех остальных веществ. Если количество метана составляет 0,3 моль, то n(Ch4) = 0,6 моль, n(CO2) = 0,3 моль и n(H2O) = 0,3 моль.

б) Газовые законы объем газа
В дополнение к приведенным выше формулам, для решения задач вычислительной химии часто необходимо использовать газовые законы, известные из физики.
При постоянной температуре объем данного количества газа обратно пропорционален давлению, при котором он находится.
При постоянном давлении изменение объема газа прямо пропорционально температуре.
Комбинированный закон Бойля-Мариотта и Гей-Люссака для газов.
Кроме того, если известна масса или количество газа, его объем можно рассчитать по формуле Менделеева-Клапейрона
где n — число молекул вещества, m — масса (г), b — молекулярная масса газа (г/моль) и R — глобальная газовая постоянная, равная 8,31 Дж/(моль х К).
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, количество содержащегося вещества, количество содержащихся молекул, определение объема (v.o.), обнаружение массы, ее массовые частицы, масса определенных молекул, названия веществ, обнаружение массы молекул, определение абсолютной массы молекул, количество содержащихся атомов, относительная плотность. Определение.
Количество вещества — это число строительных блоков (атомов, молекул, ионов), содержащихся в конкретном образце этого вещества. Единицей измерения количества вещества является моль. Количество вещества (n) связано с числом строительных блоков (N), массой (m) и объемом (V) (для газообразных веществ при температуре нулевой концентрации), содержащихся в образце вещества, следующей формулой

В котором.
Vm = 22,4 л/моль (мл/моль, м 3/кмоль) в н.у., Na = 6,02-10 23 (постоянная Авогадро) и молекулярная масса (М) численно равна относительной молекулярной массе вещества:.

Существование такой связи означает, что знание одной из величин (количества, массы, объема или числа структурных единиц вещества) позволяет определить все остальные величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Вопрос 1: Сколько вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(CO2) = 0,75 моль.
Задача № 2. Сколько молекул содержится в 2,5 моль кислорода?

Ответ: n (O2) = 1,505-1024.
Внимание. В этом сборнике лекций вы будете решать задачи общей сложности. Решения сложных задач и задач с кратким ответом см. в конспекте лекций «Решение упражнений по количественным свойствам».

Задача №3. Определите объем (н.у.), занимаемый 0,25 моль водорода.
Задача № 4. Какова масса куска оксида серы (IV) в объеме 13,44 л (об.)?

Вопрос № 5. Если 3 моль кислорода O2Чтобы. Определите массу кислорода, его количество и число молекул кислорода.
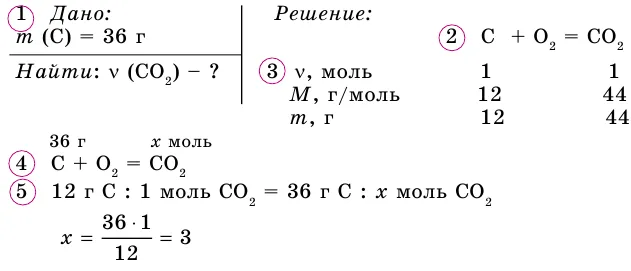
Ответ: m = 96 g- v = 67. 2 l- n(o2) = 1.81-10 24.
Работа №6. масса водорода h2. Определите количество водорода, его количество se. Количество доступных молекул водорода.

Ответ: 5 моль-112 L- 3,01- 10 24.
Работа № 7. Пример количества хлора.2 Н.О.С. Найдите количество хлора, его массу и число молекул хлора.

Ответ: 2,5 моль- 177,5 г- 1,5- 10 24.
Работа № 8. 2.4-10 23. Есть молекулы монооксида углерода (IV) CO2. Определите количество углекислого газа, его массу и количество углекислого газа (Н.С.).

Ответ: 0,4 моль — 17,6 г — 8,96 л.
Вопрос нет. 9. какова масса участка оксида азота (IV), содержащего 4,816-10 23 точки? Каков его объем (Н.С.)?

Вопрос нет. 10. 1,806-10 Масса простого отрезка вещества, содержащего 24 точки, равна 6 г. Определите молекулярный вес вещества и назовите его.

Внимание. В данном пособии рассматриваются задачи нормальной сложности. Нажмите на кнопку ниже, чтобы перейти к решению задач на количество и краткому ответу …
Решайте задачи на количество, массу и объем. Выберите следующие шаги: 1.
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Молярный объем: общая информация
Чтобы рассчитать молекулярный вес химического вещества, молекулярный вес вещества делится на его плотность. Таким образом, молекулярный вес рассчитывается по следующему типу
где VM — молекулярный вес вещества, m — молекулярная масса, p — плотность. В международной системе СИ это количество измеряется в кубических метрах на моль (м 3 /моль).
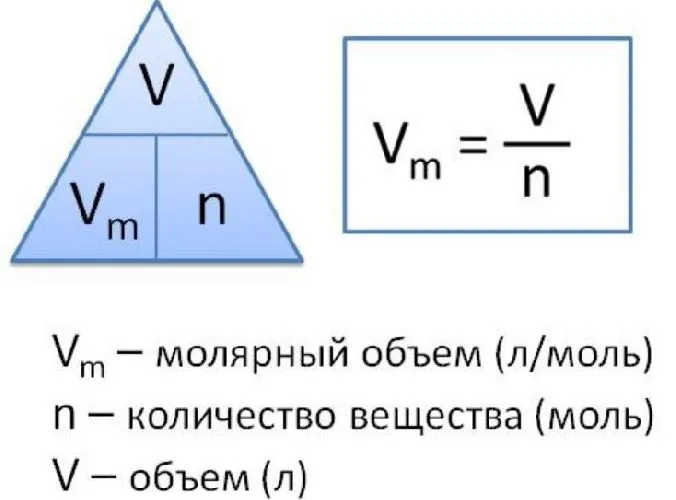
Рисунок 1.Типы молекулярных опухолей.
Молекулярная масса газов отличается от молекулярной массы жидкостей и твердых тел тем, что один молярный элемент газа всегда занимает один и тот же объем (при соблюдении одинаковых параметров).
При расчете объема газа при нормальных условиях, так как объем газа зависит от температуры и давления. Нормальными условиями являются температура 0°C и давление 101 325 кПа.
Молекулярный объем одного моля газа при нормальных условиях всегда одинаков и равен 22,41 DM3 /моль. Этот объем называется молекулярным весом идеального газа. Это означает, что для одного моля газа (кислорода, водорода, воздуха) объем составляет 22,41 дм3 /м.
Молекулярная масса при нормальных условиях может быть получена с помощью законного уравнения для идеального газа, называемого уравнением Клайперона-Менделеева
Где r — глобальная постоянная газа, r = 8,314 дж/моль*k = 0,0821 л*атм/моль k
Объем молярного газа v = rt/p = 8,314*273,15/101,325 = 22,413 л/моль, где t и p — значения температуры (к) и давления при нормальных условиях.
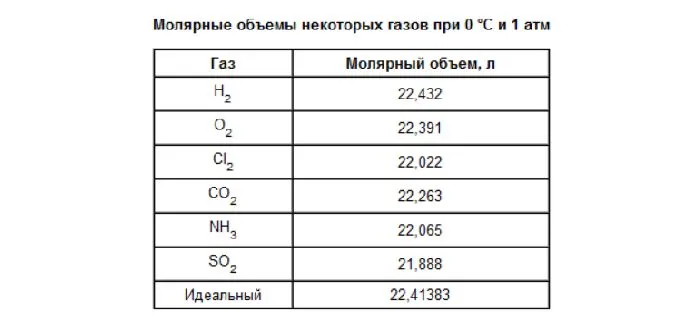
Рисунок 2.Таблица молекулярных опухолей.
Закон Авогадро
В 1811 году А. Авогадро предположил, что равные объемы различных газов (температура и давление) содержат одинаковые молекулы. Впоследствии этот случай был подтвержден и стал законом, названным в честь великого итальянского ученого.
Рисунок 3: Амедео Авогадро.
Закон становится понятным, если вспомнить, что расстояние между частицами в виде газа несравненно больше, чем размер самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы.
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствия закона Авогадро и понятие молекулярного объема основаны на том, что молекулы любого вещества содержат число частиц (в случае газов и молекул), равное постоянной Авогадро.
Чтобы найти количество молей растворенного вещества в литре раствора, необходимо определить молекулярную концентрацию вещества по формуле c = n / V Где n — количество растворенного вещества, выраженное в молях; V — объем раствора, выраженный в литрах C — молекулярный.
При расчетах газа часто необходимо преобразовать заданные условия в нормальные и наоборот. Таким образом, полезно использовать уравнения, полученные из законов газовой связи Бойля-Мариотта и Гей-Люссака.
Молярный объем

В этом видео учащиеся вспоминают основные формулы и физические величины, знакомятся с новыми понятиями молекулярного объема и учатся решать задачи на основе новых материалов. Это значительно облегчает изучение новых тем.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к видеоурокам этого и других наборов, необходимо приобрести их в каталоге и добавить в личный кабинет.



Конспект урока «Молярный объем»
Молекулярный объем — это объем одного моля вещества. Понятие молекулярного объема применимо к газам. Например, если взять 1 моль воды, то 18 г воды не взвешивают на весах, потому что это совершенно неудобно. Зная, что плотность воды составляет 1 г/мл, мы измеряем ее объем в цилиндре или мензурке.

В этом случае молекулярный объем воды составит 18 мл/моль. Молекулярный объем твердых тел и жидкостей зависит от их плотности. Вода, кислота, сахар и соль имеют разную плотность и, следовательно, разный молекулярный объем.
Если проглотить одну молекулу кислорода, одну молекулу углекислого газа и одну молекулу водорода, то при одинаковых нормальных условиях они занимают одинаковый объем, равный 22,4 л. Эти газы также содержат одинаковое число частиц, т.е. 6,02-1023. Нормальные условия или a.c. — это температура 0°C (градусов Цельсия) и давление 760 мм рт.ст. (миллиметров рт.ст.) или 101,3 кПа (килопаскалей).

Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Молекулярный объем — это также физическая величина, равная отношению объема вещества к количеству вещества. Он может быть записан в следующих типах форматов
Vm =
V — объем газа, а n — количество вещества.
Из этого уравнения также можно найти V.
V = n-Vm
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.

Объем 1 кмоль называется объемным объемом и измеряется в м 3 / кмоль. То есть 22,4 м 3 / кмоль, а объем 1 ммоль называется объемным объемом и измеряется в мл / моль. Другими словами, объем составляет 22, 4 мл/моль.
Используйте новую формулу для решения задачи.
1. найдите объем азота (N2 ) объемом 2 моль.
Найдите объем азота (N2) в объеме 2 моль. По условию, дано 2 моль азота. Найдите объем азота. Чтобы решить эту задачу, используйте уравнение, чтобы найти объем газа относительно объема вещества. Другими словами, умножьте объем молекулы на объем вещества. Подставьте значение в формулу. То есть 22,4 литра на моль, умноженные на 2 моля, дают 44,8 литра. Таким образом, 2 моль азота занимают объем 44,8 л.

2. найти объем озона (O3 ) имеет объем 67,2 литра.
Согласно этой задаче, учитывая объем озона — 67,2 литра, необходимо найти количество вещества озона. Чтобы решить проблему, используйте тип. Объем делится на молекулярный вес, и значения в формуле обмениваются. Итак, разделив 67,2 литра на 22,4 литра на молекулу, получаем 3 молекулы. Таким образом, 3 моль озона занимают объем 67,2 л.
Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Закон объемных отношений
Если в результате реакции также образуется газ, напишите уравнение реакции между газами.
Соотношение объемов реактора и вещества: 2:1:2. Получим соотношение этих газовых опухолей при нормальных условиях.


Как видите, коэффициент газовой опухоли соответствует отношению предыдущего коэффициента типа вещества в уравнении.
В этой же ситуации объемы реакционных газов и газообразных продуктов реакции относятся друг к другу как небольшие целые числа. Это закон Гей-Лоссака о пропорциональности объемов.
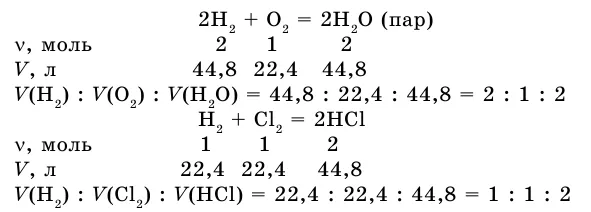
Из изученных примеров можно сделать вывод, что при решении задачи удобно использовать коэффициенты, так как они указывают на количество вещества в уравнении химической реакции.
Согласно уравнению, определите количество кислорода, необходимое для окисления 60 л серы (IV) оксидом серы (VI).

- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги в области химии:.
Лекции по химии:.
Лекции по неорганической химии:.
Лекции по органической химии:.
Отправляйте задания в любое время дня и ночи
Официальный сайт Брилёновой Натальи Валерьевны, профессора факультета информатики Екатеринбургского государственного института.
Все права интеллектуальной собственности на загруженный материал сохраняются за бенефициарами этого материала. Коммерческое и/или иное использование запрещено за пределами материалов предварительного изучения NataliblileNova.ru. Публикация и распространение опубликованных материалов не предназначены для получения коммерческой и/или иной выгоды.
Этот сайт предназначен для облегчения образовательного пути студентов. Наталья Брилёнова не предлагает и не оказывает товары и услуги.
Обязательно ссылайтесь на сайт Natalibrilenova.ru в случае создания копий материалов.
