Материалы портала onx.distant.ru
Квантовые числа
Общая характеристика квантовых чисел
Принцип (запрет) Паули
Правило Хунда
Примеры решения задач
Задачи для самостоятельного решения
Общая характеристика квантовых чисел
Главное квантовое число n характеризует энергию электрона в атоме и размер электронной орбитали. Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем). n – принимает значения 1, 2, 3, …, ∞ . Энергетические уровни обозначают прописными латинскими буквами:
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 |
| Обозначение слоя | K | L | M | N | O | P |
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку). Максимальное число электронов в оболочке Nl:
Nl = 2(2l + 1). (1)
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
| Значение l | 0 | 1 | 2 | 3 | 4 |
| Обозначение орбитали | s | p | d | f | g |
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, форму орбитали, орбитальный момент импульса электрона.
Таким образом, электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого зависит от значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет сферическую симметрию. При l = 1 (p-орбиталь) электронное облако имеет форму гантели. d-орбитали имеют различную форму: dz2 — гантель, расположенная по оси Z с тором в плоскости X – Y, dx2 — y2 — две гантели, расположенные по осям X и Y; dxy, dxz, dyz, — две гантели, расположенные под 45o к соответствующим осям.
- Формы электронных облаков для различных состояний электронов в атомах
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений ml равно числу орбиталей в данной электронной оболочке.
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
Nn = 2n2. (2)
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным. Например, три р-электрона на орбиталях р-оболочки располагаются следующим образом:
Таким образом, каждый электрон занимает одну р-орбиталь.
Примеры решения задач
Задача 1. Охарактеризуйте квантовыми числами электроны атома углерода в невозбужденном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома углерода: 1s22s22p2. В первом слое атома углерода находятся два s-электрона с антипараллельными спинами, для которых n = 1. Для двух s-электронов второго слоя n = 2. Спины двух р-электронов второго слоя параллельны; для них m s= +1/2.
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
| 6 | 2 | 1 | 0 | +1/2 |
Задача 2. Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома кислорода: 1s22s22p4. Во внешнем слое у этого атома находятся 6 электронов 2s22p4. Значения их квантовых чисел приведены в таблице.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 | 0 | 0 | –1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | –1 | +1/2 |
| 6 | 2 | 1 | 1 | –1/2 |
Задача 3. Охарактеризуйте квантовыми числами пять электронов, находящихся в состоянии 4d. Ответ представьте в виде таблицы.
Решение. Согласно правилу Хунда электроны в квантовых ячейках располагаются следующим образом:
Значения главного, побочного и спинового квантовых чисел у электронов одинаковы и равны n=4, l=2, ms=+1/2. Рассматриваемые электроны отличаются значениями квантовых чисел ml.
| № электрона | n | l | ml | ms |
| 1 | 4 | 2 | 2 | +1/2 |
| 2 | 4 | 2 | 1 | +1/2 |
| 3 | 4 | 2 | 0 | +1/2 |
| 4 | 4 | 2 | –1 | +1/2 |
| 5 | 4 | 2 | –2 | +1/2 |
Задача 4. Рассчитайте максимальное число электронов в электронном слое с n = 4.
Решение. Максимальное число электронов, обладающих данным значением главного квантового числа, рассчитываем по формуле (2). Следовательно, в третьем энергетическом уровне может быть не более 32 электронов.
Задача 5. Рассчитайте максимальное число электронов в электронной оболочке с l = 3.
Решение:
Максимальное число электронов в оболочке определяется выражением (1). Таким образом, максимальное число электронов в электронной оболочке с l = 3 равно 14.
Задачи для самостоятельного решения
1. Охарактеризуйте квантовыми числами электроны атома бора в основном состоянии. Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
2. Охарактеризуйте квантовыми числами d-электроны атома железа в основном состоянии. Ответ представьте в виде таблиц:
Расположение 3d-электронов атома железа на орбиталях:
| ? | ? | ? | ? | ? |
Значения квантовых чисел этих электронов:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
Шесть 3d-электронов атома железа располагаются на орбиталях следующим образом
Квантовые числа этих электронов приведены в таблице
| № электрона | n | l | ml | ms |
| 1 | 3 | 2 | 2 | +1/2 |
| 2 | 3 | 2 | 1 | +1/2 |
| 3 | 3 | 2 | 0 | +1/2 |
| 4 | 3 | 2 | — 1 | +1/2 |
| 5 | 3 | 2 | — 2 | +1/2 |
| 6 | 3 | 2 | 2 | — 1/2 |
3. Каковы возможные значения магнитного квантового числа ml, если орбитальное квантовое число l = 3?
Ответ: ml = +3; +2; +1; 0, — 1, — 2, — 3.
4. Охарактеризуйте квантовыми числами находящиеся во втором электронном слое электроны:
Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
| 7 | ? | ? | ? | ? |
Ответ: Электронная конфигурация 2s22p5. Главное квантовое число для всех электронов равно 2. Для s электронов l = 0, для р-электронов l = 1.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 |
0 |
0 | — 1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | — 1 | +1/2 |
| 6 | 2 | 1 | 1 | — 1/2 |
| 7 | 2 | 1 | 0 |
— 1/2 |
5. Определите максимальное число электронов на электронном слое, для которого главное квантовое число n = 6.
6. Определите максимальное число электронов на электронной оболочке, для которой побочное квантовое число l = 4.
7. Определите максимальное число электронов на третьем слое.
8. Определите максимальное число электронов на 5d электронной оболочке.
9. Какие значения может принимать орбитальное (побочное) квантовое число l?
Как вычислить кол-во электронов на орбитах {или как они по-русски называюцца
Мыслитель
(7897),
закрыт
15 лет назад
Татьяна Иванова
Гений
(56765)
15 лет назад
Максимальное число электронов на 1 орбитали (электронном облаке) – 2. Близкие по размеру и энергии орбитали образуют подуровни, максимальное число электронов на них: s-подуровень – 2, p-подуровень – 6, d-подуровень – 10, f-подуровень – 14 (орбиталей на подуровне соответственно в 2 раза меньше) . Близкие по энергии подуровни образуют ЭНЕРГЕТИЧЕСКИЕ УРОВНИ, или ЭЛЕКТРОННЫЕ СЛОИ (видимо, именно о них Вы спрашиваете) . Максимальное число электронов на энергетических уровнях: 1-й – 2, 2-й – 8, 3-й – 18, 4-й и далее – 32. НА ВНЕШНЕМ ЭЛЕКТРОННОМ СЛОЕ АТОМА НЕ МОЖЕТ БЫТЬ БОЛЕЕ 8 ЭЛЕКТРОНОВ.
Общее число электронов на всех электронных слоях равно заряду ядра (порядковому номеру элемента) . Число электронных слоев атома равно номеру периода, в котором расположен этот элемент. Заполнение нового электронного слоя начинается после того, как на предыдущем слое заполнены s- и p-орбитали.
d-орбитали предыдущего слоя заполняются после заполнения s-орбиталей следующего слоя, а уже после этих d-орбиталей заполняется наружный p-подуровень. f-орбитали заполняются только у лантаноидов и актиноидов (2 ряда по 14 элементов внизу таблицы Менделеева) ; заполняется f-подуровень третьего снаружи электронного слоя после того, как заполнился s-подуровень внешнего слоя (2 электрона) и 1 электрон на d-подуровне предыдущего слоя. После заполнения третьего снаружи f-подуровня продолжается заполнение второго снаружи d-подуровня (вставная декада) , а затем – заполняется р-подуровень внешнего слоя.
Например, ванадий V – элемент 5 группы 4 периода. У него заполнены 1 (2 электрона) и 2 (8 электронов) уровни, на 3 уровне – s- и p-подуровни (т. е. 8 электронов) , потом заполняется s-подуровень 4 слоя (2 электрона) , а затем – d-подуровень 3 слоя (3 электрона) , т. е. на 3 слое – 8 + 3 = 11 электронов, а электронная схема атома: V +23 )2 )8 )11 )2. + 23 – это заряд ядра (порядковый номер; 2 + 8 + 11 + 2 = 23 – число электронов равно порядковому номеру (это проверка) . Как узнать число d-электронов: каждый период начинается 2 элементами, у которых заполняется наружный s-подуровень (в 4 периоде это – К и Са – элементы 1 и 2 группы) , далее у 10 элементов (вставная декада) заполняется предыдущий d-подуровень – по 1 электрону (в 4 периоде – от Sc до Zn). Считаете: ванадий находится в побочной подгруппе (т. е. d-элемент) , это 5-й по счету элемент 4 периода, у него 5 – 2 = 3 d-электрона на предыдущем (третьем) слое (т. е. он третий во вставной декаде) .
У элементов побочных подгрупп 1 и 6 групп наблюдается “проскок” 1 внешнего s-электрона на предыдущий d-подуровень: возникает энергетически более выгодное состояние, когда d-подуровень заполнен полностью или наполовину. Например, у меди Сu вместо …3d9 4s2 электронная конфигурация будет …3d10 4s1.
BuSsubi FockaУченик (184)
5 лет назад
Ого, этот ответ был написан 10 лет назад, но всё же очень помог мне сейчас. Очень точно и понятно. Спасибо
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно (2n²), где (n )— его номер. Значит, на первом уровне может находиться не более (2) электронов, на втором — не более (8), на третьем — не более (18) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
У следующих элементов второго периода электроны добавляются на второй уровень:
;
B5)2)3
;
C6)2)4
;
N7)2)5
;
O8)2)6
;
F9)2)7
;
Ne10)2)8
.
У неона второй электронный слой завершён, так как содержит (8) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
;
Mg12)2)8)2
;
Al13)2)8)3
;
Si14)2)8)4
;
P15)2)8)5
;
S16)2)8)6
;
Cl17)2)8)7
;
Ar18)2)8)8
.
Максимальное количество электронов на третьем слое равно (18), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более (8) электронов.
Обрати внимание!
На внешнем электронном слое не может быть более (8) электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
;
Ca20)2)8)8)2
.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
Процесс написания электронной конфигурации атома любого элемента можно разбить в несколько этапов:
- Определение числа электронов
- Размещение электронов по уровням, подуровням и квантовым ячейкам в соответствии с нижеуказанным правилам.
Первое правило – принцип Паули.
Принцип Паули гласит, что в атоме не может быть двух электронов, для которых одинаковы значения всех четырех квантовых чисел. Они должны находиться в различных квантовых состояниях и отличаться хотя бы одним из четырех квантовых чисел.
Таким образом, с помощью математических преобразований было выяснено, что максимальное число электронов на s-, p-, d-. f- подуровнях соответственно равно 2,6, 10 и 14 независимо от значения n ( где n – характеризует энергетический уровень).
Второе правило – принцип наименьшей энергии.
Этот принцип заключается в том, что размещение электронов по уровням и подуровням должно отвечать энергии наибольшей связи их с ядрами. В связи с этим была найдена следующая экспериментальная последовательность:
1s – 2s – 2p – 3s – 3p – 4s – 3d – 4p – 5s – 4d – 5p – 6s – (5d^2) – 4f – 5d – 6p – 7s – (6d^2) – 5f – 6d – 7p
Третье правило – правило Гунда.
Этому правилу подчиняется размещение электронов по квантовым ячейкам.
Согласно ему, электроны в пределах подуровня (s-, p-, d-, f-) располагаются сначала каждый в отдельной квантовой ячейки в виде неспареных электронов.
Рассмотрим на примере атома хлора.
1 шаг. Открываем таблицу Менделеева и смотрим порядковый номер элемента. В нашем случае порядковый номер равен 17ти. Значит, атом хлора содержит 17 электронов.
2 шаг. Глядя на вышеописанные правила записываем электронную конфигурацию, при этом помним, что в подуровне s максимум мб 2 электрона, в подуровне p – 6.
Значит, у нас максимально заполняются подуровни 1s (два электрона), 2s (два электрона), 2p (6 электронов), 3s (два электрона).
Складывая все электроны (2+2+6+2), которые мы разместили по подуровням, получаем значение 12.
Для того, чтобы нам заполнить оставшийся 3p уровень, мы от общего кол-ва электронов (17) отнимаем полученное выше значение 12. Итого мы получаем, что надо разместить оставшиеся пять электронов на подуровне 3p, а это значит, что на 3p уровне 5 электронов (17-12=5).
Таким образом, электронная конфигурация имеет вид:
Cl: 1s2 2s2 2p6 3s2 3p5
3 шаг. Далее рисуется графически электронная конфигурация.
Ниже всего расположен квадрат 1s подуровня. И дальше в порядке увелечения по принципу сохранения энергии. В соответствии с правилом Гунда, в ячейке расположена два электрона с противоположными спинами (смотрящие в разные стороны стрелочки). Подобным образом заполняем все остальные ячейки.
Дойдя до подуровня 3p, мы помним, что у нас 5 электронов. Поэтому сначала рисуем стрелочки вверх, т.к. 3 ячейки, значит и 3 стрелочки вверх, а затем рисуем стрелочки вниз. Итого получаем, что в последней ячейке у нас есть один неспареный электрон.
С помощью электронной конфигурации мы можем определить все возможные степени окисления того или иного элемента.
Так, например, глядя на выше описанную электронную конфигурацию, мы видим, что у атома хлора есть один неспаренный электрон. Это значит, что для него характерны степени окисление +1, -1 и 0.
Если вам необходимо написать электронную конфигурацию Cl- (хлор минус), то вы прибавляете 1 электрон у уже имеющимся на 3p подуровне. Итого получаете – 1s2 2s2 2p6 3s2 3p6
Для хлор плюс наоборот отнимаете один электрон.
Также не стоит забыть, что атомы отличаются возбужденной и невозбужденной электронной конфигурацией, что обязательно указывается в виде символа *.
В случае, если у нас Cl*, то один спаренный электрон на подуровне 3p переходит на уровень 3d, таким образом получаем три неспаренных электрона, что свидетельствуют о возможной степени окисления +3.
У нас остаются еще неспаренные элетроны, это значит, что может существовать и Cl**, в таком случае с еще одной ячейки 3p перебегает электрон на 3d, таким образом возможна степень окисления хлора +5.
Также может перебегать и электрон с уровня 3s, в этом же случае степень оксиления будет равна +7.
24,2 K
Комментировать ответ…Комментировать…
Максимальное число электронов на квантовых уровнях и подуровнях
|
Энергети-ческий |
Энергети-ческий подуровень |
Возможные |
Число |
Максимальное |
||
|
подуровне |
уровне |
подуровне |
уровне |
|||
|
K |
s |
0 |
1 |
1 |
2 |
2 |
|
L |
s
p |
0
–1, |
1 3 |
4 |
2 6 |
8 |
|
M |
s
p
d |
0 –1, 0, 1 –2, –1, 0, 1, 2 |
1 3 5 |
9 |
2 6 10 |
18 |
|
N |
s
p
d
f |
0 –1, 0, 1 –2, –1, 0, 1, 2
–3, –2, –1, 0, 1, 2, |
1 3 5 7 |
16 |
2 6 10 14 |
32 |
Последовательность заполнения электронами
орбиталей осуществляется в соответствии
с принципом наименьшей энергии.
Согласно
прнципу наименьшей
энергии электроны заполняют
орбитали в порядке повышения их энергии.
Очередность заполнения орбиталей
определяется правилом Клечковского:
увеличение энергии и, соответственно,
заполнение орбиталей происходит в
порядке возрастания суммы главного и
орбитального квантовых чисел (n
+ l), а при
равной сумме (n
+ l) – в
порядке возрастания главного квантового
числа n.
Например, энергия электрона на подуровне
4sменьше, чем на подуровне
3d, так как в первом
случае суммаn+l= 4 + 0 = 4 (напомним, что дляs-подуровня
значение орбитального квантового числаl = = 0), а во второмn+l= 3
+ 2= 5 (dподуровень,l = 2).
Поэтому, сначала заполняется подуровень
4s, а затем 3d(см. рис. 4.8).
На подуровнях 3d(n= 3,l= 2) , 4р(n= 4,l= 1) и 5s(n= 5,l= 0) сумма значенийпиlодинаковы и равны 5. В случае равенства
значений суммnиl
сначала заполняется подуровень с
минимальным значениемn,
т.е. подуровень 3d.
В соответствии с правилом Клечковского
энергии атомных орбиталей возрастает
в ряду:
1s
< 2s <
2р < 3s
< 3р < 4s
< 3d <
4р < 5s
< 4d <
5p < 6s
< 5d
4f< 6p< 7s….
В зависимости от того, какой подуровень
в атоме заполняется в последнюю очередь,
все химические элементы делятся на 4
электронных семейства: s-,
p-, d-,
f-элементы.

4
4d
4p
3d
3
4s
3p
3s
2
2p
2s
1
1s
Уровни
Подуровни
Рис.
4.8. Энергия атомных орбиталей.
Элементы, у атомов которых в последнюю
очередь заполняется s-подуровень
внешнего уровня, называютсяs-элементами.
Уs-эле-ментов валентными
являютсяs-электроны
внешнего энергетического уровня.
У р-элементовпоследним заполняется
р-подуровень внешнего уровня. У них
валентные электроны расположены наp–
иs-под-уровнях внешнего
уровня. Уd-элементов
в последнюю очередь заполняетсяd-подуровень предвнешнего
уровня и валентными являютсяs-электроны
внешнего иd-электроны
предвнешнего энергетического уровней.
У f-элементовпоследним заполняетсяf-подуровень
третьего снаружи энергетического
уровня.
Порядок размещения электронов в пределах
одного подуровня определяется правилом
Гунда:
в
пределах подуровня электроны размещаются
таким образом, чтобы сумма их спиновых
квантовых чисел имела бы максимальное
значение по абсолютной величине.
Иными словами, орбитали данного подуровня
заполняются сначала по одному электрону
с одинаковым значением спинового
квантового числа, а затем по второму
электрону с противоположным значением.
Например, если в трех квантовых ячейках
необходимо распределить 3 электрона,
то каждый из них будет располагаться в
отдельной ячейке, т.е. занимать отдельную
орбиталь:
В этом случае сумма спиновых квантовых
чисел максимальна:
∑ms= ½ + ½ + ½ = 3/2.
Эти же 3 электрона не могут быть
расположены иначе, так как ∑msбудет меньше, например:
∑ms=
½ – ½ + ½ = ½.
Порядок распределения электронов по
энергетическим уровням и подуровням в
оболочке атома называется его электронной
конфигурацией, или электронной формулой.
Составляя электронную конфигурациюномерэнергетического уровня(главное квантовое число) обозначают
цифрами 1, 2, 3, 4…, подуровень (орбитальное
квантовое число) – буквамиs,p,d,f. Число электронов
на подуровне обозначается цифрой,
которая записывается вверху у символа
подуровня.
Электронная конфигурация атома может
быть изображена в виде так называемой
электронно-графической формулы.
Эта схема размещения электронов в
квантовых ячейках, которые являются
графическим изображением атомной
орбитали. В каждой квантовой ячейке
может быть не более двух электронов с
различными значениями спиновых квантовых
чисел.
Чтобы
составить электронную или
электронно-графическую формулу любого
элемента следует знать:
1. Порядковый номер элемента, т.е. заряд
его ядра и соответствующее ему число
электронов в атоме.
2. Номер периода, определяющий число
энергетических уровней атома.
3. Квантовые числа и связь между ними.
Так, например, атом водорода с порядковым
номером 1 имеет 1 электрон. Водород элемент первого периода, поэтому
единственный электрон занимает
находящуюся на первом энергетическом
уровнеs-орбиталь,
имеющую наименьшую энергию. Электронная
формула атома водорода будет иметь вид:
1Н 1s1.
Электронно-графическая формула водорода
будет иметь вид:
1
1s
Электронная и электронно-графическая
формулы атома гелия:
2Не 1s2
2
1s
отражают
завершенность электронной оболочки,
что обусловливает ее устойчивость.
Гелий – благородный газ, характеризующийся
высокой химической устойчивостью
(инертностью).
Атом лития 3Liимеет
3 электрона, это элементIIпериода, значит, электроны расположены
на 2-х энергетических уровнях. Два
электрона заполняютsподуровень первого
энергетического уровня и 3-й электрон
расположен наsподуровне второго энергетического
уровня:
3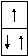
1s22s1
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
24.03.201523.67 Mб13Глава_1.doc
- #



