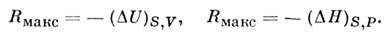Максимальная полезная работа системы
может быть получена, если перевести
тело в обратимом равновесном процессе
из состояния, когда его давление и
температура больше давления и температуры
окружающей среды, в состояние равновесия
с окружающей (то есть из
состояния р1р0,
Т1Т0
в состояние р0,
Т0).
Эта максимальная полезная работа
называется так же
работоспособностью системы или
эксергией.
Различают эксергию неподвижного тела,
эксергию потока вещества и эксергию
теплоты.
Для неподвижного тела (например,
при расширении сжатого газа или пара
из емкости) эксергия выражается формулой
Lмакс
где Vo,
Uo,
So
– объем, внутренняя энергия и энтропия
рабочего тела при параметрах окружающей
среды ро, То;
V1,
U1,
S1
– объем, внутренняя энергия и энтропия
рабочего тела в т. 1 при р1р0,
Т1Т0..
Эксергия потока вещества
выражается формулой
Lмакс=
(Lтех)макс
где Io
– энтальпия рабочего тела при
параметрах окружающей среды ро,
То;
I1
– энтальпия рабочего тела в т. 1
при р1р0,
Т1Т0.
Удельная эксергия потока равна
,
Дж/кг.
Графически удельную эксергию потока
можно показать в Т,s – координатах, если
обратимо перевести рабочее тело из
начального состояния с р1р0,
Т1Т0
в состояние равновесия с окружающей
средой р0,
Т0
сначала
изоэнтропным (адиабатным)
расширением в процессе 1-2 до р2,
Т0
и затем изотермическим расширением
в процессе 2-0 до р0,
Т0.
|
|
Эксергия теплоты.
Если в системе, состоящей из горячего
источника теплоты с температурой Т1,
внешней среды с температурой То
и рабочего тела, горячий источник отдает
количество теплоты Q1, то
максимальная работа, которая может быть
получена от этой теплоты, равна работе
прямого цикла Карно в интервале температур
Т1–То.
Эту работу называют также эксергией
теплоты и она определяется
формулой
Lмакс
.
v
Таким образом, в широком смысле под
эксергией понимается энергия, которая
при участии окружающей среды может быть
преобразована в другую форму энергии
(часть энергии,
равная максимальной полезной работе,
которую может совершить термодинамическая
система
при переходе из данного состояния в
состояние
равновесия
с окружающей
средой
– из Википедии). Эксергия зависит
как от параметров рабочего тела, так и
от параметров окружающей среды. Она не
является функцией состояния рабочего
тела, но может рассматриваться как
функция состояния расширенной системы,
состоящей из рабочего тела и окружающей
среды.
Если в каком либо процессе конечные
параметры отличаются от параметров
окружающей среды, то изменение
эксергии в этом процессе равно:
Из формулы видно, что если в реальном
процессе 1-2 из-за необратимости энтропия
рабочего тела увеличивается на S,
то эксергия уменьшается на ТоS.
Эти потери эксергии вследствие
необратимости процесса определяются
уравнением Гюи-Стодолы
|
П=ТоS |
Рассмотрим расширение газа в турбине
Потери эксергии оцениваются эксергетическим
КПД:
– для процесса

где Е1
– подведенная эксергия;
– для неподвижных тепловых аппаратов
ηе
= Евых
/ Евх
где Евых,
Евх
–эксергия на выходе из аппарата и
на входе в аппарат соответственно;
– для тепловых двигателей
ηе
= Lпол
/ (Евх
– Евых)
где Lпол
– полезная работа двигателя.
Использование понятия эксергии даёт
возможность количественно определить
влияние неравновесия,
необратимости термодинамических
процессов
на эффективность
преобразования энергии, то есть позволяет
выделить ту часть энергии, которая не
может быть использована из-за
газодинамических явлений, трения,
теплообмена.
Применение эксергии очень удобно и
полезно для определения термодинамического
совершенства любых тепловых аппаратов
и их отдельных частей.
Анергия – это энергия, которая
при участии заданной окружающей среды
не может быть преобразована в эксергию.
Энергию любой системы можно рассматривать
состоящей из эксергии
(то есть технически пригодной, превратимой
части энергии) и анергии (то есть
технически непригодной, непревратимой
части энергии).
Утверждение о том, что существуют
эксергия и анергия, позволяет сформулировать
ІІ закон термодинамики в следующем
виде: все формы энергии состоят из
эксергии и анергии, причем каждая
из составляющих может быть равна 0, то
есть:
Энергия = Эксергия
+ Анергия.
Во всех реальных необратимых процессах
часть эксергии, равная потерям эксергии,
превращается в анергию. Эксергия остается
постоянной только в идеализированных,
обратимых процессах.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
МАКСИМАЛЬНАЯ РАБОТА
- МАКСИМАЛЬНАЯ РАБОТА
-
- МАКСИМАЛЬНАЯ РАБОТА
-
в термодинамике – 1) работа, совершаемая теплоизолиров. системой при обратимом переходе из неравновесного состояния в равновесное (когда энтропия системы остаётся постоянной). 2) Работа, совершаемая системой в термостате при обратимом переходе из одного равновесного состояния в другое. Эта M. р. равна изменению величины
где
– внутр. энергия тела, S, V– его энтропия и объём,
– темп-pa и давление в термостате, отличающиеся от темп-ры T и давления P системы, т. е.
Предполагается, что в каждый данный момент система находится в равновесном состоянии, но не в равновесии со средой.
В частном случае, когда темп-pa и объём системы остаются неизменными, причём T = T0,M. р. равна изменению свободной энергии ( Гельмголъца энергии)
В случае, когда постоянны темп-pa и давление системы, причём T= T0, P = P0,M. р. равна изменению Гиббса анергии:
Предполагается, что состояние системы определяется не только T и V (или T и P), но и др. параметрами, напр, при хим. реакциях или растворении. Эти параметры могут изменяться медленно.
Для адиабатич. процессов M. р. определяется изменением внутр. энергии U при заданных S и V или изменением энтальпии H при заданных S и P:
Лит.: Ландау Л. Д., Лифшиц E. M., Статистическая физика, ч. 1, 3 изд., M., 1976, p 19, 20. Д. H. Зубарев.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия.
.
1988.
.
Полезное
Смотреть что такое “МАКСИМАЛЬНАЯ РАБОТА” в других словарях:
-
максимальная работа — Работа, произведенная термодинамической системой в обратимом процессе … Политехнический терминологический толковый словарь
-
МАКСИМАЛЬНАЯ РАБОТА РЕАКЦИИ — работа, к рая производится термодинамич. системой при протекании в ней обратимой хим. р ции. М. р. р. W макс складывается из работы по преодолению внеш. давления р мех. работы где V объем системы, и работы, к рая не сопровождается изменением… … Химическая энциклопедия
-
максимальная — максимальная: Максимально возможная длина ЗО, в пределах которой выполняются требования настоящего стандарта и технических условий (ТУ) на извещатели конкретных типов, Источник: ГОСТ Р 52651 2006: И … Словарь-справочник терминов нормативно-технической документации
-
Работа Сменная — работа в 2, 3, 4 смены, вводимая в случае, когда длительность производственного процесса превышает допустимую для работника продолжительность ежедневной работы. Сменная работа может вводиться и для более эффективного и рационального использования … Словарь бизнес-терминов
-
Работа с GMT под Windows — Связать? … Википедия
-
РАБОТА СМЕННАЯ — работа в 2, 3, 4 смены, вводимая в случае, когда длительность производственного процесса превышает допустимую для работника продолжительность ежедневной работы. Сменная работа может вводиться и для более эффективного и рационального использования … Энциклопедия трудового права
-
максимальная частота вращения — 3.2 максимальная частота вращения пmax, мин 1: Достигаемая при нажатой до упора педали частота вращения коленчатого вала двигателя в режиме холостого хода. 3.1, 3.2 (Новая редакция, title= Изменение № 1, ИУС 7 2012 ). Источник … Словарь-справочник терминов нормативно-технической документации
-
Работа на дому (мошенничество) — Объявление обещает 2000$ за неполный рабочий день и 6000$ за полный Не следует путать с Работа на дому законный способ заработка. Работа на дому (англ. work at home scheme) сх … Википедия
-
максимальная допустимая скорость — 3.17 максимальная допустимая скорость: Максимальная скорость, при которой согласно проекту возможна непрерывная работа компрессора. Источник: ГОСТ Р 53737 2009: Нефтяная и газовая промышленность. Поршневые компрессоры. Общие технические… … Словарь-справочник терминов нормативно-технической документации
-
нормальная работа — (normal operation): Работа нагревательного блока после установки в здании в соответствии с инструкциями. Источник … Словарь-справочник терминов нормативно-технической документации
в история науки, то принцип максимальной работы постулат о взаимоотношениях между химические реакции, высокая температура эволюция и потенциал работай произведено там из. Примерно этот принцип был разработан в 1875 году французским химиком. Марселлен Бертло, в области термохимия, а затем в 1876 г. американским физиком-математиком Уиллард Гиббс, в области термодинамика, в более точном виде. По сути, версия Бертло заключалась в следующем: «каждая чистая химическая реакция сопровождается выделением тепла». (и это дает максимальный объем работы). Эффекты необратимость однако показала, что эта версия неверна. Это было исправлено в термодинамике за счет включения концепции энтропия. единицы: p, v и w
Обзор
Бертло независимо сформулировал обобщение (широко известное как Третий принцип Бертло или принцип максимальной работы), которое можно кратко сформулировать так: каждая чистая химическая реакция сопровождается выделением тепла. Хотя этот принцип, несомненно, применим к подавляющему большинству химических воздействий в обычных условиях, он подлежит многочисленным исключениям и, следовательно, не может быть принят (как первоначально предполагали его авторы) в качестве надежной основы для теоретических рассуждений о связи между тепловым эффектом и химическое сродство. Существование реакций, которые обратимы при небольшом изменении условий, сразу же отменяет принцип, поскольку, если действие, протекающее в одном направлении, выделяет тепло, оно должно поглощать тепло, продолжаясь в обратном направлении. Поскольку от этого принципа отказались даже его авторы, сейчас он имеет только историческое значение, хотя в течение многих лет он оказывал значительное влияние на термохимические исследования.[1]
Таким образом, в 1875 г. французский химик Марселлен Бертло который заявил, что химические реакции будет иметь тенденцию давать максимальное количество химической энергии в виде работай по мере развития реакции.
Однако в 1876 году благодаря работам Уиллард Гиббс и другие последующие, принцип работы оказался частным случаем более общего утверждения:
Принцип работы был предвестником развития термодинамической концепции свободная энергия.
Термохимия
В термодинамика, то Свободная энергия Гиббса или же Свободная энергия Гельмгольца по сути, это энергия химической реакции, «свободная» или доступная для выполнения внешней работы. Исторически «свободная энергия» является более совершенной и точной заменой термохимия срок “близость “Использовался химиками древности для описания” силы “, которая вызвала химические реакции. Срок восходит как минимум ко времени Альбертус Магнус в 1250 г.
По мнению лауреата Нобелевской премии и профессора химической инженерии Илья Пригожин: «Поскольку движение объяснялось ньютоновской концепцией силы, химики хотели аналогичную концепцию« движущей силы »для химических изменений? Почему происходят химические реакции и почему они останавливаются в определенных точках? Химики назвали «силу», вызывающую сродство химических реакций, но у нее не было четкого определения.[2]
На протяжении всего 18 века преобладающим взглядом на тепло и свет был взгляд Исаак Ньютон, называемая «ньютоновской гипотезой», которая утверждала, что свет и тепло являются формами материи, притягиваемыми или отталкиваемыми другими формами материи, с силами, аналогичными гравитации или химическому сродству.
В 19 веке французский химик Марселлен Бертло и датский химик Юлиус Томсен пытался количественно оценить химическое сродство с помощью горячность реакции. В 1875 году, после количественной оценки теплоты реакции для большого числа соединений, Бертло предложил «принцип максимальной работы», согласно которому все химические изменения, происходящие без вмешательства внешней энергии, имеют тенденцию к образованию тел или системы тел, которые высвобождают высокая температура.
Термодинамика
Термодинамические системы в теореме о максимальной работе. dU – это энергия, потерянная в обратимой тепловой системе в виде тепловой энергии δQ и в обратимой рабочей системе в виде работы δW.
С развитием первых двух законы термодинамики в 1850-х и 60-х годах теплота реакции и работа, связанная с этими процессами, получили более точную математическую основу. В 1876 г. Уиллард Гиббс объединил все это в своем 300-страничном «О равновесии гетерогенных веществ». Предположим, например, что у нас есть общая термодинамическая система, называемая «первичной» системой, и мы механически соединяем ее с «обратимым источником работы». Обратимый источник работы – это система, которая, когда она работает или с ней выполняется работа, не изменяет своей энтропии. Следовательно, это не Тепловой двигатель и не рассеивается из-за трения или теплообмена. Простым примером может служить пружина без трения или груз на шкиве в гравитационном поле. Предположим далее, что мы термически подключаем первичную систему к третьей системе, «обратимому источнику тепла». Обратимый источник тепла можно рассматривать как источник тепла, в котором все превращения обратимы. Для такого источника добавленная тепловая энергия δQ будет равна температуре источника (T), умноженной на увеличение его энтропии. (Если бы это был необратимый источник тепла, увеличение энтропии было бы больше, чем δQ / T)
Определять:
-
Потеря внутренней энергии первичной системой Прирост энтропии первичной системы Прирост внутренней энергии обратимого источника работы Прирост энтропии обратимого источника работы Прирост внутренней энергии обратимого источника тепла Прирост энтропии обратимого источника тепла Температура обратимого источника тепла
Теперь мы можем сделать следующие заявления
Устранение 


Когда основная система обратима, равенство сохраняется и объем выполненной работы будет максимальным. Обратите внимание, что это будет продолжаться любой обратимая система, которая имеет такие же значения dU и dS .
Смотрите также
- Химическая термодинамика
- Принцип Томсена-Бертело
- Термохимия
Рекомендации
- ^ Британская энциклопедия 1911
- ^ Источник: Учебник Ильи Пригожина 1998 г. Современная термодинамика
Максимальная работа и полезная работа. В соответствии с принципами термодинамики процесс (например, химическая реакция) только в том случае может протекать самостоятельно, т. е. без подвода энергии, если он в состоянии производить внешнюю работу. Процесс дает наибольшую величину внешней работы максимальную работу), если он протекает изотермически и обратимо. Если процесс идет при постоянном давлении рис этим связано изменение объема ДК рассматриваемой системы, то произведенную внешнюю работу можно разложить на две составляющие [c.164]
Уравнения (32) и (33) являются удобным сочетанием первого и второго законов термодинамики применительно к обратимым изотермическим процессам и указывают на то, что максимальная работа (а в случае изобарных процессов максимально полезная работа) не равна тепловому эффекту процесса. Максимальная работа равна тепловому эффекту процесса только в практически нереализуемом случае, т. е. при температуре абсолютного нуля. Эти положения, как будет показано в дальнейшем, имеют существенное значение для обсуждения проблемы химического сродства. [c.112]
Из термодинамики известно, что максимальная работа химической реакции получается при обратимом (равновесном) проведении процесса. В нащем случае процесс полностью необратим и работа равна нулю. Вся энергия химической реакции полностью превращается в тепло. Электроны в этом процессе непосредственно переходят от цинка к меди. Для того чтобы получить электрическую энергию, надо провести процесс перехода [c.365]
Из Второго начала термодинамики следует, что максимальная работа имеет место в том случае, когда процесс протекает изотермически и обратимо. С термодинамической точки зрения, обратимый процесс — это такой процесс, который, при изменении внутренней энергии системы, находящейся в состоянии равновесия, на бесконечно малую величину, обратимо протекает в прямом и обратном направлении. [c.14]
Экспериментально установлено, что если различные виды работы могут быть полностью обращены в теплоту и в идеальном случае могут полностью переходить друг в друга, то обратное преобразование невозможно, так как только некоторая часть теплоты превращается в работу при циклическом процессе. Здесь речь идет о закрытой системе, совершающей круговой термодинамический процесс, а не о единичном акте, так как в последнем случае согласно принципу эквивалентности преобразование тепла в работу можно произвести полностью. Такая система является, по сути дела, или тепловой машиной (система суммарно производит работу над источником работы), или холодильной машиной (источник работы суммарно производит работу над системой). Поэтому неудивительно, что изучение вопросов, связанных со вторым началом термодинамики, исторически обязано исследованию принципа действия тепловых машин, назначение которых состоит в превращении тепла в работу. В фундаментальном труде французского инженера Сади Карно Размышления о движущей силе огня и о машинах, способных развивать эту силу (1824) сделана первая, еще весьма несовершенная попытка сформулировать второе начало термодинамики. В труде Карно рассматриваются три основных вопроса 1) необходимое условие для преобразования теплоты в работу 2) условие, при котором трансформация теплоты в работу может достигнуть максимального эффекта 3) зависимость коэффициента полезного действия тепловой машины от природы рабочего вещества. В труде Карно был сделан совершенно правильный вывод, что коэффициенты полезного действия всех обратимых тепловых машин одинаковы и не зависят от рода работающего тела, а только от интервала предельных температур, в котором работает машина. [c.88]
Соотношение (11) показывает, что при обратимом перенесении количества теплоты д от тела с температурой Т йТ к телу с температурой Т можно получить работу йА. Эта работа называется максимальной. Уравнение (11) можно рассматривать как математическую формулировку второго закона термодинамики для обратимых процессов. Можно доказать, что для любых необратимых процессов [c.98]
Зачем же вводится такое понятие Как увидим позже, расчетные соотношения, основанные на законах термодинамики, могут быть найдены именно для равновесных обратимых процессов. Здесь же остановимся на одном весьма важном свойстве таких процессов, состоящем в том, что при обратимом процессе работа, совершаемая системой при переходе из начального состояния в конечное, максимальна, а работа, затрачиваемая на обратный перевод системы в начальное состояние, минимальна. [c.21]
Изменения свободной энергии и теплосодержания обрати-мых элементов. Так как количественные следствия второго закона термодинамики применимы только к обратимым процессам, то изучение обратимых элементов особенно важно. В этом случае к опытным результатам исследований элементов можно применять термодинамические методы. Если э. д. с. обратимого элемента равняется Е вольтам и происходящий в нем процесс сопровождается прохождением п фарадеев, т. е. пЕ кулонов, где равняется 96 500 кулонов, то максимальная работа, которая может быть произведена элементом в цепи, равняется пРЕ в-кул ъля джоулей (ср. стр. 17). Так как в электрическую работу не входит механическая работа, связанная с изменением объема, то электрическую работу можно считать равной [c.271]
Максимальная работа. Только что указывалось, что максимальную работу дают обратимые процессы. Эго важное положение следует из второго начала термодинамики и может быть пояснено следующими примерами. [c.296]
Смысл этого фундаментального соотношения ясен из предыдущего. При обратимо перенесении количества теплоты q от температуры T- -dT к температуре Г можно получить максимальную работу dA. Второе начало термодинамики показывает, что это соотношение можно применить для любых (также и не циклических) обратимых процессов, единственным результатом которых является перенос теплоты от Г-1- Г к Г и совер- [c.299]
Термодинамические потенциалы имеют простой физический смысл. Согласно второму началу термодинамики, изменение внутренней энергии Ш при процессе не может быть целиком использовано для получения работы. Максимальную работу Л дает процесс, идущий обратимо, а количество энергии Аи — Л остается в виде теплоты, не способной к превращению в работу. Можно, поэтому, запас и внутренней энергии тела представить как сумму двух слагаемых [c.316]
Эта величина, так же как и е, представляет собой максимальную работу, но не потока вещества, а ту, которая может быть получена в результате обратимого переноса теплового потока q от данной температуры Т до температуры окружающей среды Гр. Из термодинамики известно, что эта работа для элементарного процесса определяется уравнением [c.29]
Из всех видов работ особое значение в термодинамике получила работа, совершаемая идеальным газом при расширении. Она может изменяться от нуля до некоторой конечной величины, в зависимости от условий и формы ведения процесса при изменении объема, например от до При расширении газа в пустоту, т. е. когда газ не преодолевает никакого сопротивления, работа равна нулю. Чем большее сопротивление приходится преодолевать газу при расширении, тем большую работу он совершает. Наибольшую работу — максимальную работу Л акс. газ совершает тогда, когда во все время процесса внешнее давление лишь на ничтожно малую величину меньше собственного давления газа, т. е. когда процесс происходит обратимо. [c.45]
Рассмотрим эти потенциалы. Воспользуемся объединенным уравнением первого и второго законов термодинамики в общем виде для обратимого процесса, в котором полная работа будет максимальной [c.86]
Обратимый процесс как стандарт для сравнения. Рассмотренные соотношения привели к выяснению важности понятия обратимости и обратимого процесса в термодинамике. По общему признанию, обратимый процесс является идеализированным процессом, недостижимым на практике. Это следует понять совершенно ясно. В процессе, который мы только что рассмотрели, обратимость требует полного отсутствия трения, материалов, не проводящих тепла, и бесконечно малую скорость изменения (поскольку допустимы только бесконечно малые движущие силы). Практически экономичная операция может потребовать значительного отклонения от этих идеализированных условий, но нет никаких внутренних физических трудностей, которые препятствовали бы выбору соответствующих условий, чтобы настолько приблизиться к этому идеалу, что незначительная экстраполяция привела бы к нему полностью. Единственной причиной введения понятия об обратимом процессе является установление стандарта для сравнения реальных процессов. Обратимым процессом является процесс, дающий максимальную работу или требующий наименьшей работы для своего осуществления. Он говорит о максимальной производительности, к которой можно стремиться, но которой никогда нельзя достигнуть полностью. Без такого абсолютного стандарта или масштаба все попытки инженеров улучшить процессы будут уподобляться стрельбе в темноте без определенной цели. С обратимым процессом как со стандартом мы встречаемся каждый раз, когда реальный процесс уже достаточно эффективен или же он слишком непроизводителен и поэтому может быть значительно усовершенствован. [c.79]
Идеальный цикл охлаждения. Поддержание любой температуры (иже температуры окружающей среды требует непрерывного отвода теплоты при данной температуре и подвода ее при несколько более высокой температуре. Таким образом, охлаждение в сущности является процессом, включающим перевод теплоты с одного температурного уровня на другой, более высокий. Это толкование имеет очень большое значение, позволяя ясно представить существенные эл енты любого процесса охлаждения. В гл. 11, при рассмотрении второго закона термодинамики, было показано, что любую обратимую тепловую машину можно рассматривать как тепловой насос. Как было показано, машина, работающая по циклу Карно, забирающая теплоту при абсолютной температуре и отдающая ее при Тд, имеет максимальный к. п. д. из всех, какие могут быть достигнуты любой тепловой машиной, работающей между данными температурными пределами. К.п.д., который является отношением произведенной работы к теплоте, поглощенной при Т , дается уравнением ) [c.483]
Уравнения (139) и (140) можно записать и непосредственно, имея в виду, что в общем случае работоспособность системы складывается из уменьшения функции работоспособности массы и работоспособности подведенной теплоты. Уравнения (139) и (140) определяют максимальное количество работы, которое может совершить система в обратимом процессе. Если процесс необратимый, то в соответствии со вторым законом, термодинамики часть максимально возлюжной работы теряется, превращаясь в теплоту и совершаемая системой работа /, оказывается меньше максимально возможной. [c.102]
Все естественные процессы необратимы (стр. 10), а обратимые процессы представляют лишь предельный случай естественных процессов, совершающихся при бесконечно малых разностях (градиентах) интенсивных параметров, а потому обладающих бесконечно малой скоростью. При обратимых (или равновесных) процессах состояние равновесия системы не нарушается. Действительные процессы могут только более или менее приближаться к обратимым, как к предельному случаю. При обратимом переходе системы из одного состояния к другому возрастание энтропии минимально, а полезная работа, совершаемая системой, максимальна сравнительно с любым необратимым переходом. Энергетический эффект перехода легче всего вычислить для случая его обратимости. Отсюда понятно значение обратимых процессов для теоретической термодинамики. [c.24]
Энтропия. Выше было показано, что система при своем превращении может совершать работу лишь в том случае, когда она переходит от более высокой температуры То к другой, более низкой температуре Т . Важным следствием второго закона термодинамики является то, что максимальная работа, которая может быть произведена в условиях обратимого процесса, зависит не только от разности температур Та — Т , но и от абсолютной величины температуры Т . Поэтому проводили исследования с целью установления связи между количеством тепла д, выделяемого или поглощаемого системой, и температурой Т, при которой происходит теплообмен. Это привело к введению новой термодинамической функции, называемой энтропией 8. [c.189]
Изменение внутренней энергии (и соответственно энтальпии АН), сопровождающее превращение системы, является постоянным (при постоянной температуре). Однако работа, совершаемая системой, является переменной. Гальванический элемент дает максимальную работу только тогда, когда он работает в обратимых термодинамических условиях. Слово обратимый в термодинамике имеет иной смысл, чем в химии. Обратимым термодинамическим процессом называют процесс, происходящий настолько медленно, что система в каждый момент находится в равновесии с окружающей средой в отношении температуры и давления. [c.192]
Второе начало термодинамики было впервые сформулировано в 1850 г. Р. Клаузиусом в виде следующего принципа Теплота не может переходить сама собой (позднее Клаузиус заменил последние слова на выражение без компенсации ) от более холодного тела к более нагретому . Энтропию (5) как функцию состояния Клаузиус ввел в 1865 г. при рассмотрении кругового обратимого процесса типа цикла Карно и поиске соотношения между имеющими место двумя превращениями тепла. Одно из них— переход тепла в работу, другое — переход тепла более высокой температуры в тепло более низкой температуры. Прийдя к выводу об увеличении энтропии изолированной системы при протекании в ней самопроизвольных процессов, Клаузиус обобщил второе начало термодинамики до вселенского закона, который сформулировал так Энтропия Вселенной стремится к максимуму . Из этого заключения следует, что эволюция Вселенной направлена к установлению равновесного состояния с максимальным значением энтропии и 5 = 0. [c.435]
Быстро или медленно этим равновесная термодинамика не занимается), но всякая система стремится к состоянию истинного равновесия. Это может служить одной из формулировок второго закона термодинамики. В качестве его формулировки можно принять и невозможность самопроизвольного перехода тепла от менее нагретого тела к более нагретому. Также, согласно второму закону, если периодически действующая машина забирает от нагревателя, имеющего температуру Тд, теплоту Q и превращает ее в работу А, то всегда Л < С, а разность Q—A переходит в виде тепла к холодильнику с температурой Т . (в виде компенсации за работу). Работа может достигнуть максимального значения Лм, а (С — ) — минимального значения при обратимом ведении процесса и при использовании идеальной машины (без трения) тогда отношение A/Q, называемое коэффициентом полезного действия, тоже достигнет максимального значения, равного [c.20]
Термодинамический анализ преследует две цели учет степени совершенства термодинамических процессов энергетических установок и указание путей увеличения экономии топлива или электроэнергии, вводимых в установку. Под термодинамическим совершенством следует понимать идеальный (наиболее желательный) эффект тепловых процессов. Так, например, совершенство перехода теплоты в работу определяется получением из этой теплоты максимально возможного (при заданных условиях) количества работы. Из термодинамики известно, что все совершенные процессы обратимы. Так как реальные процессы, как правило, не могут быть совершенными, для них вводится понятие степени совершенства, которое характеризует степень приближения реального процесса к идеальному. Обычно степень совершенства для теплосиловых установок выражается отношением реальной работы к максимально возможной. С увеличением степени совершенства уменьшается удельный расход топлива. [c.185]
В термодинамике, так же как и во всех других отделах физики, под потенциалом понимают величину, убыль которой определяет производимую-системой работу, причем эта работа может быть отнесена к различным единицам массы, что соответствует понятию удельных и мольных термодинамических потенциалов. Однако в термодинамике понятие потенциала неизбежно приходится значительно усложнять и, сверх того, в известном смысле специализировать. Здесь сказываются две причины. Во-первых, для термодинамики обязательно расчленение процессов на обратимые и необратимые. Стало быть, сразу возникает вопрос, с какой работой — с максимально возможной или же с фактически производимой — следует связывать понятие потенциала. Оказывается, в термодинамике понятие потенциала должно быть связано ни с той и ни с другой из упомянутых работ, но с их разностью. Во-вторых, работа термодинамической системы зависит от пути процесса. Стало быть, необходимо так оговорить условия опыта, чтобы эта зависимость от пути процесса была заведомо исключена. [c.206]
В первую очередь необходимо найти величину эксергии для исследуемого перепада температур. Для этого рассмотрим принципиальную схему обобщенной ОТЭС, представленную на рис. 2.8. На основе второго начала термодинамики максимальную полезную работу можно получить в такой системе, если полное изменение ее энтропии равно нулю. Достаточно рассмотреть только составляющие, связанные с процессами в нагревателе и в холодильнике, так как сам процесс преобразования мы условились считать идеальным и, следовательно, обратимым. Тогда из [c.47]
Примеры необратимых процессов были нами разобраны. В качестве же иллюстрации понятия обратимости можно указать на кристаллизацию насыщенного раствора, когда бесконечно малые изменения давления над поверхностью раствора способны вызвать конденсацию или же испарение растворителя (т. е. изменение его объема), а следовательно, и растворение или же выпадение из насыщенного раствора растворенного вещества. Помимо этого можно указать на изотермическое сообщение теплоты, наподобие выше разобранного примера с поршнем, совершающим максимальную работу. Все, что можно прибавить к вышеуказанному, является в такой же мере нереальным и сохраняет за собой значение лишь мыслительного средства. Дело в том, что вся та термодинамика, приложение которой к техническим вопросам принесло так много реальной пользы, представляет собой термодинамику обратимых процессов, так как последние несравненно более удобны для вывода всех сложных законов химической термодинамики и дают возможность оценивать оптимальные условия, к которым мы при реальных процессах можем приближаться лншь в большей или меньшей степени. [c.94]
Все термодинамические способы повышения степени рекуперации тепловой энергии в узлах теплообмена и ТС в целом определяются вторым законом термодинамики [7,20-24] идельаные обратимые процессы протекают без изменения энтропии, в то время как в реальных, необратимых процессах, она возрастает. Наиболее отчетливо это видно из анализа идеального цикла Карно, в котором возможно максимальное превращение имеющегося тепла в работу. Если обозначить количество тепла при температуре потока Т через Ц, а -температура окружающей среды, то теоретически максимально возможное количество работы А, получаемое в цикле Карно, равно Q (Т -Т )/Т . Величина TQ/TJ – часть тепла, которое рассеивается в атмосферу (рис. I). Зависимость цикла Карно от температуры =(Т]–Тд)/Т представлена на рис. 2. Из изложенного вытекает несколько важных термодинамических предпосылок, учет которых при синтезе оптимальных ресурсосберегающих ТС позволяет обеспечивать их высокую эффективность. [c.38]
Если при расчете работа окажется положительной, т. е. А>0, это значит, что реакция, протекая в условиях обратимости, слева направо доставляет работу, такая реакция принципиально возможна и, вообще говоря, тем вероятнее, чем больще получается работы. Если же работа отрицательна (А<0), нельзя надеяться на то, что реакция будет протекать сама собой. Она сможет осуществиться лищь при подводе энергии извне, т. е. при сопряжении ее с другим процессом, доставляющим работу. Для сопряжения нужна некоторая и обычно высокая степень организации. Именно это и происходит в живой природе. Энергия, заключенная в пищевых веществах, частично обесценивается в процессах обмена в клетках, но зато получают возможность протекать такие процессы, как синтез белка, синтез нуклеиновых кислот и т. п. Термодинамика не может предсказать, в каких условиях возникнет сопряжение реакций, но она не запрещает его. В клетках, как показал опыт, сопряжение двух реакций осуществляется посредством определенного соединения, участвующего в обеих реакциях. Одна из реакций — доставляющая энергию и способная протекать самопроизвольно (например, какая-либо окислительно-восстановительная реакция), создает продукт, молекулы которого аккумулируют часть энергии процесса в форме химической энергии связей. В другой реакции — потребляющей энергию (например, в синтезе белков) это промежуточное и богатое энергией соединение принимает деятельное участие и обеспечивает ее протекание. Для сравнения работоспособности различных реакций часто принимают, что исходные и конечные концентрации реагирующих веществ равны 1 моль1л. Тогда выражение для максимальной работы становится особенно простым [c.69]
Мы получили две формы фундаментального уравнения Гельмгольца, которое обычно кладут в основу учения о химическом равновесии и которое является наиболее сжатым математическим выражением обоих начал термодинамики в применении к обратимым процессам. В нем А означает максимальную работу процесса за вычетом работы расширения и Q — его тепловой эффект, оба при i = onst или при /7 — oHst, смотря ПО условиям течения процесса. В дальнейшем мы будем для простоты отбрасывать индексы и писать [c.107]
Может казаться противоречием, что мы с помощью термодинамики измеряем работу системы, совершающей необратимый переход от начального состояния к равновесному, между тем как лишь для случая обратимых процессов уравнения второго начала выражаются равенствами. Дело в том, что Л — это та работа, которую совершала бы реакция, если бы она все время шла обратимо, т. е. с самого начала до конца переходила через состояния, de Koneifiio близкие к равновесным. Цикл Вант-Гоффа показывает, что такие условия течения реакции всегда можно создать. Фактически, если реакция идет в обычных условиях, ее работа всегда несколько меньше, чем максимальная Л, но ее можно сделать очень близкой к последней, если реакцию вести достаточно медленно. Наоборот, взрывные процессы сопровождаются сильным разогреванием и большой необратимой потерей тепла в окружающую среду. Уже по одному этому например соединение водорода с кислородом со взрывом дает меньшее А, чем спокойное медленное окисление при той же Т. [c.110]
Принимая во внимание второе начало термодинамики, можно показать, что максимальная работа любой химической реакции всегда одна и та же, каким бы путем эта реакция ни протекала, лишь бы процесс был изотермический и обратимый. Иными словами, Л для каждого химического процесса зависит только от конечного и начального состояния системы. Если бы при переходе какой-либо системы из одного состояния в другое можно было при одном обратимом процессе совершать большую работу, чем при другом, тоже обратимом, то за счет этого удалось бы реализовать идею вечного двигателя (регре-tuum mobile) второго рода, что невозможно. [c.99]
Максимальная работа И иакс, которая может быть получена при данной убыли внутренней энергии АЕ в процессе перехода из состояния I в состояние 2, достигается лишь в том случае, если этот процесс обратимый. В соответствии с выражением (1.1) для 1-го начала термодинамики при этом выделяется минимальная теплота рминГ [c.23]
Учесть наличие физико-химических процессов можно приближенно, приняв скорости их протекания бесконечными или нулевыми, При бесконечной скорости имеет место равновесное течение, а при нулевой — замороженное. При равновесном течении термодинамические и газодинамические параметры определяются с привлечением соотношений термодинамики равновесных процессов. Концентрации реагирующих компонентов в таких течениях определяются из закона действующих масс, а энергия колебательных степеней свободы вычисляется по формуле Эйнштейна. Энтропия в этом случае сохраняется неизменной вдоль струйки тока, а из принципа максимальной работы в случае обратимых процессов следует, что равновесное течение является предельным течением, когда удается получить в выходном сечении сопла максимальный импульс, скорость истечения, температуру и максимальное давление по сравнению с любым другим процессом истечения в сопле заданной геометрии и с заданными параметрами заторлюженного потока. [c.250]
Поясним данное определение. Во-первых, макс. работу можно получить только в обратимом (равновесном) процессе, к-рый теоретически возможен при бесконечно малой движущей силе (напр., разности т-р, давлений, хим. потенциалов). Все реальные процессы происходят с возрастанием энтропии (см., напр., Второе начало термодинамики) при конечной разности т-р и, следовательно, необратимы. Поэтому полученная в них работа всегда будет меньше максимаггьно возможной для оценки этой работы ее надо сравнивать с максимально возможной в данном процессе, т. е. с эксергией. Во-вторых, макс. работа м. б. получена только при взаимод. системы с окружающей средой. Напр., дай получения эксергии топлива его сжигают в определенном кол-ве О,, взятом из окружающей среды при использовании для горения чистого кислорода будет получено больше теплоты, но суммарная эксергия окажется меньше, т. к. для получения Oj из воздуха необходимо затратить нек-рую работу, а значит, эксергию. Аналогично при нафеваиии к.-л. тела теплоту нужно подводить только для повышения его т-ры выше т-ры окружающей среды, а до этой т-ры подофев происходит за счет теплоты, отбираемой от среды. [c.406]
Известно, что работа, которая получается в результате любого изменения состояния системы, будет максимальной в том случае, если это изменение протекает обратимо. При спонтанных (самопроизвольных) процессах мы имеем конечную движущую силу, поэтому они необратимы. В таких процессах работа, совершенная системой, меньше той теоретической величины, которая была бы при наличии обратимого изменения. Если система переходит от состояния 1 к состоянию 2 с помощью необратимого или самопроиз- вольного процесса, то мы будем иметь в соответствии с первым законом термодинамики [c.173]
Процесс разряда ХИТ как процесс превращения одних химических веществ в другие характеризуется изменением химической энергии системы. В идеальном случае в электрохимической системе происходит термодинамически обратимое превращение химических веществ. При этом, как известно из химической термодинамики, максимальная электрическая работа А1 иакс в изобарно-изотермичеоких условиях соответствует изменению энергии Гиббса [c.16]
Физическая и коллоидная химия (1964) — [
c.94
]
Физическая и коллоидная химия Учебное пособие для вузов (1976) — [
c.56
]
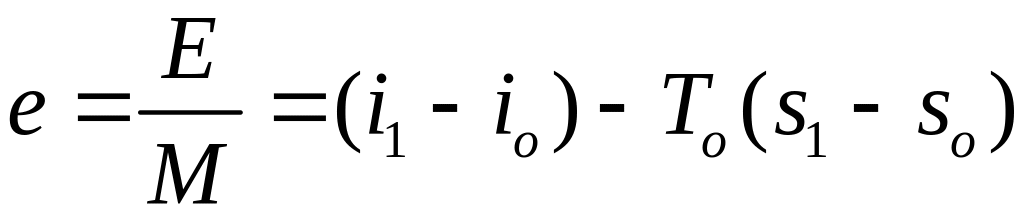


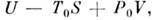 где
где 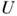 – внутр. энергия тела, S, V– его энтропия и объём,
– внутр. энергия тела, S, V– его энтропия и объём, 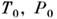 – темп-pa и давление в термостате, отличающиеся от темп-ры T и давления P системы, т. е.
– темп-pa и давление в термостате, отличающиеся от темп-ры T и давления P системы, т. е.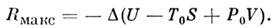
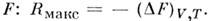 В случае, когда постоянны темп-pa и давление системы, причём T= T0, P = P0,M. р. равна изменению Гиббса анергии:
В случае, когда постоянны темп-pa и давление системы, причём T= T0, P = P0,M. р. равна изменению Гиббса анергии: 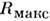
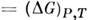 Предполагается, что состояние системы определяется не только T и V (или T и P), но и др. параметрами, напр, при хим. реакциях или растворении. Эти параметры могут изменяться медленно.
Предполагается, что состояние системы определяется не только T и V (или T и P), но и др. параметрами, напр, при хим. реакциях или растворении. Эти параметры могут изменяться медленно.