| Марганец | |||
|---|---|---|---|
| ← Хром | Железо → | |||
|
|||
| Внешний вид простого вещества | |||

Электролитический марганец |
|||
| Свойства атома | |||
| Название, символ, номер | Марганец / Manganum (Mn), 25 | ||
| Группа, период, блок |
7 (устар. 7), 4, d-элемент |
||
| Атомная масса (молярная масса) |
54,938045 (5)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ar] 3d54s2 1s22s22p63s23p63d54s2 |
||
| Радиус атома | 127 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 117 пм | ||
| Радиус иона | (+7e) 46 (+2e) 80 пм | ||
| Электроотрицательность | 1,55 (шкала Полинга) | ||
| Электродный потенциал | −1,180 В | ||
| Степени окисления | 0; +1; +2; +3; +4; +5; +6; +7 | ||
| Энергия ионизации (первый электрон) |
716,8 (7,43) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 7,21 г/см³ | ||
| Температура плавления | 1 517 К (1243 °C) | ||
| Температура кипения | 2 235 К (1961 °C) | ||
| Уд. теплота плавления | 13,4 кДж/моль | ||
| Уд. теплота испарения | 221 кДж/моль | ||
| Молярная теплоёмкость | 26,3[2] Дж/(K·моль) | ||
| Молярный объём | 7,35 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Кубическая | ||
| Параметры решётки | 8,890 Å | ||
| Температура Дебая | 400 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 6,87[3] Вт/(м·К) | ||
| Номер CAS | 7439-96-5 |
Ма́рганец (химический символ — Mn, от лат. Manganum) — химический элемент 7-й группы (по устаревшей классификации — побочной подгруппы седьмой группы, VIIB), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 25.
Простое вещество марганец — это твёрдый, но одновременно с этим, хрупкий переходный металл серебристо-белого цвета. Относится к цветным металлам.
История открытия[править | править код]
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 году шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (рус. марганец происходит от нем. Manganerz — марганцевая руда).
Распространённость в природе[править | править код]
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Массовая доля марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6 %), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железомарганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца[править | править код]
- пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O4;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан mMnO·MnO2·nH2O (45-60 % марганца);
- пурпурит Mn3+[PO4], (36,65 % марганца).
Физические свойства[править | править код]
Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой[2].
Некоторые свойства приведены в таблице.
Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент теплового расширения: 0,000022 K−1 (при 0 °C)
- Электропроводность: 0,00695⋅106 Ом−1·см−1
- Теплопроводность: 0,0782 Вт/(см·K)
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость:
- по шкале Бринелля: 196 МПа
- по шкале Мооса: 4[4]
- Давление паров: 121 Па при 1244 °C
- Молярный объём: 7,35 см3/моль
Химические свойства[править | править код]
| Окисленная форма |
Восстановленная форма |
Среда | E0, В |
|---|---|---|---|
| Mn2+ | Mn | H+ | −1,186 |
| Mn3+ | Mn2+ | H+ | +1,51 |
| MnO2 | Mn3+ | H+ | +0,95 |
| MnO2 | Mn2+ | H+ | +1,23 |
| MnO2 | Mn(OH)2 | OH− | −0,05 |
| MnO42− | MnO2 | H+ | +2,26 |
| MnO42− | MnO2 | OH− | +0,62 |
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны, а степень окисления −1 встречает очень редко).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при реакции с перегретым водяным паром, образует гидроксид, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
С соляной и серной кислотами реагирует по уравнению
С концентрированной серной кислотой реакция идёт по уравнению
С разбавленной азотной кислотой реакция идёт по уравнению
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях — жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·Mn2O3, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
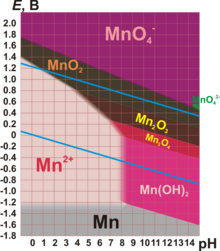
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия)
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа».
В нейтральных или кислых водных растворах ион Mn2+ образует окрашенный в бледно-розовый цвет аквакомплекс [Mn(H2O)6]2+.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10.
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3).
Получение[править | править код]
Добыча[править | править код]
Месторождения:
- Усинское месторождение марганца
Изотопы[править | править код]
Марганец является моноизотопным элементом — в природе существует только один устойчивый изотоп 55Mn.
Все другие изотопы марганца нестабильны и радиоактивны, они получены искусственно. Известны 25 радиоактивных изотопов марганца, имеющие массовое число А в диапазоне от 44 до 70. Наиболее стабильными из них являются 53Mn (период полураспада T1/2 = 3,7 млн лет), 54Mn (T1/2 = 312,3 суток) и 52Mn (T1/2 = 5,591 суток). Преобладающим каналом распада лёгких изотопов марганца (А < 55) является электронный захват (и иногда конкурирующий с ним позитронный распад) в соответствующие изотопы хрома. У тяжёлых изотопов (А > 55) основным каналом распада является β−-распад в соответствующие изотопы железа. Известны также 7 изомеров (метастабильных возбуждённых состояний) с периодами полураспада более 100 нс.
Применение в промышленности[править | править код]
Применение в металлургии[править | править код]
Марганец в виде ферромарганца применяется для раскисления стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12—13 % Mn в сталь (так называемая сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (т. н. «наклёп»). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
В 1920—1940-х годах применение марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале «Сталь» возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определённого содержания марганца в процессе мартеновской плавки, в которой, вместе с В. И. Явойским и В. И. Баптизманским, принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах[5].
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Применение в химии[править | править код]
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Теллурид марганца — перспективный термоэлектрический материал (термо-ЭДС 500 мкВ/К).
Определение методами химического анализа[править | править код]
Марганец принадлежит к пятой аналитической группе катионов.
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn2+, следующие:
1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn2+ до MnO4− с образованием марганцевой кислоты малинового цвета:
Эта реакция даёт отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой. При больших количествах марганца провести эту реакцию не удаётся, так как избыток ионов Mn2+ восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2, и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Mn2+ в MnO4− могут быть использованы другие окислители, например, персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag+ или висмутат натрия NaBiO3:
Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца (II) MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца (II), окрашенный в телесный цвет:
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца (II) и добавляют 2 капли раствора сульфида аммония.
Биологическая роль и содержание в живых организмах[править | править код]
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы и плоды дуриана — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект.
Токсичность[править | править код]
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приёмом пищи с высоким содержанием марганца, нет.[нет в источнике] В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве[6]. Оно проявляется в виде тяжёлых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Чтобы развилась клиническая картина хронического отравления марганцем, обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемых повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом йода).
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 647. — 671 с. — 100 000 экз.
В. В. Еремин и др. Химия. 10 класс. Профильный уровень. — Москва: Дрофа, 2008. — С. 166. — 463 с. — 7000 экз. — ISBN 978-5-358-01584-5. - ↑ В. Е. Зиновьев. Теплофизические свойства металлов при высоких температурах. — 1989. — 384 с.
- ↑ Поваренных А. С. Твёрдость минералов. — АН УССР, 1963. — С. 197—208. — 304 с.
- ↑ Охотский В. Б. Металлургия России на рубеже XXI века. Новокузнецк. 2005.
- ↑ Лопина О. Д.; Аврунина Г. А. (рад.), Воронцова E. И., Прядилова H. В. (гиг.), Рыжкова М. Н. (клиника), Хижнякова К. И. (суд.). Марганец // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1980. — Т. 13 : Ленин и здравоохранение — Мединал. — С. 417—420. — 552 с. : ил.
Литература[править | править код]
- Марганец / Зимина Г. В. // Большая российская энциклопедия [Электронный ресурс]. — 2017.
- Марганец // Популярная библиотека химических элементов / Сост. В. В. Станцо, М. Б. Черненко. — М.: Наука, 1983. — Кн. 1. Водород – палладий. — 575 с.
- Прокин В. А. 4.3. Марганцевые руды // Месторождения полезных ископаемых Урала / Отв. ред. В. А. Коротеев, В. А. Прокин. — Екатеринбург: Ин-т геологии и геохимии УрО РАН, 1999. — 183 с. — ISBN 5-7691-0936-X.
Ссылки[править | править код]
- Марганец на Webelements
Физико-химические методы определения марганца
Министерство образования и науки Российской Федерации
Санкт-Петербургский государственный горный университет
КУРСОВАЯ РАБОТА
по дисциплине: Методы контроля и анализа веществ
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Тема: Физико-химические методы определения марганца
Автор:
студент гр. ОНГ-09-1
Мамедов И.С.
Руководитель проекта
Санкт-Петербург 2011
Оглавление
Введение
Гравиметрические методы
Титриметрические методы
Метод перманганатометрии
Метод йодометрии
Метод броматометрии
Потенциометрическое титрование
Амперометрические методы
Методы кулонометрического титрования
Фотометрические методы
Люминесцентные методы
Заключение
Список используемой литературы
Введение
Марганец – один из первых редких металлов, применяемых в промышленности, например, для производства стали. Поэтому интерес к аналитической химии марганца возник очень давно. Однако наибольшие успехи в разработке новых методов анализа для определения марганца в различных природных и промышленных материалах достигнуты за последние два десятилетия. В настоящее время марганец определяют при анализе сталей, сплавов, полупроводниковых материалов, особо чистых веществ, органических веществ, почв, биологических материалов, горных пород различного происхождения, минералов, руд и, наконец, космического вещества в виде метеоритов и лунных пород.
Гравиметрические методы
Гравиметрическими методами марганец определяют в виде Mn304, MnS, MnS04, Мn2Р207 и других соединений, а также в виде соединений с органическими реагентами. Однако применяют эти методы довольно редко.
Определение в виде окиси марганца. Раствор (желательно не содержащий других кислот, кроме азотной) выпаривают до сиропообразного состояния и прибавляют 50 мл конц. HN03. Стакан накрывают часовым стеклом, раствор кипятят несколько минут для удаления окислов азота и затем, поддерживая температуру близкой к температуре кипения, вводят в течение 10- 20 мин. очень малыми порциями 5 г КСlO3, приоткрывая часовое стекло и быстро всыпая реагент при помощи стеклянной или фарфоровой ложечки. После прибавления всего КСlO3 раствор продолжают кипятить, пока вспенивание почти не прекратится, но некоторое количество хлорноватой кислоты будет все же оставаться в растворе. Споласкивают часовое стекло и стенки стакана небольшим количеством воды, прибавляют 40 мл холодной воды и быстро охлаждают. Фильтруют через плотный фильтр или асбест и промывают стакан и осадок на фильтре малыми порциями холодной бесцветной азотной кислоты и ледяной водой. Фильтрат и промывные воды испытывают на присутствие в них марганца висмутатным методом. Осадок прокаливают.
Весовую форму Мn304 используют мало, так как метод недостаточно точен из-за непостоянства состава осадка и частичной адсорбции им других элементов (Fe, Со и т. д.). Более точные результаты получают, если осадок от действия твердой КClO3 растворить в небольшом количестве HN03, содержащей Н202, и осадить вновь Мn02, обрабатывая раствор аммиаком и бромной водой.
Определение в виде сульфида марганца. Этот метод чаще всего применяют для определения марганца при наличии в растворе солей щелочноземельных элементов. Осаждение MnS при этом должно проводиться на холоду и в присутствии большого количества солей аммония.
Определение в виде фосфата марганца. Наиболее точным методом гравиметрического определения марганца является осаждение его в виде марганца аммонийфосфата. Метод основан на осаждении из слабощелочной среды, содержащей избыток аммонийных солей, марганца аммонийфосфата с последующим прокаливанием его при ~1050° С до Мn2Р207.
Марганец можно определять также взвешиванием осадка MnNH4P04×H20. В присутствии Fe(III), Al(III), Zn(II) и других ионов, также осаждающихся в этих условиях, марганец отделяют в виде Мn02 и затем уже после ее растворения осаждают двойной фосфат марганца и аммония.
К 100-200 мл кислого раствора, содержащего ≤ 0,001 г Мn/мл и не содержащего мешающих определению веществ, прибавляют 20 г NH4Cl и 1-2 г (NH4)2HPO4. Нагревают раствор до кипения, прибавляют конц. НСl (если необходимо для просветления раствора) и затем приливают по каплям при перемешивании разбавленный раствор аммиака. Как только появится осадок, добавление аммиака прекращают и перемешивают до тех пор, пока осадок не станет кристаллическим. Затем прибавляют раствор аммиака по каплям до полного осаждения марганца. Раствор с осадком охлаждают в ледяной воде. Дают постоять 2-3 часа, фильтруют через бумажный фильтр и промывают осадок холодным слабоаммиачным 10%-ным раствором NH4N03. Высушивают, прокаливают сначала при возможно низкой температуре до выгорания углерода, а затем при ~1050° С.
Определение в виде пикролоната марганца. Осаждение марганца пикролоновой кислотой требует меньшей затраты времени по сравнению с методами его определения в виде MnS, MnSO4, Мn2Р2O7, Мn3О4. Присутствие в исследуемом растворе ионов Fe(III), А1(III), Ti(IV), Сr(III) не мешает определению марганца.
К 10 мл 0,01 N MnSO4 добавляют 15 мл 0,01 N раствора пикролоновой кислоты. Смесь оставляют на 1,5-2 часа и затем отфильтровывают желтый мелкокристаллический осадок через тигель Шотта. Осадок промывают водой до отсутствия реакции на сульфат-ион и высушивают в виде (Cl0H7O5N4)2Mn при 105° С до постоянного веса.
Определение в виде перманганата тетрафенилфосфония. Mn(II) окисляют персульфатом аммония в присутствии ионов серебра до ионов MnO4–, которые затем осаждают в виде [(С6Н5)Р]МnO4 добавлением нитрата тетрафенилфосфония и оставляют на ночь. Осадок промывают водой до отрицательной реакции на SO42- и высушивают в вакуум-эксикаторе над конц. H2SO4. Определению не мешают окислители.
Определение в виде марганца бриллиантового желтого (C26H18O8N4S2)Mn. При действии бриллиантового желтого на соли Мn(II) образуется кристаллический осадок, малорастворимый в воде и не разрушающийся от действия уксусной кислоты и 0,1 N НС1. Осадок растворим в щелочах, аммиаке и водно-метанольной смеси (1 : 1). Ионы Fe(III), Al(III), Cr(III), Zr(IV), Th(IV), Ce(III) образуют осадки, растворимые в уксусной кислоте. Осадок не гигроскопичен.
К 10 мл исследуемого раствора Mn(II) прибавляют 7,5 мл СН3СООН (1 : 50), а затем 1,5-кратный избыток раствора бриллиантового желтого, перемешивают и оставляют стоять 60 мин. Осадок переносят во взвешенный стеклянный фильтр №4 и фильтруют с отсасыванием, затем промывают один – два раза 5-10 мл воды, подкисленной уксусной кислотой, и высушивают в термостате при 120° С до постоянного веса.
Определение марганца в виде соли 5-нитробарбитуровой кислоты можно проводить в присутствии ионов Fe(III), которые предварительно связывают в комплекс сульфосалициловой кислотой.
Анализируемую пробу (0,1 – 0,2 г Мn) растворяют в 25 мл воды, вводят 0,5 мл конц. СН3СООН, 15 мл 95%-ного С2Н5ОН и 25-30 мл 2%-ного раствора 5-нитробарбитуровой кислоты в 50%-ном этаноле. Осадок (C4H2O5N3)2Mn × 8Н20 отфильтровывают через фильтр №4, промывают последовательно водой (5 раз по 3-5 мл), 95%-ным этанолом (10 раз по 2 мл) и абсолютным диэтиловым эфиром (5 раз по 1-2 мл), высушивают под вакуумом и взвешивают. Ошибка определения Мn составляет 0,3-10%.
Определение марганца с помощью о-фенантролина. Мn(II) в слабокислой среде в присутствии ионов SCN– образует с о-фенантролином малорастворимое соединение [Mn(Cl2H8N2)2] × (SCN)2. Определению не мешают ионы щелочных, щелочноземельных металлов, Sc(III), Al(III), Сr(III) в количестве 1-10 мг. Если присутствует Fe(III), то прибавляют в 20-25 раз большее количество реагента; Cd(II) мешает определению.
Анализируемый раствор (pH 3-6) разбавляют до 25-100 мл, нагревают почти до кипения, вводят 0,3-1,0 г NH4SCN и перемешивают до полного растворения. Добавляют избыток раствора о-фенантролина (2 г солянокислой соли о-фенантролина в 100 мл воды). Смесь нагревают 2-3 мин. Через 5-10 мин. раствор отфильтровывают, осадок промывают горячим промывным раствором (3 г NH4SCN/л + 10 мл 2%-ного раствора о-фенантролина), затем водой, смесью абсолютного этилового спирта и абсолютного диэтилового эфира (1 : 3) и диэтиловым эфиром. Осадок высушивают в эксикаторе.
Титриметрические методы
Метод перманганатометрии
Содержание Mn(II) определяют титрованием соединений Mn(II) раствором КМnO4 по реакции:
Mn2++ 2МnО4–+ 2Н2О = 5МnO2+ 4Н+.
Для полноты протекания реакции вводят окись цинка и ацетатный буферный раствор. Определению марганца мешают ионы Cr(III), Ni(II), Co(II) и SO42-. Метод применяют для определения марганца в руде.
В другом варианте титруют соединения Mn(II) раствором КМnO4 до Мn(Ш) во фторидной среде. Конечную точку определяют либо визуально, либо фотометрически по окрашиванию раствора избытком КМnO4. Визуальное наблюдение становится затруднительным при содержании >0,03 г Мn. Определению не мешают небольшие количества Со(II), Ni(II), Cu(II), Fe(III), Al(III), Cr(III), а также NO3– и SO4–. Метод применим для анализа сплавов. При ускоренном методе определения марганца в рудах применяют метод обратного титрования избытка КМnO4 раствором сульфата Мn(II).
Микроколичества Mn(II) определяют методом, описанным ниже.
Подготовляют пробу так, чтобы в 5 мл ее нейтрального раствора, находящегося в градуированном цилиндре, содержалось 0,8-1,0 мг Мn. Вводят 1 г ацетата цинка и 0,5 мл 2N СН3СООН. Титруют по каплям 0,01 N раствором КМnO4 при сильном перемешивании и прибавляют небольшой избыток его. Отмечают объем, занимаемый суспензией в мерном цилиндре, дают осадку осесть и отбирают определенную порцию прозрачного раствора для обратного титрования. Приливают к ней 2 мл 4N H2SO4, вводят кристаллик KJ и титруют выделившийся иод 0,01 N раствором Na2S2O3.
Косвенное титрование осуществляют путем восстановления МnO2 стандартным раствором восстановителя с последующим титрованием его избытка раствором КМnO4. При этом окисление Mn(II) до Mn(IV) проводят перхлоратом калия или перекисью водорода.
,5 г пиролюзита кипятят с 100 мл 0,1 N раствора арсенита натрия и 20 мл конц. H2SO4 до полного разложения пробы. После охлаждения приливают 400 мл воды, прибавляют иодид или иодат (следы), после чего избыток арсенита оттитровывают перманганатом калия.
Метод йодометрии
Комплексные соединения Мn(III) с этилендиаминтетрауксусной кислотой, триэтаноламином (а также МnO2 и КМnO4) обрабатывают раствором KJ и титруют выделившийся иод раствором Na2S2O3. Fe(III) мешает определению и его необходимо связать в комплекс фосфорной или плавиковой кислотами. В качестве маскирующих веществ для Fe(III) и Cu(II) применяют комплексон III и полифосфат натрия. Сr(III), Ni(II) и малые количества Mo(VI) и W(VI) не мешают, а Со(II) мешает. Очень малые количества марганца (2-3 мг) можно определять рассматриваемым способом с точностью до 1%, используя для титрования 0,01 N раствор Na2S2O3. Метод применяют для определения марганца в рудах и сталях.
Определение МnO2 в пиролюзите можно проводить путем обработки его НCl или НВr. Получающиеся при этом С12 или Вr2 поглощаются раствором KJ с выделением йода, который титруют раствором Na2S2O3.
Метод броматометрии
Для определения марганца применяют косвенный метод, основанный на образовании малорастворимого в воде осадка оксихинолината марганца или антранилата марганца с последующим растворением его в НСl и титровании бромидброматной смесью в присутствии индикатора.
К анализируемому раствору соли Mn(II) прибавляют в достаточном количестве ацетат натрия (1-2 г на 50 мг Мn), вводят несколько капель раствора H2SO3 или 0,1-0,2 г солянокислого гидроксиламина и слегка подщелачивают по фенолфталеину. Затем вводят уксусную кислоту до обесцвечивания раствора, нагревают до 60-70° С и приливают избыток спиртового раствора 8-оксихинолина. Нагревают до кипения, дают постоять 15 мин. на паровой бане и фильтруют. Колбу и осадок промывают до получения бесцветного фильтрата. Затем осадок растворяют в 10-15 мл кипящей 4N НСl. Полученный раствор охлаждают, вводят индикатор метиловый красный, 0,5 г КВr и титруют 0,1 N раствором бромата калия.
Методы, основанные на окислении Мn(II) до Mn(VII) с последующим восстановлением Mn(VII) до Мn(II)
Методы, основанные на окислении Mn(II) до Mn(VII) различными окислителями (персульфатом аммония, висмутатом натрия, периодатом калия) с последующим восстановлением Mn(VII) до Mn(II) смесью нитрита и арсенита натрия или тиосульфатом натрия, широко применяют при анализе сталей, руд и различных сплавов.
Окисление персульфатом аммония проводят в кислой среде при нагревании в присутствии катализатора.
Эффективными катализаторами являются соли серебра, кобальта, менее эффективными – металлическая ртуть, смесь солей кобальта и меди. Одновременно c Mn(II) персульфат аммония окисляет Сr(III) до Cr2O7– и VO2+ до VO3–.
Окисление висмутатом натрия проходит при комнатной температуре без катализатора. Вместе с марганцем окисляются Cr(III) и VO2+, а также Со(II) (последний только в присутствии ионов Fe(III)). Окисление периодатом калия проводят в кислой среде. В качестве окислителя используют соли Со(III) в присутствии катализатора AgNO3.
Раствор соли Mn(VII) титруют раствором нитрита или арсенита натрия. В первом случае реакция идет медленно, во втором Mn(VII) восстанавливается не до Mn(II), а до промежуточной валентности 3,3. В этом случае титр устанавливается эмпирически. Метод применяют для определения марганца в рудах, сплавах, шлаках, стали, меди. Титрование ведут сначала быстро до момента полного исчезновения фиолетово-красной окраски, переходящей к концу титрования в розовую, и затем медленно до исчезновения розовой окраски. Ионы Ni(II), Cr(VI) мешают определению, ионы Fe(III) не мешают в присутствии фосфорной кислоты. Окончание титрования может быть установлено также фотометрически или потенциометрцчески. Титрование Mn(VII) до Mn(II) смесью эквивалентных количеств мышьяковистой кислоты и нитрита натрия проходит количественно. Конечная точка титрования проявляется значительно более резко. Ионы Ag(I) мешают и поэтому их удаляют введением раствора NaCl.
Методы, основанные на титровании комплексных соединений Мn(III) раствором соли Fe(II)
Mn(III) получают по реакции:
2Mn(NO3)2 + К2Сr2O7 + 2HAsO2 + 10HNO3 = 2Mn (NO3)3 + 2Cr (NO3)3 +
Затем титруют комплексное соединение Mn(III) с F–-ионами раствором соли Fe(II) и индикаторами дифениламином, дифенилбензидином или дифениламинсульфоновой кислотой. Фтористоводородную кислоту следует вводить для предотвращения восстановления образовавшегося Мn(III) избытком HAsO2, а также для того, чтобы окисление не пошло дальше Мn(III). Ионы Fe(III), Co(II), Ni(II), Cu(II), Sn(IV), Zn(II), Cl– и NO3 не мешают определению марганца. Соли Hg(II) мешают определению, так как обесцвечивают индикатор; соли аммония также мешают. В присутствии солей А1, Са и Mg этот метод не дает удовлетворительных результатов. Мешающее влияние указанных ионов устраняют введением метафосфорной и серной или азотной кислот. В этом случае образуется комплексная мангано- (III)-метафосфорная кислота и результаты титрования получаются более точными.
Анализируемый раствор соли Mn(II) должен быть свободен от Сl-ионов и содержать 5-40 мл конц. H2SO4 или 15-50 мл HNO3. Раствор разбавляют до 180 мл и охлаждают до комнатной температуры. Затем прибавляют достаточное количество метафосфорной кислоты и 3 капли 1%-ного раствора дифениламина. Приливают при взбалтывании раствор К2Сг2O7 (15 г бихромата калия в 1 л) и затем избыток раствора арсенита натрия (15 г окиси As (III) и 10 г карбоната натрия в 1 л). Через 30 сек. титруют 0,1 N раствором FeSO4 в 1 N H2SO4 до появления зеленой окраски.
Для определения Мn в стали используют метод, основанный на осаждении Мn(ОН)4 в реакции окисления Мn персульфатом аммония. Осадок растворяют в 0,1 М растворе соли Мора, избыток которой оттитровывают 0,1 М КМnO4.
Потенциометрическое титрование
Методы, основанные на окислении Mn(II) до Мn(III) и Mn(IV).
Потенциометрическое определение марганца основано на реакции окисления Mn(II) до Мn(III) перманганатом калия в нейтральном пирофосфатном растворе, бихроматом калия в 11,5-13,5 М Н3РO4 или в присутствии фторидов. Этот метод применяют для определения как малых (~0,1%), так и больших содержаний (до 90-95%) марганца. Вместо каломельного электрода, имеющего ряд недостатков, часто применяют биметаллическую систему электродов Pt-W. Определению марганца в нейтральном пирофосфатном растворе не мешают Fe(III), Cr(III), Co(II), Ni(II), Mo(VI), W(VI), Al(III), Mg(II), Zn(II), Cu(II), Cd(II), а также небольшие количества (до ≤0,03%) V (V). При больших содержаниях V(V) отделяют сначала МnO2 или титруют при 60°С. Влияние Cr(VI) устраняют восстановлением его до Сr(III) введением NaNO2. Метод потенциометрического титрования марганца в этих условиях применяют при анализе цветных сплавов ферромарганца и марганцевых руд, доломита, шлака, почв, сталей, горных пород.
Определению марганца титрованием бихроматом калия в конц. Н3РO4 не мешают ионы Со(II), Ni(II), Fe(III), Sn(lV), Mo(VI), U(VI), Ca(II), Mg(II), Al(III), а также H2SO4 и НСlO4 до концентраций не выше 1 N. Ошибка определения при содержании 20-150 мг Мn в 50 мл раствора составляет ±0,3%.
Титрование марганца в присутствии NaF позволяет определять его в растворах чистых солей. При определении марганца в присутствии других катионов [Fe(III), Co(II) и Сr(III)] титрование идет медленно и для ускорения реакции используют осмиевую кислоту в качестве катализатора. Титрование протекает в присутствии NH4F гладко, и раствор остается прозрачным от начала и до конца титрования даже при значительной концентрации марганца. Постоянство потенциала устанавливается в этом случае быстрее, чем в присутствии NaF, и сохраняется продолжительное время в растворе, охлажденном до 8-10 °С. Определению марганца мешают только ионы Ca(II), Mg(II) и кремневая кислота. Метод применяют при анализе шлаков и железомарганцевых руд.
Определение марганца проводят методами, основанными на окислении Mn(II) до Мn(III) с последующим титрованием растворами солей железа (II), кобальта(II), иодида калия, титапа(III) или хрома(III). При использовании последних двух растворов титрование ведут в инертной атмосфере. В качестве окислителей используют бромат калия в присутствии Н3РO4 и К2СO3, кислород воздуха в присутствии триэтаноламина или смесь кипящих НСlO4 и Н3РO4 (1 : 1).
Методы, основанные на окислении Mn(II) до Mn(VII) с последующим титрованием Mn(VIl) растворами соли Мора или арсенита натрия. В качестве окислителей используют висмутат натрия, окись серебра и другие. Ошибка метода составляет 0,2%. Используют метод для определения марганца в стали и сплавах.
Малые количества марганца (6 мг-10 мкг) можно определять с помощью потенциометрического титрования избытка комплексона III, не прореагировавшего с Mn(II), растворами солей ртути или кальция. В растворах чистых солей марганец определяют с помощью метода алкалиметрии, основанного на взаимодействии 8-оксихинолина с Мn(II). Точку эквивалентности находят методом потенциометрического титрования образующегося иона водорода раствором NaOH.
Амперометрические методы
Титрование Мn(II) раствором перманганата калия. Во избежание больших начальных токов и выделения МnO2 на электроде титрование проводят при потенциале + 0,4 в. Были исследованы условия титрования с помощью ртутного капельного электрода, но получить четкую волну электролитического восстановления перманганата трудно из-за окисления ртути. Титрование лучше проводить в присутствии ионов Zn(II). Определению марганца мешают ионы Fe(II), а также Аl(III), если содержание последнего превышает содержание марганца. В присутствии 3-4-кратного избытка меди титрование проводят медленно. Ошибка определения марганца в цинковых электролитах не превышает 1,3%.
Титрование Mn(II) раствором перманганата калия до Мn(III) наиболее удобно проводить при потенциале платинового электрода +0,4 в. При этом полностью исключается как анодный ток окисления Мn(II), так и катодный ток, образующийся при титровании Мn(III). Кривые титрования получаются отчетливыми. Ионы Fe(III), Al(III), Ti(IV), Ca(II), Mg(II), Ni(II), Co(II) в присутствии пирофосфата не мешают титрованию, так как образуют с пирофосфатом натрия комплексные соединения, не окисляющиеся КМnO4 при указанном значении потенциала. Cr(III) дает комплексное соединение с пирофосфатом натрия, состав и прочность которого изменяются во времени и поэтому в его присутствии необходимо выдержать раствор 15-20 мин. перед титрованием. Восстановители должны отсутствовать. Обычно титрование проводят с одним или двумя платиновыми индикаторными электродами. Использование амперометрической установки с двумя индикаторными электродами обеспечивает резкое возрастание величины тока вблизи точки эквивалентности, что позволяет заканчивать определение без построения графиков. Амперометрическое титрование Mn(II) по катодной волне перманганата с применением медного и графитового электродов дает удовлетворительные результаты. Недостаток графитового электрода – довольно медленное установление величины тока. Медные и молибденовые электроды не пригодны для проведения анодных процессов на фоне раствора пирофосфата натрия. Ниобий-танталовый электрод не может служить индикаторным электродом при амперометрическом титровании перманганатом. Были применены серебряные и другие электроды. Титрованием Mn(II) перманганатом калия до Mn(III) определяют марганец в стали, чугуне и цинковых электролитах.
Титрование Mn(VII) раствором соли Мора. Метод основан на окислении Мn(II) до МnО4– и титровании образующегося иона МnO4– раствором соли Мора по току окисления Fe(II) при потенциале + 1,0 в с платиновым вращающимся электродом. Титрование проводят как с одним, так и с двумя индикаторными электродами. С применением двух индикаторных электродов содержание марганца определяется более точно и с более высокой чувствительностью вследствие резкого излома кривой титрования. Метод рекомендуют для определения марганца в присутствии ионов Ni(II), Co(II), Fe(III). Определению не мешают также Аl(III), Ti(IV), Mo(VI), Zn(II). Метод применяют для определения марганца в различных сплавах, горных породах, минералах и титановых сплавах.
Разработан метод определения марганца, хрома и ванадия при их совместном присутствии. Сущность метода состоит в последовательном титровании раствором соли Мора суммы марганца, хрома и ванадия, окисленных до Mn(VII), Cr(VI) и V(V) персульфатом аммония в присутствии ионов Ag(I), затем суммы Cr(VI) и V(V) после разрушения МnO4– добавлением в раствор NaCl и титровании одного V(V) после окисления его КМnO4. Все три этапа титрования проводят при постоянном потенциале + 1,0 в с платиновым анодом, вращающимся со скоростью 800-1000 об/мин. Метод применяют при анализе сталей.
Описан метод определения марганца в ферромарганце амперометрическим титрованием с двумя индикаторными электродами, который заключается в окислении Mn(II) до [MnF5]2- и титровании раствором соли Мора. При определении 24,2 мг Мn в 60 мл раствора средняя квадратичная ошибка определения не превышает + 0,25 мг. Определению не мешают ионы Fe(III), Cr(III), Ni(II), Co(II).
Титрование ферроцианидом калия. Состав осадка ферроцианида марганца зависит от концентрации марганца в растворе и достигает постоянства только в присутствии достаточного количества ионов калия, которые обеспечивают образование осадка K4Mn4[Fe(CN)6]3. Для образования соединений постоянного состава и маскирования примесей применяют гликоль и NaCl. Титрование проводят при потенциалах от +0,8 до 1,1 в по току окисления избыточного ферроцианида. Определение марганца возможно в присутствии Cr(III), Al(III), Sb(III), Ba(II), Ca(II), Mg(II) и Sr(II). Zn(II), Cu(II), Fe(TII), Pb(II) мешают определению.
Относительная ошибка титрования чистого МnС12 при содержании 0,213 мг Mn(II) составляет 3,3%; при его содержании от 1,066 до 4,616 мг – 0,70%. Возможно определение 0,03-0,05 мг Mn(II). Титрованием 0,05 М раствором K4[Fe(CN)6] при +1,6 в определено содержание марганца в ферромарганце. Средняя ошибка определения 1-2 отн.%.
Амперометрическое титрование марганца проводят комплексоном III или ЭДТА с амальгамированным Ag-электродом, Pt-микроэлектродом, двумя Pt-электродами или ртутным капельным электродом. Титрование проводят на фоне 0,2 М раствора оксалата щелочного металла (pH 8,0) 0,01 М раствором комплексона III при потенциале -1,75 в. Минимально определяемая концентрация марганца составляет 3 мкг/мл.
Методы кулонометрического титрования
Определение малых количеств Mn(II) кулонометрическим титрованием проводят электрогенерированным бихроматом калия в 12 М Н3РO4 с амперометрической индикацией конечной точки титрования при потенциале +0,56 в. При этом возможно совместное определение Mn(II), V(IV), Ce(III) разными методами установления конечной точки титрования при анализе бронз, латуни и стали. В качестве титранта при определении микрограммовых количеств марганца используют комплексон III. Состав генерируемого электролита – 0,1 М раствор комплексоната ртути(II) в 0,1 М NH4NO3 (pH 8,5).
Было изучено титрование Мn(II) электрогенерированным Ag(II), но получены плохие результаты.
Для кулонометрического определения Mn(VII) в качестве титранта используют ионы Fe(II), генерируемые восстановлением Fe(III) на платиновом катоде в сернокислых растворах. Генерируемый электролит содержит 40 мл H2SO4 (1 : 3) и 1 г Fe2(SO4)3 на 200 мл. Возможно совместное определение Mn(VII), Cr(VI) и Fe(III), а также Mn(VII), Ce(IV) и V(V). В последнем случае ионы Fe(II) генерируют на фоне 2 М H2SO4 с двумя поляризованными платиновыми электродами. Метод применяют при анализе сталей. В качестве титранта применяют также ионы V(III).
Указанные методы применяют при анализе стали, латуни, железа. Конечную точку титрования устанавливают потенциометрически или амперометрически.
Для определения марганца используют методы кулонометрического титрования, основанные на реакции нейтрализации. Так, методом косвенной кулонометрической ацидиметрии определяют 3 мг Мn с относительной ошибкой 2-3%. В этом случае Мn(II) окисляют на платиновом аноде в растворе сульфата натрия до МnO2. Выделившиеся при этом ионы водорода титруют электрогенерированными ионами ОН–. Конечную точку титрования находят с помощью метилового красного.
Фотометрические методы
Фотометрические методы определения марганца основаны на измерении оптической плотности растворов, содержащих ион Мn04, пирофосфатомарганцевую кислоту или комплексные соединения марганца с органическими реагентами.
Определение марганца по окраске иона Мn04–
Интенсивность фиолетово-красной окраски иона Мn04– пропорциональна концентрации марганца в растворе. Перманганат-ион имеет два максимума поглощения при 525 (ε = 2230) и 545 нм (ε = 2420). Окисление Mn(II) до MnO4– персульфатом аммония проводят при температуре кипения в фосфорно-азотнокислой среде в присутствии катализатора. Концентрация Н3Р04 должна быть не меньше 0,1 М, a HN03 ~ 0,3 N, более высокая концентрация кислот нежелательна.
Определению марганца мешают ионы хлора, которые удаляют упариванием с H2S04, или связывают в малодиссоциирующее соединение с помощью сульфата ртути, а также окислением до Сl2. Допустимы крайне малые количества бромидов и иодидов. Cr(VI) также мешает определению марганца. В этом случае калибровочный график для марганца строят в присутствии определенного количества хрома. Содержание марганца при этом определяют измерением оптической плотности испытуемого раствора при 575 нм. Точность – 0,02 отн.%. Влияние Cr(VI) можно устранить измерением оптической плотности раствора относительно исходного раствора, в котором Мп04-ион восстановлен до Mn(II) нитритом натрия, раствором селенистой кислоты, сульфитом или тиосульфатом натрия. Этим методом можно определить до 2% марганца с ошибкой 1-2 отн.%.
Определение марганца в присутствии ионов Ni(II), Со(II), Fe(III) необходимо проводить по калибровочному графику, построенному для растворов, имитирующих состав исследуемых растворов. Ошибка определения 16-20 мг Мn не превышает 0,5%, при содержании марганца ≤2 мг ошибка достигает 4 отн.%.
В присутствии больших количеств Ti(IV) марганец рекомендуют определять окислением Mn(II) до Мn04 периодат-ионом, таи как в случае применения персульфата аммония появляется желтая окраска перекисного комплекса титана. Окисленные растворы перманганата устойчивы 24 часа при комнатной температуре в присутствии избытка персульфата аммония. Относительная ошибка определения 0,05-5 мг Мn в отсутствие мешающих веществ не превышает 1%.
К анализируемому раствору образца, содержащему 0,005-5 мг Мn, добавляют 5 мл раствора, (75 г HgSO4 в 400 мл конц. HN03 и 200 мл воды. К этому раствору добавляют 200 мл 85%-ной Н3РО4 и 0,035 г AgN03. Весь раствор доводят до объема 1 л). Смесь разбавляют до 90 мл, добавляют 1 г персульфата аммония и в течение 2 мин. доводят раствор до кипения. Затем охлаждают, разбавляют водой до 100 мл и измеряют оптическую плотность при 525 или 545 нм.
Описанный метод применяют для определения марганца в сталях, чугунах, рудах, в горных породах, различных сплавах, мартеновских шлаках, соединениях тория, никеле, алюминии, биологических материалах, воде, почвах и др. При определении марганца в едких щелочах предварительно экстрагируют диэтилдитиокарбаминатный комплекс Mn(II), а затем разрушают его и окисляют Мn(II) до М(VII) персульфатом аммония. Чувствительность метода 1 ×10-6%. Простой метод определения марганца в серебре высокой чистоты состоит в осаждении серебра в виде AgCl и определении Мn в фильтрате с чувствительностью 10-4-10-5% и относительной ошибкой 2-7%. Определение марганца в уране основано на отделении последнего экстракцией смесью ТБФ и СС14 и измерении оптической плотности водного раствора при 525 нм после окисления Mn(II) до Mn(VII). Метод позволяет определять до 2 мкг Мn/г при навеске урана 2 г. Определение больших количеств марганца производят дифференциальным фотометрическим методом.
Применение перйодата калия или натрия для окисления Mn(II) дает возможность с высокой точностью и более надежно определять марганец в различных объектах. Впервые этот метод для определения марганца был предложен в 1917 г. Растворы получают более устойчивыми, чем при окислении персульфатом аммония. Реакция протекает довольно быстро в горячем растворе, содержащем HN03 или H2S04. Для ускорения этой реакции применяют соли серебра.
При анализе растворов, содержащих железо, добавляют фосфорную кислоту, которая обесцвечивает желтую окраску ионов Fe(III), а также предотвращает возможное осаждение периодата или иодата марганца. При малых концентрациях марганца определение рекомендуют проводить в 2 N H2S04, а при больших – в 3,5 N H2S04. Определению марганца мешают восстановители и хлорид-ионы. Допустимо присутствие 50-кратных количеств Cu(II), Ni(II) и 20-100- кратных количеств Со(II). Однако можно достигнуть полной компенсации окраски любых количеств этих примесей, применяя в качестве раствора сравнения испытуемый раствор, в котором Mn(VII) восстановлен до Mn(II) нитритом натрия. Такой способ дает хорошие результаты даже при количествах Сu, Ni, Со и Сг в 200-300 раз превышающих содержание марганца. Этот прием используют при определении содержания марганца в соединениях тория, сталях, манганиновых сплавах.
Восстановление ионов Мn04 в растворе сравнения проводят комплексоном III. В этом случае определению не мешают ионы Zn(II), Al(III), Mg(II), K(I), Na(I), Mo(VI) и SiO32-. Метод применяют при анализе стекол. Очень большие количества железа не мешают в серно-фосфорнокислой среде. Влияние ионов Fe(II), сульфитов, нитритов, бромидов, иодидов, оксалатов можно устранить упариванием исследуемого раствора с HN03 или смесью HN03 и H2S04. В присутствии значительных количеств сурьмы, олова и висмута возможно помутнение раствора в результате гидролиза их солей. В этом случае растворы после разведения фильтруют и затем производят окисление Мn(II). При анализе цериевых руд влияние желтой окраски ионов Ce(IV) устранить не удается. Определению марганца мешают ионы V(V), As(III), U(VI), не мешают ионы As(V), Sb(III), бората, фторида, перхлората, пирофосфата.
К 100 мл исследуемого раствора, содержащего 0,1-1 мг Мn, помещенного в коническую колбу, прибавляют 20 мл конц. HN03, 10 мл конц. H2SO4, 5-10 мл конц. Н3РО4 и 0,3-0,5 г KJO4. Раствор нагревают до кипения и выдерживают при температуре, близкой к кипению, в течение 10 мин, затем охлаждают и переносят раствор в мерную колбу. Доводят объем раствора до метки и измеряют оптическую плотность раствора.
Описанным методом определяют содержание марганца от тысячных долей процента до целых процентов. При содержании МnО 6,5-1,3% погрешность составляет 3,5-6,0 отн.%, а при содержании МnО 1,3-0,065% – 6,0-30 отн.%. Этим методом определено содержание марганца в горных породах и рудах, сталях, воде, воздухе, шлаках, рении и его препаратах, соединениях тория, стеклах, титане, а также в лунных породах.
В металлическом титане марганец определяют без концентрирования, если содержание его равно тысячным долям процента; при более низком содержании марганца производят его концентрирование осаждением диэтилдитиокарбаминатом натрия из цитратных растворов при pH=6 с последующим вытеснением ионами цинка и окислением в присутствии AgN03. Абсолютная ошибка метода при содержании 0,0001-0,001% Мn составляет 0,0001%.
Ниже приведена методика определения марганца в воде окислением Mn(II) до Mn(VII) двуокисью свинца.
К 200-500 мл анализируемой воды прибавляют 10 мл конц. HN03, смесь упаривают до ~ 10 мл, к остатку добавляют 1 г Рb02 и кипятят несколько минут. Прозрачный раствор фиолетового цвета декантируют и измеряют оптическую плотность при 525 нм. Определению мешают Fe(III) (>1 мг/л).Для связывания Fe(III) к пробе прибавляют 10 мл H3PO4.
Для окисления Mn(II) до Mn(VII) применяют перекись серебра Ag202. Метод позволяет определять малые содержания марганца (≤1×10-4%). В качестве окислителей используют перекисные комплексные соединения Ag(III), такие как [Ag(J06)2]7- и [Ag(Te06)2]9-. Лучшие результаты получены при использовании [Ag(J06)2]7-. Метод менее продолжителен, а окраска более устойчива, чем при окислении персульфатом аммония, периодатом калия или перекисью серебра. Для окисления Mn(II) до Mn(VII) в слабокислой среде применяют перксенонат натрия (Na4Xe06× x Н20). Реакцию окисления можно записать в следующем виде:
Na4Xe06 + Н20 = 4Na+ + ОН– + НХеО63-,
НХеО63- + 2Мn2+ + 9Н+ = 2МnО4– + 5ХеО3+ + 7Н20.
Окраска раствора устойчива в течение 3 час. Этот метод применяют для спектрофотометрического определения содержания марганца при 525 нм в металлическом уране, его окислах и сплавах.
Показано, что гексанитратоцериат аммония в присутствии 0,5-2 N HN03 и Ag(I) (катализатора) количественно окисляет Мn(II) до Mn (VII) при комнатной температуре. Реакцию используют для определения марганца в сталях. Этим методом возможно определение 0,00033-0,02 мг Мn 1мл.
Определение марганца по окраске пирофосфатомарганцевой кислоты
Пирофосфатомарганцевая кислота образуется при окислении Мn(II) броматом калия на холоду в присутствии пирофосфорной кислоты. Максимум светопоглощения раствора наблюдается при 520 нм (ε = 800). Этим методом определено содержание марганца в горных породах, марганцево-магниевых ферритах, стали, ферромарганце.
Хромат калия быстро и количественно окисляет Mn(II) до Mn(III) в фосфорно-сернокислой среде с образованием окрашенного фосфатного комплекса. На этом основан фотометрический метод титрования марганца раствором К2Сr04 при 510 нм.
К анализируемому раствору, содержащему 1-25 мг Mn(II), прибавляют 2 мл конц. H2SO4 и 15-20 мл конц. Н3РO4, разбавляют водой до 50 мл и титруют 0,1 N К2Сr04 при 510 нм. Кривая титрования имеет четкий излом.
Люминесцентные методы
гравиметрический марганец титрование люминесцентный
Люминесцентные методы определения марганца с применением органических реагентов малочувствительны и малочисленны. Можно упомянуть определение марганца с помощью 8-оксихинолина и койевой кислоты. Чувствительность определения в УФ 0,03 мкг Мn. Метод применяют для обнаружения марганца на бумажных хроматограммах. Синий цвет флуоресценции при ультрафиолетовом освещении наблюдается при взаимодействии марганца с 0,2%-ным спиртовым раствором кверцетина. Чувствительность 5×10-3 мкг Мn.
Определение марганца методом приготовления кристаллофосфоров. Кристаллофосфор, приготовленный из вольфрамового ангидрида, карбонатов лития и магния и активированный марганцем, имеет ярко-красную флуоресценцию, интенсивность которой зависит от концентрации марганца. Спектр флуоресценции литий- магний – вольфраматного кристаллофосфора, активированного марганцем, представляет собой бесструктурную полосу с максимумом 668 нм. Для количественного определения марганца использован метод фотографирования флуоресценции полученных кристаллофосфоров совместно с заранее приготовленной шкалой и фотометрирования возникших на фотопластинке пятен. Метод весьма специфичен. Другие ионы в количестве до 2 мкг практически не мешают определению марганца. Чувствительность определения 1×10-8% при навеске 10 г (воды или кислоты). Ошибка определения не превышает ±30%. Этот способ использован для определения марганца в воде и соляной кислоте.
Для определения марганца используют кристаллофосфор Sb204-Mn. Тетраокись сурьмы исключительно чувствительна к примеси марганца. Оранжево-красная полоса излучения (500-632-800 нм) отчетливо обнаруживается уже при содержании 1×10-7 Mn/г. Марганец определяют визуальным сравнением флуоресценции испытуемых и эталонных образцов. Сильными гасителями люминесценции Sb204 – Мn являются Fe(III), Zn(II), Ni(II), Co(II), Pb(II), Cu(II). Увеличивают яркость свечения окислы бора, фосфора и мышьяка.
Метод используют для определения марганца в воде, кислотах (HСl, HN03, H2S04, CH3COOH). Добавка В203 к Sb204 повышает воспроизводимость и чувствительность метода, не оказывая влияния на форму и положение полосы излучения фосфора. При термическом высвечивании кристаллофосфора, изготовленного из ортофосфата кадмия и активированного марганцем, обнаруживается ряд пиков красной люминесценции с lmax = 617 нм. Интенсивность пика, соответствующего 16° С, пропорциональна концентрации марганца, что используется для определения его микроколичеств в ортофосфате кадмия.
Xемилюминесцентные методы. Силоксеи в солянокислой среде с перманганатом калия дает сильное оранжево-красное свечение. Сумма света хемилюминесценции прямо пропорциональна количеству перманганат-иона.
Наибольший выход света наблюдается в соляной кислоте, причем сумма свечения практически не зависит от ее концентрации в пределах 0,1-3 N. Максимальное почернение пластинки происходит при содержании 0,02-0,03 г силоксена в 10 мл общего объема. Чувствительность определения составляет 0,1-1 мкг Мn/0,5 мл. Относительная ошибка ±15%. Показана возможность определения Mn(II) после окисления его до Мn04 персульфатом аммония в присутствии нитрата серебра.
В ячейки микрокюветы вводят по 0,25 мл 0,4 N НСl, бидистиллата и различные количества 0,5×10-4 М KMnO4. Затем в темной комнате микрокювету устанавливают на фотопластинку и в каждую ячейку прибавляют силоксен. По калибровочному графику находят содержание марганца в анализируемом растворе.
Силоксен используют также в качестве хемилюминесцентного индикатора при цериметрическом определении марганца.
Предложен метод определения марганца, основанный на измерении хемилюминесценции, возникающей при окислении люминола перекисью водорода в присутствии о-фенантролина и цитрата натрия. Соединения марганца катализируют эту реакцию. На интенсивность свечения мало влияет порядок смешения реагентов и степень окисления марганца. Чувствительность определения 0,005 мкг Мn!мл. Определению марганца мешают соли Fe(III), Co(II), Сг(III).
К анализируемому раствору, содержащему 0,05-5 мкг Мn, добавляют 0,5 мл очищенной экстракцией смеси растворов 0,3 М цитрата натрия, 0,3 М NH4Cl и 0,6 М NH4OH, столько же 0,01 М раствора о-фенантролина и 0,003 М раствора люминола и воду до объема 14,5 мл. После этого добавляют 0,5 мл 0,3 М раствора перекиси водорода и через 5 мин. измеряют интенсивность хемилюминесценции. Содержание марганца находят по калибровочному графику.
Определение микроколичеств марганца возможно по его каталитическому влиянию на свечение люцигенина в присутствии Н202 в щелочной среде. Суммарное свечение определяется фотографическим методом по почернению фотопластинки. Максимальная интенсивность свечения наблюдается при pH ~ 12,5-13, концентрации Н202 ≥ 4-10-2 М и концентрации люцигенина 10-6 М (свечение в холостом опыте почти не наблюдается).
Заключение
Расширение объектов исследования и все возрастающие требования современной промышленности к чистоте материалов и к комплексному использованию сырья привели к разработке новых, более точных, быстрых и высокочувствительных методов определения марганца. Наиболее существенным достижением в аналитической химии марганца явилось использование нейтронно-активационного метода. Благодаря высокому значению поперечного сечения реакции радиационного захвата тепловых нейтронов природным изотопом 55Мn, этот метод позволяет определять марганец из очень малых количеств исследуемых проб и без их разрушения.
Список используемой литературы
1. Аналитическая химия. В 2 кн. Кн. 2 : Физико-химические методы анализа : учеб. для студ. вузов, обучающихся по химико-технол. спец. / В. П. Васильев. – 6-е изд., М. : Дрофа, 2007. – 383.
. Аналитическая химия марганца. А.К. Лаврухина, Л.В. Юкина. М.: «Наука», 1974. -216.
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 –
амфотерные, +6, +7 – кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 – пиролюзит
- MnO(OH) – бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 – браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо
восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие
соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если
выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Mn(NO3)2 = (t) MnO2 + NO2
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.

В реакциях с щелочами марганец переходит в СО +6, в кислой среде – принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда – щелочная)
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца (VI) – MnO3, H2MnO4 – неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли – манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4 + H2O

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца (VII) – неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 – проявляют
кислотные свойства. Соли марганцовой кислоты – перманганаты.
В различных средах – кислотной, нейтральной и щелочной – марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
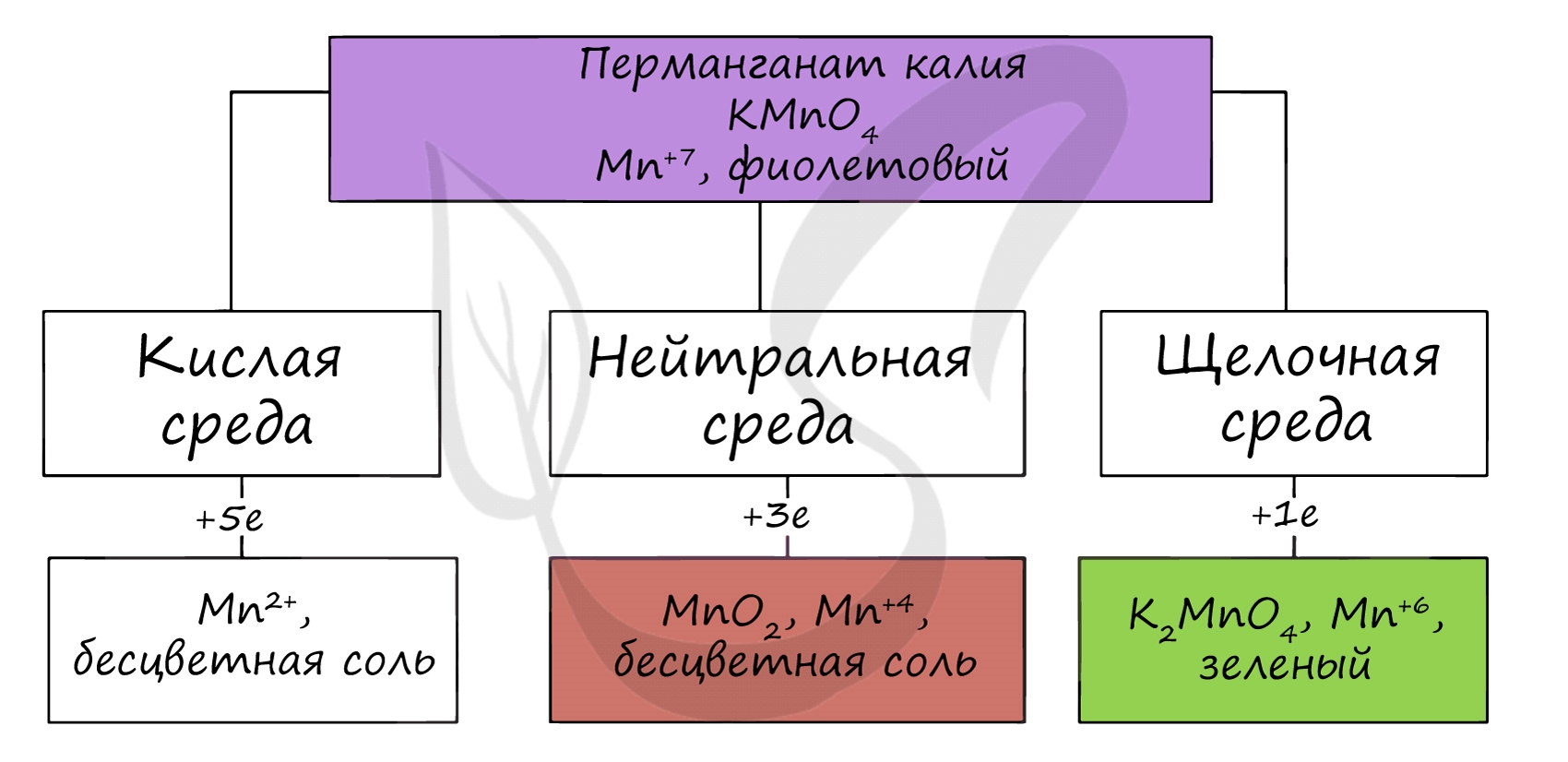
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты – перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту – марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) – Mn2+, в щелочной – Mn6+.
KMnO4 + H2O2 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke – зубец. С древнейших времен известен сплав
меди с цинком – латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS – цинковая обманка, сфалерит
- ZnO – цинкит
- ZnCO3 – симсонит, цинковый шпат
- 2ZnO*SiO2*H2O – гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка
различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком 🙂
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
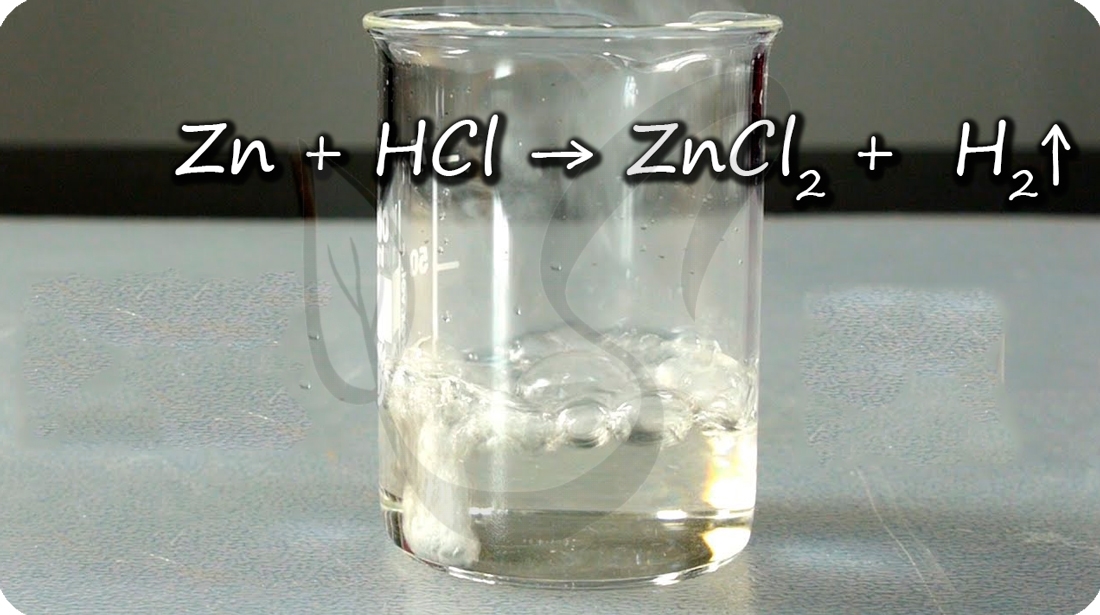
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями.
При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или
при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов.
При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра – аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.


![{displaystyle {ce {Mn{}+2H2O->[^{circ }t]Mn(OH)2{}+H2uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12d72ac7a850fbf2fb0a137b2000ceaaff482a61)





![{displaystyle {ce {2KMnO4->[^{circ }t]K2MnO4{}+MnO2{}+O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b6b513a4b27d4fcd10197c138653ec9021c55980)


![{displaystyle {ce {2 Na + Mn2{}(CO)10{}-> 2 Na[Mn(CO)5{}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/99c1eed8a87d9cfa0c2b98d15b5aadd576ab15f1)









