Характеристика фосфора
Положение в ПСХЭ
Фосфор (P) располагается во 3 периоде, в V группе, главной подгруппе, имеет порядковый номер 15.
Атомные числа
A (массовое число) = 31
P (число протонов) = 15
N (число нейтронов) = A – Z = 31 – 15 = 16
ē (число электронов) = 15
Электронное строение атома
P
+15
2
8
5
15P 1s2 2s2 2p6 3s2 3p3
Валентные электроны
| 15P | ↑↓ | ↑ | ↑ | ↑ | ||||||||
| 3s | 3p | 3d |
| 15P* | ↑ | ↑ | ↑ | ↑ | ↑ | |||||||
| 3s | 3p | 3d |
Степени окисления
минимальная: -3
максимальная: +5
Свойства простого вещества
Фосфор – p-элемент, неметалл.
Высший оксид
P2O5 – оксид фосфора (V).
Проявляет кислотные свойства:
P2O5 + 6NaOH ⟶ 2Na3PO4 + 3H2O
Высший гидроксид
H3PO4 – ортофосфорная кислота.
Проявляет кислотные свойства:
H3PO4 + 3NaOH ⟶ Na3PO4 + 3H2O
Водородное соединение
PH3
| Фосфор | |||
|---|---|---|---|
| ← Кремний | Сера → | |||
|
|||
| Внешний вид простого вещества | |||

Образцы жёлтого, красного и фиолетового фосфора |
|||
| Свойства атома | |||
| Название, символ, номер | Фосфор/ Phosphorus (P), 15 | ||
| Группа, период, блок |
15 (устар. 5), 3, p-элемент |
||
| Атомная масса (молярная масса) |
30,973762(2)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ne] 3s2 3p3, 1s22s22p63s23p3 |
||
| Радиус атома | 128 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 106 пм | ||
| Радиус иона | 35 (+5e) 212 (-3e) пм | ||
| Электроотрицательность | 2,19 [2] (шкала Полинга) | ||
| Электродный потенциал | 0 | ||
| Степени окисления | −3[3], -1, 0, +1, (+2), +3, +5 | ||
| Энергия ионизации (первый электрон) |
1011,2(10,48) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | (белый фосфор)1,82 г/см³ | ||
| Температура плавления | 44,15 °C (317,3 K) | ||
| Температура кипения | 279,85 °C (553 K) | ||
| Уд. теплота плавления | 2,51 кДж/моль | ||
| Уд. теплота испарения | 49,8 кДж/моль | ||
| Молярная теплоёмкость | 21,6[4] (ромбич.) Дж/(K·моль) | ||
| Молярный объём | 17,0 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Кубическая, объёмноцентрированная | ||
| Параметры решётки | 18,800 Å | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) (0,236) Вт/(м·К) | ||
| Номер CAS | 7723-14-0 |
Фо́сфор (химический символ — P, от др.-греч. φῶς — свет и φέρω — несу, φωσφόρος — светоносный; также от лат. Phosphorus) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы, VA) третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 15.
Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л[5]. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3 (F,Cl,OH), фосфорит (Сa3(PO4)2) и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
История[править | править код]
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для его добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не начнёт испускать зловоние, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.

Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Аморфную аллотропную модификацию фосфора — красный фосфор Pn — выделил, нагревая белый фосфор без доступа воздуха, А. Шрёттер в середине XIX в.
В 1865 году Гитторф охлаждением красного фосфора в расплавленном свинце получил, как полагали, новую кристаллическую модификацию, которую назвали фиолетовой. Эта модификация была построена из группировок P8 и P9, связанных мостиковыми атомами фосфора в трубки. Однако в настоящее время считается, что фиолетовый фосфор — это крупнокристаллическая модификация красного.
Происхождение названия[править | править код]
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φώς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Физические свойства[править | править код]
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропных модификаций. Все существующие аллотропные модификации фосфора пока (2021 г.) до конца не изучены. Традиционно различают три его модификации: белый, красный, чёрный. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих трёх. При стандартных условиях устойчивы только две аллотропические модификации фосфора, например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный.

Белый фосфор[править | править код]
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.

Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра[6]. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствие воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде[6], но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой[7].
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г[4], а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей[4]. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги[8][9].
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде[6], а также под действием ионизирующего излучения[10] белый фосфор превращается в красный фосфор.
Жёлтый фосфор[править | править код]
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Плотность 1,83 г/см³, плавится при 43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зелёным пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10[11].
Так как фосфор реагирует с водой лишь при температуре свыше 500 °C, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твёрдое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (или в форме водного раствора хлорида кальция)[12].
Красный фосфор[править | править код]

Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом, в который входит красный фосфор, покрыта тёрочная поверхность спичечных коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор[править | править код]
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8⋅106 Па.
Химические свойства[править | править код]
Химическая активность фосфора значительно выше, чем у азота. При этом тенденция к образованию кратных связей у фосфора выражена слабее, чем у азота. Это объясняется тем, что две одинарные связи (δ + δ) имеют большую энергию, чем одна двойная (δ + π), а три одинарные (δ + δ + δ) — большую, чем одна тройная (δ + π + π). Поэтому фосфор не образует соответствующие аналоги соединений и ионов азота с кратными связями (N2, NO, N3–, N2+). Особенностью фосфора, с другой стороны, является способность образовывать цепочечные и кластерные структуры[13]. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворённом состоянии, а также в парах до 800 °С фосфор состоит из молекул 
.
При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами[править | править код]
Фосфор легко окисляется кислородом:
(с избытком кислорода),
(при медленном окислении или при недостатке кислорода).
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
.
фосфиды разлагаются водой и кислотами с образованием фосфина.
C неметаллами — восстановитель:
,
.
С водородом фосфор практически не соединяется. Однако вода разлагает некоторые фосфиды по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — 
Взаимодействие с водой[править | править код]
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
.
Реакция взаимодействия красного фосфора и воды с образованием ортофосфорной кислоты и водорода. Реакция протекает при температуре 700—900 °C. Катализатором могут выступать: платина, медь, титан, цирконий [1]:
.
Взаимодействие со щелочами[править | править код]
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования с образованием фосфина[14]:
.
Восстановительные свойства[править | править код]
Сильные окислители превращают фосфор в фосфорную кислоту:
,
.
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
.
Получение[править | править код]
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
,
или:
.
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
.
Применение[править | править код]
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Изотопы[править | править код]
Известно более 20 изотопов фосфора (с массовым числом от 24 до 47). Природный изотоп 31P стабилен. Из радиоактивных изотопов наиболее долгоживущие: 30P (T1/2 = 2,5 мин), 32P (T1/2 = 14,26 суток) и 33P (T1/2 = 25,34 суток)[15].
Элементарный фосфор[править | править код]
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве[править | править код]
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности[править | править код]
Фосфаты широко используются:
- в качестве комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии, например, так называемый состав «мажеф»).
Фосфатные связующие[править | править код]
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Биологическая роль соединений фосфора[править | править код]
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)2·Ca(OH)2, составляющего также основу и зубной эмали. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г;
- для беременных и кормящих женщин 3—3,8 г;
- для детей и подростков 1,5—2,5 г.
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приёме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Некоторые источники[16]:
| Продукт | Содержание, мг/100 г |
|---|---|
| Очищенное конопляное семя | 1650 |
| Семена тыквы (ядра) | 1233 |
| Семена подсолнечника (ядра) поджаренные | 1158 |
| Семена мака | 870 |
| Горчичный порошок | 828 |
| Кунжут (очищенный) | 774 |
| Семена дыни (ядра) | 755 |
| Какао-порошок | 734 |
| Твёрдый пармезан | 694 |
| Семена подсолнечника (ядра) сушёные | 660 |
| Сафлора семена (ядра) | 644 |
| Семена льна | 642 |
| Семена лотоса | 626 |
| Сыр швейцарский нежирный | 605 |
| Кешью сырые | 593 |
| Орехи пили | 575 |
| Амарантовая крупа | 557 |
| Сыр гауда | 546 |
| Овёс | 523 |
| Грецкий орех чёрный | 513 |
| Печень говяжья тушёная | 497 |
| Фисташки сырые | 490 |
| Миндаль | 481 |
| Киноа | 457 |
| Люпин, семена | 440 |
| Карп | 415 |
| Фасоль | 407 |
| Арахис | 397 |
| Сыр рокфор | 392 |
| Мука из цельного зерна | 357 |
| Печень куриная | 297 |
| Вырезка свиная | 286 |
| Желтоперый тунец | 278 |
| Сгущённое молоко | 253 |
| Яйцо | 198 |
| Говядина | 188[17] |
| Курица | 178 |
Токсикология элементарного фосфора[править | править код]
Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в лёгкие, вызывает пневмонию при хроническом действии.
Белый фосфор очень ядовит, растворим в липидах. Летальная доза белого фосфора для человека (в зависимости от его веса) — 15—150 мг. Попадая на кожу, белый фосфор даёт тяжёлые ожоги, а также может проникать в организм через поражения кожи, вызывая сильное отравление.
Острые отравления белым фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать поражённые участки растворами медного купороса или соды.
ПДК паров жёлтого фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³[18] .
Токсикология соединений фосфора[править | править код]
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15—100 мг/кг) и чрезвычайно высокой (<15 мг/кг) токсичности большинство фосфорорганических соединений (ФОС) используются в качестве пестицидов (инсектициды, акарициды, зооциды и т. д.) или боевых отравляющих веществ. Примером боевых отравляющих веществ являются — зарин, зоман, табун, новичок, V-газы.
ФОС проявляют свойства веществ нервно-паралитического действия. Токсичность фосфорорганических соединений обусловлена ингибированием фермента ацетилхолинэстеразы, вследствие чего развивается головная боль, тошнота, головокружение, сужение зрачков (миоз), затруднение дыхания (одышка), возникает слюнотечение, понижается артериальное давление, возникают конвульсии, проявляется паралитическое воздействие, кома, и как следствие может быстро возникнуть летальный исход. Эффективным антидотом при отравлении ФОС является атропин.
Опасность для здоровья[править | править код]
Рейтинг NFPA 704:

Фосфор жёлтый элементарный относится к 1-му классу опасности.
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Phosphorus: electronegativities (англ.). WebElements. Дата обращения: 15 июля 2010. Архивировано 7 января 2010 года.
- ↑ Sulfur and Phosphorus Compounds (англ.). Дата обращения: 27 января 2010. Архивировано из оригинала 13 февраля 2010 года.
- ↑ 1 2 3 Редкол.:Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 145.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ 1 2 3 Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 30. Фосфор // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 62—65. — 2 350 000 экз.
- ↑ Горение белого фосфора под водой Архивная копия от 17 июня 2016 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Kemal T. Saracoglu, Ahmet H. Acar, Tamer Kuzucuoglu, Sezer Yakupoglu. White phosphorus burn (англ.) // The Lancet. — 2010. — Vol. 376, no. 9734. — P. 68. — doi:10.1016/S0140-6736(10)60812-4.
- ↑ Chou TD, Lee TW, Chen SL, Tung YM, Dai NT, Chen SG, Lee CH, Chen TM, Wang HJ. The management of white phosphorus burns (англ.) // Burns. — 2001. — Vol. 27, iss. 5. — P. 492—497. — doi:10.1016/S0305-4179(01)00003-1. — PMID 11451604.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑
Шретер В., Лаутеншлегер К.-Х., Бибрак Х. и др. Химия = Chemie. — М.: Химия, 1989. — С. 351. — ISBN 5-7245-0360-3. - ↑ Химическая энциклопедия / Редкол.: Зефиров Н. С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- ↑ Под ред. Ю.Д. Третьякова. Неорганическая химия: в 3 т. — Москва: Издательский центр «Академия», 2004. — Т. 2. — С. 156.
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.

- ↑ USDA. Дата обращения: 31 декабря 2015. Архивировано 1 марта 2014 года.
- ↑ Буланов Ю. Б. Химический состав продуктов. Пищевая ценность.
- ↑ УНИАН — здоровье — Что происходит с фосфором? Дата обращения: 26 мая 2010. Архивировано 23 мая 2013 года.
Ссылки[править | править код]
- Взрыв фосфора с калиевой селитрой (видео) (недоступная ссылка с 14-04-2018 [1859 дней])
- Фосфорная луна — Опыт с белым фосфором
- Фосфор, учебный фильм
- Фосфор на Webelements
- Фосфор в Популярной библиотеке химических элементов
Содержание
- Строение атома фосфора
- Общие сведения о строении атома фосфора
- Электронное строение атома фосфора
- Примеры решения задач
- Фосфор и его характеристики
- Общая характеристика фосфора
- Атомная и молекулярная масса фосфора
- Аллотропия и аллотропные модификации фосфора
- Изотопы фосфора
- Ионы фосфора
- Молекула и атом фосфора
- Примеры решения задач
- Фосфор, свойства атома, химические и физические свойства
- Фосфор, свойства атома, химические и физические свойства.
- Атом и молекула фосфора. Формула фосфора. Строение атома фосфора:
- Изотопы и модификации фосфора:
- Свойства фосфора (таблица): температура, плотность, давление и пр.:
Строение атома фосфора
Общие сведения о строении атома фосфора
Относится к элементам p-семейства. Неметалл. Обозначение – P. Порядковый номер – 15. Относительная атомная масса – 30,974 а.е.м.
Электронное строение атома фосфора
Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов.
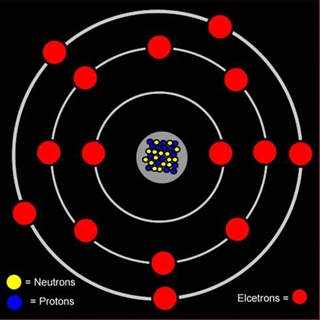
Рис.1. Схематическое строение атома фосфора.
Распределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
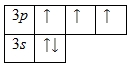
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
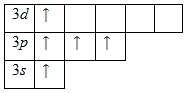
Именно поэтому для фосфора также характерна степень окисления +5.
Примеры решения задач
| Задание | Определите число нейтронов в ядре изотопа титана с массовым числом 48. |
| Решение | Массовое число А указывает суммарное число протонов Z и нейтронов в ядре атома любого элемента: |
Атом титана имеет порядковый номер 22, следовательно, количество протонов в ядре равно 22 (Z=22). Тогда число нейтронов в ядре атома титана определим по формуле:
n= A- Z =.48 -22 = 26.
Ответ n = 26
| Задание | Элемент состоит из двух изотопов в соотношении 2:3. Ядро первого изотопа содержит 10 протонов и 10 нейтронов. Определите атомную массу второго изотопа, если средняя относительная масса элемента равна 21,2. В ответе укажите на сколько нейтронов больше в ядре атома второго изотопа. |
| Решение | Относительная атомная масса первого изотопа равна: |
A1 = Z +n = 10 + 10 = 20 а.е.м.
Относительную атомную массу второго изотопа обозначим через A2.
Средняя относительная атомная масса элемента определяется суммой масс его изотопов с учетом их количества. Составим уравнение:
В ядре атома второго изотопа 10 протонов, следовательно, число, нейтронов будет равно n= A- Z =.22 — 10= 12. По условию задачи в ядре атома первого изотопа было 10 нейтронов. Значит, ядро атома второго изотопа содержит на два нейтрона больше, чем ядро первого изотопа.
Источник
Фосфор и его характеристики
Общая характеристика фосфора
Фосфор принадлежит к числу довольно распространенных элементов; содержание его в земной коре составляет около 0,1% (масс.). Вследствие легкой окисляемости фосфор в свободном состоянии в природе не встречается.
Из природных соединений фосфора самым важным является ортофосфат кальция Ca3(PO4)2, который в виде минерала фосфорина иногда образует большие залежи. Часто встречается также минерал апатит, содержащий кроме Ca3(PO4)2, еще CaF2 или CaCl2.
Атомная и молекулярная масса фосфора
Значения атомной и молекулярной масс фосфора совпадают; они равны 30,9737.
Аллотропия и аллотропные модификации фосфора
Фосфор образует несколько аллотропических модификаций.
Белый фосфор получается в твердом состоянии при быстром охлаждении паров фосфора; его плотность 1,83 г/см 3 . В чистом виде белый фосфор совершенно бесцветен и прозрачен (рис. 1). На холоду хрупок, но при температуре выше 15 o С становится мягким и легко режется ножом.
На воздухе белый фосфор очень быстро окисляется и при этом светится в темноте. Уже при слабом нагревании, для чего достаточно просто трения, фосфор воспламеняется и сгорает. Имеет молекулярную кристаллическую решетку, в узлах которой находятся тетраэдрические молекулы P4. Сильный яд.

Рис. 1. Аллотропные модификации фосфора. Внешний вид.
Если белый фосфор нагреть до температуры 250-300 o С он переходит в другую модификацию имеющую красно-фиолетовую окраску и называемую красным фосфором. Это превращение происходит очень медленно и под действием света.
Красный фосфор по своим свойствам сильно отличается от белого: медленно окисляется на воздухе, не светится в темноте, загорается только при 260 o С и неядовит.
При сильном нагревании красный фосфор, не плавясь, испаряется (сублимируется). При охлаждении паров получается белый фосфор.
Черный фосфор образуется из белого при нагревании его до 200-220 o С под очень высоким давлением. По виду он похож на графит, жирен на ощупь и тяжелее других модификаций. Полупроводник.
Изотопы фосфора
Известно, что в природе фосфор находится в виде единственного изотопа 31 P (23,99%). Массовое число равно 31. Ядро атома изотопа фосфора 31 P содержит пятнадцать протонов и шестнадцать нейтронов.
Существуют искусственные изотопы фосфора с массовыми числами от 24-х до 46-ти, среди которых наиболее стабильным является 32 P с периодом полураспада равным 14 суток.
Ионы фосфора
На внешнем энергетическом уровне атома фосфора имеется пять электронов, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 3 .
В результате химического взаимодействия фосфор может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
Молекула и атом фосфора
Молекула фосфора одноатомна — Р. Приведем некоторые свойства, характеризующие атом и молекулу фосфора:
Энергия ионизации атома, эВ
Радиус атома, нм
Примеры решения задач
| Задание | Вычислите массу фосфора, который надо сжечь в кислороде для получения оксида фосфора (V) массой 3,55 г? |
| Решение | Запишем уравнение реакции горения фосфора в кислороде с образованием оксида фосфора (V): |
Рассчитаем количество вещества оксида фосфора (V) (молярная масса – 284 г/моль):
Согласно уравнению реакции n(P2O5) : n(P) = 2:4, значит:
n(P) = 2 × 0,0125 = 0,025 моль.
Тогда, масса фосфора (молярная масса – 124 г/моль) будет равна:
m(P) = 0,025 × 124 = 3,1г.
Ответ Масса фосфора равна 3,1 г
| Задание | Фосфин можно получить действием соляной кислоты на фосфид кальция. Рассчитайте объем фосфина (н.у.), который образуется из 9,1 г фосфида кальция. Массовая доля выхода продукта составляет 90%. |
| Решение | Запишем уравнение реакции получения фосфина из фосфида кальция: |
Рассчитаем количество вещества фосфида кальция (молярная масса – 182 г/моль):
n(PH3) = 9,1 / 182 = 0,05 моль.
Согласно уравнению реакции n(PH3) : n(Ca3P2) = 2:1, значит:
n(PH3) = 2 × 0,05 = 0,1 моль.
Тогда, объем выделившегося фосфина будет равен:
V(PH3) = 0,1 × 22,4 = 2,24 л.
Учитывая выход продукта реакции, объем фосфина составляет:
V(PH3) = 2,24 × 90/100% = 2,016 л.
Источник
Фосфор, свойства атома, химические и физические свойства

Фосфор, свойства атома, химические и физические свойства.




30,973762(2) 1s 2 2s 2 2p 6 3s 2 3p 3
Фосфор — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 15. Расположен в 15-й группе (по старой классификации — главной подгруппе пятой группы), третьем периоде периодической системы.
Атом и молекула фосфора. Формула фосфора. Строение атома фосфора:
Фосфор (лат. Phosphorus, от др.-греч. φῶς – “свет” и φέρω – “несу”; φωσφόρος – “светоносный”) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением P и атомным номером 15. Расположен в 15-й группе (по старой классификации – главной подгруппе пятой группы), третьем периоде периодической системы.
Фосфор – неметалл. Относится к группе пниктогенов.
Фосфор обозначается символом P.
Как простое вещество фосфор при нормальных условиях представляет собой твёрдое вещество белого, красного, фиолетового, черного или синего цвета. Все модификации фосфора различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный.
Химическая формула фосфора P.
Электронная конфигурация атома фосфора 1s 2 2s 2 2p 6 3s 2 3p 3 . Потенциал ионизации (первый электрон) атома фосфора равен 1011,81 кДж/моль (10,486 686 (15) эВ).
Строение атома фосфора. Атом фосфора состоит из положительно заряженного ядра (+15), вокруг которого по трем оболочкам движутся 15 электронов. При этом 10 электронов находятся на внутреннем уровне, а 5 электронов – на внешнем. Поскольку фосфор расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома фосфора на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – три неспаренных электрона. В свою очередь ядро атома фосфора состоит из 15 протонов и 16 нейтронов. Фосфор относится к элементам p-семейства.
Радиус атома фосфора (вычисленный) составляет 114 пм.
Атомная масса атома фосфора составляет 30,973762(2) а. е. м.
Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Фосфор содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Белый фосфор очень ядовит.
Изотопы и модификации фосфора:
Свойства фосфора (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Фосфор |
| 102 | Прежнее название | |
| 103 | Латинское название | Phosphorus |
| 104 | Английское название | Phosphorus |
| 105 | Символ | P |
| 106 | Атомный номер (номер в таблице) | 15 |
| 107 | Тип | Неметалл |
| 108 | Группа | Пниктоген |
| 109 | Открыт | Хенниг Бранд, Германия , 1669 г. |
| 110 | Год открытия | 1669 г. |
| 111 | Внешний вид и пр. | Твёрдое вещество белого, красного, фиолетового, черного или синего цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | Несколько аллотропных модификаций фосфора, в т.ч.:
– белый фосфор (α-фосфор (α-форма) с кубической объёмно-центрированной кристаллической решёткой и β-фосфор (β-форма) с гексагональной кристаллической решёткой), – синий фосфор |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | Фосфорен |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,099 % |
| 120 | Содержание в морях и океанах (по массе) | 7,0·10 -6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0007 % |
| 122 | Содержание в Солнце (по массе) | 0,0007 % |
| 123 | Содержание в метеоритах (по массе) | 0,11 % |
| 124 | Содержание в организме человека (по массе) | 1,1 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 30,973762(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 3 |
| 203 | Электронная оболочка | K2 L8 M5 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 98 пм |
| 205 | Эмпирический радиус атома* | 100 пм |
| 206 | Ковалентный радиус* | 107 пм |
| 207 | Радиус иона (кристаллический) | P 3+
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 180 пм |
| 209 | Электроны, Протоны, Нейтроны | 15 электронов, 15 протонов, 16 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 15-ая группа (по старой классификации – главная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3 , -2, -1, 0, +1, +2, +3 , +4, +5 |
| 302 | Валентность | III, V |
| 303 | Электроотрицательность | 2,19 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1011,81 кДж/моль (10,486 686 (15) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | 72,037(1) кДж/моль (0,746609(11) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность | 1,823 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – белый фосфор,
≈2,2-2,34г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – красный фосфор, 2,36 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – фиолетовый фосфор, 2,69 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – чёрный фосфор |
| 402 | Температура плавления | 44,15 °C (317,3 K, 111,5 °F) – белый фосфор,
≈590 °C (≈860 K, ≈1090 °F) – красный фосфор |
| 403 | Температура кипения | 280,5 °C (553,7 K , 536,9 °F) – белый фосфор |
| 404 | Температура сублимации | ≈416-590 °C (≈689,2-863 K, ≈780,8-1094 °F) – красный фосфор,
620 °C (893 K, 1148 °F) – фиолетовый фосфор |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,66 кДж/моль – белый фосфор |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 51,9 кДж/моль – белый фосфор |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 23,824 Дж/(K·моль) – белый фосфор |
| 411 | Молярный объём | 16,99054 см³/моль |
| 412 | Теплопроводность | 0,236 Вт/(м·К) (при стандартных условиях ) – белый фосфор,
12,1 Вт/(м·К) (при стандартных условиях ) – красный фосфор, 0,236 Вт/(м·К) (при 300 K) – белый фосфор |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | Белый фосфор α-форма |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 18,800 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | P-1 |
| 517 | Номер пространственной группы симметрии | 2 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 12185-10-3 – белый фосфор,
7723-14-0 – красный фосфор |
205* Эмпирический радиус атома фосфора согласно [3] составляет 128 пм.
206* Ковалентный радиус фосфора согласно [1] и [3] составляет 107±3 пм и 106 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) белого фосфора согласно [3] составляет 2,51 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) белого фосфора согласно [3] составляет 49,8 кДж/моль.
Источник
+938 рейтинг
Определи массовое число изотопа фосфора
.
- определи
- массовое
- число
- изотопа
- фосфора
- физика
- 5 – 9 классы
gegur_zn
в разделе Физика
Всего ответов: 1
+53 рейтинг
Ответ:
31
Объяснение:
Массовое число ядра атома равно числу атомных единиц массы, содержащихся в массе этого ядра.
danylkin3_zn

Определите число протонов, электронов и нейтронов в атомах элементов: натрия, фосфора, золота.

reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. §7. Вопросы и задания. Номер №2
Решение
![]() Получай решения и ответы с помощью нашего бота
Получай решения и ответы с помощью нашего бота
| Элемент | Число протонов (
p + ) = номеру элемента |
Число электронов (
e − ) = номеру элемента |
Число нейтронов (
n 0 ) = массовое число (А) − номер элемента (Z) |
|---|---|---|---|
| Nа (натрий) | 11 | 11 | 23 − 11 = 12 |
| P (фосфор) | 15 | 15 | 31 − 15 = 16 |
| Au (золото) | 79 | 79 | 197−79 = 118 |





