Массовое число Решение
ШАГ 0: Сводка предварительного расчета
ШАГ 1. Преобразование входов в базовый блок
Количество протонов: 11 –> Конверсия не требуется
Количество нейтронов: 6 –> Конверсия не требуется
ШАГ 2: Оцените формулу
ШАГ 3: Преобразуйте результат в единицу вывода
17 –> Конверсия не требуется
25 Структура атома Калькуляторы
Массовое число формула
Массовое число = Количество протонов+Количество нейтронов
A = p++n0
Что такое массовое число атома?
Сумма общего числа электронов и протонов в атоме называется массовым числом атома. Обозначается буквой A. Массовое число всегда целое. Нейтральный атом содержит равное количество электронов и протонов.
If you have a given mass of a compound, you can calculate the number of moles. Conversely, if you know how many moles of the compound you have, you can calculate its mass. For either calculation, you need to know two things: the chemical formula of the compound and the mass numbers of the elements that comprise it. An element’s mass number is unique to that element, and it’s listed right underneath the element’s symbol in the periodic table. The mass number of an element is not the same as its atomic number.
TL;DR (Too Long; Didn’t Read)
The atomic mass number of each element appears under its symbol in the periodic table. It’s listed in atomic mass units, which is equivalent to grams/mole.
Atomic Number and Atomic Mass Number
Every element is characterized by a unique number of positively charged protons in its nucleus. For example, hydrogen has one proton, and oxygen has eight. The periodic table is an arrangement of the elements according to increasing atomic number. The first entry is hydrogen, the eighth is oxygen and so on. The place an element occupies in the periodic table is an immediate indication of its atomic number, or the number of protons in its nucleus.
Besides protons, the nuclei of most elements also contains neutrons. These fundamental particles don’t have a charge, but they have roughly the same mass as protons, so they must be included in the atomic mass. The atomic mass number is the sum of all protons and neutrons in the nucleus. The hydrogen atom may contain a neutron, but it usually doesn’t, so the mass number of hydrogen is 1. Oxygen, on the other hand, has an equal number of proteins and neutrons, which raises its mass number to 16. Subtracting an element’s mass number from its atomic mass tells you the number of protons in its nucleus.
Finding the Mass Number
The best place to look for an element’s atomic mass number is in the periodic table. It’s displayed under the symbol for the element. You might be mystified by the fact that in many versions of the periodic table, this number contains a decimal fraction, which you wouldn’t expect if it was derived simply by adding protons and neutrons.
The reason for this is that the number displayed is the relative atomic weight, which is derived from all the naturally occurring isotopes of the element weighted by the percentage of each that occurs. Isotopes are formed when the number of neutrons in an element is more or less than the number of protons. Some of these isotopes, such as carbon-13, are stable, but some are unstable and decay over time to a more stable state. Such isotopes, such as carbon-14, are radioactive.
Virtually all elements have more than one isotope, so each has an atomic mass that contains a decimal fraction. For example, the atomic mass of hydrogen listed in the periodic table is 1.008, that for carbon is 12.011 and that for oxygen is 15.99. Uranium, with an atomic number of 92, has three naturally occurring isotopes. Its atomic mass is 238.029. In practice, scientists usually round mass number to the nearest integer.
Units for Mass
The units for atomic mass have been refined over the years, and today scientists use the unified atomic mass unit (amu, or simply u). It is defined to be equal to exactly one-twelfth the mass of an unbound carbon-12 atom. By definition, the mass of one mole of an element, or Avogadro’s number (6.02 x 1023) of atoms, is equal to its atomic mass in grams. In other words, 1 amu = 1 gram/mole. So if the mass of one hydrogen atom is 1 amu, the mass of one mole of hydrogen is 1 gram. The mass of one mole of carbon is therefore 12 grams, and that of uranium is 238 grams.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 ноября 2019 года; проверки требуют 4 правки.
Ма́ссовое число́ атомного ядра — суммарное количество протонов и нейтронов (называемых общим термином «нуклоны») в ядре. Обычно обозначается буквой A. Массовое число близко к атомной массе изотопа, выраженной в атомных единицах массы, но совпадает с ней только для углерода-12, поскольку атомная единица массы (а. е. м.) определяется сейчас как 1⁄12 массы атома 12С. Во всех остальных случаях атомная масса не является целым числом, в отличие от массового числа. Так, массовое число изотопа хлора 35Cl равно 35, а его атомная масса составляет 34,96885 а.е.м.
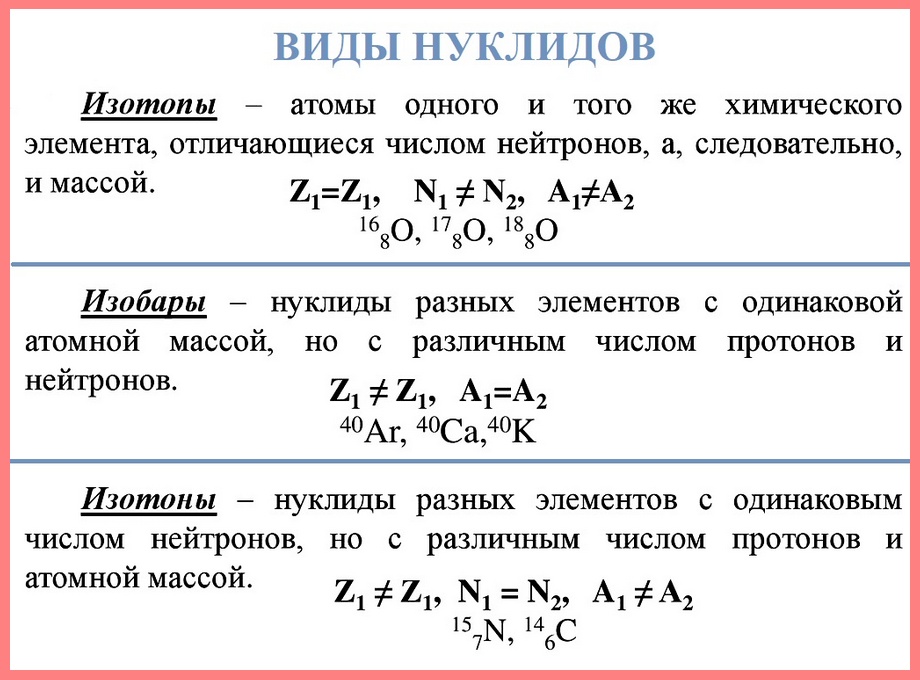
Массовое число в обозначении конкретного нуклида (вида атомных ядер) пишется верхним левым индексом, например 232Th. Нуклиды с одинаковым массовым числом называются изобарами (например, изобарами являются нуклиды 14C и 14N).
Знание массового числа позволяет оценить массу ядра и атома. Если известно массовое число, то масса М атома и его ядра оценивается из следующего соотношения М ≈ А·mN, где mN ≈ 1,67·10−27 кг — масса нуклона, то есть протона или нейтрона. Например, в состав атома алюминия-27 и его ядра входит 27 нуклонов (13 протонов и 14 нейтронов). Его масса примерно равна 27·1,67·10−27 кг ≈ 4,5·10−26 кг. Если необходимо получить массу ядра с большей точностью, то нужно учесть, что нуклоны в ядре связаны силами ядерного притяжения, и поэтому в соответствии с соотношением E = mc2 масса ядра уменьшается. В массу атома также следует добавить суммарную массу электронов на орбитах вокруг ядра. Однако все эти поправки не превышают 1 %[1].
Массовое число совпадает с барионным числом ядра. Барионное число сохраняется во всех известных процессах, поэтому любые радиоактивные распады и ядерные реакции не приводят к изменению суммы массовых чисел ядер в левой и правой части реакции. Например, при альфа-распаде урана-238
в левой части массовое число начального ядра равно 238, в правой части реакции — два ядра с массовыми числами 234 и 4, что в сумме даёт 238. С учётом того, что массовое число альфа-частицы (ядра гелия-4) равно 4, альфа-распад снижает массовое число распадающегося ядра на 4 единицы. Любые типы бета-распада (бета-минус-распад, позитронный распад, электронный захват, все типы двойного бета-распада) не изменяют массовое число, поскольку в этом процессе происходит лишь превращение некоторых нуклонов ядра из одного вида в другой (протонов в нейтроны или обратно). Изомерный переход также не изменяет массовое число ядра.
Примечания[править | править код]
- ↑ «Ишханов Б. С., Капитонов И. М., Кэбин Э. И., Частицы и атомные ядра. Основные понятия, Изд. МГУ, Москва, 2009, 271 с., тираж 100 экз.» Дата обращения: 15 февраля 2011. Архивировано 25 ноября 2012 года.
«Строение атома. Массовое число»
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
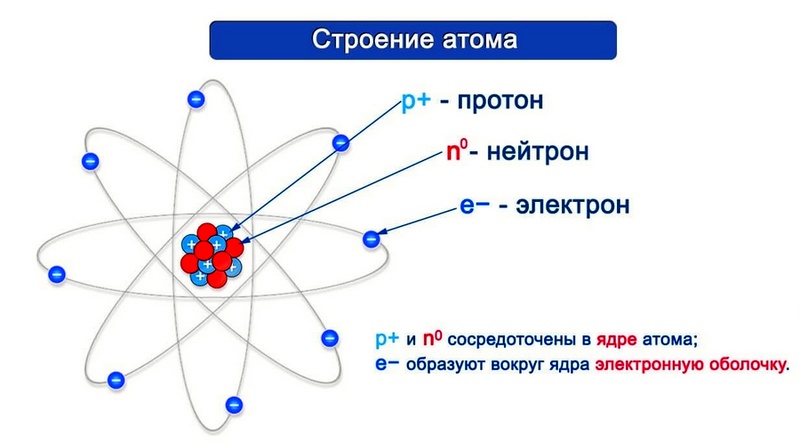
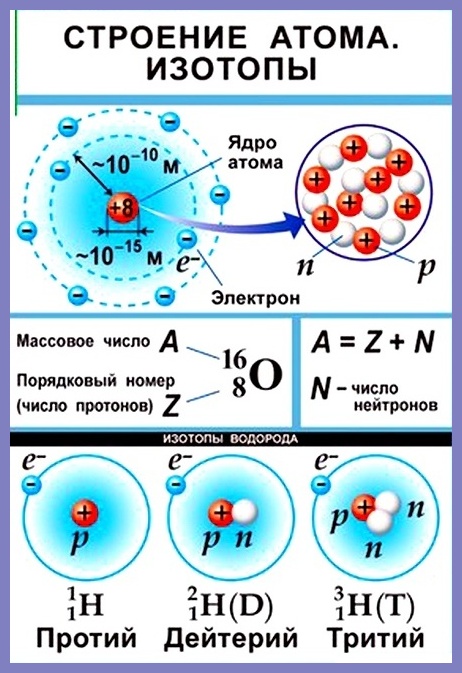
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
Диаметр атома 10-10 м, диаметр ядра 10-14 – 10-15 м. Масса атома водорода равна 1,67 • 10-24 г, атома углерода — 1,99 • 10-23 г, атома железа — 9,29 • 10-23 г.
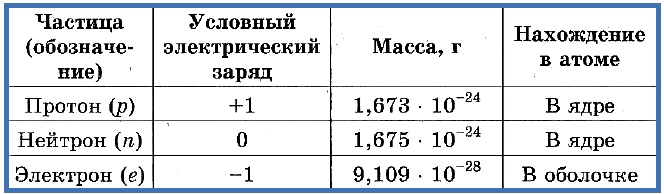
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Таблица 1. «Элементарные частицы атома»
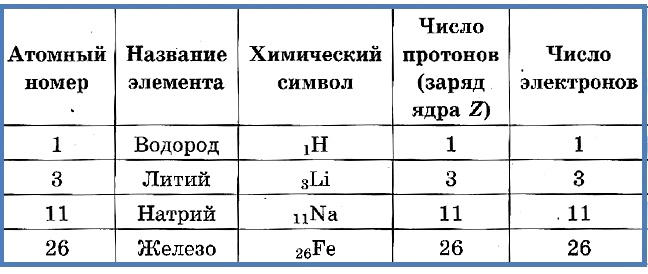
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23Na или натрий-23.
Массовое число кислорода, А(16О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16О, 17О и 18О.
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16О, 17О и 18О — это изотопы. Природные изотопы урана — 234U, 235U и 238U.
Ионы — заряженные частицы, образующиеся при отщеплении от нейтральных атомов или присоединении к ним электронов. Ионы образуются также из молекул в результате присоединения протона Н+ (NH3 → NH4+) или отщепления Н+ (HNO3 -> NO3–).
Таблица 3. «Обозначение и название ионов»
Катионы — это положительно заряженные ионы (Na+, Аl3+), анионы — отрицательно заряженные ионы (Cl–, NO3–).
Заряд иона указывают в виде индекса справа вверху от символа химического элемента: Li+ , Са2+. На первом месте пишут цифру, на втором — знак заряда. Цифру 1 не пишут.
Конспект урока по химии «Строение атома».
Если у вас есть заданная масса соединения, вы можете рассчитать количество родинок. И наоборот, если вы знаете, сколько у вас молей соединения, вы можете рассчитать его массу. Для любого расчета вам нужно знать две вещи: химическую формулу соединения и массовые числа элементов, которые его составляют. Массовое число элемента уникально для этого элемента, и оно указано прямо под символом элемента в периодической таблице. Массовое число элемента не совпадает с его атомным номером.
TL; DR (слишком долго; не читал)
Атомная масса каждого элемента отображается под его символом в периодической таблице. Он указан в атомных единицах массы, что эквивалентно грамму / моль.
Атомный номер и атомная масса
Каждый элемент характеризуется уникальным количеством положительно заряженных протонов в своем ядре. Например, водород имеет один протон, а кислород – восемь. Периодическая таблица – это расположение элементов в соответствии с возрастающим атомным номером. Первая запись – водород, восьмая – кислород и так далее. Место, которое элемент занимает в периодической таблице, является непосредственным указанием его атомного номера или числа протонов в его ядре.
Помимо протонов, ядра большинства элементов также содержат нейтроны. Эти фундаментальные частицы не имеют заряда, но имеют примерно такую же массу, что и протоны, поэтому они должны быть включены в атомную массу. Массовое число атомов представляет собой сумму всех протонов и нейтронов в ядре. Атом водорода может содержать нейтрон, но обычно его нет, поэтому массовое число водорода равно 1. Кислород, с другой стороны, имеет равное количество белков и нейтронов, что повышает его массовое число до 16. Вычитая Массовое число элемента от его атомной массы говорит вам количество протонов в его ядре.
Нахождение массового числа
Лучшее место для поиска атомного номера элемента – периодическая таблица. Он отображается под символом для элемента. Вы можете быть озадачены тем фактом, что во многих версиях периодической таблицы это число содержит десятичную дробь, которую вы не ожидаете, если она будет получена путем простого добавления протонов и нейтронов.
Причина этого заключается в том, что отображаемое число представляет собой относительный атомный вес, который выводится из всех встречающихся в природе изотопов элемента, взвешенного по проценту от каждого встречающегося. Изотопы образуются, когда число нейтронов в элементе больше или меньше числа протонов. Некоторые из этих изотопов, такие как углерод-13, являются стабильными, но некоторые являются нестабильными и со временем распадаются до более стабильного состояния. Такие изотопы, такие как углерод-14, являются радиоактивными.
Практически все элементы имеют более одного изотопа, поэтому каждый имеет атомную массу, которая содержит десятичную дробь. Например, атомная масса водорода, указанная в периодической таблице, составляет 1, 008, для углерода – 12, 011, а для кислорода – 15, 99. У урана с атомным номером 92 есть три естественных изотопа. Его атомная масса составляет 238, 029. На практике ученые обычно округляют массовое число до ближайшего целого числа.
Единицы массы
Единицы измерения атомной массы были уточнены на протяжении многих лет, и сегодня ученые используют единую единицу измерения атомной массы (amu или просто u). Он определен равным ровно одной двенадцатой массе несвязанного атома углерода-12. По определению масса одного моля элемента, или число Авогадро (6, 02 × 10 23) атомов, равна его атомной массе в граммах. Другими словами, 1 аму = 1 грамм / моль. Таким образом, если масса одного атома водорода составляет 1 а.е.м., масса одного моля водорода составляет 1 грамм. Таким образом, масса одного моля углерода составляет 12 граммов, а урана – 238 граммов.